Класс: 8 Цель урока
| Вид материала | Урок |
- Урок литературы 5 класс. Цель урока, 46.04kb.
- Карта анализа урока цель посещения урока, 186.71kb.
- Тема урока №1 по мировой художественной культуре (9 класс), 109.91kb.
- Урок №24 10 класс Тема урока: «Линейные массивы», 41.5kb.
- Литература, 11 класс Тема урока : Александр Исаевич Солженицын, 20.69kb.
- Урок литературного чтения 2 класс Тема урока : Н. Носов, 86.86kb.
- Тема урока: «Серная кислота и ее соли» Цель урока, 113.23kb.
- Тема урока: Нестандартные методы решения уравнений. Цель урока, 24.43kb.
- Колесниковой Ирины Евгеньевны учителя музыки гусш №55 Дата: 17 марта 2005 Класс, 101.15kb.
- М. Ю. Лермонтов «Герой нашего времени», 9 класс «История души человеческой…» (Глава, 383.18kb.
Кислоты. Урок – путешествие.
Класс: 8
Цель урока: углубить представления учащихся о кислотах (состав, классификация, многообразие), развивать понятие об электролитической диссоциации, прививать навыки в написании уравнений электролитической диссоциации, продолжить работу по развитию умений составления формул химических соединений.
Оборудование: растворы кислот (соляной, серной, уксусной), индикаторная бумага фенолфталеиновая и лакмусовая, рисунки с изображением фруктов, муравьёв, аскорбиновая кислота (витамин «С» из аптеки), химические стаканы, пробирки.
Начало урока. На доске прикреплён плакат-карта: «Путешествие в страну кислот» На столах у учащихся – инструкции по технике безопасности при работе с кислотами. На стенах размещены таблицы «Изменение окраски индикаторов» и «Электрохимический ряд напряжений металлов».
Вступление: «Состав и классификация кислот» - так называется этот урок.
Он будет совсем необычным для нас.
Представим себе, что это – не класс.
Отправимся все мы на 40 минут
В страну, где кислоты сегодня нас ждут.
Но прежде проверим, все ли готовы к путешествию. Проведём разминку. На листочках расставить степени окисления элементов в предложенных формулах. (Листочки собрать) См. приложение.
Теперь весь класс разделим на две команды по рядам и проверим готовность каждой команды. В команде выбирается менеджер, у которого есть список команды. Каждый ответ учащихся заносится знаком + в список. По итогам выставляется отметка.
Вопрос первый: Составьте формулы веществ, образованных: 1) серой и водородом
2) алюминием и хлором
Вопрос второй: Составьте формулы по названиям: 1) оксид фосфора (5)
2) оксид углерода (4)
Представители каждой команды выполняют работу на доске.
Фронтальный опрос: 1) Какие вещества называются оксидами?
2) Какие вещества называются основаниями?
3) Какие вещества называются солями?
4) Какие вещества называются кислотами?
Все готовы, можно ехать.
Станция «Историческая». Выступления учащихся об истории открытия кислот.
Рассказы об азотной, серной, соляной и др. кислотах. См. приложение.
H2SO4 – серная кислота.
Пирит в природе под действием кислорода и воды постепенно окисляется и образует сульфаты двух- и трехвалентного железа и серную кислоту. Наши предки научились применять эти соли в быту. Так, из сернокислого железа готовили чернила, использовали его при крашении тканей. Применяли эти соли в иконописи, при золочении, обработке кожи и в медицине. Упоминаются они в различных лечебниках XVI и XVII вв. и в делах "Аптекарского приказа". Эти соли обладали вяжущим кислым вкусом и потому их называли квасцами, что происходит от старинных русских слов "квас", "квасить", "квашение".
В XVII в. квасцы в значительном количестве ввозились из-за границы. В 1671 г. через Архангельский порт к нам было ввезено 100 бочек немецких квасцов. Первые заводы по производству квасцов были построены на Руси в XVIII веке. Первое современное промышленное производство серной кислоты "контактным методом" было создано в России на химическом заводе в Санкт-Петербурге в 1903 году (теперь завод называется "Красный химик").
До 19 века для приготовления квасцов из колчедана часто применяли следующий метод: руду измельчали и раскладывали на ровном месте в виде усеченного конуса; сверху руду закрывали крышей так, чтобы не падали косые лучи солнца. Как описано в старой рукописи: куче руды "...так долго дают лежать под кровлей, пока (она) не разгорячится насквозь.... При этом она от себя такой испускает пар и запах, что почти можно задохнуться". Вокруг кучи делали канаву, выложенную камнем и непроницаемую для раствора квасцов. Время от времени руду поливали водой, которая стекала в канаву, потом в сборник раствора квасцов. Затем этот раствор выпаривали на свинцовых или чугунных сковородках и получали сухие соли. В описанном способе, повторяющем природный процесс, создавались благоприятные условия для окисления колчедана. Поэтому окисление шло довольно "быстро", примерно в течение одного года.
Серный ангидрид и серная кислота были известны средневековым алхимикам. На Руси серная кислота появилась в XVII в. Называли ее купоросным маслом, так как она образуется при прокаливании "купороса". Мировые потребности серной кислоты в средние века ограничивались десятками килограммов в год. Она производилась для нужд аптек и алхимических лабораторий. Некоторое количество концентрированной кислоты шло для производства особых спичек, содержащих бертолетову соль. В небольших количествах серная кислота с 1767 г. стала применяться на "Московском суконном дворе" при крашении тканей. Использовали её и для получения азотной и соляной кислот.
Соляная кислота - HCl
С соляной кислотой мы, сами того не зная, сталкиваемся ежедневно. Соляная кислота, выделяющаяся в желудке, используется для процесса пищеварения. Под ее воздействием большинство бактерий, попавших в желудок с пищей, быстро погибает. При пониженной кислотности желудочного сока необходимо лечение.
Трудно сказать, кто и когда впервые получил соляную кислоту. Нам известно, что уже в конце XV в. алхимик Василий Валентин и в XVI в. Андреас Либавий в усердных поисках эликсира жизни прокаливали в своих алхимических приборах поваренную соль с квасцами и купоросами и получили продукт, который описали под названием «кислого спирта». Это и была знакомая теперь нам соляная кислота, конечно, очень нечистая.
Для первых исследователей это было совершенно новое вещество, обладавшее свойствами, которые сильно поражали их воображение. Нюхая его, они задыхались и кашляли, «кислый спирт» дымил в воздухе. При опробовании на вкус, он обжигал язык и нёбо, металлы он разъедал, ткани разрушал.
В 1658 г. немецкий химик И.Р.Глаубер нашел новый способ получения соляной кислоты, которую он назвал «соляным спиртом». Способ этот широко применяется до сих пор в лабораториях. Он нагревал поваренную соль с концентрированной серной кислотой и выделявшийся «дым» поглощал водой.
В 1772 г. английский химик Дж.Пристли (1733–1804) установил, что при действии серной кислоты на поваренную соль выделяется бесцветный газ, который может быть собран над ртутью, и что этот газ обладает чрезвычайно большой способностью растворяться в воде. Водный раствор этого газа получил название «соляной кислоты», а сам газ Пристли назвал «чистой газообразной соляной кислотой».
В 1774 г. шведский химик К.В.Шееле , исследуя действие соляной кислоты (которую он называл еще «соляным спиртом») на оксид марганца(IV), нашел, что он растворяется в соляной кислоте на холоде. При нагревании выделяется газ желто-зеленого цвета, обладающий очень резким запахом, способностью разрушать растительные краски и действующий на все металлы, не исключая золота. Так был открыт хлор, который долго считали оксидом неизвестного элемента.
Дэви в сообщении о своих опытах с соляной кислотой, сделанном им в 1810 г., высказался в пользу признания нового вещества, не подвергающегося разложению, элементом, и предложил назвать это вещество по его цвету хлорином (от греч.
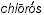 – желто-зеленый). Из свойств хлора особенно поражала его способность энергично вступать в соединение с металлами. На основании этого немецкий ученый Швейгер предложил в 1811 г. назвать хлор галогеном (от греч.
– желто-зеленый). Из свойств хлора особенно поражала его способность энергично вступать в соединение с металлами. На основании этого немецкий ученый Швейгер предложил в 1811 г. назвать хлор галогеном (от греч.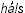 – соль и
– соль и 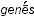 – рождающий), т.е. образующим соли – солеродом, а хлористые металлы – галоидами, т.е. похожими на соль. В русской научной литературе хлор долгое время называли солетвором, а в 1820 г. впервые появилось название «хлор».
– рождающий), т.е. образующим соли – солеродом, а хлористые металлы – галоидами, т.е. похожими на соль. В русской научной литературе хлор долгое время называли солетвором, а в 1820 г. впервые появилось название «хлор».История азотной кислоты
Aзoтнaя киcлoтa имeeт длиннyю иcтopию, вocxoдящyю к IX вeкy. Первым, кто полyчил aзoтнyю киcлoтy, был apaбcкий aлxимик, имeвший пceвдoним Гeбep.
Пepвoнaчaльнo aлxимики нe yмeли coздaвaть кoнцeнтpиpoвaнныe pacтвopы киcлoты. Bпepвыe кoнцeнтpиpoвaннaя дымящaяcя aзoтнaя киcлoтa была пoлyчeнa в 1648 гoдy нeмeцким aптeкapeм-aлxимикoм Иoгaннoм Pyдoльфoм Глayбepoм пyтeм пepeгoнки aзoтнoи киcлoты, пoлyчeннoй взaимoдeиcтвиeм cepнoи киcлoты и кaлиeвoй ceлитpы KNO3. B 1763 гoдy M. B. Лoмoнocoв иccлeдoвaл и oпиcaл этoт мeтoд. Технoлoгия пoлyчeния aзoтнoй киcлoты нe мeнялacь до кoнцa XVIII cтoлeтия. B Poccии в 1910 гoдy было пoлyчeнo 8100 тoнн aзoтнoй киcлoты, a в 1914-м - 18 000 тoнн.
B 1776 гoдy Aнтyaн-Лopaн Лaвyaзьe пpивeл дoкaзaтeльcтвa нaличия в aзoтнoй киcлoтe киcлopoдa, a в 1826 гoдy Джoзeф Льюиc Гeй-Люccaк, пpoфeccop физики и xимии в пapижcкoи Copбoннe и выcшeй Пoлитexничecкoй шкoлe, oпpeдeлил фopмyлy aзoтнoй киcлoты. Гeй-Люccaк тaкжe paзpaбoтaл нeкoтopыe ycoвepшeнcтвoвaния в мeтoдe пoлyчeния aзoтнoи киcлoты.
Пepвыe иccлeдoвaния cинтeзa aзoтнoй киcлoты из aммиaкa oтнocятcя к нaчaлy XIX вeкa. Этoт мeтoд включaeт в ceбя кaтaлитичecкoe oкиcлeниe aммиaкa вoздyxoм пpи 700 °C дo oкcидa aзoтa(II) в пpиcyтcтвии плaтинoвoгo кaтaлизaтopa. B Poccии в 1916 гoдy coздaeтcя oпытнaя ycтaнoвкa, a в 1917-м был ввeдeн в cтpoй пepвыи зaвoд пo пpoизвoдcтвy aзoтнoй киcлoты из aммиaкa в Дoнeцкe.
Станция «Экспериментальная».
Краткая история об открытии индикаторов. Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, закупленной в Германии, случайно пролил её. Кислота попала на фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Это явление заинтересовало Бойля, и он тут же провёл серию опытов с разными кислотами и цветами разных растений. Оказалось, что цветки васильков, роз и других растений могут изменять окраску при действии кислот. Особенно интересным оказался фиолетовый настой лакмусового лишайника. В растворах кислот он был красным, а в растворах щелочей – синим. После некоторых раздумий Роберт Бойль назвал такие вещества индикаторами, что в переводе с английского – «указатели». Химики стали использовать их для распознавания кислот и оснований.
Задание: с помощью индикаторов определить, в каком стакане находится раствор кислоты, и запомнить номер. В это время второй учащийся из команды решает уравнения на доске. Нужно подчеркнуть то уравнение, в котором перед кислотой стоит коэффициент, соответствующий номеру стакана. Какая команда справится первой?
Уравнения. Задания без коэффициентов напечатаны на листочках.
2NaOH + H2SO4 = Na2SO4 + 2H2O
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
Mg + 2HCl = MgCL2 + H2
(Для первой команды кислота во второй пробирке и подчеркнуть нужно третье уравнение).
Fe2O3 + 6 HCl = FeCl3 + 3H2O
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
(Для второй команды кислота в третьей пробирке и подчеркнуть нужно второе уравнение).
Подведём итог: Что такое ИНДИКАТОРЫ?
Отгадайте загадки:
Не страшны кислоты мне,
Даже очень сильные.
Но в растворах щелочей
Становлюсь малиновый.
Ярче сока всех малин. Кто я? (фенолфталеин)
В щелочах я очень жёлтый,
А в кислотах очень красный.
А в среде нейтральной –
Цвет оранжевый, прекрасный.
Индикатор очень важный,
Как зовусь я? (метилоранжем)
Почему индикаторы меняют окраску одинаково в растворах всех кислот? Что общего у всех кислот? Что происходит при растворении кислот в воде? И снова состязание. Каждая команда получает карточку с названиями кислот. Первый ученик пишет формулу кислоты, второй – уравнение диссоциации, третий – снова формулу, четвёртый – уравнение диссоциации. Первой считается команда, выполнившая задание без ошибок. Листок передаём как эстафетную палочку. (кислоты угольная, сернистая, сероводородная, азотная)
Станция «Практическая». Здесь мы расскажем и послушаем о том, где и как применяются кислоты. (Рассказы учащихся о различных кислотах) (лимонная, яблочная, уксусная, аскорбиновая, ацетилсалициловая)
Аскорбиновая кислота

Структурная формула аскорбиновой кислоты
Аскорби́новая кислота́ (Витамин C) C6H8O6 является растворимым в воде витамином, способствует образованию дезоксирибонуклеиновой кислоты.
История
Впервые в чистом виде витамин С был выделен в 1928 году, а в 1932-м было доказано, что именно отсутствие аскорбиновой кислоты в пище человека вызывает цингу.
Свойства
Аскорбиновая кислота — бесцветное кристаллическое вещество, без запаха, обладает кислым вкусом, хорошо растворимое в воде; обладает восстановительными свойствами, повышает сопротивляемость к неблагоприятным воздействиям, способствует регенерации.
Получение
Синтезируется растениями (из галактозы) и большинством животных (из глюкозы), за исключением приматов и некоторых других животных (например, морских свинок), которые получают её с пищей. Синтетически получают из глюкозы.
Источники в пище
Наиболее богаты аскорбиновой кислотой плоды киви, шиповника, красного перца, цитрусовых, чёрной смородины, лук, томаты, листовые овощи (например, салат и капуста).
Авитаминоз
Среди симптомов нехватки в организме витамина С находятся слабость иммунной системы, кровоточивость дёсен, бледность и сухость кожи, замедленное восстановление тканей после физических повреждений (раны, синяки), потускнение и выпадение волос, ломкость ногтей, боли в ступнях.
Применение
Люди должны получать аскорбиновую кислоту с пищей, поскольку у приматов ген, отвечающий за образование одного из ферментов синтеза аскорбиновой кислоты, нефункционален.
Показан пассивным курильщикам, т.к. способствует ослаблению влияния веществ, содержащихся в сигаретном дыме. По некоторым данным одна выкуренная сигарета "сжигает" около 25 мг аскорбиновой кислоты. Аскорбиновая кислота не вырабатывается в организме, поэтому необходимое количество должно поступать с пищей. Физиологическая потребность для взрослых - 90 мг/сутки.
Пищевая промышленность
Аскорбиновая кислота и ее натриевая соль (аскорбат натрия) применяется в пищевой промышленности в качестве консерванта Е300, предотвращающего окисление продукта.
Чтобы повысить иммунитет, угощаю всех аскорбиновой кислотой.
Аспирин

АЦЕТИЛСАЛИЦИЛОВАЯ (2-(АЦЕТИЛОКСИ)-БЕНЗОЙНАЯ) КИСЛОТА – белое кристаллическое вещество, малорастворимое в воде, хорошо растворимо в спирте, в растворах щелочей.
Ацетилсалициловая кислота уже более 100 лет широко применяется как лекарственное средство – жаропонижающее, обезболивающее и противовоспалительное. Существует более 50 названий – торговых марок препаратов, основным действующим началом которых является это вещество. Это необычное лекарственное средство можно назвать рекордсменом среди лекарств. Ацетилсалициловая кислота – долгожитель в мире лекарств, в 1999 официально отметила свой столетний юбилей, и до сих пор это самое популярное лекарство в мире. Ежегодное потребление лекарственных препаратов содержащих ацетилсалициловую кислоту превышает 40 млрд. таблеток.
Еще одна особенность ацетилсалициловой кислоты – это первое синтетическое лекарственное вещество. Человек испокон веков использовал лечебные растения, затем научился выделять из экстрактов растений лекарственные вещества в чистом виде, но первым лекарством, полного аналога которому не существует в природе, стала ацетилсалициловая кислота.
В природе есть похожее вещество – салициловая кислота. Это соединение содержится в коре ивы, и его целебные свойства были известны с древности. Отвар коры ивы как жаропонижающее, обезболивающее и противовоспалительное средство рекомендовал применять еще Гиппократ. В 1828 немецкий химик Бюхнер из коры ивы выделил вещество, которое назвал салицин (от латинского названия ивы – Salix). Чуть позже из салицина была получена чистая салициловая кислота, и доказано, что она обладает лечебными свойствами. Салицин, выделенный из ивовой коры – отхода от производства корзин, использовали в качестве лекарственного средства, однако он производился в очень небольших количествах, и был дорог. В 1860 немецкий химик А.Кольбе разработал метод синтеза салициловой кислоты, и вскоре в Германии появился завод по производству этого вещества. 1899 фирма «Bayer» запатентовала торговую марку аспирин – имя, под которым наиболее известно это лекарство. Кстати, салициловая кислота тоже нашла свое место в медицине, ее раствор – салициловый спирт лечит кожные воспалительные процессы и входит в состав многих косметических лосьонов.
Ацетилсалициловая кислота понижает температуру, уменьшает местные воспалительные процессы, обезболивает. А еще разжижает кровь и поэтому применяется при опасности возникновения кровяных тромбов. Доказано, что длительный прием небольшой дозы ацетилсалициловой кислоты людьми, склонными к заболеваниям сердечно-сосудистой системы, значительно снижает риск инсульта и инфаркта миокарда.
Но ни в коем случае нельзя забывать, что лекарственными средствами, нельзя злоупотреблять. Как и любое лекарственное средство, ацетилсалициловая кислота небезопасна.
Наше путешествие закончено. Подведём итоги. (фронтальная беседа по вопросам)
- С какими кислотами вы были знакомы раньше?
- О каких услышали сегодня впервые?
- Где лично вы встречаетесь с кислотами в жизни?
- Какие меры предосторожности нужно соблюдать при работе с кислотами?
