Влияние возраста и физиологического состояния животных на активность ферментных систем клеток, тканей и органов 03. 03. 01 физиология 03. 01. 04 биохимия
| Вид материала | Автореферат |
- «Физиология и этология животных» Специальность 111201. 65 Ветеринария. Пояснительная, 240.53kb.
- Методические рекомендации к написанию и оформлению рефератов по курсу «физиология, 129.81kb.
- Анатомия и физиология человека Общее знакомство с организмом человека, 174.34kb.
- Задачами физиологии и этологии животных являются, 536.54kb.
- Тема: Двигательная активность и лфк для людей пожилого возраста, 353.11kb.
- «Физиология нервной системы», 172.86kb.
- Пояснительная записка Нормальная физиология наука и учебная дисциплина о жизненных, 578.98kb.
- Влияние пренатального стресса на процессы окислительной модификации белков и активность, 202.57kb.
- Рабочая программа дисциплины «физиология» (Физиология животных), 288kb.
- Программа дисциплины «Физиология с основами анатомии», 721.8kb.
На правах рукописи
МОСЯГИН ВЛАДИМИР ВЛАДИМИРОВИЧ
ВЛИЯНИЕ ВОЗРАСТА И ФИЗИОЛОГИЧЕСКОГО
СОСТОЯНИЯ ЖИВОТНЫХ НА АКТИВНОСТЬ
ФЕРМЕНТНЫХ СИСТЕМ
КЛЕТОК, ТКАНЕЙ И ОРГАНОВ
03.03.01 – физиология
03.01.04 - биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Москва - 2010
Работа выполнена на кафедре физиологии животных ФГОУ ВПО «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина» (ФГОУ ВПО МГАВМиБ)
Научные консультанты:
доктор биологических наук,
профессор Максимов Владимир Ильич
доктор биологических наук,
профессор Фурман Юрий Васильевич
Официальные оппоненты:
доктор биологических наук,
профессор Шевелев Николай Серафимович
доктор биологических наук,
профессор Шапошников Андрей Александрович
доктор биологических наук,
профессор Воробьева Светлана Владимировна
Ведущая организация:
ГНУ «Всероссийский научно-исследовательский институт физиологии, биохимии и питания животных»
Защита диссертации состоится «____» ____ 20__ г. в ____ часов на заседании совета по защите диссертаций Д 220.042.04 при ФГОУ ВПО МГАВМиБ (109472, г. Москва, ул. Академика Скрябина, 23, тел. 377-93-83).
С диссертацией можно ознакомиться в библиотеке ФГОУ ВПО МГАВМиБ.
Автореферат разослан «__» _____ 20__ г.
Ученый секретарь
диссертационного совета Фомина В.Д.
1. Общая характеристика работы
Актуальность работы. В настоящее время все более очевидной становиться важная и многообразная роль ферментных систем среди различных факторов, участвующих в регуляции и интеграции процессов развития и жизненных отправлений организма. На механизмах, основу которых составляют ферментные системы, базируется раскрытие в онтогенезе путей реализации наследственной информации, регуляции роста и развития, гомеостаза (Свечин К.Б, Аршавский И.А., Квасницкий А.В. и соавт., 1967; Никитин В.Н., 1975; Лысов В.Ф., 1977, 1996, 2004; Кузнецов А.И., 1986; Максимов В.И., 1999-2002, 2004, 2005; Максимов В.И. и др., 1999-2010; Гудин В.А., 2006; Torronteras S.R.et al., 1993). В частности, характерные периоды более быстрого и замедленного роста и развития органов и организма в целом в определенной степени связаны с активностью ферментных систем.
Известно, что активность этих систем зависит от степени воздействия различных факторов внешней и внутренней среды клетки, таких как изменение рН, концентрации субстрата, химическая модификация молекул, наличие специфических активаторов и ингибиторов, изменения проницаемости мембран, скорости деградации молекул фермента, индукции и репрессии биосинтеза белка молекул ферментов и др. (Чернов Н.Н., 1996; Болдырев А.А., 1997). Степень влияния этих факторов во многом определяется экзогенными и эндогенными условиями существования, оказывающими воздействие на организм, к ним относят: возраст, тип кормления, состояние гормонального фона, физиологическое состояние, периодов репродуктивной деятельности животных, стресс, нарушения метаболизма и др. Таким образом, активность ферментов, играет ведущую роль в реализации механизмов биохимической адаптации, обеспечивающих существование организма в постоянно изменяющейся внешней среде (А.М. Мороз, 1984; A.C. Swann, 1985 и др.; М.Н. Маслова и др, 1991; И.И. Мавров и др., 2002; Е.А. Силиванова, 2006; Д.Н. Кыров, 2006 и др.; Максимов В.И., 2002, 2006, 2008).
Одним из основных свойств живой клетки является избирательный транспорт веществ и энергии в клетку из внешней среды, ведущую роль в которых играет активный транспорт, осуществляемый ферментными системами мембран (ионными насосами), интегральными компонентами которых являются АТФазы. АТФ-зависимые ионные насосы, представляющие комплекс ферментов, обеспечивают как первичный транспорт катионов (H+, Na+, K+, Ca2+) и анионов (Cl-, HCO3-) против их электрохимических градиентов, так и вторично-активный перенос через мембрану в клетку сахаров, аминокислот, органических кислот, за счет энергии трансмембранного градиента концентрации ионов Na+. С работой АТФаз так же связана генерация биотоков, трансмембранного потенциала и передача нервного импульса, процессы сопряжения окислительного фосфорилирования. Накоплено большое количество сведений по изучению транспорта ионов и функционированию Mg2+- , Ca2+- , Na+,K+- , H+–АТФаз (Кагава Я., 1985; Болдырев А.А. и др., 1985, 1998; Вишняков С.И., 1989; Skou J.C. et al., 1992; Скулачев В.П., 1989, 2001; Опритов В.А., 1996; Цвилиховский М.И., 1997; Владимиров Ю.А., 1998; Чизмаджеев Ю.А., 2000, Лопина О.Д., 1997, 1999, 2001; Schiener-Bobis G., 2002; Jorgensen P.L. et al.,2003; Рубцов А.М., 2005 и др.).
Показатель активности АТФазных ионных насосов является очень чутким критерием оценки метаболического состояния организма. Для обеспечения процессов активного транспорта питательных веществ необходимы существенные затраты энергии, которые составляют до 40 % от суммарной энергии, поступившего корма. Существенное влияние на активность транспортных АТФаз оказывает обеспеченность животных белком различного качественного состава (Максимюк Н.Н., 1998; Фурман Ю.В., 2001).
Среди питательных веществ корма, влияющих на организм животных, ведущая роль принадлежит белку, он обеспечивает жизнедеятельность организма и способствует его росту. Роль белка особенно значима для организма птицы. В отличие от других животных птица нуждается в постоянном поступлении в организм большого количества полноценного белка. Более интенсивный обмен веществ в расчете на единицу массы тела птицы определяет и ее более высокую продуктивность. Известно, что 80 % протеина в рационах птицы приходится на долю растительных кормов, однако они имеют дефицит по ряду аминокислот и нуждаются в обогащении ими. Недостаток или избыток (имбаланс) аминокислот в рационе сопровождается нарушением обмена веществ, значительными потерями продуктивности, перерасходом кормов, снижением жизнеспособности организма, рентабельности производства в целом (Архипов А.В., 1984, 2007; Лемешева М., 2006).
Дальнейший прогресс птицеводства во многом зависит от использования новых ресурсосберегающих технологий. Это в свою очередь связано с решением проблемы дефицита кормового протеина и аминокислот за счет расширения их производства и повышения эффективности их использования (Фисинин В., 2006, 2007, Гальперн И.Л., 2009). Эту проблему в значительной степени можно решить за счет рационального использования отходов кожевенной промышленности. На предприятиях легкой промышленности их накапливается большое количество, они не только не используются, но и являются источником загрязнения окружающей среды. Производство белковых кормовых добавок из этих отходов является перспективным направлением рационального использования вторичных ресурсов (Фурман Ю.В., 2001;Бикташев Р.У., 1985).
Активность транспортных АТфаз в значительной степени зависит от изменения состава внутренней среды клетки, наблюдаемой во многих патологических процессах и в частности при воспалительных заболеваниях, что часто наблюдается у свиней (Орлянкин Б.Г., 2009; Straw B.E., 2006; Кабанов В.Д., 2001, Мисайлов В.Д., 2000).
Известно, что в воспалительный процесс вовлекаются многие биохимические компоненты, и в первую очередь ферментные системы. При повреждении клеточных мембран тканей в стадии альтерации в формирующемся очаге воспалительного процесса отмечается резкое снижение энергетических процессов и уменьшением количество ресинтезированного АТФ, вследствие реакции сосудов и развития ишемии. Это свою очередь оказывает существенное влияние на все энергозависимые процессы в клетке и ее органоидах. Нарушение структуры мембран приводит к нарушению механизмов транспорт ионов и метаболитов, накапливаются промежуточные метаболиты, отмечается распад сложных органических соединений на более простые. В результате физико-химические характеристики тканей очага воспаления резко изменяются. Повышается осмотическое и онкотическое давление, вследствие накопления одновалентных ионов (Cl-, Na+, H+, K+) при одновременном уменьшении Ca2+, Mn2+, Mg2+, что лежит в основе развития в последующем механизмов экссудации. Повышению проницаемости биологических мембран приводит к выравниванию градиента концентрации ионов и выходу содержимого клеточных органоидов наружу. Особое значение в развитии воспалительного процесса, на стадии альтерации, играют лизосомы, содержащие большое число гидролитических ферментов, выход которых в цитоплазму приводит к лизису клетки и близлежащих тканей (Протасова Т.Н., 1975; Серов В.В. и Пауков В.С., 1995).
Анализируя все вышесказанное, следует отметить, вместе с тем, что еще нет сведений об особенностях влияния возраста и физиологического состояния в конкретные фазы постнатального онтогенеза на активность ферментных систем клеток органов и тканей различных видов животных. Нет данных по такому важному вопросу, как изменение активности ферментных систем клеток тканей и органов при действии чрезвычайных факторов среды, приводящих к развитию воспалительного процесса. При этом такие факторы могут быть эндогенного и экзогенного характера, патогенетические, предрасполагающие и сопутствующие. К ним относят различные физические, химические и биологические воздействия, приводящие к развитию стресса, нарушению обмена веществ, токсикоамз, метаболической иммунодепрессии, технопатий, эндокринных заболеваний, послеродовых и других органопатологий (Плященко С.И. и др, 1983, 1988; Онегов А.П. и др., 1984; Юрков В.М., 1988; Ярилин А.А., 1989; Жаров А.В., 1998; Идрисов Г.З., 1998; Хаитов Р.М., 2000; Кармолиев Р.Х., 2002, 2005; Галактионов В.Г., 2005; Mafayer J.R. et al., 1987).
В связи с этим вполне очевидна актуальность исследования активности ферментных систем клеток тканей и органов в постнатальном онтогенезе у птиц и свиней в зависимости от физиологического состояния и действия чрезвычайных факторов среды.
Цель работы - выявление особенностей становления физиолого-биохимических процессов и функций в организме разных видов животных в постнатальном онтогенезе, связанных с активностью ферментных систем их клеток тканей и органов в зависимости от физиологического состояния, кормления и влияния чрезвычайных факторов среды.
Для достижения цели, были поставлены следующие задачи:
1. Установление видовых особенностей функционирования АТФазных ферментных систем клеток, тканей и органов птиц и свиней.
2. Выявление активности ферментных систем (АТФаз) в ядерных и цитоплазматических мембранах эритроцитов цыплят-бройлеров, специфичности влияние ионного состава среды инкубации и ингибиторов на её активность.
3. Исследование особенности функционирования ферментных систем (АТФаз) в ядерной и цитоплазматической мембранах эритроцитов цыплят бройлеров в зависимости от возраста, а так же скармливания пептидной кормовой добавки из отходов кожевенного производства (ПКД) и сукцината натрия.
4. Выявление активности ферментных систем (АТФаз) в клетках тканей и органов цыплят-бройлеров в зависимости от возраста и скармливания ПКД.
5. Исследование активности ферментных систем клеток (АТФаз, протеаз, аминотрансфераз, фосфатаз и рибонуклеаз) в зависимости от физиологического состояния половой системы свиноматок.
6. Изучение активности ферментных систем клеток (АТФаз, протеаз, аминотрансфераз, фосфатаз и рибонуклеаз) в зависимости от действия чрезвычайных факторов, приводящих к развитию воспалительных процессов половой системы свиноматок.
7. Выявление локализации ферментных систем (АТФаз, фосфатаз) клеток эндометрия свиноматок в зависимости от влияния чрезвычайных факторов среды.
8. Исследование содержания нуклеиновых кислот в клетках эндометрия свиноматок в зависимости от физиологического состояния и действия чрезвычайных факторов среды.
Научная новизна работы. Впервые установлена видовая особенность активности ферментных систем клеток тканей и органов, которая имеет свое своеобразие у птиц и свиней.
В ядерных и цитоплазматических мембранах эритроцитов цыплят-бройлеров выявлены АТФазы, активируемые ионами Mg2+-, Na+, K+-, Ca2+- и HCO3-. АТФазы цитоплазматических и ядерных мембран эритроцитов цыплят имеют существенные различия, проявляющиеся во влиянии на них ионов Na+ и K+. Так, ионы Na+,K+ детерминируют АТФазную активность цитоплазматических мембран на 97%, ионы Ca2+ - на 87% и HCO3- анион - на 96% с высокой степенью достоверности. Активность АТФазы ядер не зависела от наличия в среде инкубации ионов Na+,K+ и Ca2+ (P>0,05) и была детерминирована ионами HCO3- на 96% (P<0,01).
У цыплят-бройлеров выявлена АТФазная активность и особенности функционирования в ядерных и цитоплазматических мембранах эритроцитов Mg2+-, Na+, K+-; Ca2+- и HCO3-- АТФаз при обычном кормлении и на рационах, содержащих сукцинат натрия и протеиновую кормовую добавку из отходов кожевенного производства. Применение сукцината и протеиновой кормовой добавки из отходов кожевенного производства способствует усилению обменных процессов в организме цыплят-бройлеров, отражающихся на активности АТФаз мембранных структур эритроцитов и показателях продуктивности.
У свиноматок выявлена функциональная активность Mg2+-, Na+, K+-, Ca2+- и HCO3–- АТФаз ядер, митохондрий и лизосом клеток эндометрия свиноматок в период различных стадий полового цикла, а также при наличии острого и хронического воспаления. При этом установлено:
- что активность изучаемых АТФаз изменяется в зависимости от половой цикличности и характера воспалительного процесса в эндометрии;
- наличие взаимосвязи активности АТФаз и протеаз, аминотрансфераз и фосфатаз клеток эндометрия свиноматок в динамике полового цикла, а также при наличии острого катарального эндометрита;
- зависимость ферментативной активности протеаз, аминотрансфераз и фосфатаз от их локализации, стадии полового цикла и рН среды;
- изменение активности протеаз, аминотрансфераз и фосфатаз, отражающееся на активности АТФаз ядер, митохондрий и лизосом клеток эндометрия свиноматок при остром катаральном эндометрите.
Получены новые данные о содержании и распределении в тканях эндометрия свиноматок ДНК и РНК в различные стадии полового цикла и при остром послеродовом эндометрите. Установлено, что скорость аутолиза нуклеиновых кислот в эндометрии свиноматок изменяется в зависимости от стадии полового цикла и наличия воспалительного процесса.
Теоретическая и практическая значимость работы. Выполненные исследования носят фундаментальный характер и содержат новые решения актуальной научной проблемы выяснения становления физиолого-биохимических механизмов активного транспорта ионов.
Установленные особенности физиолого-биохимических механизмов активного транспорта с участием АТФазных ионных насосов с возрастом, кормлением, физиологическим состоянием необходимы для решения практических задач по созданию нормальных условий содержания животных, обеспечивающих полное проявление их генетических потенциальных возможностей.
Результаты проведенных исследований расширяют и конкретизируют существующие представления о взаимосвязи ферментных систем в эндометрии при физиологических перестройках, связанных с половой цикличностью, а так же при развитии острого и хронического воспалительных процессов.
Полученные данные открывают перспективу для дальнейших исследований по раскрытию молекулярных механизмов функционирования АТФазных транспортных систем в субклеточных структурах клеток органов и тканей животных при изменении внешних и внутренних условий существования. Результаты работы предполагают целенаправленный поиск специфических препаратов, способных эффективно регулировать транспортные процессы. Проведенные биохимические исследования вносят несомненный вклад в решение фундаментальной проблемы регуляции активного транспорта веществ с участием АТФазных ионных насосов.
Положения, выносимые на защиту:
1. Существует видовая особенность активности АТФазных ферментных систем клеток тканей и органов.
2. Физиолого-биохимические механизмы активного транспорта ионов с участием Mg2+-; Na+,K+-; Ca2+- и HCO3-- АТФаз в организме птиц имеют возрастные особенности.
3. Кормовые добавки (пептидная и сукцинат натрия) оказывают стимулирующее влияние на активность АТФаз, физиолого-биохимические показатели крови, тканей и органов и продуктивность цыплят-бройлеров.
4. Чрезвычайный фактор, вызвавший эндометрит изменяет физиолого-биохимические механизмы активного транспорта с участием Mg2+-; Na+,K+-; Ca2+- и HCO3—АТФаз субклеточных органоидов эндометрия свиноматок.
Апробация работы и публикации. Материалы диссертационной работы доложены и одобрены на: Международной научно-производственной конференции по акушерству, гинекологии и биотехнологии репродукции животных (С.-Петербург, 2001); VI международной научно-производственной конференции «Проблемы сельскохозяйственного производства на современном этапе и пути их решения» (Белгород, 2002); Международной научно-практической конференции молодых ученых и специалистов «Аграрная наука в начале XXI века» (Воронеж, 2002); VII международной научно-производственной конференции БГСХА «Проблемы сельскохозяйственного производства на современном этапе и пути их решения» (Белгород, 2003); XV международной научно-практической конференции, посвященной 300-летию С.-Петербурга «Новые фармакологические средства в ветеринарии» (С.-Петербург, 2003); Международной научно-практической конференции Курского института социального образования (филиала) РГСУ «Теоретические и прикладные проблемы социально-правовых, медико-биологических, технико-экономических сфер жизни общества» (Курск, 2007); Международной научно-практической конференции Курского института социального образования (филиала) РГСУ «Научные исследования, автоматика и динамика машин, инновационные и средозащитные технологии в техносфере» (Курск, 2007); Конференциях профессорско-преподавательского состава Курской государственной сельскохозяйственной академии имени И.И. Иванова (Курск, 1995-2005); VIII международном симпозиуме «Биологические механизмы старения» (Украина, Харьков, 2008); Всеукраинской научной конференции с международным участием «Актуальные проблемы современной биохимии и клеточной биологии» (Украина, Днепропетровск, 2008); II съезде физиологов СНГ (Кишинев, 2008); 74-й научной конференции Курского государственного медицинского университета, сессии Центрально-Черноземного научного центра РАМН и отделения РАЕН (Курск, 2009); Всеукраинской научно-практической конференции «Досягнения перспективи експерементальноi i клiнiчноi бiохiмii» (Украина. Тернополь, 2009); Всероссийской научной конференции с международным участием «Теоретические основы физической культуры» (Казань, ТГГПУ, 2009); Международной научно-практической конференции «Актуальные проблемы ветеринарной медицины», посвященной 90-летию ФГОУ ВПО МГАВМиБ (Москва, 2009); Международной научно-практической конференции «Адаптация и становление физиологических функций у животных», посвященной 90-летию кафедры физиологии животных ФГОУ ВПО МГАВМиБ (Москва, 2010); межкафедральном совещании по предварительной экспертизе диссертации в ФГОУ ВПО МГАВМиБ.
По материалам диссертации опубликованы 52 работы, в том числе: 3 -патента на полезную модель, 11 - в рецензируемых печатных изданиях, рекомендованных ВАК РФ. В публикациях содержится полный объём информации, касающийся темы диссертации.
Основные материалы, изложенные в диссертации, получены автором самостоятельно.
Выражаю научным консультантам и своим коллегам глубокую благодарность и признательность за оказанную помощь.
Структура и объём диссертации
Диссертация изложена на 246 страницах машинописного текста, иллюстрирована 40 таблицами и 79 рисунками. Состоит из введения, обзора литературы, описания методов исследования (1 глава), изложения собственных результатов (6 глав), заключения, выводов, практических рекомендаций и списка литературы, включающего 359 источника, в том числе 228 отечественных и 131 иностранных.
2. Материалы и методы исследований
Исследования проведены в 1992…2010 г.г. и выполнялись в научно-исследовательских лабораториях кафедры физиологии животных ФГОУ ВПО «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина», в биохимическом отделе ТМО № 6 г. Курска, на животных птицефабрики «Курская» Курского района Курской области, птицефабрики «Красная поляна» Железногорского района Курской области, ООО «Курские мясопродукты», подсобного хозяйства Курской АЭС.
Объем исследований представлен в таблице 1, общая схема исследований – на рисунке 1.
Таблица 1. Количество и возрастные группы исследованных животных
| Возраст | Количество, голов | Средняя масса тела |
| Цыплята-бройлеры кросса «ISA» | ||
| 1 сут | 50 | 46,3±0,7 г |
| 10 сут | 40 | 271±11 г |
| 20 сут | 40 | 774±31 |
| 30 сут | 40 | 1157±68 г |
| 40 сут | 40 | 2125±109 г |
| Свиньи крупной белой породы | ||
| 2 мес. | 10 | 18-19 кг |
| 6 мес. | 10 | 75-85 кг |
| 12 мес. | 10 | 110-120 кг |
| Здоровые свиноматки крупной белой породы | ||
| 2 года | 21 | 170-180 кг |
| Свиноматки крупной белой породы с острым эндометритом | ||
| 2 года | 21 | 170-180 кг |
| Свиноматки крупной белой породы с хроническим эндометритом | ||
| 2 года | 21 | 170-180 кг |
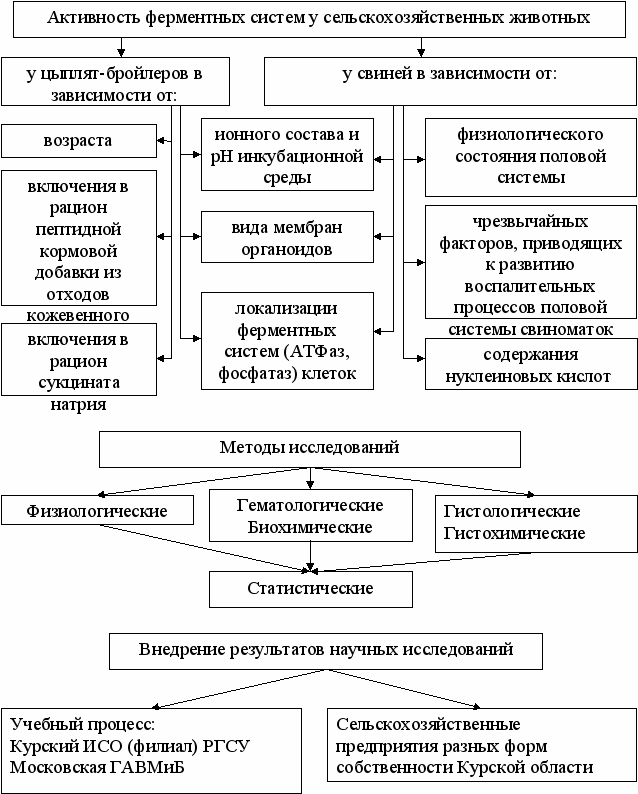 Рис.1. Схема исследований
Рис.1. Схема исследованийМатериалы исследований. Для решения поставленных задач проведено:
1. Исследование влияния кормовых добавок на четырех группах цыплят. Из суточных цыплят живой массой 37–40 грамм были сформированы четыре группы по 100 голов в каждой: три группы опытные и одна – контрольная.
Кормление экспериментальных цыплят проводили комбикормами с пониженным уровнем протеина, в 100 г которых содержалось 18–20 % сырого протеина и 295–310 ккал обменной энергии. Для доведения уровня протеина в комбикорме до рекомендуемых норм использовали протеиновую кормовую добавку из отходов кожевенного производства (опытные группы 1 и 2), мясокостную муку и сухое обезжиренное молоко (опытные группы 3 и 4), содержание в кормосмесях опытных и контрольной групп сырого протеина, кальция и фосфора существенно не отличалось (P>0,05).
В течение периода постановки опыта (40 суток) оценивали общее клиническое состояние и поведение птицы. Отмечено, что скармливание препаратов в указанных дозах не вызывает видимых изменений в поведении и клиническом состоянии цыплят.
Норма кормления соответствовала рекомендации ВИЖа (А.П. Калашников, В.И. Фисинин, В.В. Щеглов, Н.И. Клейменов, 2003).
Во время опытов осуществляли контроль за состоянием здоровья животных, вели наблюдение за приемом и поедаемостью корма, учитывали их реакцию на различные внешние раздражители.
Кровь для исследований брали у цыплят в 1, 10, 20, 30 и 40 суточном возрасте из вен шеи после умерщвления декапитацией. Отделение эритроцитов от плазмы проводили путем центрифугирования в рефрижераторной центрифуге (t=100C) в течение 30 мин при 3000 оборотах. Эритроциты после отделения от плазмы двукратно отмывали физиологическим раствором.
Печень, почки, фрагменты скелетной мускулатуры и сердце брали у цыплят в 10, 20, 30 и 40 суточном возрасте.
2. Изучение активности ферментных систем эндометрия свиноматок в зависимости от состояния здоровья и стадии полового цикла. Животных разделяли на группы в зависимости от состояния здоровья и стадии полового цикла. Стадии полового цикла определяли по функциональному состоянию яичников и на основании гистологического анализа. Характер воспалительного процесса устанавливали на основании гистологических исследований эндометрия.
Фрагменты эндометрия брались из разных участков рога матки свиноматок непосредственно во время убоя для биохимического, гистологического и гистохимического анализа.
Методы исследований. Физиологическое состояние свиней и птиц, в зависимости от возраста, оценивали общепринятыми в клинической практике методами – определение температуры тела, частоты пульса и дыхательных движений в минуту, массы тела и ее среднесуточный прирост, состояния кожи, волосяного покрова, слизистых оболочек, выделений (В.Ф. Лысов, 1977, 2004, А.И. Кузнецов, 2003; и др.).
Для определения морфофизиологических, биохимических показателей, брали кровь из хвостовой артерии свиней от 10 животных в каждой группе. Кровь стабилизировали гепарином. У птиц - методом декапитации, а в более старшем возрасте – из подкрыльцовой вены от 10 животных в каждой группе. Кровь стабилизировали средой Алсвера.
Морфофизиологические показатели. В крови определяли скорость оседания эритроцитов (СОЭ) методом Панченкова. Определение гемоглобина – гемоглобин-цианидным колориметриическим методом (Симонян Г.А, 1995; Петров А.М. и др., 1995, 1999). Подсчет эритроцитов и лейкоцитов в камере Горяева и автоматическим кондуктометрическим счетчиком «Пикоскель-PS-4» (Лысов В.Ф. и др., 2004). Отдельных форм лейкоцитов (лейкограмму) общепринятыми методами (Кондрахин И.П., 1985; Симонян Г.А. идр., 1995). В сыворотке крови исследовали содержание общего белка на рефрактометре ИРФ-22, концентрацию общего кальция, неорганического фосфора, глюкозы, АЛТ, АСТ устанавливали с использованием наборов «Био-Ла-Тест» фирмы «Лахема» с последующим спектрофотометрированием, фракции белка методом электрофореза на пленках из ацетата целлюлозы, аминокислотный состав мышечной ткани – автоматическим анализатором ААА 339М (Микротехна Прага).
Биохимические показатели.
1. Субклеточные фракции (ядра, митохондрии, лизосомы) выделяли методом дифференциального центрифугирования с последующим двухкратным промыванием каждой фракции в 50 - мМ трисHCl буфере (рН 7,4) по методике Chauveau J. et al.(1956).
2. Выделение ядер и цитоплазматических мембран эритроцитов цыплят-бройлеров методом 3-х кратного замораживания-оттаивания в растворе сахарозы.
3. АТФазную активность определяли методами:
а) Keeton, K.S., 1972, при этом активность Na+,К+ - АТФазы рассчитывали по разности между общей АТФазой и уабаиннечувствительной АТФазой.
б) Иващенко А.Т. и др.,1981. при этом активность АТФаз оценивали по приросту неорганического фосфата после инкубации при 370С и выражали в наномолях неорганического фосфата (Фн) отщепленного 1 мг белка в 1 мин.
4. Неорганический фосфат определяли спектрофотометрическим методом (Кондрашова М.Н. и др., 1965) при длине волны 390нм, а также по методу Чена (1957) в модификации Казеннова А.М. и соавт. (1984).
5. Определение активности протеолитических ферментов в гомогенате и субклеточных фракциях проводили модифицированным методом Ансона М.Л. (Anson M.L., 1938).
6. Концентрацию белка в гомогенате и субклеточных фракциях определяли методом Lowry et al (1951), а также методом Варбурга и Кристиана (Досон Р., 1991).
