Влияние возраста и физиологического состояния животных на активность ферментных систем клеток, тканей и органов 03. 03. 01 физиология 03. 01. 04 биохимия
| Вид материала | Автореферат |
- «Физиология и этология животных» Специальность 111201. 65 Ветеринария. Пояснительная, 240.53kb.
- Методические рекомендации к написанию и оформлению рефератов по курсу «физиология, 129.81kb.
- Анатомия и физиология человека Общее знакомство с организмом человека, 174.34kb.
- Задачами физиологии и этологии животных являются, 536.54kb.
- Тема: Двигательная активность и лфк для людей пожилого возраста, 353.11kb.
- «Физиология нервной системы», 172.86kb.
- Пояснительная записка Нормальная физиология наука и учебная дисциплина о жизненных, 578.98kb.
- Влияние пренатального стресса на процессы окислительной модификации белков и активность, 202.57kb.
- Рабочая программа дисциплины «физиология» (Физиология животных), 288kb.
- Программа дисциплины «Физиология с основами анатомии», 721.8kb.
7. Активность АСТ и АЛТ в гомогенате определяли методом Райтмана-Френкеля (Колб и др., 1976; Кондрахин И.П. и др., 1985).
8. Белок в гомогенате определяли спектрофотометрически методом Варбурга и Кристиана (Досон Р., 1991).
8. Активность ЩФ и КФ в гомогенате устанавливали методом Бодански (Комаров Ф.И. и др., 1981) по гидролизу n-нитрофенилфосфата.
9. Белковые фракции в гомогенате оценивали электрофоретически на мембранах из ацетата целлюлозы «Владипор» МФАС–ОС–1.
10. Количественное содержание РНК и ДНК в навеске слизистой оболочки матки устанавливали методом двухволновой спектрофотометрии в УФ спектре (Шмидт, Таннгаузер, 1945).
11. Активность дезоксирибонуклеазы и рибонуклеазы определяли опосредованно по уменьшению содержания нуклеиновых кислот в гомогенате эндометрия в процессе инкубирования в 0,2 М натрий-ацетатном буфере при рН 5,2 (метод Schneider W.S., Hogeboon J.H., 1952 в модификации Бенинг Т.А., 1964; Шапот В.С., 1968; Марокко И.Н., 1971).
12. Гистологические исследования проводили по методу Меркулова, гистохимический анализ по Гомори (Агеев А.К., 1969; Журавлева Т.Б., 1978).
В работе использовали реактивы фирм Sigma, Merk, наборы реактивов «Био-Ла-Тест» фирмы «Лахема» и реактивы отечественного производства (ч.д.а.).
Статистическая обработка. Полученные в ходе исследований данные подвергались биометрической обработке (Варфоломеев С.Д., 1999; Дерффель К.,1994; Геккелер К.,1994; Крутов В.И., 1989, Макарова Н.Я., Трофимец В.Я., 2002, Кутейников А.Н., 2008) на ПЭВМ с использованием пакета прикладных программ.
Достоверность обозначалась: * - Р < 0,05; ** - Р < 0,01.
3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
3.1. Активность ферментных систем тканей и органов птиц и свиней
3.1.1. АТФазная активность органов и тканей цыплят-бройлеров
Активность общей АТФазы и влияние на неё ионов электролитов и ингибиторов. Ионы натрия, калия и магния оказывают активирующее действие на активность АТФазы в разных диапазонах концентраций, так максимальная АТФазная активность проявляется при концентрациях ионов: натрия – 115-145, ионов калия – 19-28, ионов магния – 2,0 - 4,0ммоль·мл-1.
Однофакторный дисперсионный анализ показал, что активность АТФазы была на 76,5% детерминирована ионами магния, на 96,5% ионами натрия и на 47,6% ионами калия.
Изучение комбинаций оптимальных концентраций этих ионов показало, что максимальная АТФазная активность отмечалась в инкубационной среде, содержащей: Na+ - 120 ммоль·мл, К+ - 20 ммоль·мл; Mg2+ - 3,0 ммоль·мл и составляла 9,240,23 нмоль Фн ·мг белка-1·мин-1.
Полученные результаты указывают на то, что ионы натрия играют основную регуляторную роль в активности фермента.
Анализ этих данных позволяет предположить, что величина транспорта веществ, а, следовательно, и активность АТФазы существенно зависит от количества натрия в плазме крови. Таким образом, избыток или недостаток этих ионов в кормах цыплят-бройлеров может отражаться на уровне межклеточного обмене веществ, вызывая его существенные нарушения.
Влияния ионов на АТФазную активность ядер и цитоплазматических мембран эритроцитов цыплят-бройлеров. У цыплят суточного возраста отмечено, что наибольшую активность в цитоплазматических мембранах имели Na+,K+- и HCO3--АТФазы, в ядрах - HCO3--АТФаза (табл. 2.).
Таблица 2. АТФазная активности цитоплазматических и ядерных мембран эритроцитов цыплят суточного возраста (нмоль Фн мг белка-1·мин-1) и коэффициенты детерминации, (n=10)
| АТФаза Мембраны | Mg2+- | Na+,K+- | Ca2+- | HCO3-- |
| Цитоплазматическая | 8,320,12 | 12,370,13 | 10,360,14 | 12,150,13 |
| Коэфф. детерминации | - | 0,97** | 0,87** | 0,96** |
| Ядерная | 4,890,18 | 5,080,14 | 5,050,15 | 14,610,43 |
| Коэфф. детерминации | - | 0,03 | 0,02 | 0,96** |
Однофакторный дисперсионный анализ показал, что ионы Na+,K+ детерминируют АТФазную активность цитоплазматических мембран на 97%, ионы Ca2+ - на 87% и HCO3- анион - на 96% (P<0,01).
Активность АТФазы ядер не зависела от наличия в среде инкубации ионов Na+,K+ и Ca2+ (P>0,05) и была детерминирована ионами HCO3- на 96% (P<0,01).
Двухфакторный дисперсионный анализ (табл. 3). Показал, что наибольшее влияние на активность АТФаз цитоплазматических мембран и ядер оказывал возраст цыплят.
Таблица 3. Коэффициенты детерминации влияния возраста и ионного состава среды инкубации на активность АТФаз, (n=40)
| Коэффициенты детерминации | Na+, K+ | Ca2+ | HCO3- |
| Цитоплазматическая мембрана | |||
| фактор А (возраст) | 0,5480** | 0,7250** | 0,3610** |
| фактора Б (ионный состав) | 0,3450* | 0,1290* | 0,5230* |
| Ядра | |||
| фактор А (возраст) | 0,9190** | 0,9230** | 0,0283* |
| фактора Б (ионный состав) | 0,0004 | 0,010* | 0,8490** |
АТФазная активность цитоплазматической мембраны эритроцитов была детерминировали ионами Na+, K+, Ca2+ и HCO3-. В то же время ионы Na+, K+ и Ca2+ практически не влияли на АТФазную активность ядер, а анион HCO3- детерминировал ее на 84,9%. Это говорит о том, что цитоплазматические мембраны эритроцитов цыплят содержат анион-чувствительную АТФазу, подобную F1-фактору Рэкера и, по-видимому, участвующую в процессах энергообеспечения эритроцитов птиц.
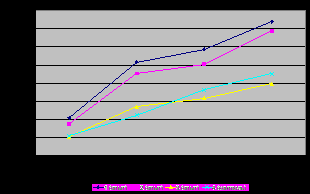
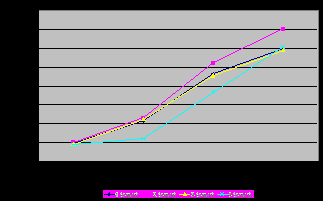
Влияние кормовых добавок на активность АТФаз ядерных и цитоплазматических мембран эритроцитов цыплят-бройлеров. Активность АТФаз цыплят 10 суточного возраста существенно ниже, чем у цыплят 20, 30 и 40-суточного возраста, что, по-видимому, связано с возрастными особенностями строения эритроцитов (рис.2-5.).
Активность Na+,K+- и HCO3--АТФаз была (Р0,05) выше во всех опытных группах, чем активность Mg2+-АТФазы. Причем с возрастом отмечался более интенсивный прирост активности этих АТФаз, что подтверждается уравнениями регрессии.
На величину активности АТФаз существенное влияние оказывали изучаемые препараты. Так, активность АТФаз в 1 и 2 группах опыта была выше этого показателя в контрольной группе (Р0,05).
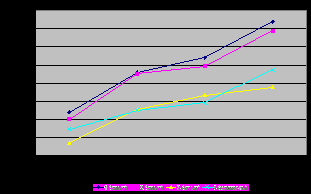 |  |
| Рис. 2. Активность Mg2+-АТФазы цитоплазматических мембран эритроцитов цыплят бройлеров, (n=10) | Рис. 3. Активность Na+,K+-АТФазы цитоплазматических мембран эритроцитов цыплят бройлеров, (n=10) |
 |  |
| Рис. 4. Активность Ca2+-АТФазы цитоплазматических мембран эритроцитов цыплят бройлеров, (n=10) | Рис. 5. Активность HCO3--АТФазы цитоплазматических мембран эритроцитов цыплят бройлеров, (n=10) |
У цыплят опытной группы 1, получавшей ПКД, рост активности АТФазы происходил более интенсивно по сравнению с другими группами (табл. 6.).
Таблица 6. Уравнения регрессии динамики активности АТФазы (у - активность АТФазы, а Х - возраст цыплят)
| Группа | Mg2+-АТФаза | Na+,K+-АТФаза | Ca2+-АТФаза | HCO3--АТФаза |
| 1 | y=8,95+0,15X | y=10,71+0,16X | y=9,69+0,16X | y=8,05+0,44X |
| 2 | y=8,88+0,14X | y=10,30+0,16X | y=9,67+0,16X | y=7,95+0,44X |
| 3 | y=7,94+0,097X | y=10,29+0,09X | y=9,36+0,13X | y=9,06+0,31X |
| 4 | y=8,27+0,097X | y=9,90+0,11X | y=9,18+0,10X | y=8,75+0,29X |
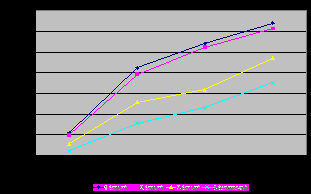
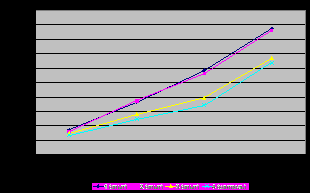
Динамика АТФазной активности ядер эритроцитов цыплят бройлеров при скармливании им ПКД и сукцината была существенно ниже (Р0,05), чем цитоплазматических мембран (рис. 6-9).
С возрастом отмечается существенный прирост активности Mg2+-, Na+,K+- и Ca2+-АТФаз. В то время как активность HCO3--АТФазы снижается.
 | 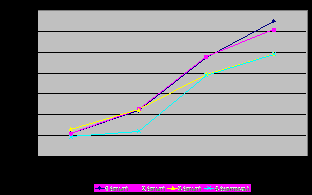 |
| Рис. 6. Активность Mg2+-АТФазы ядер эритроцитов цыплят-бройлеров, (n=10) | Рис. 7. Активность Na+,K+-АТФазы ядер эритроцитов цыплят-бройлеров, (n=10) |
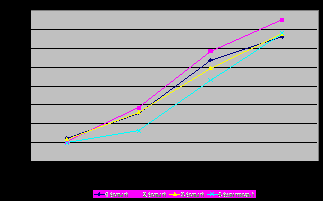 |  |
| Рис. 8. Активность Ca2+-АТФазы ядер эритроцитов цыплят-бройлеров, (n=10) | Рис. 9. Активность HCO3--АТФазы ядер эритроцитов цыплят-бройлеров, (n=10) |
Активность Mg2+-АТФазы у цыплят 10, 20, 30 и 40 суточного возраста всех групп опыта была достоверно (Р0,05) выше, чем в контроле.
Общая динамика изменения Na+,K+-АТфазной активности аналогична динамике Mg2+-АТФазы.
Внесение в среду инкубации ионов Ca2+ не отражалось на АТФазной активности ядер эритроцитов цыплят-бройлеров 10 суточного возраста по сравнению с Mg2+-АТФазой.
Активность HCO3--АТФазы ядер по сравнению с активностью Mg2+-АТФазы была выше в среднем в 2,5 раза.
Для Mg2+-, Na+,K+ и Ca2+-АТФаз установлена сходная динамика возрастной активности, несколько отличающаяся по группам опыта - наибольший прирост активности отмечен в группах 1 и 2, получавших ПКД (табл. 7.).
Таблица 7. Уравнения регрессии динамики активности АТФазы ядер
| Группа | Mg2+-АТФаза | Na+,K+-АТфаза | Ca2+-АТФаз | HCO3--АТФаз |
| 1 | y=3,48+0,08X | y=3,54+0,08X | y=3,46+0,09X | y=10,60-0,04X |
| 2 | y=3,19+0,10X | y=3,23+0,10X | y=3,27+0,11X | y=15,67-0,12X |
| 3 | y=3,47+0,08X | y=3,46+0,08X | y=3,44+0,09X | y=12,77-0,09X |
| 4 | y=3,18+0,08X | y=3,23+0,08X | y=3,13+0,10X | y=10,40-0,03X |
Динамика активности HCO3--АТФазы имеет существенные отличия от других АТФаз - отмечено ее снижение, особенно интенсивное в опытных группах 2 и 3, получавших сукцинат натрия (Р0,05).
Скармливание препаратов значительным образом отражается на динамике прироста АТФазной активности, что видно по уравнениям регрессии. Так наибольшее влияние на активность HCO3--АТФазы ядер оказывает совместное применение препаратов (опытная группа 2) и янтарная кислота (опытная группа 3), что очевидно связано с активацией энергетического обмена.
Двухфакторный дисперсионный анализ (табл. 8) показал, что активность Mg2+-АТФазы на 61,3 %, 63,9% и 79,7% соответственно в 1, 2 и 3 опытных группах детерминирована возрастом цыплят и на 28,9 % скармливанием ПКД, 21,6% - при совместном скармливании ПКД и сукцината. Использование сукцината (опытная группа 3) оказывало влияние на активность этой АТФазы на 1,5%. Совместное влияние факторов было так же незначительным: 3,1%, 3,1% и 4,7% соответственно по группам опыта (Р0,05).
Активность Na+,K+-АТфазы на 61,8 %, 70,4% и 86,9% детерминирована возрастом цыплят (соответственно в 1, 2 и 3 опытных группах) и на 30,7 % скармливанием ПКД, 20,6% - при совместном скармливании препаратов. Использование сукцината (опытная группа 3) не оказывало достоверного влияния. Совместное влияние факторов было незначительным: 3,7%, 3,6% и 2,57% соответственно по группам опыта.
Таблица 8. Результаты двухфакторного дисперсионного анализа, (n=160)
| Коэффициенты детерминации | 1 (опыт) | 2 (опыт) | 3 (контроль) |
| Mg2+-АТФаза | |||
| фактор А (возраст) | 0,613* | 0,639* | 0,797** |
| фактора Б (добавки) | 0,289* | 0,216* | 0,015* |
| совместное влияние факторов | 0,031* | 0,032* | 0,047* |
| Na+,K+-АТфаза | |||
| фактор А (возраст) | 0,618* | 0,704* | 0,869* |
| фактора Б (добавки) | 0,307* | 0,206* | 0,003 |
| совместное влияние факторов | 0,037* | 0,036* | 0,025* |
| Ca2+-АТФаза | |||
| фактор А (возраст) | 0,579* | 0,610* | 0,816** |
| фактора Б (добавки) | 0,328* | 0,294* | 0,082** |
| совместное влияние факторов | 0,045* | 0,043* | 0,012* |
| HCO3--АТФаза | |||
| фактор А (возраст) | 0,854** | 0,863** | 0,964** |
| фактора Б (добавки) | 0,107* | 0,099* | 0,007* |
| совместное влияние факторов | 0,031* | 0,029* | 0,001 |
Практически аналогичное влияние факторов было установлено для активности Ca2+-АТФазы. Возраст влиял на активность этого фермента 57,9 %, 61,0% и 81,6% (соответственно в 1, 2 и 3 опытных группах).
Активность Ca2+-АТФазы была детерминирована на 32,8 % скармливанием ПКД, 29,4 % - при совместном скармливании препаратов и на 8,2% - сукцинатом.
Совместное влияние факторов было так же незначительным: 4,5%, 4,3% и 1,2% соответственно по группам опыта.
Активность HCO3--АТФазы была так же детерминирована возрастом цыплят, соответственно по группам опыта на 85,4 %, 86,3 % и 96, 4 %. В то же время влияние добавок было существенно меньшим - 10,7%, и 9,9 % в группах 1 и 2, получавших ПКД и ПКД совместно с сукцинатом. Влияние сукцината (группа 3) было несущественным 0,7%. Незначительным было так же и совместное влияние факторов – 3,1% и 2,9% соответственно в группах опыта 1 и 2.
Активность Mg2+-АТФазы, Na+,K+-АТфазы и Ca2+-АТФазы ядер почти на 90 %, была детерминирована возрастом цыплят. Влияние добавок и совместное влияние факторов было незначительно 0,9 – 3,9% (табл. 9).
Таблица 9. Результаты двухфакторного дисперсионного анализа, (n=160)
| Коэффициенты детерминации | 1 (опыт) | 2 (опыт) | 3 (контроль) |
| Mg2+-АТФаза | |||
| фактор А (возраст) | 0,906** | 0,899** | 0,888** |
| фактора Б (добавки) | 0,013* | 0,039* | 0,011* |
| совместное влияние факторов | 0,013* | 0,012* | 0,015* |
| Na+,K+-АТфаза | |||
| фактор А (возраст) | 0,891** | 0,893* | 0,842** |
| фактора Б (добавки) | 0,009* | 0,023* | 0,006 |
| совместное влияние факторов | 0,016* | 0,005 | 0,011 |
| Ca2+-АТФаза | |||
| фактор А (возраст) | 0,911** | 0,908** | 0,916** |
| фактора Б (добавки) | 0,012* | 0,031* | 0,009* |
| совместное влияние факторов | 0,012* | 0,012* | 0,007 |
| HCO3--АТФаза | |||
| фактор А (возраст) | 0,659* | 0,259* | 0,520* |
| фактора Б (добавки) | 0,009 | 0,614* | 0,219* |
| совместное влияние факторов | 0,025 | 0,092* | 0,124* |
Активность HCO3--АТФазы была также детерминирована возрастом цыплят, соответственно по группам опыта на 65,9 %, 25,9% и 52,0 %.
Достоверное влияние кормовых добавок было установлено только в группах опыта 2 и 3, получавших сукцинат, соответственно на 61,4% и 21,9%. В этих группах опыта так же выявлено совместное влияние факторов, детерминирующих активность фермента на 9,2% и 12,4% соответственно.
АТФазная активность тканей и органов цыплят бройлеров. АТФазная активность неодинакова в различных тканях. Изученные нами объекты по убыванию активности можно расположить в следующий ряд: почкипеченьэритроцитыскелетные и сердечные мышцы. В процессе выращивания цыплят (с возрастом) активность АТФазы возрастает. Наибольшие изменения в этом отношении отмечены в почках, далее следует печень и эритроциты и в меньшей степени такие сдвиги наблюдались в мышцах.
Проведенные исследования также показали, что АТФазная активность во всех изученных объектах находится в зависимости от состава рациона, что подтверждается уравнениями регрессии (табл.10).
Рост активности АТФазы в гепатоцитах цыплят опытных групп 1 и 2 происходил более интенсивно, чем в контрольной группе и группе опыта 3. Более высокую активность АТФазы в гепатоцитах цыплят опытных групп 1 и 2 можно объяснить тем, что протеин кормовой добавки гидролизован, продукты гидролиза интенсивно всасываются в кишечнике, достигают печени и активизируют в ней метаболические процессы.
Таблица 10. Уравнения регрессии активности АТФазы тканей и органов цыплят-бройлеров (у - активность АТФазы, Х - возраст цыплят в сут)
| Группа | Печень | Почки | Мышечная ткань | Сердце |
| 1 | y=5,94+0,10X | y=7,34+0,03X | y=6,81+0,07X | y=7,69+0,09X |
| 2 | y=5,90+0,09X | y=7,27+0,03X | y=6,75+0,07X | y=7,66+0,09X |
| 3 | y=5,95+0,09X | y=7,23+0,03X | y=6,73+0,07X | y=6,66+0,11X |
| 4 | y=5,89+0,09X | y=7,16+0,03X | y=6,86+0,06X | y=6,46+0,12X |
В почках и мышцах рост активности АТФазы можно расположить в следующей убывающей последовательности: 1, 2, 3 опытные группы и 4 контрольная группа.
В сердечной мышце наиболее интенсивный рост активности АТФазы происходил в контрольной группе и опытной группе 3, получавшей сукцинат.
Двухфакторный дисперсионный анализ влияния возраста и кормовых добавок показал, что АТФазная активность печени, почек, сердца и мышечной ткани в значительной степени детерминирована возрастом (P<0,05), соответственно на 83,8%, 44,6%, 80,9% и 71,0%.
Влияние кормовых добавок было существенно меньше (P<0,05) и составляло: печень - 1,5%; почки - 4,9%; сердце – 2,9%; скелетная мускулатура – 2,1%. Наибольшее влияние добавок отмечено для АТФазы почек. Совместного влияния факторов было незначительным (P>0,05).
3.1.2. Активность ферментных систем тканей и органов свиней
Активность АТФаз эритроцитов свиноматок.
Влияние строфантина-G на АТФазную активность эритроцитов свиней.
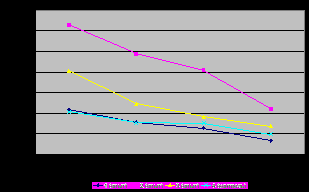
С возрастом отмечается достоверное снижение активности Mg2+,Na+,K+-АТФазы, Mg2+-АТФазы и Na+,K+-АТФазы эритроцитов свиней (рис. 9.), что подтверждается данными корреляционного и регрессионного анализов (табл.11)
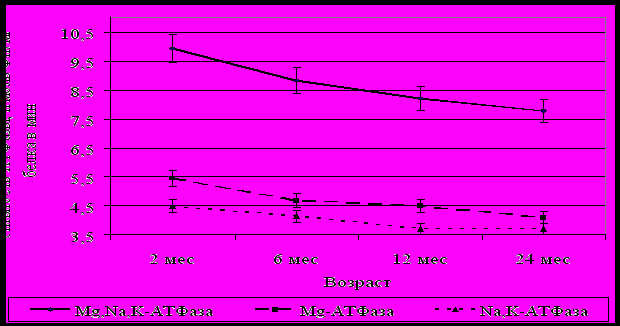
Рис.9. Динамика АТФазной активности эритроцитов свиней и влияние на нее ингибиторов
Таблица 11. Показатели корреляционного и регрессионного анализа возрастной динамики активности АТФазы эритроцитов свиней
| Показатель | Mg2+,Na+,K+-АТФаза | Mg2+-АТФаза | Na+,K+-АТФаза |
| Коэффициент возрастной корреляции | -0,7753* | -0,82301* | -0,5556143* |
| Уравнение регрессии | y=9,64-0,047x | y=5,27-0,054x | y=4,37-0,033x |
Двухфакторный дисперсионный анализ показал, что активность АТФазы была детерминирована на 9,15% возрастом и на 87,34% строфантином-G (Р<0,05). Совместное влияние факторов было незначительным (0,58%).
Влияние стадий полового цикла на АТФазную активность эндометрия свиней. Во всех стадиях полового цикла активность Mg2+-; Na+, K+-; Ca2+- и HCO3–-АТФаз была достоверно выше во 2-й трети рогов матки, что по нашему мнению связано с развитой сетью спиральных артерий и большим количеством маточных желез в этой части эндометрия (табл. 12).
Следует отметить, что АТФазная активность существенно зависела от стадий полового цикла. Наибольшая активность всех АТФаз в 1-й, 2-й и 3-й третях рогов матки была выявлена в стадии возбуждения полового цикла, в стадии торможения происходило достоверное снижение активности АТФаз, а наименьшие её значения были установлены в стадии уравновешивания полового цикла. Это связано с интенсивными перестройками гистологической структуры и изменением уровня метаболических процессов в эндометрии, происходящих на разных стадиях полового цикла.
На АТФазную активность внутриклеточных органоидов эндометрия значительное влияние оказывал ионный состав среды инкубации. Добавление в среду ионов K+ приводило к достоверному приросту активности Na+,K+-АТФазы по сравнению с активностью Mg2+-АТФазы во всех стадиях полового цикла и участках рогов матки, что объясняется значительной ролью данной АТФазы в функционировании маточных желез и выработке секрета.
Активность Ca2+-АТФазы имела достоверные отличия от активности Mg2+-АТФазы:
- в ядрах в стадиях возбуждения и торможения полового цикла в 1-й и 2-й третях рогов матки, что связано с важной регулирующей ролью иона Ca2+ в процессах клеточной пролиферации;
- в митохондриях в стадии возбуждения во 2-й трети, в стадии торможения во всех участках рогов и в стадии уравновешивания в 1-й и 3-й третях рогов матки.
- в лизосомах в стадию возбуждения в 1-й и 3-й третях и в стадию уравновешивания во всех третях рогов матки.
Внесение в среду инкубации гидрокарбонат иона (HCO3-) привело к достоверному (Р0,05) увеличению АТФазной активности изучаемых органоидов по сравнению с Mg2+-АТФазой во всех участках рогов матки и стадиях полового цикла. Наибольший прирост активность этой АТФазы отмечалась в стадию возбуждения полового цикла, что связано, по-видимому, с интенсификацией пролиферации клеток эндометрия и активацией процессов энергообеспечения в эту стадию. В стадию торможения происходило достоверное снижение активности HCO3–-АТФазы, а наименьшего уровня она достигала в стадию уравновешивания.
В ядрах и лизосомах клеток различных участков эндометрия между активностями всех АТФаз и существует сильная положительная связь. В то время как для АТФаз митохондрий отмечается достоверная взаимосвязь активности Mg2+- АТФазы с активностью Ca2+- АТФазы и активности Na+,K+-АТФазы с активностью HCO-3-АТФазы (табл. 13, 14). Это свидетельствует, очевидно, о том, что АТФазы в ядрах и лизосомах выполняют сходные функции: поддержание осмотического давления и градиента концентраций ионов внутри этих органелл и активизация обменных процессов отражается на увеличение активности всех АТФаз. Достоверная корреляционная связь Mg2+- АТФазы с Ca2+-АТФазой митохондрий объясняется, очевидно, тем, что кальциевая АТФаза митохондрий очень чувствительна к ионам магния, а магниевая АТФаза, наоборот, к ионам кальция. Поэтому при активизации обменных процессов, для нормального функционирования митохондрий, необходимо поддержание соотношения этих ионов на одном уровне. Достоверная корреляционная связь активности Na+,K+-АТФазы с активностью HCO-3-АТФазы. Это объясняется, по-видимому, сильной чувствительностью Na+,K+- АТФазы митохондрий к концентрации водородных ионов, уровень которых в этих органоидах поддерживается на одном уровне за счет работы анионной АТФазы.
Таблица 12. Активность АТФаз органоидов клеток эндометрия свиноматок, нмоль Фн мг белка-1·мин-1, (n=10)
| АТФаза | Стадия возбуждения | Стадия торможения | Стадия уравновешивания | |||||||||
| Mg2+ | Na+, K+ | Ca2+ | HCO3- | Mg2+ | Na+, K+ | Ca2+ | HCO3- | Mg2+ | Na+, K+ | Ca2+ | HCO3- | |
| Ядра | ||||||||||||
| 1-я треть | 149,91,6* | 194,52,0*+ | 224,02,0*+ | 216,21,8*+ | 121,62,2* | 143,92,2*+ | 163,12,9*+ | 193,13,0*+ | 100,31,1 | 114,41,2+ | 111,81,1+ | 144,51,0+ |
| 2-я треть | 212,11,6* | 326,21,8*+ | 240,41,8*+ | 240,41,8*+ | 152,72,1* | 255,23,1*+ | 203,12,8*+ | 267,13,6*+ | 123,10,8 | 172,11,0+ | 124,20,5 | 238,31,6+ |
| 3-я треть | 119,61,28* | 172,61,6*+ | 130,31,5* | 181,21,2*+ | 79,23,9* | 111,12,0*+ | 92,12,5* | 155,91,8*+ | 69,21,6 | 95,21,3+ | 74,10,9 | 125,61,4+ |
| Митохондрии | ||||||||||||
| 1 | 263,01,6* | 389,41,7*+ | 242,61,8* | 636,12,7*+ | 220,75,2* | 316,22,0*+ | 158,42,8*+ | 547,36,8*+ | 200,21,9 | 282,61,2+ | 133,11,4+ | 502,51,9+ |
| 2 | 317,61,6* | 413,31,8*+ | 287,61,8*+ | 693,11,6*+ | 283,04,2* | 346,74,0*+ | 239,23,5*+ | 647,44,8*+ | 226,32,1 | 313,22,7+ | 214,61,7 | 589,12,6+ |
| 3 | 204,11,3* | 342,11,6*+ | 210,52,0* | 619,92,0+ | 152,52,3* | 249,41,0*+ | 225,63,3*+ | 574,812,1+ | 131,70,9 | 212,20,9+ | 181,01,1+ | 476,13,7+ |
| Лизосомы | ||||||||||||
| 1 | 122,51,1 | 158,01,0*+ | 113,81,0*+ | 158,51,3*+ | 79,91,5 | 128,02,2+ | 90,32,2 | 139,82,5+ | 73,51,0 | 118,90,8+ | 81,91,0+ | 119,01,2+ |
| 2 | 166,81,4* | 197,71,8*+ | 179,91,5* | 239,91,2*+ | 137,23,5* | 157,01,6*+ | 90,32,2 | 139,82,5+ | 124,61,0* | 135,30,7*+ | 126,50,7*+ | 151,70,8*+ |
| 3 | 93,91,8* | 107,11,6* | 116,71,5*+ | 121,21,7*+ | 71,12,6 | 97,31,5*+ | 84,82,4 | 111,22,5*+ | 64,20,6* | 93,60,5*+ | 81,61,0+ | 96,91,0*+ |
