Применение озонированного перфторана в комплексном лечении острых перитонитов и профилактике послеоперационных осложнений (экспериментально-клиническое исследование) 14. 01. 17 хирургия
| Вид материала | Исследование |
- Местная сочетанная иммунотерапия в комплексном лечении и профилактике послеоперационных, 643.69kb.
- Применение композиционного материала «эластопоб»- ар при лечении грыж брюшной стенки, 330.27kb.
- Применение лазерной фотостимуляции в детской хирургии (экспериментально-клиническое, 554.39kb.
- Бимануальная и коаксиальная факоэмульсификация в лечении больных с сочетанной патологией, 593.1kb.
- Комплексное лечение неязвенных гастродуоденальных кровотечений с использованием внутрипросветной, 591.74kb.
- Оглы Профилактика спаечного процесса при хирургическом лечении трубной беременности, 419.84kb.
- А. И. Неймарк, И. B. Снегирев,, 129.75kb.
- Применение споробактерина в комплексном лечении острого холецистита у пациентов пожилого, 606.3kb.
- Местная цитокинотерапия в комплексном лечении и профилактике раневой инфекции открытых, 199.33kb.
- Экспериментально-клиническоеисследование, 142.06kb.
Основную исследуемую (1-ю) группу составили 24 пациента, которым в комплексное лечение перитонита было включено орошение брюшной полости озонированным перфтораном из расчёта 1 мл/кг массы больного и внутривенное введение озонированного перфторана из того же расчёта с заданной концентрацией озона 5 мг/л (5000 мкг/л).
2-ю (контрольную) группу составили 24 больных с перитонитом, которым проводилось стандартное лечение.
Наиболее частой причиной перитонита в 1-й и 2-й группах был деструктивный аппендицит – 25 (52,1 %) больных, далее следовали деструктивный холецистит – 9 (18,8 %), перфоративная язва желудка и 12-перстной кишки – 8 (16,7 %), гнойный сальпингит и пиоовариум – 4 (8,3 %), перфорация тонкой кишки – 2 (4,2 %).
У большинства пациентов в возрасте старше 45 лет, оперированных по поводу острого перитонита, выявлена сопутствующая патология: со стороны органов дыхания (бронхиты – 3; ХОБЛ – 1) у 4 (8,3%) больных; сердечно – сосудистой системы (ИБС – 1, ГБ – 3, варикозное расширение вен нижних конечностей – 2) в 6 (12,5%) случаях и хронические заболевания почек – у 2 (4,2%) больных; у двоих – сахарный диабет и ещё у одного– хронический алкоголизм. Все оперированные с деструктивным холециститом женщины (8 больных – 16,7%) страдали ожирением II-III степени.
Методы экспериментальных и клинических исследований
Цитологические исследования
Перитонеальные мазки, взятые по ходу эксперимента и во время операции у больных, фиксировали в смеси Никифорова и окрашивали по Романовскому-Гимза в нашей модификации.
Микроскопию мазков проводили с помощью бинокулярного светового микроскопа «Микмед-5» при иммерсионном увеличении х1000 (окуляр- х10, объектив- х100). Микрофотографирование проводили с помощью цифровой камеры, входящей в комплект «МЕКОС-Ц1».
Факторы неспецифической резистентности (методики применены в эксперименте и клинике)
Исследованы: а) фагоцитарный индекс (ФИ) и фагоцитарное число (ФЧ) с количеством лейкоцитов (КЛ);
б) средние цитохимические показатели (СЦП) интрацеллюлярной цитотоксичности (микробицидной активности) КБ и МПО;
в) сывороточные факторы - БАС и лизоцим.
I) КЛ в крови определяли по методу в камере Горяева (1972).
2) ФАЛ крови – по И.Я. Серебрийскому и М.А. Антоновой (1950).
3) БАС крови - по О.В. Смирновой и Т.А. Кузьминой (1966)).
4) активность лизоцима определяли по В.Г. Дорофейчуку (1968).
5) цитохимический метод определения КБ.
Активность КБ в лейкоцитах периферической крови определяли по методу В.С. Пигаревского (1983) в собственной модификации.
6) цитохимический метод определения активности МПО.
МПО в мазках из лейкоцитарной массы определяли по Грехем-Кнолю в модификации Корновского (1966).
Микробиологические исследования (использованы для изучения экспериментального и клинического материалов. Исследования проводили в лаборатории ФГУЗ «Дагестанская противочумная станция Роспотребнадзора»).
Определение родовой и видовой принадлежности проводилось:
а) по культуральным свойствам; б) морфологическим свойствам; в) биохимическим признакам.
Предварительно, таким же способом, исследована 5% каловая взвесь, которая вводилась крысам опытной группы. После титрования, путем последовательных десятикратных разведений, взвесь высевали на питательные среды: Эндо, КА, ЩА, ЖСА, МПБ с глюкозой, В-Б и К-Т и ЦДС, затем инкубировали в течение 24 ч в термостате при t° 37°С. Определяли также титр микробных тел в 1 мл (КОЕ – колониеобразующие единицы).
Гистологические исследования
Весь материал фиксировали в 10% нейтральном формалине и спирт-формоле. После парафиновой проводки, гистологические срезы толщиной 5-6 мкм, изготовляли на микротоме «Reichert» и окрашивали:
- гематоксилином и эозином;
- азур-нитрофунгин-фуксином и гематоксилином (АС № 1597667 от 08.06.1990, авторы: Р.М. Рагимов, Т.С. Гусейнов, З.Н. Бутаев);
- по Романовскому-Гимза в собственной модификации (удостоверение на отраслевое рацпредложение № 0-3007 от 02.10.1987);
- для выявления аргирофильных волокон – азотнокислым серебром по Футу (Lillie, 1966);
- для гистохимического выявления ДНК и РНК – метиловым зелёным и пиронином (Патент РФ на изобретение, № 2202776 от 20.04.2003, авторы: Р.М.Рагимов, А.С. Алкадарский);
- для выявления секрета бокаловидных клеток – альциановым синим.
Клеточный состав структур исследуемых органов изучали под иммерсионным увеличением х1000 микроскопа «Микмед-5».
Фармакокинетика перфторана изучена по предложенной нами методике: «Способ выявления перфторана в биологических тканях и жидких средах» (Патент РФ на изобретение №2221246 от 10.01.2004, авторы: Рагимов Р.М., Алкадарский А.С., Голубев А.М.). Под микроскопом обнаруживали окрашенные частицы перфторана.
Электронно-микроскопические исследования. Кусочки тканей селезёнки и брыжеечных лимфоузлов отдельно фиксировали в 2,5% растворе глютарового альдегида, приготовленном на 0,1М фосфатном буфере, затем их подвергали дегидратации в спиртах возрастающей концентрации, заливали в эпон – 812. Приготовленные на ультратоме «LKB-5» срезы толщиной в 0,3 мкм, контрастировали уранилацетатом и цитратом свинца. Исследования проводили в лаборатории электронной микроскопии ЦНИЛ Российского госмедуниверситета.
Методика денситоморфометрии
С помощью аппаратно-программного комплекса «МЕКОС-Ц1» определяли размеры изучаемых структур (в мкм) и их площади (в мкм2).
Дополнительные методы клинических исследований
Кроме Стандарта обследования, состоящего из общепринятых клинических, лабораторных и инструментальных методов, всем больным в динамике определяли ЛИИ, параметры неспецифической резистентности, цитологические и микробиологические показатели перитонеального экссудата в пробах, взятых во время операции, через сутки и на 5-е сутки. Кроме того, изучали моторную активность ЖКТ методом чрескожной фоноэнтерографии.
После лапаротомии и ревизии брюшной полости уточняли причину перитонита, его распространённость, брали мазки и экссудат для микробиологического исследования, оценивали тяжесть состояния и прогноз перитонита.
Методы статистической обработки результатов исследования
Статистическая обработка результатов исследования проведена с использованием компьютерной программы «Биостат», (версия 4.03, 1998г.). Вычислены показатели: средняя арифметическая (Х), стандартное отклонение (σ), стандартная ошибка средней (σх), медиана, min и max. Использованы парный критерий Стьюдента и критерий Стьюдента для множественных попарных сравнений с поправкой Бонферрони. Для отдельных показателей выборок определены медиана (Ме), 25-й и 75-й процентили (р25, р75), используя программу «Excel 2003»; различия между группами в этом случае определяли, применяя критерий Крускала – Уоллиса (при р<0,05, попарные множественные сравнения проводили по критерию Данна); использованы также критерий χ-квадрат и точный критерий Фишера (последние - для анализа таблиц сопряженности).
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Результаты экспериментальных исследований в контрольной группе животных (без перитонита)
Сравнительный анализ динамики результатов исследования в 4-х сериях контрольной группы показал существенную разницу в клеточном составе перитонеальной жидкости у животных 1-й и 3-й серий, по сравнению со 2-й и 4-й сериями. Это касалось, в первую очередь, макрофагов («перфторофагов») и нейтрофильных гранулоцитов, что, по нашему мнению, связано с воздействием перфторана и озона. Плотность макрофагов в мазках достоверно выше в 1-й и 3-й сериях до 7-х суток эксперимента, особенно, на 1-2-е сутки, но к 14-м суткам экспериментов не отличалась от нормы (табл. 7). Количество их увеличивалось более чем в 2 раза, и в 1-й серии на 1-е сутки достигало 7,64±1,03 (у интактных крыс - 3,78±0,97 на площади мазка в 8000 мкм2). В 3-й серии примерно такая же картина.
Таблица 7
Динамика мононуклеарных фагоцитов (Х±σ)
| Сроки | Серии | ||||
| 1-я серия | 2-я серия | 3-я серия | 4-я серия | Интактн. | |
| 1сутки | 8,36±1,43*# | 3,88±1,36 | 9,1±1,20*# | 3,77±0,67 | 3,88±1,17 |
| 2сутки | 8,77±1,30*# | 3,33±1,0 | 9,5±1,19*# | 3,11±0,60 | 3,88±1,17 |
| 3сутки | 7,88±1,05*# | 4,5±1,20 | 8,36±1,80*# | 4,22±0,97 | 3,88±1,17 |
| 7сутки | 6,37±1,06# | 5,28±0,95 | 7,0±1,30*# | 4,87±1,12 | 3,88±1,17 |
| 14 сутки | 4,57±0,53 | 3,87±0,83 | 4,71±1,11 | 4,28±0,75 | 3,88±1,17 |
Примечание: Х - среднее, σ – стандартное отклонение; *-р<0,05 по сравнению с 4 серией, #-р<0,05 по сравнению с интактными животными.
Усиливалась миграция эозинофилов, количество их, по сравнению с интактными животными, увеличивалось (Ме=2, р25=1, р75=2, min=0, max=3; р<0,05), в контрольной серии - (Ме=0, р25=0, р75=0, min=0, max=1). Во 2-й и 4-й сериях несколько была выражена реакция со стороны нейтрофильных лейкоцитов: во 2-й серии их количество на 1-2-е сутки было выше, чем у интактных крыс (табл.8).
Таблица 8
Динамика КЛ перитонеальной жидкости (Х±σ)
| Сроки | Серии | ||||
| 1-я серия | 2-я серия | 3-я серия | 4-я серия | Интактн. | |
| 1сутки | 3,36±1,02* | 6,11±1,05# | 4,0±1,05 | 4,88±1,05 | 4,11±1,05 |
| 2сутки | 2,88±0,78* | 6,37±0,74*# | 3,12±0,64* | 4,69±1,26 | 4,11±1,05 |
| 3сутки | 4,0±0,70 | 4,88±0,92 | 4,81±1,25 | 4,56±1,32 | 4,11±1,05 |
| 7сутки | 4,0±0,75 | 4,57±0,97 | 4,13±0,83 | 4,62±0,74 | 4,11±1,05 |
| 14сутки | 3,14±0,69* | 4,12±0,64 | 3,57±0,78 | 4,57±0,97 | 4,11±1,05 |
Примечание: Х – среднее, σ – стандартное отклонение; *-р<0,05 по сравнению с 4 серией, #-р<0,05 по сравнению с интактными животными.
Легкий нейтрофильный лейкоцитоз в перитонеальной жидкости, который сохранялся у крыс 2-й серии до 2-х суток, на 3-и сутки сменился на слабую лимфоцитарную реакцию, что является результатом воздействия озонированного физиологического раствора.
При исследовании параметров неспецифического иммунитета была обнаружена их существенная динамика также в 1-й и 3-й сериях (при введении озонированного перфторана и перфторана). Количество лейкоцитов крови увеличивалось на 1-3 сутки во всех сериях, кроме 4-й серии. Показатели фагоцитарного блока также были повышены: при этом во 2-й серии отмечалось увеличение только ФЧ, а в 1-й и 3-й сериях – обоих показателей – ФИ и ФЧ; причём во 2-й серии на 2-е и 7-е сутки, в 3-й серии – с 1-х по 7-е сутки , а в 1-й серии –показатели ФАЛ до конца экспериментов оставались высокими (табл. 9).
Таблица 9
Динамика ФЧ (в %) в группе контрольных животных (Х±σ)
| Сроки | Серии | ||||
| 1 серия | 2 серия | 3 серия | 4 серия | Интактн. | |
| 1сутки | 96,3±1,5*# | 85,3±2,7 | 95,2±1,3*# | 81,17±3,4 | 84,78±2,9 |
| 2сутки | 97,3±1,2*# | 89,5±4,3# | 97,0±1,2*# | 86,2±1,17 | 84,78±2,9 |
| 3сутки | 96,1±1,4*# | 84,7±3,01 | 96,2±1,9*# | 82,5±2,88 | 84,78±2,9 |
| 7сутки | 94,6±2,16*# | 89,5±3,7*# | 94,3±2,3*# | 82,8±2,71 | 84,78±2,9 |
| 14сут. | 91,2±1,17*# | 87,3±2,9 | 87,5±2,4 | 85,0±1,41 | 84,78±2,9 |
Примечание: Х - среднее, σ – стандартное отклонение; *-р<0,05 по сравнению с 4 серией, #-р<0,05 по сравнению с интактными животными.
Количественный СЦП КБ имел высокий уровень в сериях с перфтораном, и, особенно, с озонированным перфтораном. При введении озонированного перфторана стимулировалась также активность МПО, сохраняясь высокой до 3-х суток наблюдений.
Таблица 10
Динамика бактерицидной активности сыворотки (%, Х±σ)
| Сроки | Серии | ||||
| 1 серия | 2 серия | 3 серия | 4 серия | Интакт. | |
| 1сутки | 63,4±1,14*# | 47,2±1,3 | 62±0,71*# | 46,4±1,5 | 47±1,22 |
| 2сутки | 76,2±2,05*# | 50,4±1,14*# | 66,4±1,51*# | 46,6±1,5 | 47±1,22 |
| 3сутки | 60,4±1,52*# | 48,4±1,14 | 57,4±1,34*# | 48,4±1,3 | 47±1,22 |
| 7сутки | 51,4±2,51*# | 48,3±2,19 | 48,6±1,14 | 46,8±0,8 | 47±1,22 |
| 14сутки | 52,2±0,83*# | 48,2±0,83 | 49,2±0,83# | 48,0±1,0 | 47±1,22 |
Примечание: Х - среднее, σ – стандартное отклонение; *-р<0,05 по сравнению с 4 серией, #-р<0,05 по сравнению с интактными животными.
Уровни БАС и лизоцима были высоки в 1-й и 3-й сериях, но более в серии с озонированным перфтораном (табл. 10).
Некоторые аспекты фармакокинетики перфторана при внутрибрюшном его введении
При микроскопии мазков, окрашенных по предложенной нами методике, обнаруживались свободные частицы тёмно-фиолетового цвета; такие же частицы выявлялись на поверхности и в цитоплазме макрофагов и на мембранах эритроцитов. В цитоплазме отдельных макрофагов определялись неокрашенные частицы, которые при захвате макрофагами теряли оболочку из проксанола, поэтому и способность к окрашиванию. Через 24 часа резко возрастало количество «перфторофагов». Большая часть частиц после фагоцитоза не окрашивалась, но редко встречались мелкие частицы фиолетового цвета. Микроскопия замороженных срезов указывала на наличие частиц перфторана в синусоидах красной пульпы селезёнки. Через 72 часа количество перфторофагов увеличивалось в синусоидах красной пульпы селезёнки и встречались в промежуточных синусах брыжеечных лимфатических узлов. В препаратах печени появление перфторана мы наблюдали (в цитоплазме купферовских клеток) только на 4-7-е сутки после внутрибрюшного введения. В сроки 48-72 часа после инфузии перфторана, селезёнка крыс увеличивалась (размеры и масса) в 1,4 – 1,6 раз.
При внутрибрюшном введении перфторана, начиная с первых часов, происходило его всасывание в микрогемо- и лимфоциркуляторное сосудистое русло через стоматы брюшины. Попадая в брюшную полость, перфторан вызывал усиление миграции макрофагов, которые захватывая частицы эмульсии, становились более активными. Эта гипотеза нами была проверена и подтверждена в эксперименте при изучении фагоцитарной активности макрофагов в отношении частиц китайской туши (в разведении 1:500), введённой в брюшную полость в 2-х отдельных сериях: в одной, смешивая с перфтораном, в другой – с физиологическим раствором (контроль). Выяснилось, что активность макрофагов (ФИ) в серии с перфтораном была в 2-2,5 раза выше, чем в контроле.
Таким образом, эксперименты показали, что озонированный перфторан оказывает более выраженное стимулирующее влияние на факторы неспецифической резистентности, чем озонированный физиологический раствор и перфторан без озона. Кроме того, озонированный перфторан, в отличие от озонированного физиологического раствора, способствует усилению миграции и функциональной активности перитонеальных мононуклеарных фагоцитов, которые являются активными фагоцитирующими клетками и «санитарами» в очагах воспаления, очищающими здоровую ткань от детрита. Выявленные качества озонированного перфторана позволили нам предложить его не только как стимулятор неспецифического иммунитета, но и в лечении гнойных перитонитов.
Результаты экспериментальных исследований у животных опытной группы (с экспериментальным перитонитом)
При оценке результатов экспериментальных исследований в опытной группе одним из показателей эффективности методики служила выживаемость животных. Показатели 1-й серии достоверно отличались в позитивную сторону от результатов остальных трёх серий: по ходу экспериментов в 1-й серии пало 4 (5,2%) крысы. Несколько выше была летальность во 2-й и 3-й сериях, где с 1-й по 14-е сутки погибло соответственно 19 (25,33%) и 17 (22,67%) животных (р=0,002 и р=0,005 по сравнению с 1-й серией). Всего из эксперимента выбыли 82 крысы, причем 42 (56,0%) из них - в 4-й серии (табл.2).
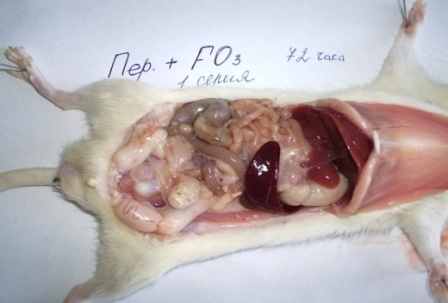
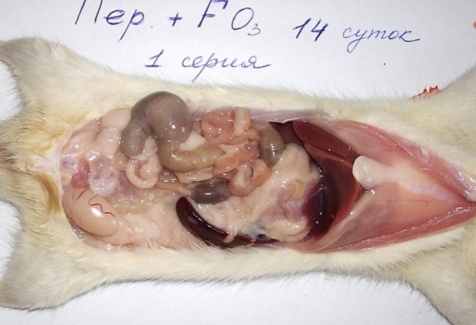
Макроскопическая картина органов брюшной полости после введения озонированного перфторана на фоне каловой взвеси (1-я серия) на всех этапах исследования была существенно лучше, чем во всех остальных 3-х сериях (рис. 1 и 2).
У 70 (93,3%) крыс 1-й серии распространённый перитонит не развивался, а ограничивался охватом одной, у 63 животных (84,6%) – двух областей. Чаще всего воспалительный очаг обнаруживался в нижнем этаже брюшной полости. Только в 5 (6,7%) случаях наблюдалось распространение инфекционного процесса и развитие разлитого гнойного перитонита. У крыс 1-й серии на 1-е сутки в брюшной полости обнаруживали 0,4-0,7 мл мутноватой жидкости с молочным оттенком, а визуальные изменения внутренних органов сводились к увеличению размеров селезёнки, лёгкому отёку стенки подвздошной кишки в нижней 1/3 и набуханию брыжеечных лимфатических узлов. У отдельных животных на 3-7-е сутки обнаруживали мелкие абсцессы диаметром 2-3мм, в редких случаях (у 6 животных – 8%) - нежные рыхлые спайки.
В отличие от первой, во 2-й серии у 20 (26,7%) животных развился распространенный гнойный процесс, который охватывал всю брюшную полость (χ2= 9,408; р = 0,002, по сравнению с 1-й серией). При введении озонированного физиологического раствора в ранние сроки эксперимента обнаруживали 1-2 мл гнойного экссудата (рис. 1, б), абсцессы имели размер до 8-12 мм в диаметре; с 3-х суток обнаруживались спайки, а после 7 суток они были отчётливо выражены (рис. 2, б). Тонкая кишка была отёчная и атоничная на большом протяжении, в просвете её определялось желтоватое жидкое пенистое содержимое.
 а) 1-я серия | 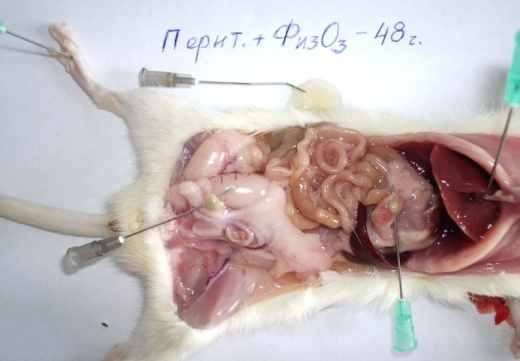 б) 2-я серия |
 в) 3-я серия | 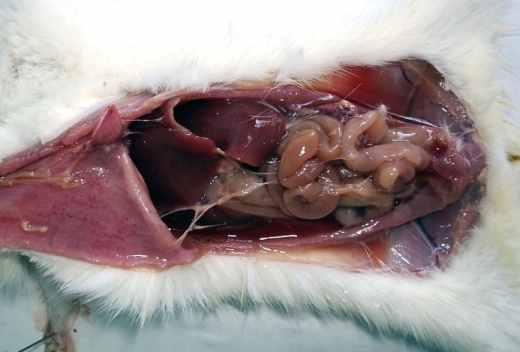 г) 4-я серия |
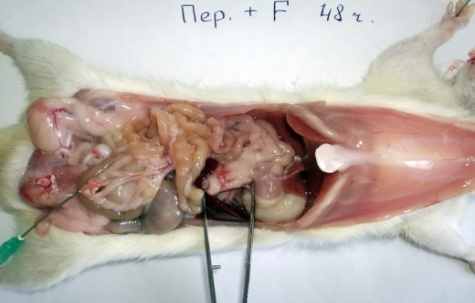
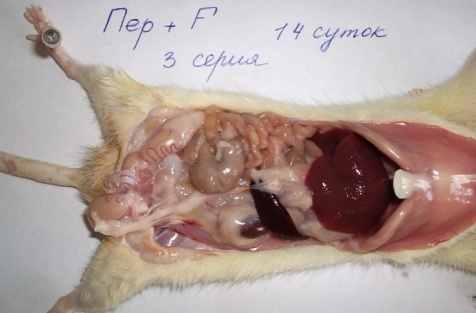
Рис. 1. Макроскопическая картина развития калового перитонита
у крыс на 2-и (б, в) и 3-и (а, г) сутки экспериментов.
У животных 3-й серии (перфторан без озонирования) на 1-е сутки определялся не геморрагический выпот, а мутноватая жидкость молочного оттенка со следами перфторана (рис. 1, в). Изменения селезёнки и отёчность стенки тонкой кишки и брыжеечных лимфоузлов также были более выражены, чем в 1-й серии (картина примерно такая же, как у крыс 2-й серии (распространённый перитонит – в 22,7% случаев; при сравнении 2-й и 3-й серий, (χ2)р = 0,705), но спаек меньше (рис.1, в; 2, в).
Наиболее ярко выраженная картина гнойного перитонита развивалась при введении в брюшную полость каловой взвеси и физиологического раствора (4-й серия). Крысы этой серии с 1-х суток были вялые, шерсть взъерошена и выражена одышка; на 1-5-е сутки обильно пили воду, а затем переставали принимать пищу и, были заторможены. В течение первых 7-ми суток эксперимента отмечался массовый падёж животных (табл. 2). У крыс 4-й серии в брюшной полости на 1-2-е сутки эксперимента определялась мутная геморрагическая жидкость с запахом, а на 3-7-е сутки – гнойно-фибринозная жидкость и большое количество абсцессов размерами в горошину; брюшина тусклая, сальник скомкан, имел синюшно-багровый цвет, в складках определялись инфильтраты (рис.1, г).
 а) 1-я серия | 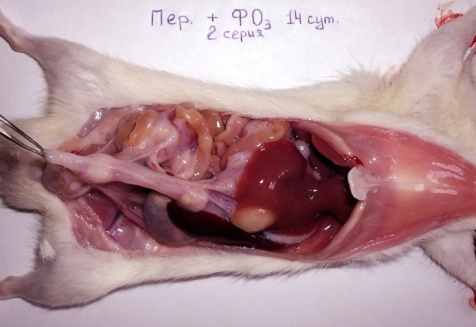 б) 2-я серия |
 в) 3-я серия | 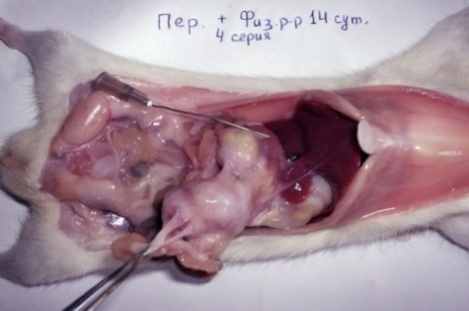 г) 4-я серия |
Рис. 2. Выраженность спаечного процесса у крыс опытной
группы на 14-е сутки экспериментов.
Тонкая кишка была отёчная, атоничная. Уже к концу 1-х суток у отдельных животных в складках сальника и между петлями тонкой кишки определялись гнойные очаги. На 1-2-е сутки находили нежные, в последующем определялись продольные и поперечные шнуровидные и плоскостные спайки, в их складках – абсцессы. У выживших крыс на 7-14-е сутки органы брюшной полости были во множественных спайках, которые образовывали конгломераты (рис. 2, г).
Цитологическая картина перитонеальной жидкости у животных 4-й серии характеризовалась на 1-е сутки явным повышением в ней плотности нейтрофильных гранулоцитов (рис. 3, г). Но после 3-х суток отмечалось их неуклонное снижение, которое подтверждало дальнейшее распространение гнойного процесса, прогрессирование перитонита и нарастание интоксикации. На этом фоне снижалась фагоцитарная активность лейкоцитов. В перитонеальных мазках определялись дистрофические лейкоциты с множеством не переваренных микроорганизмов (рис. 3, г). На 1-е сутки количество деструктивных клеток и эозинофильных лейкоцитов увеличивалось более чем в 10 раз. На 2-е сутки доля деструктивных клеток составляло более 20 %, фибробластов – около 8,5 % (в 1-й серии на данный срок доля первых составляла 5,4 %, а фибробластов – всего лишь 1,2 %, во 2 серии – соответственно 10 % и 7,3 %).
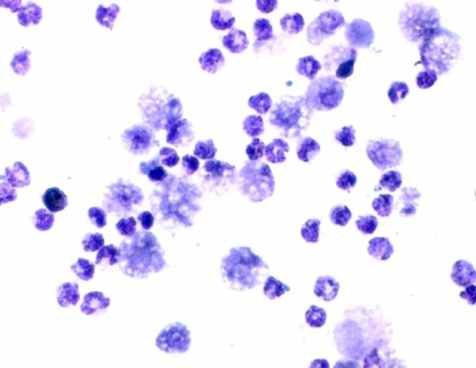 а) 1-я серия | 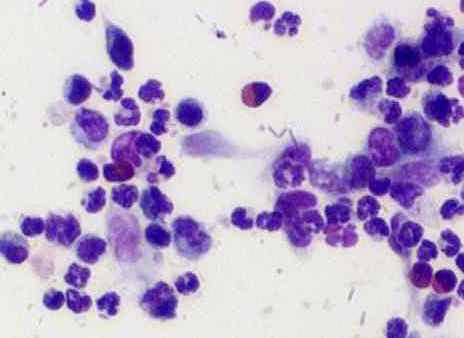 б) 2-я серия |
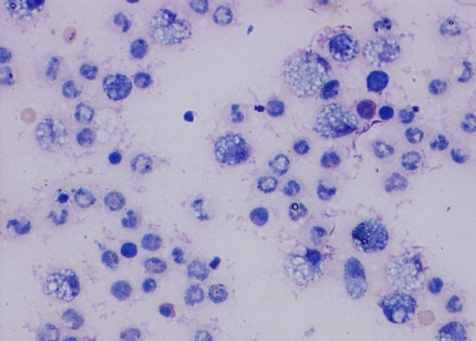 в) 3-я серия | 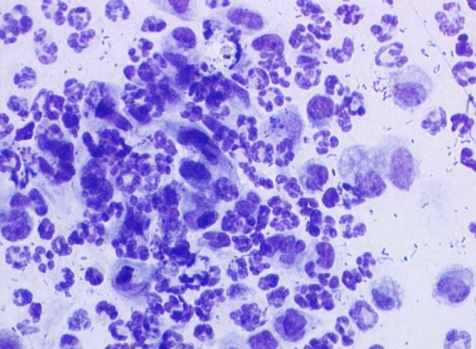 г) 4-я серия |
Рис. 3. Цитологическая картина перитонеальной жидкости у крыс опытной группы на 2-е сутки экспериментов. Окраска по Романовскому-Гимза в нашей модификации. Увел.: х600.
Таким образом, изменения состава клеток и их плотности в перитонеальном экссудате, отчетливо коррелировали с тяжестью воспалительного процесса, что свидетельствовало о наименьшей выраженности его у крыс 1-й серии. При этом в 1-й и 3-й сериях более характерна была реакция мононуклеарных фагоцитов (рис. 3, а, в). Внутри макрофагов и нейтрофилов обнаруживались набухшие микроорганизмы в стадии переваривания. В цитоплазме отдельных макрофагов видны были фагоцитированные нейтрофильные лейкоциты и обломки клеток, что указывало на их высокую функциональную активность. В 1-й серии на 1-е сутки эксперимента иногда определялись внеклеточные скопления микроорганизмов, а в последующие сроки этого не наблюдалось. Во 2-й и 3-й сериях скопления микроорганизмов находили до 3-х, на отдельных препаратах – до 7-х суток, а в 4-й серии – во все сроки наблюдений.
Выраженность спаечного процесса в сериях опытов росла пропорционально увеличению количества фибробластов в перитонеальной жидкости, что в наибольшей степени выражено было также в 4-й серии. Напротив, в 1-й (особенно) и 3-й сериях количество фибробластов было значительно меньше. Вместе с тем, в этих сериях отмечалось повышение числа макрофагов (перфторофагов), которые активно фагоцитировали детрит и микроорганизмы, кроме того, сдерживали миграцию фибробластов, тем самым, возможно, и развитие спаечного процесса.
Морфологическая гистоструктура стенки тонкой кишки (рис. 4, а) и брыжеечных лимфатических узлов после введения озонированного перфторана отличалась от картины животных других серий тем, что во все сроки деструктивные изменения в тканях были выражены значительно меньше, и уже к 14-м суткам картина была близка к гистоструктуре животных контрольной группы.
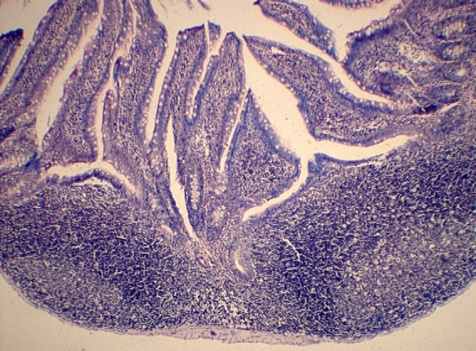 а) 1-я серия | 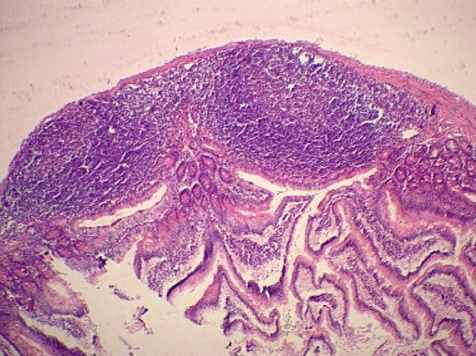 б) 4-я серия |
Рис. 4. Слизистая оболочка и лимфоидная бляшка подвздошной кишки крыс опытной серии на 2-е сутки экспериментов. Окраска по Романовскому-Гимза в нашей модификации (а) и гематоксилином-эозином (б). Увел.: х100.
Аналогичные результаты получены при электронно- микроскопических исследованиях. В 1-й серии дистрофические изменения клеток регионарных иммунных органов и эндотелия их микрососудов и синусоидов выражены в меньшей степени, а к 7-м суткам признаки острой фазы воспаления вовсе не наблюдались, в то время, как в серии с озонированным физиологическим раствором (2-я серия) они носили прогрессирующий характер с первых суток и на всех этапах развития экспериментального перитонита (рис. 5).
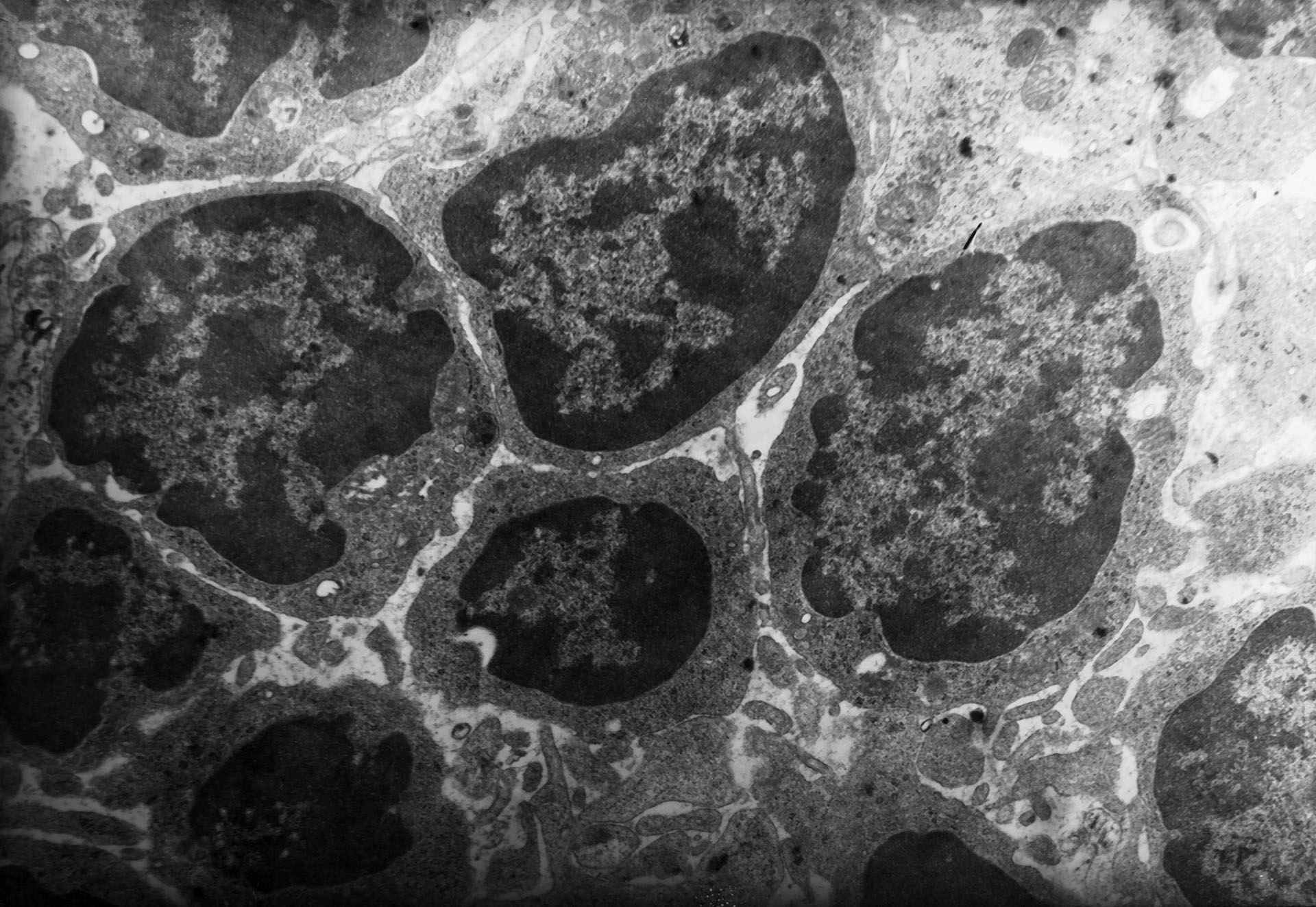 а) 1-я серия: малые лимфоциты в куполе лимфоидного узелка | 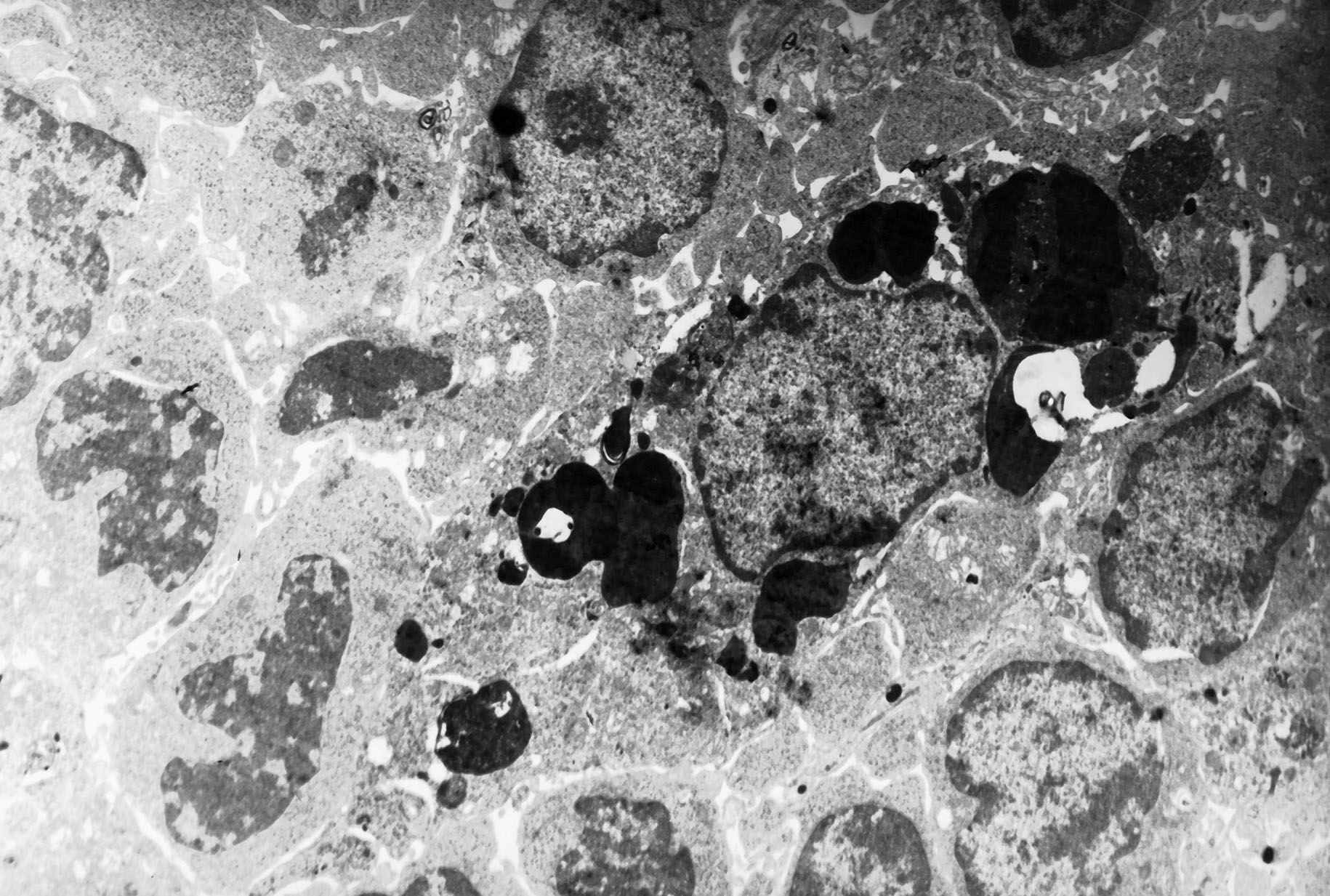 б) 2-я серия: лимфоциты с повреждениями в окружении макрофага |
Рис. 5. Лимфоциты корковой зоны брыжеечного лимфатического узла крысы на 1-е сутки перитонита после воздействия озонированного перфторана (а) и озонированного физиологического раствора (б). Электронограмма, увел.: х 10000.
В динамике развития калового перитонита небезынтересные данные были получены при микробиологических исследованиях проб перитонеального экссудата. Для сравнения был изучен микробный пейзаж введённой крысам 5% каловой взвеси и наблюдали следующую картину: на агаре Эндо образовались фуксиново-красные колонии округлой формы с металлическим блеском диаметром 2-3мм и с ровными краями (Е. coli) и бесцветные колонии, склонные к сливному росту (P. vulgaris). При микроскопии мазков обнаружены грамотрицательные палочки. На Ж-СА – мутные округлые ровные колонии (S-формы) кремового цвета, диаметром от 0,5 до 2 мм. В мазках – грамположительные кокки, расположенные гроздьями (Staphylococcus) или цепочками (Streptococcus), или же парами (Enterococcus). На КА – сплошной рост полупрозрачных и непрозрачных зернистых колоний, в мазках, окрашенных по Граму, - грамотрицательные палочки и грамположительные кокки, двухконтурные образования с зернистым содержимым и псевдомицельные нити (Candida albicans). На ЩА, наряду с мутными зернистыми колониями, образовались прозрачные, слегка голубоватые колонии, гладкие, с ровными краями, гомогенные в проходящем свете. При микроскопии – слегка изогнутые, грамотрицательные палочки небольшого размера (Aeromonas). Титр микробных тел 5% каловой взвеси составлял 2х108 м.к. в 1мл.
У крыс 4-й серии микробиологическая картина перитонеальной жидкости в условиях развивающегося перитонита (каловая взвесь + физиологический раствор) прослежена лишь до 7-х суток, т.к. до 14 суток преобладающее большинство крыс не доживало.
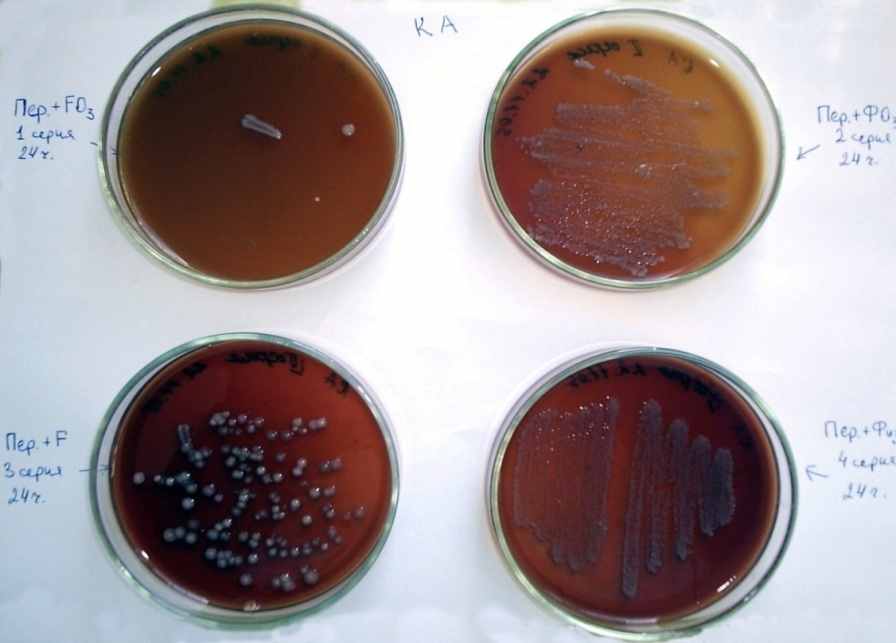
Рис. 6. Результат микробиологического исследования на 1-е сутки экспериментов. Характер роста колоний на КА (верхний ряд: слева – 1-я серия, справа – 2-я серия; нижний ряд: слева – 3-я серия, справа – 4-я серия).
На всех использованных средах в 1-е сутки отмечался сплошной ползучий рост. Культуральные свойства были выражены нечетко. Такая же картина роста на чашках Петри отмечалась и на 2-е сутки: сплошной рост колоний на кровяном и щелочном агарах. Обильный рост культуры не давал возможность определить форму колоний, так как вся поверхность ЩА в эти сроки и до 7-х суток была сплошь проросшая Pr. vulgaris. В мазках также определялось значительное количество E. coli и Staphylococcus aureus.
Принципиально отличалась микробиологическая картина экссудата у животных 1-й серии. На первые сутки на твердых питательных средах отмечался рост от 3 до 8 колоний S-формы, диаметром не более 2-3 мм. Микроскопия мазков из выросших небольших колоний микроорганизмов, окрашенных по Грамму, подтверждали рост Е. coli, Pr. vulgaris, Candida albicans и Staphylococcus. KOE составило 2х103 м.к. в 1 мл. К 3-м суткам, на отдельных питательных средах, прорастали лишь единичные колонии в S- форме, а на ЩА и Ж-СА роста микроорганизмов вовсе не было. Изучение морфологии микроорганизмов и ферментативной активности указывали на наличие Е.coli и Pr.vulgaris с титром 3х102 м.к. в 1 мл. Другая микрофлора не обнаружена. На 7-14-е сутки посевы на питательные среды роста какой-либо флоры не давали. А во 2-й и 3-й сериях, по сравнению с 1-й, рост культур был более существенным (рис. 6, 7), но скудным, чем в 4-й серии (рис. 6).

Рис. 7. Посевы проб из брюшной полости на среду Эндо у крыс опытной группы на 2-е сутки эксперимента (слева – 1 серия, справа – 2 серия).
В частности, во 2-й серии на 1-е сутки (среда Эндо) был отмечен сплошной рост фуксиново-красных колоний с металлическим блеском. Обильный рост таких колоний сохранялся и при разведении материала в 1:1000. На КА наблюдался рост мелких колоний в S-форме и ползучий рост колоний в R-форме. Обильный рост колоний в S- и R-форме наблюдался на ЩА. На Ж-СА также дал обильный рост колоний в S-форме. Выросшие культуры были идентифицированы как E. coli, Pr. vulgaris, Staphylococcus, Steptococcus, Candida albicans. Примерно такая же картина наблюдалась в 3-й серии. Титры микробных клеток в перитонеальных пробах во 2-й и 3-й сериях (на все сроки эксперимента) на порядок выше, чем в 1-й серии, но значительно ниже, нежели в 4-й серии.
Изученные параметры факторов неспецифической резистентности в условиях экспериментального перитонита также свидетельствовали о преимуществах применения озонированного перфторана (1-я серия) по сравнению со всеми остальными сериями, особенно с 4-й серией. Через сутки после инфузии озонированного перфторана на фоне введения 5 % каловой взвеси отмечалось увеличение количества лейкоцитов крови, при этом ФИ существенно не менялся. СЦП интрацеллюлярных КБ сохранялся на уровне контроля; несколько была повышена активность МПО нейтрофилов и БАС крови, но уровень сывороточного лизоцима, тем не менее, снижался.
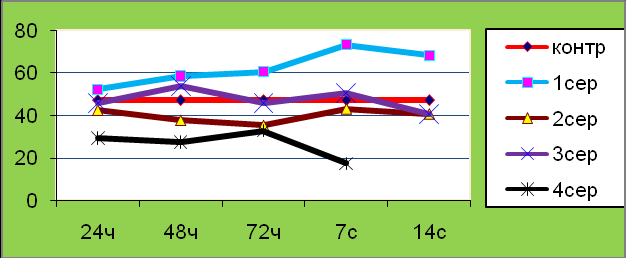
Рис. 8. Показатели БАС (в %) по срокам и сериям экспериментов в опытной группе животных.
Через 2 суток у крыс 1-й серии КЛ не отличалось от параметров интактных животных, но показатели фагоцитарного блока начинали несколько снижаться. На этом фоне БАС крови и уровень лизоцима продолжали расти (рис. 8).
На 3-и сутки наблюдалась вторая волна увеличения КЛ, а показатели ФАЛ снижались. Уровень лизоцима к 3-м суткам превышала контрольные показатели. На 7-е сутки тенденция сохранялась – увеличение количества лейкоцитов, снижение ФИ и ФЧ, повышение БАС. К 14-м суткам КЛ оставалось выше контроля, но были несколько снижены, по сравнению с контролем, показатели ФАЛ, СЦП активности КБ и МПО. Но во 2-й и, особенно, в 4-й серии, показатели ФАЛ, интрацеллюлярной и сывороточной микробицидности были ниже, чем в 3-й серии (серия с перфтораном) и значительно ниже показателей 1-й серии (серия с озонированным перфтораном).
Рис.9. Динамика показателей ФЧ (в %) у крыс в сериях опытной
группы по срокам экспериментов.
В целом выявлена была общая закономерность, состоящая в том, что прогрессирование гнойного перитонита сопровождалась более глубокими изменениями параметров неспецифического иммунитета (рис. 8, 9).
При анализе полученных результатов становится очевидным некоторое лечебное действие перфторана и озонированного физиологического раствора в условиях экспериментального перитонита. При этом более выраженный лечебный эффект оказывал озонированный перфторан
Таким образом, исследования при экспериментальном каловом перитоните по всем параметрам свидетельствуют о высокой эффективности внутрибрюшного введения озонированного перфторана в целях санации, поддержания иммунного статуса, предупреждения развития послеоперационного пареза кишечника и спаечного процесса брюшной полости, снижения показателей летальности (р=0,00 по сравнению со 2-й и 3-й сериями). Полученные результаты позволили рекомендовать данную методику для применения в клинической практике.
Результаты клинических исследований
Объём хирургического вмешательства включал: 1) устранение источника перитонита; 2) санация и лаваж брюшной полости, рациональное её дренирование; 3) мероприятия по борьбе с парезом кишечника (декомпрессия) и 4) завершение первичной операции с определением дальнейшей тактики ведения больного.
У больных основной группы, кроме этого, проводилось дополнительное орошение брюшной полости озонированным перфтораном из расчёта 1 мл/кг массы тела и внутривенное введение озонированного перфторана из того же расчёта. Для этого, после стандартного лаважа, дополнительно промывали брюшную полость 0,5-1 л физиологического раствора (если для лаважа был использован не физиологический раствор, а другой состав), зажимали дренажные трубки и орошали все отделы брюшной полости озонированным перфтораном с помощью шприца с толстой иглой, после чего ушивали лапаротомную рану. Зажимы с дренажей снимали через 1,5 – 2 часа после операции. В остальном послеоперационное лечение больных с перитонитом в основной и контрольной группах принципиально не отличалось. С учётом тяжести перитонита, 3 больным озонированный перфторан вводили в брюшную полость через дренажи повторно, на 2-е сутки после операции.
При перитонитах, развившихся после перфорации язвы желудка и двенадцатиперстной кишки, чаще всего выявлялись значительное количество экссудата с примесью желудочного содержимого, вздутие желудка и тонкой кишки, атония и растяжение кишечных петель газами и жидким содержимым. Когда распространённый гнойный перитонит носил явно выраженный характер, что в наших наблюдениях встречалось в 43,75% случаев, определялись отёчность и атония стенки кишки на большом протяжении, инъецированность сосудов париетальной и висцеральной брюшины, а на поверхности её – множественные фибринозные наложения. При этом степень преимущественного поражения того или иного отдела кишечника зависела от характера и давности осложнения, приведшего к развитию перитонита.
При деструктивных аппендицитах у 10 (40%) из 25 пациентов наблюдалась картина местного неотграниченного перитонита, а у 15 больных перитонит носил распространённый характер, что зависело от возраста больного, его иммунного статуса и времени, прошедшего от начала заболевания до поступления в стационар. При деструктивных холециститах операции задерживались из-за поздней обращаемости и вследствие безуспешных попыток разрешения патологического процесса консервативной терапией. При перитоните, развившемся на почве деструктивного холецистита, среди возбудителей гнойного процесса микрофлора кишечной группы и анаэробы встречались реже.
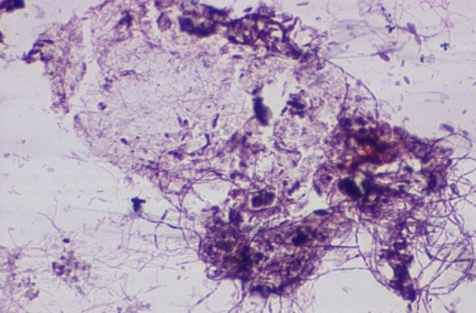
В исследуемые группы вошли больные с местным и распространённым фибринозно-гнойным перитонитом (рис. 10).
 | 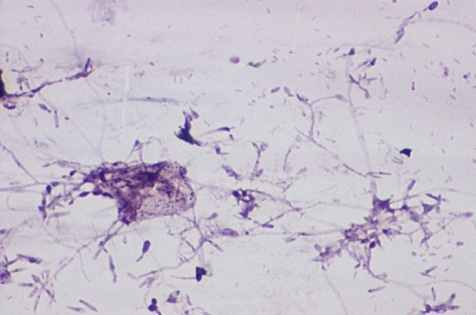 |
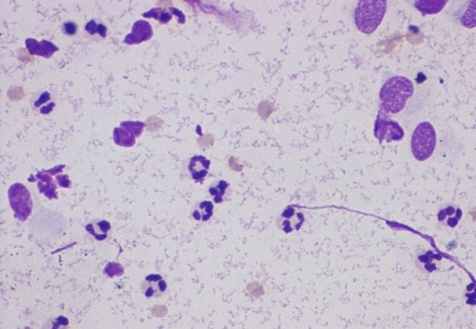 | 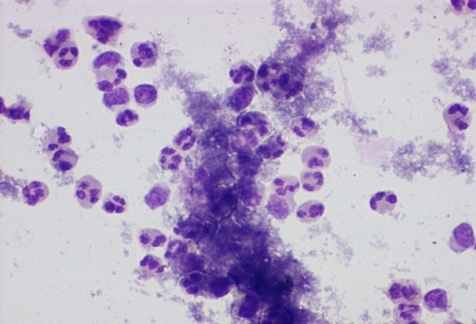 |
Рис. 10. Мазки из брюшной полости больных при перитонитах разной этиологии. Окраска по Романовскому-Гимза в нашей модификации. Увел.: х400.
У 4 человек из них, при гнойном процессе в тазовой области и деструктивном холецистите, проведены операции по устранению источника перитонита малоинвазивным (видеолапароскопическим) способом.
При атонии кишечной стенки, когда диаметр просвета тонкой кишки не превышал 3,5-4см, обходилось зондированием желудка, в остальных случаях вводили назо-интестинальный зонд на 50-70см за связку Трейца. В основной группе декомпрессию ЖКТ в послеоперационном периоде проводили 6 (25,0%) больным, а в контрольной группе такая необходимость возникла у 14 (58,3%) пациентов (развитие пареза кишечника снижалось на 33,3%, χ2 =4,2; р=0,04), в том числе у 6 больных на 2-е сутки (критерий Фишера, р=0,022). На 2-е сутки после операции им проводили назо-интестинальную интубацию с лекарственной стимуляцией моторики кишечника. В случаях, когда перитонит ограничивался охватом не более 1-2 областей брюшной полости, или же давность распространённого перитонита до оперативного вмешательства не превышала 12-24-х часов, в послеоперационном периоде у больных основной группы проводили декомпрессию желудка.
У больных контрольной группы, при подобных случаях, нередко приходилось повторное проведение желудочной или кишечной (в 2 случаях) декомпрессии назо-гастральным (-интестинальным) интубированием и лекарственной стимуляцией моторики кишечника. Причиной служил развивающийся послеоперационный парез кишечника при отсутствии отделяемого через установленный во время операции зонд. Объективно: не было улучшения состояния, больные отмечали вялость и тошноту, а на фоноэнтерограмме отсутствовали признаки перистальтики кишечника (определялись шумы с амплитудой ниже -50 Дб). УЗ или рентгенологические исследования указывали на признаки послеоперационного пареза кишечника.
Динамика факторов неспецифического иммунитета прослежена нами в основной и контрольной группах с момента поступления до 5-х суток и сопоставлена со средними показателями, полученными нами у здоровых добровольцев. Изученные исходные (до начала лечения) средние статистические показатели ФАЛ, цитохимически выявляемых КБ, МПО нейтрофильных гранулоцитов, БАС и лизоцима крови были очень близки в основной и контрольных группах и существенно отличались от таковых у обследованных добровольцев (которые приняты нами за норму).
КЛ крови превышало норму 1,5 – 3,5 раза, при этом снижалось число функционально активных полинуклеарных фагоцитов. СЦП свидетельствовали об угнетении функции интрацеллюлярных микробицидных систем (рис.11), а БАС крови падала в среднем на 31 %, уровень лизоцима – более чем в 2 раза.
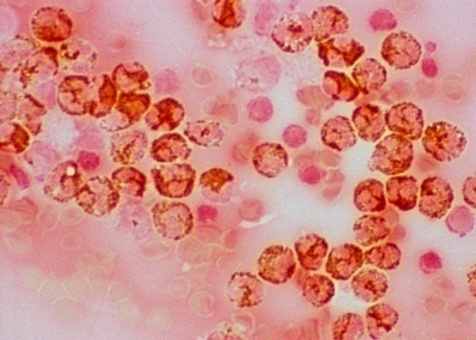 а) лейкомасса больного с местным неотграниченным перитонитом, снижение активности МПО |  б) лейкомасса больного с распространённым гнойным перитонитом, истощение МПО активности |
Рис. 11. Интрацеллюлярные гранулы МПО нейтрофильных гранулоцитов. Исходные показатели. Окраска бензидином. Увел.: х600.
К 3-м суткам после операции на фоне лечения отмечена частичная коррекция указанных показателей, однако в основной группе они достоверно превосходили данные контрольной группы. К 5-ым суткам в основной группе показатели изученных факторов неспецифического иммунитета практически приближались к норме (рис. 12, а), а в контрольной группе оставались ещё существенно угнетёнными (12, б).
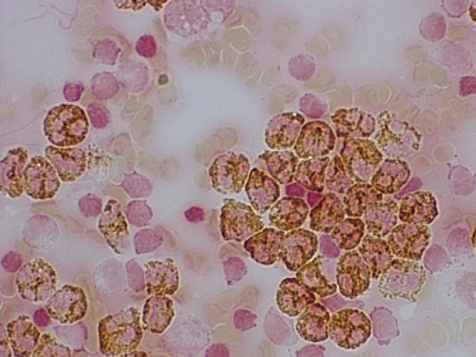 а) умеренная насыщенность окраски ПО-гранул лейкоцитов | 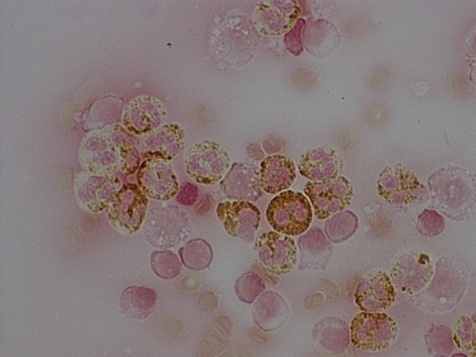 б) большинство лейкоцитов с низким содержанием фермента |
Рис. 12. Ферментативная активность лейкоцитов на 5-е сутки с начала комплексного (а) и стандартного (б) лечения у больных с распространённым гнойным перитонитом. Окраска бензидином. Увел.: х600.
Микробиологические исследования показали, что качественный и количественный микробный состав взятой жидкости зависел от источника и причины перитонита, сроков заболевания, распространённости и возраста больных. Микробный состав был наиболее разнообразен и агрессивен, когда источником перитонита была деструкция дистального отдела подвздошной кишки и толстой кишки. В этих случаях на среде Эндо вырастали округлой формы фуксиново – красные колонии E. coli и бесцветные колонии P. vulgaris, на КА зернистые колонии давали сплошной рост (рис. 13).
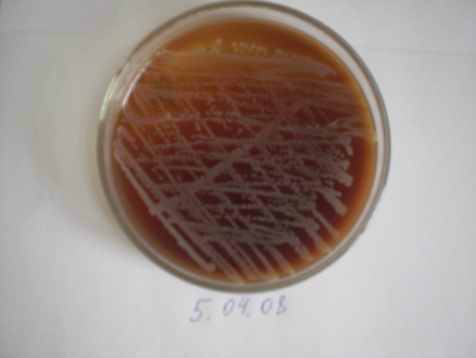 а) культура на кровяном агаре | 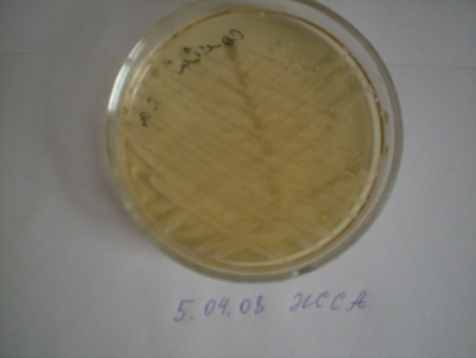 б) желточно-солевой агар |
