Особенности позднего неонатального периода у новорожденных, перенесших тяжелую перинатальную гипоксию 14. 00. 09 Педиатрия научный консультант доктор медицинских наук, профессор халецкая о. В
| Вид материала | Автореферат диссертации |
- Бахметьев Владимир Иванович Ведущая организация : Государственное общеобразовательное, 587.63kb.
- «Российский научный центр восстановительной медицины и курортологии Росздрава», 372.3kb.
- «Ставропольская государственная медицинская академия Министерства здравоохранения, 679.45kb.
- «Военно-медицинская академия имени С. М. Кирова», 1026.04kb.
- Реконструкция и эндопротезирование трахеобронхиального дерева при доброкачественных, 759.88kb.
- Выбор метода лечения острого панкреатита в зависимости от особенностей течения заболевания., 628.63kb.
- В. О. Бернацкий доктор философских наук, профессор; > А. А. Головин доктор медицинских, 5903.36kb.
- Лицензированная медсестра, Эрик Ван Вийнгаерден, доктор медицинских наук, Херман Боббаерс,, 1773.58kb.
- Рохлина Майя Леоновна доктор медицинских наук, профессор Игонин Андрей Леонидович доктор, 564.38kb.
- Лазерная фотодинамическая терапия ожоговых ран (экспериментальное исследование) 14., 295.89kb.
Таблица 4.
Факторы, действующие в антенатальном и неонатальном периоде, и способствующие инвалидизации детей, перенесших тяжелую гипоксию.
Фактор | Относительный риск | Доверительный интервал |
| Угроза выкидыша во время настоящей беременности | 2,50 | 1,04 – 5,97 |
| Масса тела 2,5 кг и менее | 2,98 | 1,18 – 7,49 |
| Срок гестации 37 недель и менее | 3,04 | 1,13 – 8,08 |
| Неонатальные судороги | 3,13 | 1,31 – 7,38 |
| Сохранение NTISS выше 20 баллов в течение двух недель и более | 2,70 | 1,13 – 6,42 |
Для нас особенно важным представляется последний фактор, так как высокая оценка по шкале NTISS свидетельствует о наличии полиорганного поражения. При этом влияние не максимального значения оценки, а именно длительности ее сохранения на высоком уровне говорит о том, что возможность оптимизации терапии в позднем неонатальном периоде для улучшения отдаленных исходов существует.
С учетом полученных данных нами было проведено проспективное обследование 113 новорожденных детей, поступивших в отделение реанимации и интенсивной терапии на первой неделе жизни (основная группа).
При оценке степени тяжести органных поражений мы старались руководствоваться существующими классификациями, принятыми в Российской Федерации. При этом использовались показатели, определяемые при рутинном обследовании пациента отделения реанимации. Степень тяжести поражения различных систем могла быть выражена в баллах от «0» до «3».
Перинатальное поражение головного мозга гипоксического генеза отмечалось у всех 113 детей. Тяжесть поражения оценивали согласно «Классификации перинатальных поражений ЦНС», 2005 г. Церебральная ишемия II степени (2 балла) отмечалась у 91,2% пациентов, III степени (3 балла) – у 8,8%.
Вторым по частоте развития у новорожденных, перенесших тяжелую гипоксию, являлось поражение легких. При балльной оценке за «0» принималось отсутствие поражения, 1 балл давался детям, которые требовали лишь проведения кислородотерапии или СРАР (спонтанное дыхание с постоянным положительным давлением), 2 балла означали необходимость проведения искусственной вентиляции с концентрацией кислорода во вдыхаемой смеси менее 60% и среднего давления в дыхательных путях не более 10 см водного столба. При необходимости проведения традиционной вентиляции в более жестких режимах и/или высокочастотной вентиляции тяжесть поражения дыхательной системы оценивалась в 3 балла.
При этом 0 баллов получили 2,7% детей, 1 балл – 12,4%, 2 балла – 48,7% пациентов, 3 балла – 36,3% новорожденных.
Для оценки состояния почек мы использовали классификацию ишемической нефропатии (ИН), предложенную Е.Н. Байбариной. ИН I степени имели 61,1% детей (1 балл), ИН II степени - 13,3% новорожденных (2 балла), ИН III степени – 1,8% пациентов (3 балла). 23,9% детей, не имевших повышения сывороточного креатинина и/или снижения диуреза менее 1 мл/кг/час, получили 0 баллов.
Со стороны желудочно-кишечного тракта (ЖКТ) картина выглядела следующим образом. 57,5% детей не имели четкого диагноза со стороны ЖКТ. Поэтому условно они получили 0 баллов. Диагноз I ст. некротизирующего энтероколита (1 балл) мог быть выставлен 33,6% детям. II стадия некротизирующего энтероколита (2 балла) была диагностирована у 7,1% детей. И наконец, III стадия некротизирующего энтероколита (3 балла), потребовавшая оперативного вмешательства, развилась у двух детей (1,8%) (перфорация кишечника и перитонит).
Для оценки состояния сердечно-сосудистой системы использовались данные клинического осмотра, рентгенографии грудной клетки (кардиоторакальный индекс), эхокардиографии с допплерографией и электрокардиографии. 0 баллов получили дети (49 человек (43,4%)) с полным отсутствием признаков поражения сердечно-сосудистой системы и/или бессимптомным течением транзиторной ишемии миокарда (изменения зубца Т и/или сегмента ST в грудных отведениях на ЭКГ). В случае наличия клинической симптоматики (приглушение тонов сердца, незначительная (не более 25%) от нормы тахи- или брадикардия) в сочетании с изменениями на ЭКГ дети получали 1 балл (11 пациентов (9,7%)). При наличии расширения границ сердца, снижения сократительной функции сердца и/или необходимости инотропной поддержки (допамин в дозе 4 мкг/кг/мин и более) поражение сердечно-сосудистой системы соответствовало 2 баллам (51 новорожденный (45,1%)). Декомпенсированную сердечную недостаточность (3 балла) имели при поступлении 2 (1,8%) ребенка.
При оценке тяжести постгипоксического поражения печени учитывалась активность аланинаминотрансферазы (АлАт) сыворотки крови как фермента, отражающего цитолиз гепатоцитов. 67 детей (59,3%) имели нормальную активность ферментов сыворотки крови, еще у 25 (22,1%) детей при нормальном значении АлАт, отмечалось повышение АсАт более 1 мккат/л (0 баллов). 12 (10,6%) детей имели значения АлАт в пределах 1-1,9 мккат/л (1 балл), 6 (5,3%) новорожденных – 2 – 2,9 мккат/л (2 балла), 3 (2,7%) пациента – 3 мккат/л и выше (3 балла).
В целом тяжесть гипоксического повреждения различных органов и систем выглядела следующим образом (Рисунок 1).
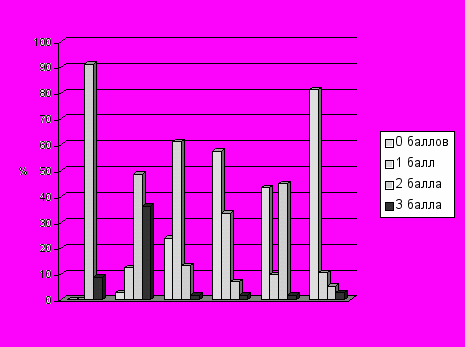
ЦНС легкие почки ЖКТ сердце печень
Рисунок 1.
Тяжесть повреждения органов и систем (%) в раннем неонатальном периоде у новорожденных, перенесших тяжелую гипоксию.
Сумма баллов тяжести органных поражений варьировала от 3 до 18. Один ребенок (умер на восьмые сутки жизни) набрал максимальную сумму баллов – 18. Поражение, оцененное на 3 балла, по трем системам имел также один новорожденный (тяжелая дыхательная недостаточность, декомпенсированная сердечная недостаточность, олигурическая ОПН). Еще шесть детей имели сочетание тяжелой ишемии головного мозга и острого респираторного дистресс-синдрома, потребовавшего аппаратной вентиляции в жестких режимах (один из пациентов умер). По нашему мнению, именно у этих восьми детей правомочным был диагноз полиорганной недостаточности. Кроме того, полиорганная недостаточность развивалась в последние сутки перед смертью еще у троих погибших детей. (Термин «полиорганная недостаточность» предполагает не просто нарушение функций нескольких органов или систем по отдельности, а качественно иное состояние, заключающееся в развитии «порочного круга», вовлекающего в себя новые и новые поражения) [Лейдерман И.Н., 1999]
К концу неонатального периода состояние детей основной группы выглядело следующим образом.
В течение первого-второго месяца жизни умерли 8 (7,1%) пациентов. Состояние 47 детей (41,6%) оставалось тяжелым и очень тяжелым, все они продолжали лечение в стационаре. 8 новорожденных (7,1%) готовились к выписке домой. И наконец, состояние 50 пациентов (44,2%) расценивалось как среднетяжелое.
Среднетяжелое состояние ребенка к концу первого месяца жизни расценивалось как благоприятный ближайший исход, тяжелое и очень тяжелое – как неблагоприятный.
Причины сохраняющейся тяжести состояний были достаточно разнообразными. У части детей отмечались выраженные проявления со стороны нервной системы (судорожный синдром, гидроцефалия, формирующийся ДЦП (15 детей)). У 12 новорожденных длительная вентиляция в жестких режимах привела к развитию «классической» бронхолегочной дисплазии. Но наиболее часто встречались бактериальные инфекции, осложнявшие течение основного процесса, или сочетание нескольких факторов (вегето-висцеральные дисфункции, холестаз и др.), каждый из которых сам по себе не являлся критическим, но в сумме с другими увеличивал тяжесть патологического процесса.
Госпитальные инфекции отмечались у 23 детей с неблагоприятным исходом к концу позднего неонатального периода, в то время как у новорожденных с благоприятным исходом они развились у 11 детей (2=11,458; р=0,000).
Бактериальные инфекции в группе с неблагоприятным ближайшим исходом были представлены следующими нозологиями: поздний неонатальный сепсис у 2 детей, пиелонефриты – у 4 пациентов, гнойный менингит на фоне ПИВК III ст. – у 2 новорожденных, перитонит как осложнение некротизирующего энтероколита в одном случае. Наиболее часто диагностировалась вентилятор-ассоциированная пневмония (как единственный очаг – у 14 детей, в сочетании с пиелонефритом у 2 детей, в сочетании с менингитом также у 2 пациентов, а также у обоих новорожденных с сепсисом).
Факторы, определяющие неблагоприятный ближайший исход в возрасте 1 месяца, представлены в Таблице 5.
Таблица 5.
Факторы риска длительного (более 1-го месяца) сохранения тяжести состояния у новорожденных, перенесших тяжелую гипоксию.
| Фактор | Относительный риск | Доверительные интервалы |
| 1 | 2 | 3 |
| Срок гестации 34 недели и менее | 1,76 | 1,15 – 2,68 |
| Масса тела 2, 0 кг и менее | 2,19 | 1,46 – 3,28 |
| max NTISS более 30 баллов | 1,77 | 1,15 – 2,85 |
| Сохранение NTISS более 20 баллов в течение двух недель | 2,66 | 1,85 – 3,80 |
| Наличие тяжелой ишемии головного мозга | 2,09 | 1,41 – 3,07 |
| 1 | 2 | 3 |
| Поражение дыхательной системы, потребовавшее вентиляции с «жесткими» параметрами | 1,79 | 1,15 – 2,76 |
| Наличие инфекционных осложнений | 2,19 | 1,44 – 3,33 |
| Сумма баллов органного поражения при поступлении 7 и выше | 1,84 | 1,65 – 3,20 |
Таким образом, незрелость (низкая масса тела и срок гестации) несомненно влияет на исход у детей, перенесших гипоксию. Зависит течение патологического процесса и от тяжести исходного гипоксического поражения. Причем прогностически неблагоприятными являются тяжелое гипоксическое повреждение головного мозга и дыхательной системы, а также полиорганность поражения (высокая максимальная оценка по шкале NTISS и сумма органных поражений 7 и более). Влиять на данные факторы в позднем неонатальном периоде уже невозможно.
Тем не менее, наличие инфекционных осложнений и длительное сохранение высокой оценки по шкале NTISS являются факторами «управляемыми», поэтому они и заслуживают особого внимания.
При анализе протоколов вскрытия и просмотре гистологических материалов у 34 погибших детей были выявлены следующие закономерности.
Во все возрастные периоды можно было выделить три ведущие причины смерти: дыхательные расстройства (РДС на первой неделе жизни, бронхолегочная дисплазия в конце неонатального периода), внутричерепные кровоизлияния и бактериальные осложнения, особенно ИВЛ-ассоциированные пневмонии.
В целом, проведенное патологоанатомическое исследование свидетельствовало о полиорганности поражения у новорожденных, перенесших тяжелую гипоксию.
Тяжелое повреждение головного мозга и дыхательной системы клинически и морфологически исходно отмечалось у всех детей. В динамике отмечалось прогрессирование патологического процесса с развитием лейкомаляции, вентрикуломегалии и бронхолегочной дисплазии. Отмечалась четкая корреляция морфологических изменений с данными рентгенологического исследования (для БЛД) и нейросонографии (для повреждения головного мозга). В то же время на первой неделе жизни отмечалась гиподиагностика субарахноидальных кровоизлияний гипоксического генеза.
Другим проблемным моментом являлась недооценка степени поражения почек, которое также отмечалось у 100% погибших детей независимо от сроков наступления смерти. Тяжесть нефропатии нарастала в динамике.
В то же время повышение уровня сывороточного креатинина – общепризнанного маркера поражения почек – наблюдалось лишь у половины детей, причем у подавляющего большинства из них в последние сутки перед летальным исходом. Причиной могло быть превалирование канальцевых нарушений, приводящее к снижению фильтрации лишь в конечной стадии, на фоне некроза тубулярного эпителия и обструкции канальцев. По нашему мнению, необходима прицельная диагностика повреждений канальцевого эпителия. Изменения со стороны других органов и систем были менее выраженными, однако суммарно увеличивали тяжесть состояния ребенка.
Высокая распространенность инфекционных осложнений (чаще всего, вентилятор-ассоциированных пневмоний) еще раз говорила о необходимости усиления мер профилактики и оптимизации антибактериальной терапии.
Итак, после проведения катамнестического исследования, проспективного наблюдения за новорожденными, перенесшими тяжелую перинатальную гипоксию, и анализа протоколов патологоанатомического исследования было определено, что
- возможность воздействовать на отдаленные исходы через оптимизацию тактики ведения больного в позднем неонатальном периоде существует;
- течение позднего неонатального периода определяется не только тяжестью исходного гипоксического поражения головного мозга и дыхательной системы, но и наличием сочетанной патологии, а также развитием инфекционных осложнений;
- гиподиагностика поражений почек может быть связана с отсутствием методик, позволяющих оценить состояние канальцевого аппарата, страдающего в первую очередь;
- развитие вентрикуломегалии является неблагоприятным прогностическим признаком у детей, перенесших тяжелую перинатальную гипоксию.
Для профилактики и своевременного лечения осложнений необходима ранняя диагностика развивающейся патологии.
Поскольку органы и системы новорожденных, перенесших тяжелую перинатальную гипоксию, в позднем неонатальном периоде имеют свои функциональные особенности, важной задачей является поиск наиболее корректных показателей поражения почек и печени, а также прогностических маркеров развития вентрикуломегалии и гидроцефалии.
Оценка функционального состояния почек у детей данной группы сложна и важна. Во-первых, почки являются органом-мишенью и для гипоксических, и для токсических воздействий. Во-вторых, традиционные лабораторные показатели не всегда отражают истинную тяжесть их повреждения, что особенно четко видно при анализе морфологических данных у погибших детей.
Очевидно, для оценки функций почек должен использоваться комплекс исследований, адекватно отражающий состояние как клубочковых, так и канальцевых функций. При этом диурез не может являться основным показателем, отражающим скорость клубочковой фильтрации, поскольку на его величину большое влияние оказывает характер проводимой терапии: массивная инфузионная нагрузка, инотропная поддержка, диуретики. Вследствие этих причин у новорожденных, перенесших тяжелую гипоксию, отмечалась тенденция к полиурии (медиана колебалась от 4,29 мл/кг/час на первой неделе жизни до 5,29 мл/кг/час в конце неонатального периода).
Уровень сывороточного креатинина может служить для первоначальной оценки скорости клубочковой фильтрации так же, как и расчетный показатель клиренса эндогенного креатинина по формуле Баррата. Уровень сывороточного креатинина в течение неонатального периода снижался достоверно со 104,95 мкмоль/л (медиана) до 47,72 мкмоль/л (медиана) (р=0,00001).
Однако на первой неделе жизни и в случаях гипо- и гиперфильтрации разница между расчетным КЭК и КЭК, определенным традиционным методом, становится достоверной (Таблица 6).
Таблица 6.
Динамика клиренса эндогенного креатинина (мл/кг/мин), определенного расчетным и традиционным методами, у детей основной группы.
| сутки | 4-7 | 10-14 | 24-32 | статистика |
| по формуле Баррата | ||||
| медиана | 16,66 | 32,00 | 40,28 | ANOVA chi sq=29,217; p=0,00001 |
| 5 центиль | 8,93 | 13,91 | 19,68 | |
| 95 центиль | 53,28 | 57,37 | 59,77 | |
| традиционный метод | ||||
| медиана | 21,23 | 29,95 | 45,21 | ANOVA chi sq=15,647; p=0,0004 |
| 5 центиль | 3,18 | 5,55 | 12,19 | |
| 95 центиль | 74,77 | 117,26 | 192,48 | |
| статистика | z=2,11; p=0,035 | z=0,14; p=0,890 | z=1,65; p=0,097 | |
Разница расчетного и традиционного клиренсов обусловлена колебаниями креатинина мочи. Кроме того, расчетный метод может применяться лишь в периоде стабильного образования и выведения креатинина, чего нельзя сказать о раннем неонатальном периоде.
Таким образом, для первоначальной оценки клубочковых функций может использоваться уровень сывороточного креатинина, для более корректного определения скорости клубочковой фильтрации при подозрении на ее снижение исследование клиренса эндогенного креатинина должно проводиться традиционным методом.
Активность псевдохолинэстеразы – маркера повышенной проницаемости гломерулярного барьера – также не может использоваться для оценки состояния клубочков, так как величина ее остается в пределах возрастной нормы практически у всех детей на протяжении всего неонатального периода.
Для оценки состояния канальцевого эпителия может использоваться метод определения функционального состояния нефротелия при помощи исследования экскреторной фракции натрия или морфологических нарушений с определением активности в моче фермента гамма-глютамилтранферазы – маркера поражения щеточного эпителия канальцев.
В динамике величина экскреторной фракции натрия у детей основной группы выглядела следующим образом: она снижалась с 1,49 (медиана) до 0,17 %. Величина 95-го центиля также снижалась очень значительно: 9,15 до 1,55%. В то же время величина экскреторной фракции натрия определяется рядом факторов, среди которых изменения скорости клубочковой фильтрации, уровень альдостерона, водная нагрузка, дотация калия и натрия при проведении инфузионной терапии и т.д.
Корректно учесть влияние всех многочисленных факторов, действующих на величину экскреции натрия у новорожденного, находящегося на лечении в отделении реанимации, возможным не представляется. Поэтому в качестве возможного маркера поражения канальцевого эпителия была выбрана активность ГГТ мочи, величина которой определяется лишь степенью повреждения щеточной каймы клеток. Корреляция величины экскреторной фракции натрия с активностью ГГТ была достоверной на протяжении всего неонатального периода (r=0,390; p=0,015).
При исследовании активности ГГТ на 4-7 сутки жизни у детей основной группы, группы сравнения и контрольной группы медианы оказались очень близки: 59,00; 59,24 и 51,07 Ед/мг креатинина соответственно, однако величина 95-го центиля у детей основной группы (256,48) в 2,5 раза превышала таковые у детей группы сравнения и контрольной группы (106,46 и 112,99 Ед/мг креатинина соответственно). Выделялась группа детей (21 пациент) активность фермента у которых на протяжении всего неонатального периода составляла 3-4 возрастные нормы: у четверых их этих детей в дальнейшем присоединился пиелонефрит, у троих появились признаки интерстициального нефрита, дисметаболические изменения отмечались еще у 11 новорожденных).
В динамике у детей основной группы происходило достоверное повышение активности фермента (р=0,010), в основном, за счет пациентов с пограничными значениями показателя, что могло быть связано с нефротоксичным действием проводимой терапии (медиана составила 94,48 Ед/мг креатинина, 95-ый перцентиль – 276,76 Ед/мг креатинина).
Проведенный далее анализ других показателей функционального состояния почек показал, что их использование в условиях гипоксического повреждения почек у новорожденных в критических состояниях некорректно.
Таким образом, определение активности гамма-глютамилтрансферазы мочи является наиболее корректным показателем, отражающим состояние канальцевого эпителия на фоне перенесенной гипоксии и продолжающейся медикаментозной нагрузки. Изменения активности ГГТ коррелируют как с морфологическими данными, так и с длительным сохранением изменений в общем анализе мочи (незначительная протеинурия, эпизоды глюкозурии и оксалурии) (р<0,01).
Достаточно тесно с состоянием почек связано состояние печени. При морфологическом исследовании степень поражения печени не зависела от возраста ребенка, во всех случаях превалировали дистрофические изменения.
Нами была проанализирована выраженность цитолитического, холестатического и гепатодепрессивного синдромов по данным лабораторных исследований в динамике позднего неонатального периода
Исследование активности аланинаминотрансферазы не показало наличия выраженных цитолитических процессов у детей, перенесших тяжелую гипоксию: активность АлАт составила 0,31 мккат/л (медиана), 2,5 мккат/л (95-ый перцентиль) на 4-7 день жизни и 0,36 мккат/л (медиана), 1,24 мккат/л (95-ый перцентиль) на 24-32 день жизни. В конце первой недели жизни 8% детей имели активность АлАт выше 2 мккат/л, далее показатели постепенно приходили к норме.
Снижение синтетической функции печени также отмечалось на первой неделе жизни у большинства детей (медиана 4,24 Ед/л, 5-ый перцентиль – 2,9 Ед/л, 95-ый перцентиль – 5,78 Ед/л), к концу первого месяца жизни активность фермента нормализовалась (медиана – 5,40 Ед/л, 5-ый перцентиль – 4,82 Ед/л).
Таким образом, гипоксическое повреждение мембран гепатоцитов в сочетании со сниженной синтетической функцией свойственно лишь раннему неонатальному периода. Характер поражения печени в позднем неонатальном периоде несколько меняется.
Лабораторные изменения, свойственные холестазу, обнаруживались на 24-32 сутки жизни у четверти детей, перенесших тяжелую гипоксию (Таблица 7).
Таблица 7.
Динамика активности гаммаглютамилтрансферазы (ЕД/л) у детей основной группы.
| | медиана | 5-ый центиль | 95-ый центиль | статистика |
| 4-7 сутки | 74,7 | 17,15 | 169,73 | z=3,548; p=0,0004 |
| 24-32 сутки | 117,0 | 43,84 | 475,81 |
Так же достоверно происходило и повышение активности щелочной фосфатазы (р=0,02). Однако, в связи с наличием значимых изменений фосфатно-кальциевого обмена у детей, перенесших тяжелую перинатальную гипоксию, данный показатель специфичным для холестаза назвать нельзя. (Так, фосфат/креатининовый коэффициент мочи у детей данной группы увеличился с 0,18 ммоль/ммоль креатинина (медиана), 0,73 ммоль/ммоль креатинина (95-ый перцентиль) на 4-7 сутки жизни до 1,79 ммоль/ммоль креатинина (медиана), 3,63 ммоль/ммоль креатинина (95-ый перцентиль) в конце неонатального периода).
Еще более показательными выглядели изменения билирубинового коэффициента (Таблица 8).
Таблица 8.
Динамика уровня билирубинового коэффициента (%) у детей основной группы.
| | медиана | 5-ый центиль | 95-ый центиль | статистика |
| 4-7 сутки | 14,11 | 4,63 | 50,12 | z=6,178; p=0,000001 |
| 24-32 сутки | 42,96 | 15,88 | 78,91 |
Уровень непрямого и прямого билирубина по отдельности интерпретировать нецелесообразно из-за множества причин, приводящих к гипербилирубинемии у новорожденных.
Таким образом, для уточнения состояния печени оптимальным является использование следующего комплекса маркеров: АлАт для диагностики цитолиза, ХЭ – для оценки синтетической функции печени. Данные показатели наиболее актуальны для раннего неонатального периода. Уровень ГГТ сыворотки крови для правильной диагностики холестатического синдрома должен оцениваться совместно с расчетом билирубинового коэффициента. Особое значение признаки холестаза приобретают при оценке гепатотоксичности применяемых лекарственных препаратов в позднем неонатальном периоде.
Одним из спорных вопросов неонатальной неврологии является вопрос о патогенезе, ранней диагностике и лечении вентрикуломегалии и гидроцефалии. Поскольку данное понятие обобщает этиологически, патогенетически и клинически абсолютно разные понятия мы проанализировали возможные причины развития вентрикуломегалии у новорожденных основной группы и группы сравнения.
Первая часть исследования проводилась с целью уточнения патогенеза вентрикуломегалии у новорожденных, перенесших гипоксию средней степени тяжести. Было обследовано в динамике 103 ребенка. За норму принимали следующие размеры боковых желудочков: ширина передних рогов боковых желудочков – 2-4 мм, третьего желудочка – 2-4 мм, задних рогов боковых желудочков – 12-13 мм. Вентрикуломегалия легкой степени диагностировалась при расширении передних рогов боковых желудочков до 5-8 мм при нормальных размерах третьего желудочка, умеренная вентрикуломегалия – при расширении передних рогов до 9 мм, третьего желудочка – до 6 мм, при большем расширении желудочков речь шла о выраженной вентрикуломегалии [Е.А. Зубарева, 2004].
Всего вентрикуломегалия отмечалась у 30 (29%) новорожденных из 103: вентрикуломегалию легкой степени имели 19 детей (63,4%), умеренную – 6 новорожденных (20%) и выраженную – 5 детей из 30 (16,4%) пациентов. 73 ребенка в динамике проявлений вентрикуломегалии не имели.
К концу первого месяца жизни размеры желудочковой системы нормализовались у 12 детей из 30, 15 имели легкую вентрикуломегалию, у двоих оставалась умеренное и у одного ребенка выраженное расширение желудочковой системы. Положительная динамика отмечалась у всех детей независимо от проводимого лечения.
Обследование детей включало в себя, наряду с клиническим и нейросонографическим исследованием, определение кислотно-основного состояния крови и уровня бикарбонатов мочи.
При допплерографии крупных сосудов головного мозга было выявлено, что у детей с вентрикуломегалией индекс резистентности в передних мозговых артериях был достоверно выше, чем у детей с нормальными размерами желудочковой системы: 0,636±0,064 и 0,580±0,075 для первой и второй подгрупп на 4-7 сутки соответственно (F=3,124; p=0,002). Таким образом, у новорожденных с вентрикуломегалией отсутствовала компенсаторная постгипоксическая гиперперфузия головного мозга. Характеризовалась эта группа детей и наличием ряда признаков морфо-функциональной незрелости по данным нейросонографии, среди которых: визуализация латеральной борозды в виде треугольника (отмечалась у 11 из 30 (36,6%) новорожденных с вентрикуломегалией и у 12 из 73 (16,4%) без нее (2 =5,816; р=0,016)), незначительная асимметрия передних и задних рогов боковых желудочков (2=20,469; р=0,000), неправильные контуры сосудистых сплетений (2=7,987, р=0,005). Отсутствие компенсаторной гиперперфузии на фоне морфо-функциональной незрелости новорожденных обуславливало необходимость развития иных механизмов компенсации постгипоксических расстройств метаболизма в ткани мозга.
Предположение о возможном значении уровня бикарбонатов венозной крови и мочи как прогностических маркеров развития вентрикуломегалии возникло по двум причинам: во-первых, существует прямая взаимосвязь между мозговым кровотоком и газовым составом крови, во-вторых, фермент карбангидраза является энзимом, общим для эритроцитов, почек (где он участвует в переносе ионов водорода) и сосудистых сплетений.
В целом, факторы риска развития вентрикуломегалии у детей группы сравнения выглядели следующим образом (Таблица 9).
Таблица 9.
Вероятность развития вентрикуломегалии при наличии факторов риска.
| Показатель | Относительный риск | Доверительные интервалы |
| Наличие 2 и более нейросонографических признака незрелости на 4-7 сутки жизни | 1,70 | 1,16 – 2,45 |
| ИР ПМА более 0,6 на 4-7 сутки жизни | 3,03 | 2,11 – 4,31 |
| Уровень бикарбонатов венозной крови менее 21 ммоль/л на 4-7 сутки жизни | 2,90 | 1,66 – 5,02 |
| Концентрация бикарбонатов мочи менее 5 ммоль/мкмоль креатинина на 4-7 сутки жизни | 3,81 | 2,87 – 5,02 |
