«Ставропольская государственная медицинская академия Министерства здравоохранения и социального развития»
| Вид материала | Автореферат |
- Актуальные проблемы физической культуры, спорта, туризма и спортивной медицины: инновации, 45.22kb.
- Основная образовательная программа высшего профессионального образования направление, 1695.58kb.
- «Челябинская государственная медицинская академия Министерства здравоохранения и социального, 810.19kb.
- Дифференцированный выбор метода хирургического лечения кист поджелудочной железы 14., 344.34kb.
- Р. Н. Мищенко Рекомендовано к печати редакционно-издательским советом Стгма, 118.58kb.
- Учебно-методическое пособие Многоуровневые тесты по акушерству В. А. Аксененко,, 950.54kb.
- Ушакова ольга Владимировна нарушения функции поджелудочной железы при хронических вирусных, 270.36kb.
- Клинико-диагностические критерии супрапищеводных синдромов гастроэзофагеальной рефлюксной, 329.02kb.
- Рабочая программа цикла последипломного обучения врачей, 4256.76kb.
- Рабочая учебная программа по детским хирургическим болезням с ортопедией и травматологией, 938.04kb.
На правах рукописи
ГЛАДКИХ
НАТАЛЬЯ НИКОЛАЕВНА
ПРОЛАПС МИТРАЛЬНОГО КЛАПАНА:
КЛИНИКО-ПАТОГЕНЕТИЧЕСКИЙ АНАЛИЗ С ПОЗИЦИИ
ДИСПЛАЗИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ
14.00.05 – внутренние болезни
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
доктора медицинских наук
Ставрополь – 2009
Работа выполнена в ГОУ ВПО «Ставропольская государственная медицинская академия Министерства здравоохранения и социального развития»
^ Научный консультант: доктор медицинских наук, профессор ЯГОДА Александр Валентинович
Официальные оппоненты: доктор медицинских наук, профессор,
академик РАМН,
^ МАРТЫНОВ Анатолий Иванович
доктор медицинских наук, профессор,
заслуженный деятель науки РФ,
ЯКОВЛЕВ Виктор Максимович
доктор медицинских наук, профессор
^ АМИЯНЦ Владимир Юрьевич
Ведущая организация Российский государственный
медицинский университет
Защита диссертации состоится «–––––––––» ––––––––––––––––––––––––––––– 2009 г.
в ––––––– часов на заседании диссертационного совета Д 208.098.01 при ГОУ ВПО «Ставропольская государственная медицинская академия Министерства здравоохранения и социального развития» (355017, Ставрополь, ул. Мира, 310).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Ставропольская государственная медицинская академия Министерства здравоохранения и социального развития»
Автореферат разослан «–––––» ––––––––––––––––– 2009 г.
Ученый секретарь
диссертационного совета
Д 208.098.01
доктор медицинских наук,
профессор А.С. Калмыкова
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Первичный ПМК относится к числу распространенных клапанных аномалий сердца (Мартынов А.И. и соавт., 1998; Клеменов А.В., 2002; Boudoulas H. et al., 2002). Принимая во внимание благоприятное в большинстве случаев течение и прогноз, некоторые клиницисты вообще не рассматривают ПМК как патологическое состояние (Avierinos J.F., 2002). Однако ряд исследований свидетельствует, что такое представление нельзя распространять на всех пациентов с данной патологией сердца. Доказательством служит повышенный риск возникновения у этих больных серьезных осложнений: инфекционного эндокардита, тромбоэмболий, аритмий, сердечной недостаточности (Нечаева Г.И. и соавт., 2007; Boudoulas H. et al., 2001; James P.A. et al., 2003).
В течение двух последних десятилетий ПМК рассматривают как одно из проявлений дисплазии соединительной ткани (Яковлев В.М. и соавт., 1987; Клеменов А.В., 2005). Однако при подходе к проблеме ПМК в рамках соединительнотканной дисплазии нередко теряется конкретное содержание, указывающее на клапанную патологию сердца (Сторожаков Г.И. и соавт., 2001). Между тем ПМК – это генетически детерминированный синдром, занимающий свою нишу в каталоге наследственных болезней человека (McKusick V.A., 2006).
На современном этапе предлагается выделять ПМК в качестве самостоятельного диспластического синдрома (Земцовский Э.В., 2008). Рассмотрение ПМК как синдрома определяет решение вопросов взаимосвязи внешних и висцеральных признаков ДСТ с точки зрения понимания патогенеза соединительнотканных нарушений.
Однако следует констатировать, что разработки по клинико-патогенетической оценке системной патологии соединительной ткани, формирующей фенотип пациентов с ПМК, находятся в стадии поиска решения этой проблемы. Отсутствуют четкие алгоритмы диагностики вовлеченности в диспластический процесс у больных ПМК других органов и систем. Многие патогенетические аспекты нарушения структуры и функции соединительной ткани у пациентов с ПМК остаются не изученными.
В единичных исследованиях представлены сведения о роли аутоиммунного компонента и некоторых цитокинов в формировании малых аномалий сердца у новорожденных и детей (Кантемирова М.Г. и соавт., 1998; Вторушина В.В., 2006). Работы, посвященные изучению коллагенового аутоиммунитета, цитокинового профиля у взрослых пациентов с ПМК, практически отсутствуют.
Недостаточно данных и о функциональном фенотипе эндотелия при ПМК, тогда как известно, что эндотелиальные клетки участвуют в метаболизме межклеточного матрикса, а система взаимодействий цитокины–эндотелиальная клетка является ключом к пониманию патогенеза ряда патологических процессов (вазоконстрикции, ремоделирования сосудов, нарушения агрегации тромбоцитов и др.).
Отсутствуют сведения об ассоциации ПМК с HLA-антигенами у жителей Ставропольского края РФ. Изучение состава HLA у последних дало бы возможность прогнозировать ПМК и его варианты в конкретной геногеографической зоне.
В связи с этим клинико-патогенетический анализ у больных ПМК с позиции дисплазии соединительной ткани представляет несомненный теоретический и практический интерес, так как, с одной стороны, позволит уточнить механизмы развития соединительнотканных нарушений и установить их взаимосвязь с клиническими проявлениями, обосновать предпосылки к возникновению и особенностям течения ряда ассоциированной патологии, а, с другой, обогатит арсенал врачей критериями, которые могут использоваться для дифференцированного диагностического подхода и формирования групп диспансерного наблюдения.
^ Цель исследования. Разработать комплексный диагностический подход в оценке выраженности кардиальных и экстракардиальных соединительнотканных нарушений на основе клинико-патогенетического анализа больных ПМК с позиции дисплазии соединительной ткани.
^ Задачи исследования:
- Изучить особенности внешних стигм, психо-вегетативной дисфункции, структурно-функционального состояния миокарда, патологии опорно-двигательного аппарата, органов брюшной полости, почек, белой линии живота у пациентов с ПМК.
- Определить сывороточное содержание аутоантител к коллагенам I, II, III, IV, V типов, цитокинов и ростовых факторов – IL-1β, IL-4, IL-10, TNF-α, IFN-γ, FGF-b, TGF-1 – во взаимосвязи с различными вариантами ПМК и характером внешнего фенотипа.
- Оценить степень выраженности эндотелиально-тромбоцитарных нарушений при различных вариантах ПМК.
- Выявить особенности распределения HLA-антигенов у больных ПМК Ставропольского края и определить их ассоциированность с вариантами ПМК и костно-мышечными дисплазиями.
- Установить у больных ПМК взаимосвязь структурно-функционального ремоделирования миокарда с состоянием коллагенового аутоиммунитета, цитокинового профиля, маркерами функции эндотелия и HLA-антигенами.
- Выявить особенности внешнего фенотипа и патогенеза при некоторых ассоциированных с ПМК коморбидных состояниях.
- Предложить возможные последовательности (алгоритмы) обследования больных ПМК для решения вопросов ранней диагностики кардиальных и экстракардиальных изменений и формирования групп, подлежащих диспансерному наблюдению.
^ Научная новизна работы. Поставлена и решена новая научная проблема комплексного диагностического подхода в оценке выраженности кардиальных и экстракардиальных соединительнотканных нарушений у больных ПМК на основе клинико-патогенетического анализа с позиции дисплазии соединительной ткани. Развито научное представление (концепция) о ПМК как диспластическом синдроме.
Установлена высокая частота и широкий спектр костно-мышечной патологии у молодых пациентов с ПМК. Доказана информативность сочетания определенных внешних признаков ДСТ с ПМК для целенаправленного рентгенологического выявления нестабильности краниовертебрального сегмента и сколиотической деформации позвоночника, ультразвуковой верификации растяжения белой линии живота.
Раскрыты новые закономерности патогенеза при ПМК, проявляющиеся нарушением коллагенового аутоиммунитета, цитокинового баланса и эндотелиально-тромбоцитарной функции. Определена повышенная продукция аутоантител к коллагенам, преимущественно интерстициальным, и ростовых факторов, оценено их значение в формировании кардиальных и костно-мышечных дисплазий. Представлена цитокиновая модель патогенеза нарушений метаболизма соединительной ткани при ПМК. Впервые установлено, что наиболее выраженные нарушения цитокинового баланса присущи ПМК в случаях его комбинации с аневризмой межпредсердной перегородки и при миксоматозной дегенерации створок. Впервые показана взаимосвязь функционального фенотипа эндотелия и варианта ПМК: усиление дисбаланса эндотелиальных маркеров в последовательности: ПМК I степени – ПМК II степени – ПМК в комбинации с аневризмой межпредсердной перегородки или при миксоматозной дегенерации створок клапана.
Проведена оценка структурно-функционального состояния миокарда с нормализацией ЭхоКГ-параметров к площади поверхности тела, учетом тяжести ПМК и характера его комбинаций с другими малыми аномалиями сердца, которая позволила впервые выявить роль в ремоделировании миокарда у пациентов с ПМК повышенных уровней аутоантител к коллагенам I и II типов, основного фактора роста фибробластов и эндотелина-1.
Впервые определены особенности распределении HLA-антигенов у больных ПМК Ставропольского края. Выявлены особенности позитивных и негативных HLA-ассоциаций, свойственные миксоматозной дегенерации створок, ремоделированию миокарда, отдельным костно-мышечным дисплазиям и позволяющие прогнозировать их развитие у больных ПМК.
Разработан и научно обоснован алгоритм стратификации пациентов с ПМК в группу риска развития ремоделирования миокарда.
Впервые выявлены особенности фенотипа и регуляторных механизмов, имеющие диагностическое и прогностическое значение при остеохондрозе, «гипертонии белого халата», ортостатической недостаточности, геморрагиях, сахарном диабете I типа, хроническом тонзиллите, ассоциированных с ПМК.
^ Практическая значимость. Комплекс антропометрических параметров и внешних признаков ДСТ, в том числе в сочетании с психо-вегетативной дисфункцией, может быть использован в качестве скрининга для целенаправленной эхокардиографической верификации ПМК.
Определена возможность диагностики у больных ПМК сколиотической деформации позвоночника в случаях нарушения осанки, а также нестабильности краниовертебрального сегмента, сколиоза и растяжения белой линии живота – при гипермобильности суставов. Рентгенологическое исследование у пациентов с ПМК позволит сократить сроки и расширить спектр выявляемой ортопедической патологии для реализации профилактических и реабилитационных мероприятий. Высокая частота встречаемости миксоматозной дегенерации ПМК при болезни Шойермана-Мау определяет показания к целенаправленному поиску миксоматоза створок в случаях данной патологии.
Нормализованная к площади поверхности тела оценка эхокардиографических величин у больных ПМК повысит возможности ранней диагностики структурно-функционального ремоделирования миокарда.
Алгоритм обследования, включающий выделение вариантов ПМК с иммуно-эндотелиальными нарушениями, позволит стратифицировать группу риска ремоделирования миокарда и определит необходимость диспансерного наблюдения данной категории пациентов.
Установленная зависимость степени выраженности структурно-функциональных изменений сердца, костно-мышечных дисплазий с HLA-антигенами даст возможность выделить прогностические критерии миксоматозной дегенерации митрального клапана, ремоделирования миокарда, сколиотической деформации позвоночника у пациентов с ПМК, проживающих в Ставропольском крае.
Факт потенцирующего влияния ДСТ на формирование раннего остеохондроза, эндотелиально-тромбоцитарных нарушений и иммунологических сдвигов обусловливает необходимость использования особенностей внешнего фенотипа при ассоциированных с ПМК коморбидных состояниях для ранней их диагностики и/или формирования групп повышенного риска развития осложнений ассоциированной патологии.
Предложенная последовательность диагностического процесса у пациентов с ПМК – от анализа внешних фенотипических признаков к инструментальному выявлению висцеральных изменений, проведению специальных биохимических и иммуногенетических исследований для уточнения характера диспластического синдрома и состояния здоровья данной категории пациентов – является оптимальной с точки зрения целостности изучаемой патологии и может быть использована в числе мероприятий диспансеризации.
^ Основные положения, выносимые на защиту:
- особенности внешнего фенотипа, психо-вегетативной дисфункции, ремоделирования миокарда, патологии опорно-двигательного аппарата, желчного пузыря и белой линии живота у пациентов с ПМК;
- увеличение при ПМК сывороточных аутоантител к коллагенам I и II типов, IL-1β, FGF-b, TGF-1 и снижение TNF-α, IFN-γ, коллагеновой агрегации тромбоцитов, активности фактора Виллебранда и его соотношения с NOn;
- максимальная выраженность антителообразования к коллагенам I и II типов, цитокинового дисбаланса при комбинации ПМК с АМПП, миксоматозной дегенерации клапана и клинически значимых костно-мышечных дисплазиях; преобладание вазоконстрикторных и протромбогенных факторов в группах ПМК с миксоматозной дегенерацией клапана или сочетающегося с АМПП;
- связь ПМК с HLA-А25, В8, В27, В35, Cw3, Cw5 и особенности HLA при различных вариантах ПМК и костно-мышечных дисплазиях;
- вклад повышенных уровней аутоантител к коллагенам I и II типов, IL-1β, FGF-b, ЕТ-1 и HLA-А25, В27, В35 в ремоделирование миокарда у пациентов с ПМК;
- потенцирующее влияние ДСТ на формирование у больных ПМК раннего остеохондроза, эндотелиально-тромбоцитарной дисфункции при геморрагиях, сахарном диабете, «гипертонии белого халата», иммунной дисрегуляции в случаях хронического тонзиллита;
- разработка алгоритмов обследования больных ПМК с целью ранней диагностики сочетанной патологии и формирования групп, подлежащих диспансерному наблюдению.
^ Внедрение в практику. Результаты исследования внедрены в практику работы терапевтического и консультативно-поликлинического отделений ГУЗ «Ставропольский краевой клинический центр специализированных видов медицинской помощи», консультативно-поликлинического и кардиологических отделений ГУЗ «Краевой клинический кардиологический диспансер», терапевтических отделений МУЗ «Городская поликлиника №1» г. Ставрополя. Итоговые материалы диссертационной работы используются в лекциях и на практических занятиях со студентами кафедр внутренних болезней №1 с курсом поликлинической терапии, пропедевтики внутренних болезней лечебного факультета, внутренних болезней педиатрического и стоматологического факультетов ГОУ ВПО «Ставропольская государственная медицинская академия Министерства здравоохранения и социального развития».
По результатам работы получен патент на изобретение (№ 2257138 от 27.07.2005) и оформлено рационализаторское предложение (№ 1132 от 09.12.2004).
Публикация и апробация работы. По теме диссертации опубликовано 57 работ, в том числе 12 статей в изданиях, рекомендованных ВАК Минобрнауки РФ для публикации результатов докторских диссертаций: «Вестник аритмологии» (2003), «Клиническая медицина» (2004, 2007, 2009), «Терапевтический архив» (2005), «Гематология и трансфузиология» (2007, 2008), «Медицинская иммунология» (2007), «Российский кардиологический журнал» (2007), «Кардиоваскулярная терапия и профилактика» (2007), «Травматология и ортопедия России» (2007), «Вестник Санкт-Петербургского Университета. Серия 11» (2007). Издана монография «Малые аномалии сердца» (Ставрополь, 2005).
Основные положения диссертационной работы доложены и обсуждены на III конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины» (Москва, 2004), IV съезде кардиологов ЮФО «От исследований – к стандартам лечения» (Сочи, 2005), Первой Всероссийской научно-практической конференции «Актуальные вопросы внутренней патологии. Дисплазия соединительной ткани» (Омск, 2005), V съезде кардиологов ЮФО «Диспансеризация, качественная диагностика, лечение и реабилитация – залог успеха кардиологической службы» (Кисловодск, 2006), Всероссийской научно-практической конференции с международным участием «Некоронарогенные заболевания миокарда: диагностика, лечение, проблемы профилактики» (Санкт-Петербург, 2006), VI съезде кардиологов ЮФО «Качественная диагностика, лечение, реабилитация и диспансеризация – залог успеха кардиологии в достижении активного творческого долголетия, улучшения качества жизни и уровня здоровья Российской нации» (Ростов-на-Дону, 2007), на заседании Ставропольского краевого научно-практического общества терапевтов (Ставрополь, 2008); на совместном заседании кафедры внутренних болезней №1 с курсом поликлинической терапии и проблемной комиссии «Дисплазия соединительной ткани в онтогенезе» Ставропольской государственной медицинской академии (Ставрополь, 2009).
^ Объëм и структура диссертации. Диссертация изложена на 324 страницах машинописного текста, содержит 93 таблицы, 57 рисунков, 28 клинических наблюдений, состоит из введения, 6 глав, обсуждения результатов, выводов и практических рекомендаций, библиографического указателя, включающего 334 источника литературы, из которых 175 наименования на русском языке и 159 – на иностранных.
Диссертационная работа выполнена на кафедре внутренних болезней №1 с курсом поликлинической терапии Ставропольской государственной медицинской академии в соответствии с планом научных исследований в рамках отраслевой научно-исследовательской программы №18 «Профилактическая медицина».
Номер государственной регистрации 01200600722.
^ СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования. Всего наблюдался 481 больной, проходивший обследование в ГУЗ «Краевой клинический кардиологический диспансер» г. Ставрополя, ГУЗ «Ставропольский краевой клинический центр специализированных видов медицинской помощи». У всех пациентов было получено письменное информированное согласие на участие в исследовании.
^ Основную группу больных первичным ПМК сформировали 320 человек (180 мужчин и 140 женщин) в возрасте от 18 до 32 лет (средний возраст 22,9±0,6 лет). Критерии включения: наличие эхокардиографически верифицированного ПМК; отсутствие сопутствующих сердечно-сосуди-стых заболеваний, острых и хронических заболеваний внутренних органов. Критерии исключения: наследственные болезни соединительной ткани (синдромы Марфана, Элерса-Данлоса и другие); заболевания сердца, приводящие к поражению миокарда левого желудочка и папиллярной мускулатуры (как потенциальные причины вторичного ПМК); приобретенные деформации опорно-двигательного аппарата; травмы органов опоры и движения в течение последних 2-х лет, сопровождающиеся нарушением целостности костной ткани.
Наиболее часто встречались сочетание ПМК I степени с АРХ (33%) и изолированный ПМК I степени (25%). Реже регистрировались другие варианты ПМК, а именно ПМК II степени в сочетании с АРХ (12%), ПМК I степени в сочетании с ПТК (10%), комбинация ПМК с аневризмой межпредсердной перегородки и АРХ (8%), изолированный ПМК II степени (7%) и ПМК I степени в комбинации с ПТК и АРХ (5%).
Митральная регургитация имела место у 80,3% пациентов с ПМК. Преобладала I степень регургитации – 45,3% случаев.
Миксоматозная дегенерация клапанных створок выявлялась у 15,6% больных ПМК. Выраженность миксоматозной дегенерации соответствовала первой, то есть минимальной, степени.
Подавляющее число больных ПМК (81,3%) предъявляли жалобы характерные для вегето-сосудистой дистонии. Психологическое тестирование также свидетельствовало о болезненном характере выявляемых расстройств по шкале вегетативных нарушений и высокой частоте демонстративного, возбудимого, гипертимического, циклотимического, экзальтированного типов акцентуированных личностей.
Ортостатическая недостаточность при выполнении активной ортостатической пробы обнаружена у 21,8% пациентов с ПМК.
Нарушения сердечного ритма выявлены у 75% обследуемых с ПМК. Доля прогностически значимых нарушений ритма и проводимости в виде желудочковых экстрасистол высоких градаций, пароксизмальных наджелудочковой и желудочковой тахикардий, синдрома слабости синусового узла составила лишь 15%. Прогностически значимые нарушения сердечного ритма и проводимости имели тенденцию к более частой регистрации в случаях ПМК II степени, ПМК в комбинации с аневризмой межпредсердной перегородки и АРХ.
^ Обследовано 23 семьи. Отбор семей осуществлялся по пробанду с ПМК. Всего обследовали 93 человека, среди которых пробандов было 23 (20 женщин и 3 мужчин, в возрасте 18-32 лет), родственников I степени родства – 70 (родителей – 28, сибсов – 9, детей – 33).
Группу больных ^ ПМК с «гипертонией белого халата» сформировали 25 больных (15 мужчин и 10 женщин) в возрасте от 18 до 28 лет (средний возраст 23,1±0,6 лет). Критериями включения являлось отсутствие факторов риска и заболеваний сердечно-сосудистой системы, тромбогеморрагических осложнений в анамнезе.
Группу ^ ПМК с геморрагиями в анамнезе сформировали 12 пациентов (6 мужчин и 6 женщин) в возрасте от 18 до 28 лет (средний возраст 25,3±2,1 лет). Критерии включения: отсутствие сопутствующей патологии, анамнестических указаний на тромбоэмболии и оперативные вмешательства, роды в течение последнего года. В структуре геморрагий при ПМК превалировали носовые кровотечения и обильные меноррагии у женщин. В общем анализе крови и по данным коагулограммы у больных ПМК с геморрагиями в анамнезе отклонений от нормы не было.
Критериями формирования групп больных сахарным диабетом с ПМК (12 мужчин и 8 женщин, средний возраст 24,9±1,3 лет) и без такового (6 мужчин и 4 женщины, средний возраст 24,6±2,3 лет) являлись: впервые выявленный сахарный диабет I типа (длительность заболевания до 6 месяцев), состояние компенсации углеводного обмена (обследование проводили в среднем через 7 дней после коррекции углеводного обмена актрапидом+протафаном), отсутствие клинически манифестных осложнений диабета, других сопутствующих заболеваний и факторов сердечно-сосудистого риска.
Группу ^ ПМК с хроническим тонзиллитом составили 24 больных (16 мужчин и 8 женщин) в возрасте от 18 до 26 лет (средний возраст 19,0±0,8 лет). Критерии включения: наличие ПМК и хронического тонзиллита, отсутствие признаков обострения тонзиллита в момент обследования и предшествующие 2 месяца, отсутствие хронических заболеваний внутренних органов.
Группу здоровых людей составили 40 обследуемых (22 мужчины и 18 женщин) в возрасте от 18 до 32 лет (средний возраст 21,9±0,8 лет) без ПМК и других признаков ДСТ, не имеющих отягощенного наследственного анамнеза. В качестве контроля в иммуногенетическом исследовании использованы данные о распределении HLA-антигенов у 215 здоровых жителей Ставропольского края.
Наряду со стандартным клинико-лабораторным обследованием проводили антропометрические измерения, анализ внешних стигм дисморфогенеза, психологическое тестирование (опросники К. Леонгарда, К.К.Яхина и Д.М. Менделевича), клинико-генеалогический анализ, эходопплеркардиографию («Vivid-3», Израиль), рентгенологические исследования опорно-двигательного аппарата, УЗИ органов брюшной полости, почек, белой линии живота («Aloka-1700», Япония). Регистрировали суточный профиль АД (Spacelabs 90207, США). Методом ИФА определяли сывороточные концентрации аутоантител к коллагенам I, II, III, IV и V типов («Имтек», Россия), цитокинов IL-1β, IL-4, IL-10, TNF-α и IFN-γ («Цитокин», Россия), TGF-β1 и FGF-b («Biosource International Inc.»), эндотелина-1, тромбоксана В2 и 6-кето-простагландина F1α («Amersham»). Колориметрическим методом устанавливали содержание оксида азота («R&D Systems», США). Активность фактора Виллебранда определяли с помощью реагентов НПО «РЕНАМ» (Россия). Изучали индуцированную агрегацию тромбоцитов, используя в качестве индукторов адреналин в конечной концентрации 5 мкМ/мл («Гедеон Рихтер», Венгрия), АДФ – 20 мкМ/мл и коллаген – 0,2 мг/мл («РЕНАМ», Россия). В работе были использованы панели гистотипирующих иммунных сывороток HLA против антигенов I класса и комплемент кроличий лиофилизированный («Гисанс», Россия).
Для проведения статистического анализа данных применяли пакет программ «Biostat 4.0» и «Microsoft Office Excell 2007». Использовали показатели медианы, моды, асимметрии и эксцесса; квантильный анализ, основанный на расчете центилей по Мостеллеру и Тьюки; однофакторный дисперсионный анализ с вычислением двухвыборочного t-критерия Стьюдента, критерия Ньюмена-Кейлса; критерии Крускала-Уоллиса, Данна, 2 с поправкой Йетса, точный критерий Фишера; коэффициенты линейной корреляции Пирсона (r) и ранговой корреляции Спирмана (rs); многофакторный линейный регрессионный анализ. Диагностическую ценность признаков определяли их чувствительностью, специфичностью, предсказательной ценностью при положительных и отрицательных результатах, точностью. Для оценки взаимосвязи между системой HLA и ПМК рассчитывали частоту антигена, гена, показатели RR, EF или PF. Достоверными считали различия при p<0,05. Показатели, имеющие нормальное распределение значений по группе, представлены как среднее±стандартная ошибка средней (
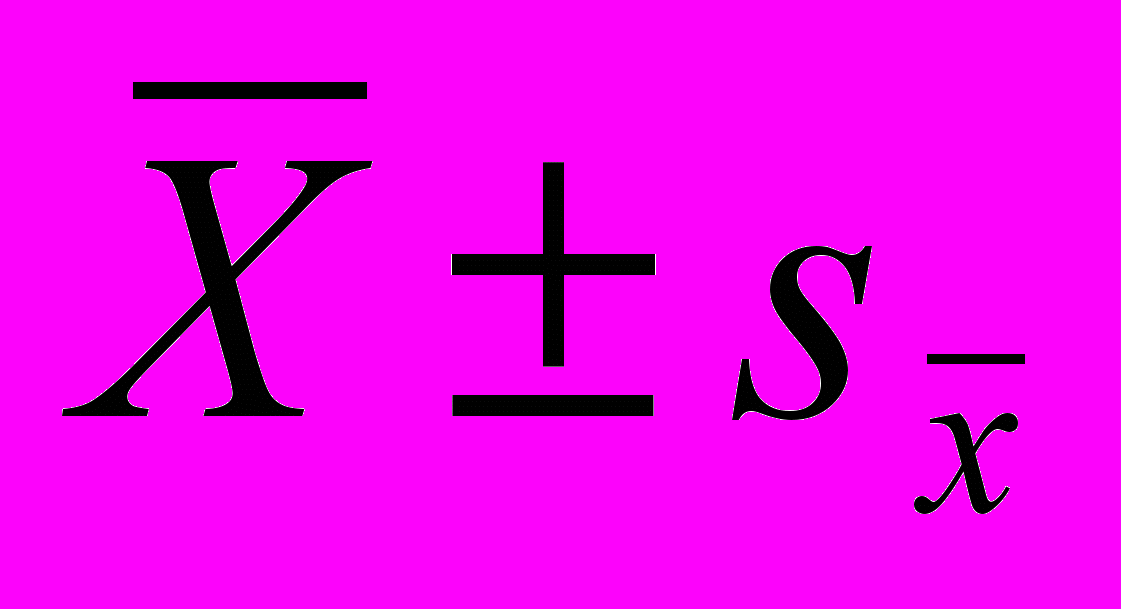 ).
).^ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
У пациентов с ПМК определены особенности антропометрических параметров в виде более низких по сравнению со здоровыми людьми показателей массы (64,0±1,3 и 71,8±1,2 кг соответственно; р<0,05), индекса Кетле (20,7±0,3 и 22,8±0,5 кг/м2 соответственно; р<0,05) и площади поверхности тела (1,8±0,01 и 2,0±0,03 м2 соответственно; р<0,05).
Внешние стигмы дисморфогенеза выявлены во всех случаях ПМК и характеризовались значительной гетерогенностью количественных диапазонов. Наибольшее количество внешних стигм (более 7) констатировано в случаях ПМК II степени, при комбинации ПМК с аневризмой межпредсердной перегородки и АРХ, при наличии миксоматозной дегенерации ПМК.
Установлена зависимость между числом внешних стигм дисморфогенеза и выявляемыми по опроснику К.К. Яхина и Д.М. Менделевича данными психологического тестирования, из чего следует обусловленность психо-вегетативной недостаточности неполноценностью соединительнотканных структур.
Фенотип большинства больных ПМК формировали астенический тип конституции (χ2=56,3; р<0,001), нарушение осанки (χ2=97,6; р<0,001), сколиотическая деформация позвоночника (χ2=20,2; р<0,001), ВДГК I степени (χ2=8,4; р=0,004), крыловидные лопатки (χ2=22,1; р<0,001), положительные тесты запястья (χ2=16,5; р<0,001) и большого пальца (χ2=15,8; р<0,001), гипермобильность суставов (χ2=26,8; р<0,001) и продольное плоскостопие (χ2=12,7; р<0,001). Не было выявлено конкретных внешних стигм характерных для различной тяжести ПМК и его комбинаций с другими внутрисердечными малыми аномалиями.
У всех детей женщин-пробандов с ПМК при внешнем осмотре отмечены внешние стигмы дисморфогенеза и эхокардиографически верифицированы малые аномалии сердца. В структуре этих аномалий у детей преобладали сочетание ПМК с АРХ (45,5% случаев) и изолированные АРХ (42,4%), реже встречался изолированный ПМК (12,1%).
Рентгенологическое исследование расширило спектр патологии опорно-двигательного аппарата у больных ПМК за счет аномалий краниовертебрального сегмента (53,7% случаев; р<0,001), врожденных аномалий развития позвонков (12,8%; р>0,05), дегенеративно-дистрофических заболеваний позвоночника (полисегментарный остеохондроз, спондилез, грыжа межпозвоночного диска) (35,7%; р<0,001), болезни Шойермана-Мау (7,8%; р>0,05), дисплазии тазобедренных суставов (10%; р>0,05) и в 2 раза увеличило процент диагностики деформации позвоночника и стоп. Факт регистрации случаев тяжелых скелетных дисплазий (III степень ВДГК и сколиоза, IV степень плоскостопия) отмечен только при ПМК II степени или при сочетании ПМК с АМПП. Больные с миксоматозной дегенерацией ПМК отличались более высокой частотой встречаемости болезни Шойермана-Мау (27,8%; р<0,05).
Результаты ультразвукового исследования пациентов с ПМК демонстрировали распространенность растяжения белой линии живота (27% наблюдений; р=0,02) и контурной деформации желчного пузыря (32%; р=0,028) преимущественно в виде фиксированного перегиба в области шейки.
Для целенаправленной инструментальной диагностики костно-мышечных и экстракардиальных висцеральных изменений у больных ПМК проводили анализ диагностической ценности внешних фенотипических признаков. Высокими показателями чувствительности (100%), положительной (70%) и отрицательной (100%) предсказательной ценности, точности (75,8%) оценивалось нарушение осанки в группе больных ПМК со сколиотической деформацией позвоночника. Приводим алгоритм для диагностики патологии опорно-двигательного аппарата в случае выявления у пациента с ПМК нарушения осанки (рис. 1).

Рис. 1. Алгоритм инструментальной диагностики при сочетании нарушения осанки и ПМК.
Гипермобильность суставов у больных ПМК с нестабильностью краниовертебрального сегмента характеризовалась высокими показателями специфичности (81%), положительной предсказательной ценности (81%) и точности (75%), а при сколиотической деформации позвоночника – высокими показателями специфичности (88,9%) и положительной предсказательной ценности (73,9%). У больных ПМК с растяжением белой линии живота гипермобильность суставов обладала высокими специфичностью (83,9%), отрицательной предсказательной ценностью (85,2%) и точностью (80%).

Рис. 2. Алгоритм инструментальной диагностики при сочетании гипермобильности суставов и ПМК.
Вполне очевидно, что сочетание ПМК с суставной гипермобильностью диктует необходимость выполнения у этой категории пациентов рентгенографии позвоночника с целью верификации нестабильности краниовертебрального сегмента и/или сколиоза, а также проведения ультразвукового исследования белой линии живота для установления факта ее растяжения (рис. 2).
Выявлена прямая зависимость между градацией суставной гипермобильности и степенью растяжения белой линии живота у женщин с ПМК (rs=+0,75; р<0,05).
Фенотипическая манифестация нарушений структуры и функции соединительной ткани у пациентов с ПМК сопровождалась повышением сывороточных концентраций ААТ к коллагенам I и II типов (рис.3).
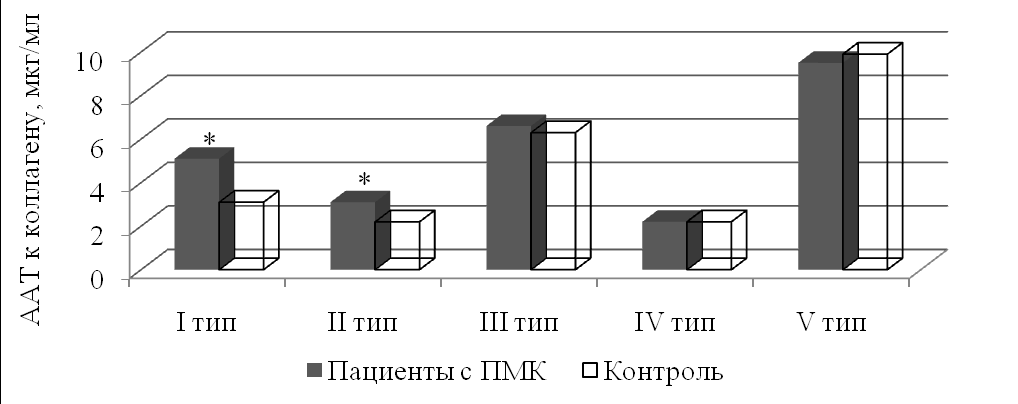 Рис. 3. Содержание ААТ к коллагенам I-V типов у больных ПМК и здоровых людей. * – р<0,05 в сравнении со здоровыми (критерий Ньюмена-Кейлса).
Рис. 3. Содержание ААТ к коллагенам I-V типов у больных ПМК и здоровых людей. * – р<0,05 в сравнении со здоровыми (критерий Ньюмена-Кейлса).Установленные отклонения в продукции коллагеновых аутоантител у пациентов с ПМК не только характеризуют вовлечение коллагена, преимущественно интерстициального, в процесс формирования кардиальных и экстракардиальных диспластических изменений, но и свидетельствуют о нарушении иммунорегуляции.
Точка зрения о вариабельности характера и степени выраженности клинического фенотипа коллагеновых мутаций (Dalgleish R., 1997) подтверждается установленной в нашем исследовании взаимосвязью состояния коллагенового аутоиммунитета с различными вариантами ПМК (табл. 1). Нормальный уровень аутоантител к изучаемым коллагенам I-V типов в группе изолированного ПМК I степени позволяет предположить отсутствие значимых нарушений метаболизма соединительной ткани и «дефектов» иммунной системы. Случаи ПМК в комбинации с аневризмой межпредсердной перегородки и АРХ характеризовались максимальной концентрацией аутоантител к коллагену II типа.
Таблица 1
^ Уровень аутоантител к коллагенам плазмы крови в зависимости от варианта ПМК (
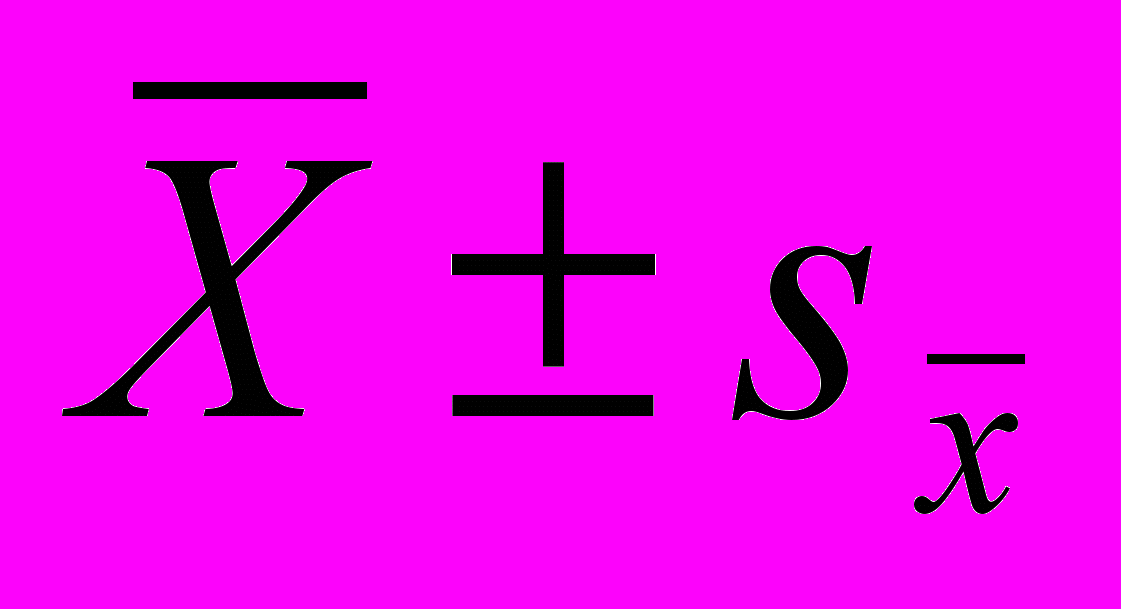 )
)| Группы обследуемых | Уровень аутоантител к коллагену, мкг/мл | ||||
| I тип | II тип | III тип | IV тип | V тип | |
| ПМК I степени (n=55) | 4,7±0,6 | 2,9±0,6 | 6,1±0,5 | 1,8±0,3 | 7,8±0,9 |
| ПМК I степени + АРХ (n=72) | 6,4±0,3* | 4,2±0,2* | 6,8±0,5 | 2,3±0,2 | 10,5±0,9 |
| ПМК I степени + ПТК (n=22) | 5,9±0,9* | 2,9±0,2 | 7,3±0,5 | 2,4±0,3 | 7,5±0,9 |
| ПМК I ст.+ ПТК + АРХ (n=11) | 6,3±0,2* | 4,8±0,1* | 7,8±0,6 | 2,3±0,4 | 9,6±1,1 |
| ПМК II степени (n=16) | 6,7±0,5* | 4,4±0,2* | 8,1±1,1 | 2,3±0,3 | 8,6±0,9 |
| ПМК II степени + АРХ (n=27) | 6,9±0,9* | 4,5±0,2* | 7,9±0,3 | 2,2±0,2 | 8,4±0,9 |
| ПМК I ст.+ АМПП +АРХ (n=17) | 4,2±0,9 | 5,2±0,5* | 6,8±0,7 | 1,6±0,4 | 9,4±1,2 |
| Здоровые (n=40) | 3,1±0,3 | 2,2±0,4 | 6,3±0,3 | 2,2±0,2 | 9,9±0,6 |
* – р<0,05 в сравнении со здоровыми (критерий Ньюмена-Кейлса).
Миксоматозная дегенерация ПМК сопровождалась увеличением плазменных концентрацией антител к коллагенам I и II типа, а также более высоким по сравнению с пациентами без миксоматозной дегенерации уровнем ААТ к коллагенам II и V типов (рис. 4).
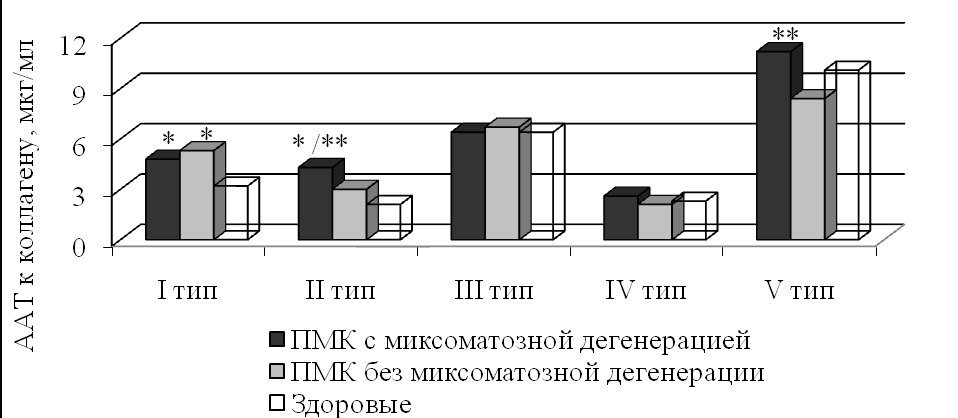 Рис. 4. Уровень ААТ к коллагенам I-V типов у больных ПМК с учетом признаков миксоматозной дегенерации. * – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).
Рис. 4. Уровень ААТ к коллагенам I-V типов у больных ПМК с учетом признаков миксоматозной дегенерации. * – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).Расширение спектра антител к коллагенам различных типов и увеличение их количественного уровня позволяют характеризовать в целом более выраженные дефекты аутоиммунных механизмов при миксоматозной дегенерации ПМК и при ПМК, сочетающемся с аневризмой межпредсердной перегородки.
У пациентов с ПМК наблюдался несбалансированный профиль сывороточных цитокинов, ответственных за синтез коллагена, эндотелиальную функцию и иммунный ответ: повышение IL-1β, TGF-1, FGF-b и снижение TNF-α, IFN- и их соотношений с IL-4, IL-10.
Повышение уровня IL-1β, TGF-1 и FGF-b в крови больных ПМК может характеризовать компенсаторную индукцию синтеза коллагена, а также синтеза растворимых рецепторов к TNF-α параллельно с торможением выработки этого цитокина посредством TGF-1 и с угнетением продукции IFN-γ.
Выявленный дисбаланс цитокинов у больных ПМК является дополнительным патогенетическим фактором в формировании эндотелиальной дисфункции. Так, большинство ростовых факторов усиливает образование ЕТ-1, а в сочетании с низким уровнем IFN- способствует снижению синтеза оксида азота. Снижение TNF-α и IFN- у пациентов с ПМК кроме того отражает нарушение иммунного ответа.
Группы больных ПМК I степени как изолированного, так и в комбинации с АРХ и/или ПТК отличались от здоровых низким уровнем TNF-α и высоким – TGF-1. Случаи ПМК II степени, ПМК II степени в сочетании с АРХ характеризовались высокими концентрациями IL-1β, TGF-1 и FGF-b. Максимальные отклонения в цитокиновом статусе в виде увеличения сывороточного содержания IL-1β, IL-4, IL-10, TGF-1 и FGF-b, выявлены у больных ПМК в комбинации с АМПП и АРХ. В этой же группе пациентов зарегистрированы и наиболее выраженные нарушения баланса цитокинов в виде повышенных индексов IL-1/IL-4, IL-1/IL-10 и сниженных – TNF-α/IL-4, TNF-α/IL-10, IFN-/IL-4, IFN-/IL-10.
Больных с миксоматозной дегенерацией ПМК отличали высокие сывороточные концентрации IL-1, TGF-1 и, особенно, FGF-b, а также низкое содержание IFN- (табл. 2, рис. 5).
Таблица 2
^ Уровень TGF-1 и FGF-b с учетом признаков миксоматозной
дегенерации ПМК (
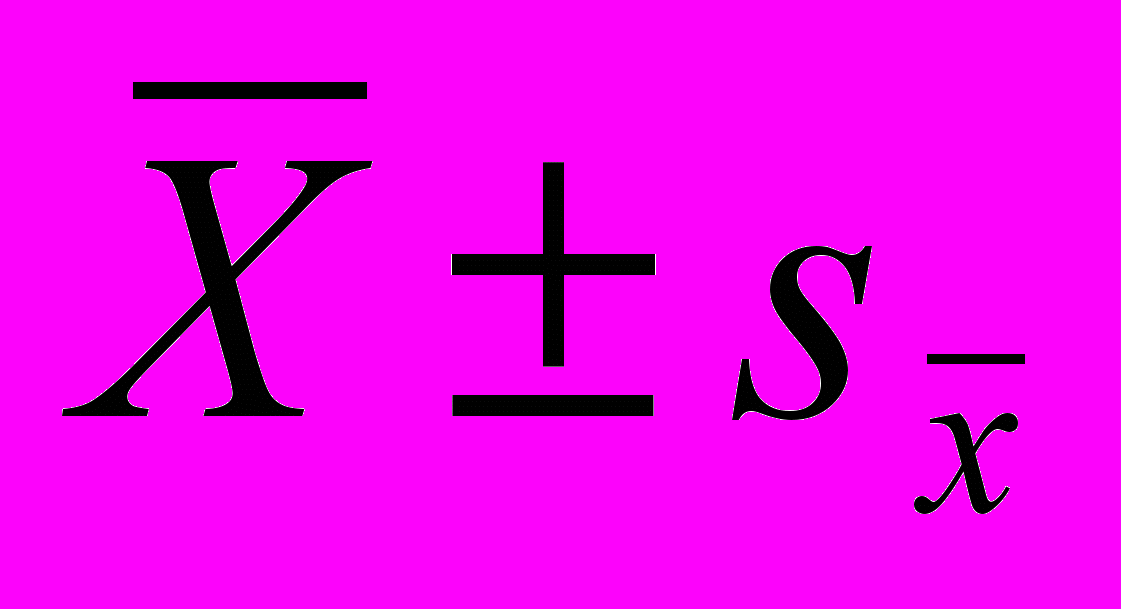 )
)| Группы обследуемых | TGF-1, нг/мл | FGF-b, пг/мл |
| ПМК с МД (n=25) | 4,3±0,3* | 65,8±1,2*/** |
| ПМК без МД (n=115) | 3,8±0,5* | 38,9±3,1* |
| Здоровые (n=20) | 0,5±0,2 | 15,6±2,8 |
* – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).
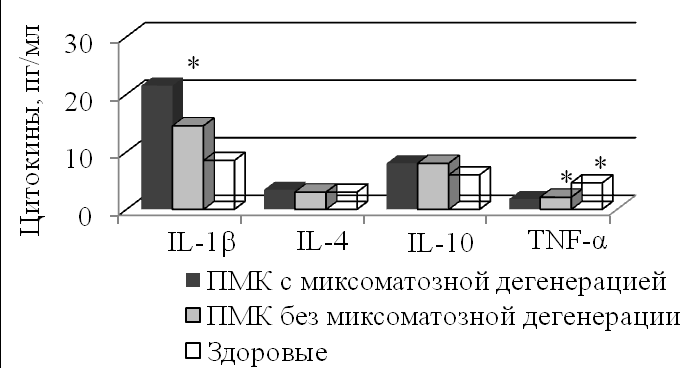
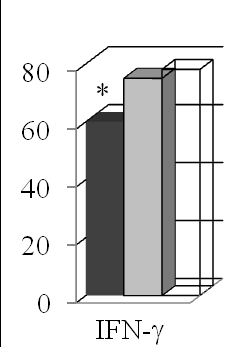
Рис. 5. Содержание цитокинов с учетом признаков миксоматозной дегенерации ПМК. * – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерии Крускала-Уоллиса и Данна).
Несбалансированный профиль цитокинов у больных с миксоматозной дегенерацией ПМК выражался повышением индекса IL-1/IL-4 и низкими значениями TNF-α/IL-4, IFN-/IL-4 и IFN-/IL-10, которые определяют способность IL-4 и IL-10 ингибировать функции Th1 и угнетать продукцию IFN-, формируя один из механизмов нарушений иммунологического реагирования.
В целом цитокиновый статус в случаях ПМК различался не только количественными параметрами, но и качественными особенностями. В связи с этим представляется возможным говорить о дифференциально-диагностической ценности определения цитокинов у больных пролапсом митрального клапана.
Известно, что ростовые факторы не только индуцируют синтез коллагена, но и являются одними из важных регуляторов скелетного морфогенеза и скелетных изменений (Tsuchida K. et al., 2003; Marie P.J. et al., 2005). В подобных условиях образование повышенных уровней TGF-1, FGF-b и антител к интерстициальным коллагенам I и II типов у больных ПМК с клинически значимыми костно-мышечными дисплазиями – деформациями грудной клетки, позвоночника, стоп, суставной гипермобильностью – рассматривается как весьма вероятное (табл.3, рис. 6).
Таблица 3
^ Концентрация ростовых факторов в крови больных ПМК
с учетом костно-мышечных признаков ДСТ (
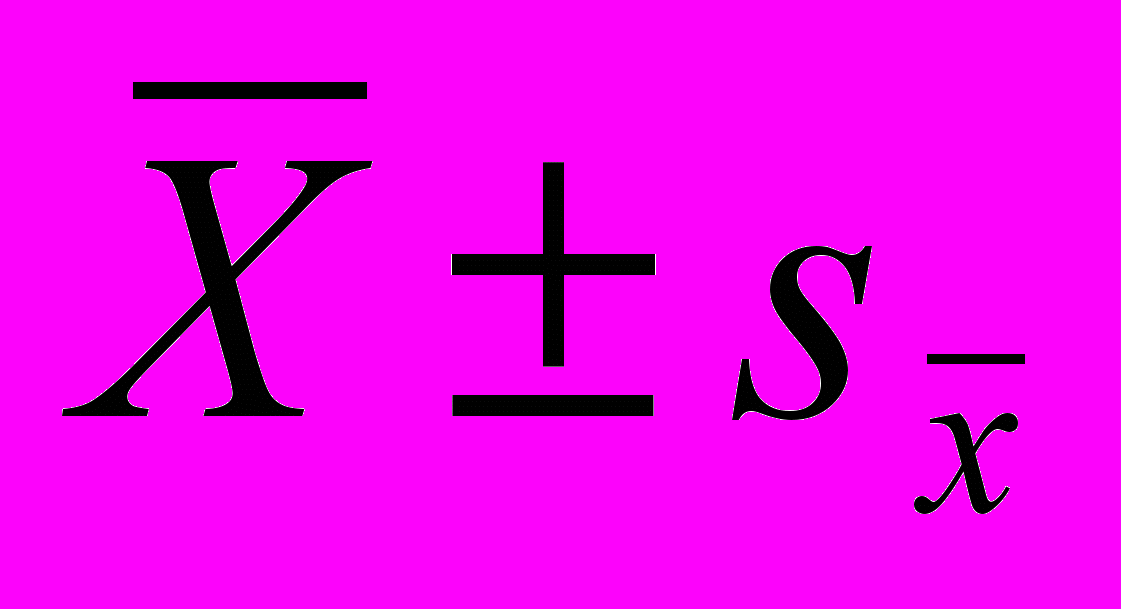 )
)| Группы обследуемых | TGF-1, нг/мл | FGF-b, пг/мл |
| С ВДГК, сколиозом, плоскостопием, ГМС (n=113) | 4,7±0,6* | 45,6±3,2* |
| Без ВДГК, сколиоза, плоскостопия, ГМС (n=27) | 3,7±1,3 | 32,6±4,7 |
| Здоровые (n=20) | 0,5±0,2 | 15,6±2,8 |
* – р<0,05 в сравнении со здоровыми (критерий Ньюмена-Кейлса).
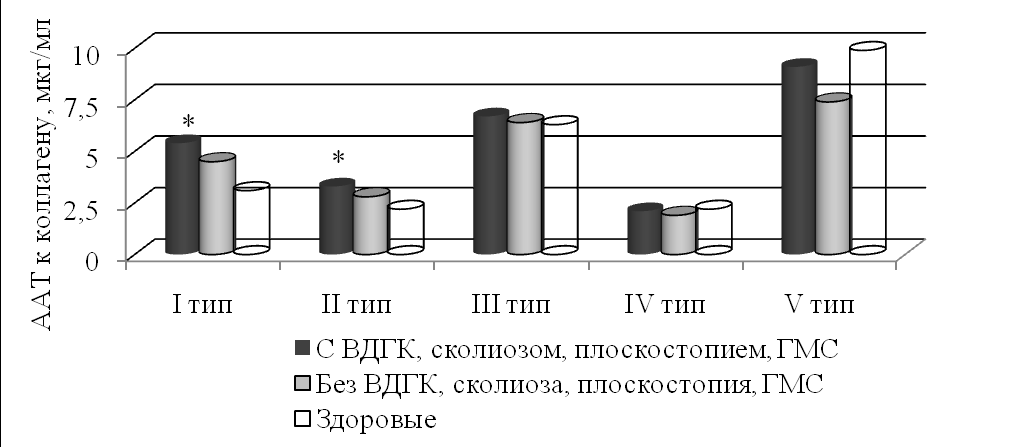 Рис. 6. Уровень ААТ к коллагену у больных ПМК с учетом костно-мышечных признаков ДСТ. * – р<0,05 в сравнении со здоровыми (критерий Ньюмена-Кейлса).
Рис. 6. Уровень ААТ к коллагену у больных ПМК с учетом костно-мышечных признаков ДСТ. * – р<0,05 в сравнении со здоровыми (критерий Ньюмена-Кейлса).Одним из проявлений дисфункции эндотелия при наследственных нарушениях структуры и функции соединительной ткани рассматривают дефицит фактора Виллебранда (Баркаган З.С. и соавт., 2004), определяющего в том числе состояние коллагена субэндотелия сосудов. Изучение альтернативных модуляторов функции эндотелия у больных ПМК продемонстрировало снижение показателя vWF/NOn. Выявленный факт отражает не только снижение активности фактора Виллебранда, но и относительное увеличение продукции окиси азота, которое, на наш взгляд, может иметь адаптивное значение, в определенной мере предупреждая развитие внутрисосудистых осложнений, в частности тромбозов, при пролапсе митрального клапана.
Результаты исследования маркеров функции эндотелия с учетом варианта ПМК показали различную степень их изменения (табл. 4).
Снижение активности фактора Виллебранда зарегистрировано во всех группах ПМК, что позволяет рассматривать его в качестве маркера изменения функционального фенотипа эндотелия у данной категории пациентов. В случаях пролабирования митрального клапана II степени было зарегистрировано высокое содержание ТхВ2 при отсутствии нарушения его равновесия с 6-keto-PGF1α, что свидетельствует о сохранении по линии метаболизма арахидоновой кислоты компенсаторных способностей эндотелия. У больных ПМК в сочетании с аневризмой межпредсердной перегородки и АРХ определялось повышенное содержание ЕТ-1, отражающего более выраженную функциональную, а значит и структурную, неполноценность субэндотелиального экстрацеллюлярного матрикса как основы развития дисфункции эндотелия.
Таблица 4
^ Эндотелиальные маркеры в зависимости от варианта ПМК
(
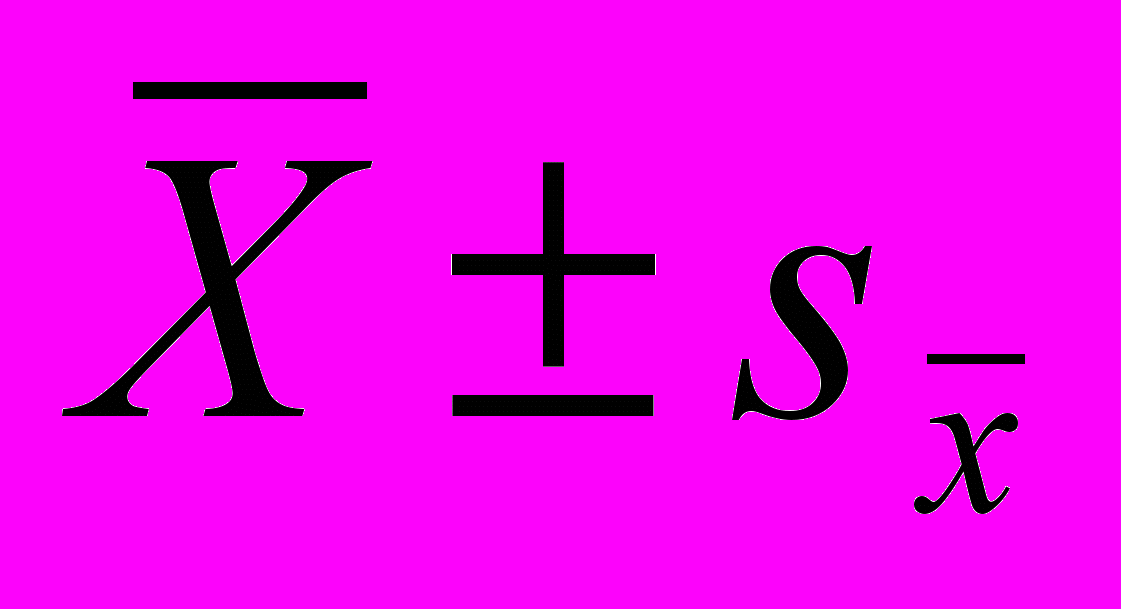 )
)| Группы обследуемых | ЕТ-1, пг/мл | NOn, мкмоль/л | ТхВ2, пг/мл | 6-keto-PGF1α, пг/мл | vWF, % |
| ПМК I ст. (n=30) | 25,1±4,8 | 39,2±8,2 | 64,3±4,4 | 60,4±4,2 | 98,7±3,8* |
| ПМК I ст.+АРХ (n=46) | 27,8±4,7 | 33,7±9,7 | 65,4±3,2 | 60,5±4,7 | 95,4±4,2* |
| ПМК I ст.+ПТК (n=14) | 25,9±4,5 | 40,4±6,5 | 63,9±3,8 | 58,9±3,7 | 96,4±3,2* |
| ПМК I ст.+ПТК + АРХ (n=10) | 26,3±3,6 | 36,7±8,4 | 64,4±2,8 | 60,2±4,8 | 96,2±4,4* |
| ПМК II ст. (n=12) | 29,1±2,8 | 38,7±9,7 | 77,9±5,6* | 70,8±6,8 | 100,0±6,2* |
| ПМК II ст.+АРХ (n=14) | 28,8±3,4 | 35,1±4,6 | 83,5±4,7* | 80,9±5,7 | 100,0±6,7* |
| ПМК I ст.+ АМПП +АРХ (n=14) | 54,6±2,8*/** | 22,8±5,5 | 72,4±1,2 | 60,2±2,3 | 80,7±8,7* |
| Здоровые (n=20) | 24,8±2,3 | 23,1±2,4 | 56,4±3,2 | 54,2±4,7 | 125,0±6,7 |
* – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравнении с другими группами ПМК (критерий Ньюмена-Кейлса).
Коэффициент ЕТ-1/NOn в группе ПМК в комбинации с аневризмой межпредсердной перегородки и АРХ характеризовал преобладание вазоконстрикторных и протромбогенных процессов. Эти данные отчасти подтверждают мнение о самостоятельном предикторном значении аневризмы межпредсердной перегородки в отношении возникновения тромбоэмболических осложнений (Mathioli A.V. et al., 2001). Кроме того, в группах ПМК II степени, ПМК II степени в сочетании с АРХ, ПМК в комбинации с аневризмой межпредсердной перегородки и АРХ не было отмечено снижения TxB2/NOn характерного для ПМК I степени – как изолированного, так и в сочетании с АРХ и/или ПТК, вероятно, в результате относительного дефицита синтеза NO в условиях повышенной вазоконстрикторной активации (включая TxB2) при более выраженной соединительнотканной дисплазии сердца.
В случаях миксоматозной дегенерации створок определены высокий уровень ЕТ-1 и максимальное снижение активности фактора Виллебранда (табл. 5), нарушение баланса ЕТ-1/NOn, ЕТ-1/6-keto-PGF1α, ТхВ2/6-keto-PGF1α, ТхВ2/NOn и vFW/NOn, которые могут быть связаны с более «жесткой» генетической детерминацией функционального фенотипа эндотелия в виде персистирующей активации и последующего «истощения» компенсаторных способностей эндотелиальных клеток.
Таблица 5
^ Эндотелиальные маркеры у больных ПМК с учетом признаков
миксоматозной дегенерации (
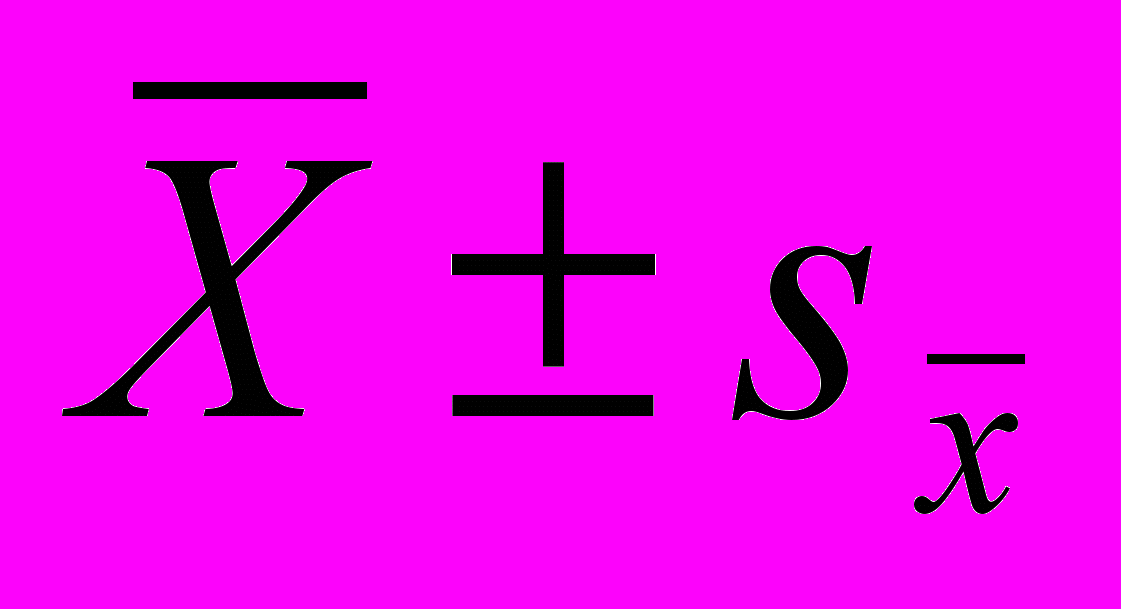 )
)| Группы обследуемых | ЕТ-1, пг/мл | NOn, мкмоль/л | ТхВ2, пг/мл | 6-keto-PGF1α, пг/мл | vWF, % |
| ПМК с МД (n=25) | 48,1±2,4*/** | 20,1±5,6 | 79,6±5,4 | 46,9±5,3 | 75,0±7,1*/** |
| ПМК без МД (n=115) | 28,8±3,2 | 41,2±7,9 | 65,7±6,2 | 62,1±3,2 | 96,8±3,5* |
| Здоровые (n=20) | 24,8±2,3 | 23,1±2,4 | 56,4±3,2 | 54,2±4,7 | 125,0±6,7 |
* – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).
В процессе изучения индуцированной агрегации тромбоцитов у больных ПМК выявлены особенности, связанные с неодинаковой значимостью отдельных индукторов в активационных изменениях тромбоцитов. При использовании в качестве индуктора адреналина нарушение агрегационной способности выявлено у 42 больных (19,1%, р>0,05), АДФ – у 40 (18,2%, р>0,05) и коллагена – у 140 (63,6%, р<0,05) пациентов с ПМК. Среди вариантов дезагрегации доминировали гипоагрегационные сдвиги.
Выявлено более значительное угнетение ответа пластинок на коллагеновый индуктор агрегации у больных с миксоматозной дегенерацией ПМК. При этом значения адреналиновой и АДФ-индуцированной агрегации тромбоцитов в обеих группах ПМК не различались и соответствовали контрольным величинам (табл. 6).
