«Ставропольская государственная медицинская академия Министерства здравоохранения и социального развития»
| Вид материала | Автореферат |
- Актуальные проблемы физической культуры, спорта, туризма и спортивной медицины: инновации, 45.22kb.
- Основная образовательная программа высшего профессионального образования направление, 1695.58kb.
- «Челябинская государственная медицинская академия Министерства здравоохранения и социального, 810.19kb.
- Дифференцированный выбор метода хирургического лечения кист поджелудочной железы 14., 344.34kb.
- Р. Н. Мищенко Рекомендовано к печати редакционно-издательским советом Стгма, 118.58kb.
- Учебно-методическое пособие Многоуровневые тесты по акушерству В. А. Аксененко,, 950.54kb.
- Ушакова ольга Владимировна нарушения функции поджелудочной железы при хронических вирусных, 270.36kb.
- Клинико-диагностические критерии супрапищеводных синдромов гастроэзофагеальной рефлюксной, 329.02kb.
- Рабочая программа цикла последипломного обучения врачей, 4256.76kb.
- Рабочая учебная программа по детским хирургическим болезням с ортопедией и травматологией, 938.04kb.
Таблица 6
^ Агрегация тромбоцитов у больных ПМК с учетом признаков
миксоматозной дегенерации (
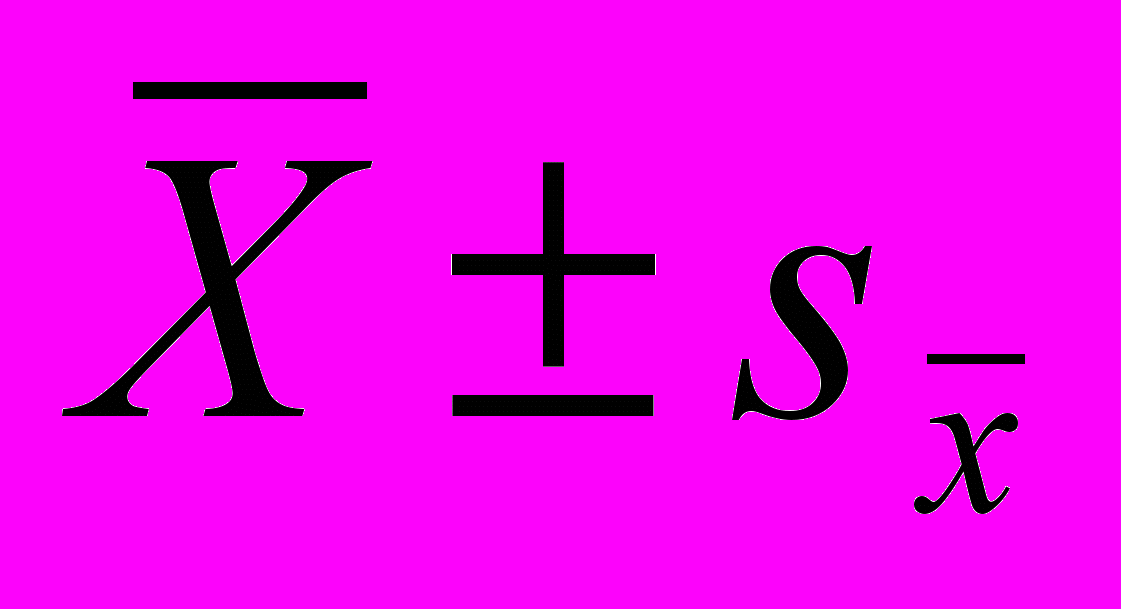 )
)| Группы обследованных | Индуцированная агрегация тромбоцитов, % | ||
| адреналином | АДФ | коллагеном | |
| ПМК с МД (n=180) | 53,1±7,6 | 61,4±6,4 | 21,6±5,3*/** |
| ПМК без МД (n=40) | 58,2±6,4 | 57,8±5,2 | 36,9±3,6* |
| Здоровые (n=40) | 64,6±4,9 | 58,9±3,8 | 62,4±3,9 |
* – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).
Дисфункция агрегации тромбоцитов может выступать в качестве одного из звеньев патогенеза соединительнотканных нарушений, создавая предпосылки для изменения взаимосвязи тромбоцит-сосудистая стенка. По-видимому, нарушения тромбоцитарно-сосудистого гемостаза у больных ПМК составляют звенья единого, многообразного патогенетического каскада нарушения структуры и функции соединительной ткани.
Дисплазия соединительной ткани, обусловленная разнообразными генетическими дефектами биосинтеза коллагена и других компонентов соединительной ткани, проявляется нарушением межклеточного взаимодействия через продукты главного комплекса гистосовместимости (Глотов А.В. и соавт., 2005). Спектр позитивных HLA-ассоциаций у пациентов с ПМК, жителей Ставропольского края РФ, характеризовался разнообразием: А25 (RR=4,10, EF=0,16, 2=13,5, р<0,001), В8 (RR=3,26, EF=0,17, 2=11,8, р<0,001), В27 (RR=4,79, EF=0,19, 2=18,5, р<0,001), В35 (RR=3,10, EF=0,16, 2=10,6, р<0,001), Сw3 (RR=5,83, EF=0,29, 2=30,3, р<0,001), Cw5 (RR=2,65, EF=0,20, 2=10,9, р<0,001), А1/А25 (RR=10,8, EF=0,12, 2=15,6, р<0,001), А1/А29 (RR=4,78, EF=0,12, 2=10,9, р<0,001), А1/А31 (RR=4,79, EF=0,19, 2=18,5, р<0,001), А2/А25 (RR=6,97, EF=0,13, 2=14,5, р<0,001), А3/А25 (RR=9,05, EF=0,10, 2=12,0, р<0,001), В7/В35 (RR=10,8, EF=0,12, 2=15,6, р<0,001), В8/В27 (RR=5,72, EF=0,23, 2=17,2, р<0,001), В17/В27 (RR=4,78, EF=0,12, 2=10,9, р<0,001) и Сw3/Cw5 (RR=7,49, EF=0,14, 2=16,3, р<0,001).
К негативным HLA-маркерам у больных ПМК относились ассоциации с антигенами А24 (RR=0,30, РF=0,14, 2=9,4, р=0,028) и А26 (RR=0,22, EF=0,14, 2=11,2, р<0,001).
Гетерогенность иммуногенетических маркеров, во-первых, согласуется с информацией об отсутствии определенного генетического дефекта при ПМК (Loeys B. et al., 2001; Freed L.A. et al., 2003). Во-вторых, принимая во внимание концептуальную модель причин мультифакториального заболевания F. Vogel, можно допустить участие указанных HLA-маркеров в образовании «генетического фона», который, как известно, способен модифицировать экспрессию главных генов. В-третьих, логично предположить, что значительный спектр позитивно ассоциированных с ПМК HLA-специфичностей является результатом полигенности заболевания и отражает неоднородность путей реализации патологического процесса, что и обусловливает клинический полиморфизм.
Анализ распределения HLA-ассоциаций при различных вариантах ПМК выявил ряд особенностей: фенотипы А1/А29, А1/А31, А2/А25 были типичны для случаев пролабирования митрального клапана I степени (ПМК I степени, ПМК I степени в сочетании с АРХ и/или ПТК), а антигены А25, В35, В27 – для пролабирования митрального клапана II степени (ПМК II степени, ПМК II степени в сочетании с АРХ). Комбинация ПМК с аневризмой межпредсердной перегородки и АРХ была связана с В27, А1/А25. Определена высокая точность антигенов А25, В27 и фенотипа В8/В27 для диагностики миксоматозной дегенерации ПМК. Обнаруженная ранее сопряженность HLA-А25, В27, В35 с максимально выраженными изменениями метаболизма соединительной ткани (Яковлев В.М. и соавт., 2005) позволяет предполагать значение указанных антигенов как маркеров выраженности диспластического процесса в целом.
К одной из концепций, определяющих иммуногенетическую детерминированность дисплазии соединительной ткани, относят нарушение формообразования рыхлой или твердой соединительной ткани, реализующее такой тип HLA-ассоциаций, как локомоторный (Яковлев В.М. и соавт., 2005). В нашем исследовании получены данные о характере распределения HLA-антигенов при различных костно-мышечных дисплазиях, что позволяет, в частности, выделить у пациентов с ПМК группу риска по развитию сколиотической деформации позвоночника. При сколиозе определена высокая диагностическая ценность HLA-фенотипов В7/В35 (специфичность 94,4%, отрицательная предсказательная ценность 79,2%, точность 77,3%) и В8/В27 (специфичность 86,5%, отрицательная предсказательная ценность 77,7%, точность 71,4%). Клинически значимые костно-мышечные дисплазии являются редкостью для носителей HLA-А24 и А26.
В динамике при длительном наблюдении больных ПМК было отмечено ремоделирование камер сердца в виде увеличения частоты и степени митральной регургитации с тенденцией к увеличению средних показателей размеров левого предсердия и давления в легочной артерии, к снижению показателей сердечного выброса (Перекальская М.А. и совт., 2002). В этой связи вполне закономерны вопросы: «Почему относительно благополучные пациенты неожиданно декомпенсируются?» и «Имеются ли маркеры надвигающейся катастрофы?» (Нечаева Г.И. и соавт., 2001). Нами была сделана попытка частично ответить на эти вопросы.
У пациентов с ПМК, по нашим данным, эхокардиографические показатели соответствовали норме.
Таблица 7
^ Показатели ЭхоКГ у пациентов с ПМК с учетом антропометрических величин (
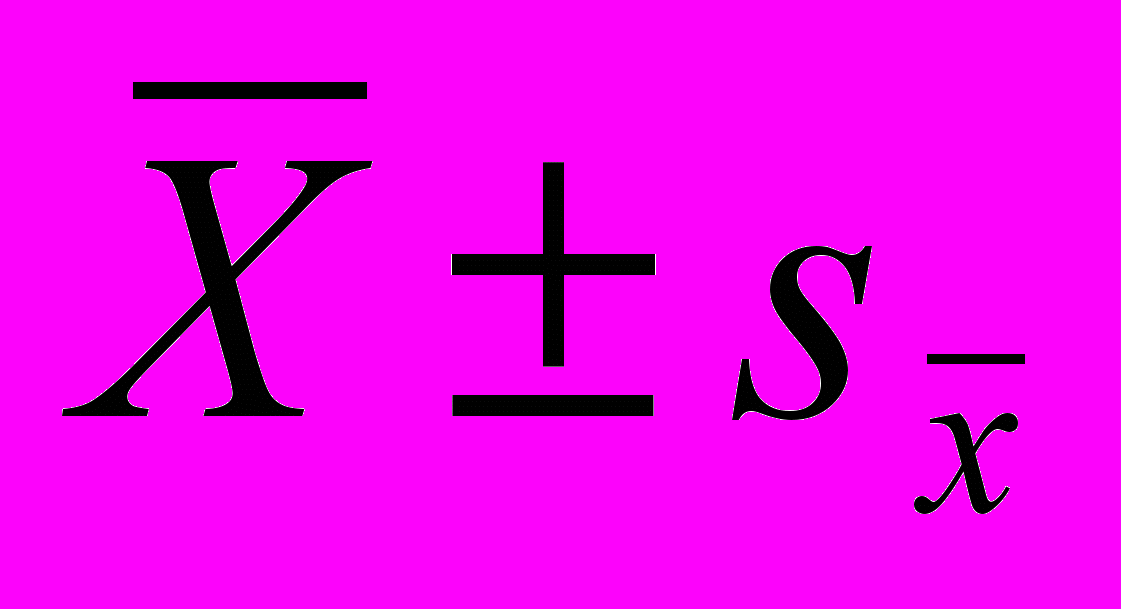 )
)| Показатель | Пациенты с ПМК (n=278) | Здоровые (n=40) |
| ИЛП, см/м2 | 1,6±0,02* | 1,2±0,03 |
| ИКДО, мл/м2 | 53,9±1,6* | 43,2±1,3 |
| ИКСО, мл/м2 | 16,7±1,2 | 13,4±1,2 |
| ИММЛЖ, г/м2 | 80,1±1,8* | 57,3±1,5 |
| УИ, мл/м2 | 38,2±1,4* | 29,9±1,3 |
| Индекс правого предсердия, см/м2 | 1,3±0,03 | 1,2±0,04 |
| Индекс правого желудочка, см/м2 | 1,3±0,01 | 1,3±0,05 |
* – р<0,05 в сравнении со здоровыми (t-критерий Стьюдента).
Однако при анализе эхокардиографических величин с учетом антропометрических параметров (после их нормализации к площади поверхности тела) у части больных ПМК и в группе в целом выявлено достоверное увеличение индексов левого предсердия, конечного диастолического объема, массы миокарда левого желудочка и ударного индекса, что демонстрирует у определенной категории больных (86,5%) начальные признаки ремоделирования миокарда (табл. 7).
Увеличение ИЛП, ИКДО и ИКСО закономерно оказались более отчетливыми в группе ПМК с митральной регургитацией II степени.
Из указанного выше следует, что, во-первых, для правильной оценки отклонений структурно-функциональных параметров миокарда при ПМК необходимо интерпретировать эхокардиографические величины с учетом антропометрических особенностей и, во-вторых, выявление предикторов структурно-функционального ремоделирования миокарда у больных ПМК могло бы сыграть одну из ключевых ролей в разработке мер системной профилактики этого состояния.
Установлено также, что структурно-функциональное ремоделирование миокарда связано с состоянием коллагенового аутоиммунитета, цитокинового профиля и серологических маркеров функции эндотелия. Линейный многофакторный регрессионный анализ демонстрировал наибольший вклад в ремоделирование миокарда левого желудочка при ПМК гиперпродукции аутоантител к коллагенам I и II типов, повышенной концентрации FGF-b и ЕТ-1:
ИММЛЖ (г/м2) = 36,4 + 2,9 х ААТ к коллагену I типа (мкг/мл) + 2,1 х ААТ к коллагену II типа (мкг/мл) + 0,4 х FGF-b (пг/мл) + 0,09 х ЕТ-1 (пг/мл).
Определены иммуногенетические маркеры предрасположенности к структурно-функциональному ремоделированию миокарда у больных ПМК (табл. 8).
Таблица 8
^ Структурно-функциональные параметры сердца у больных ПМК в зависимости от HLA-фенотипа (
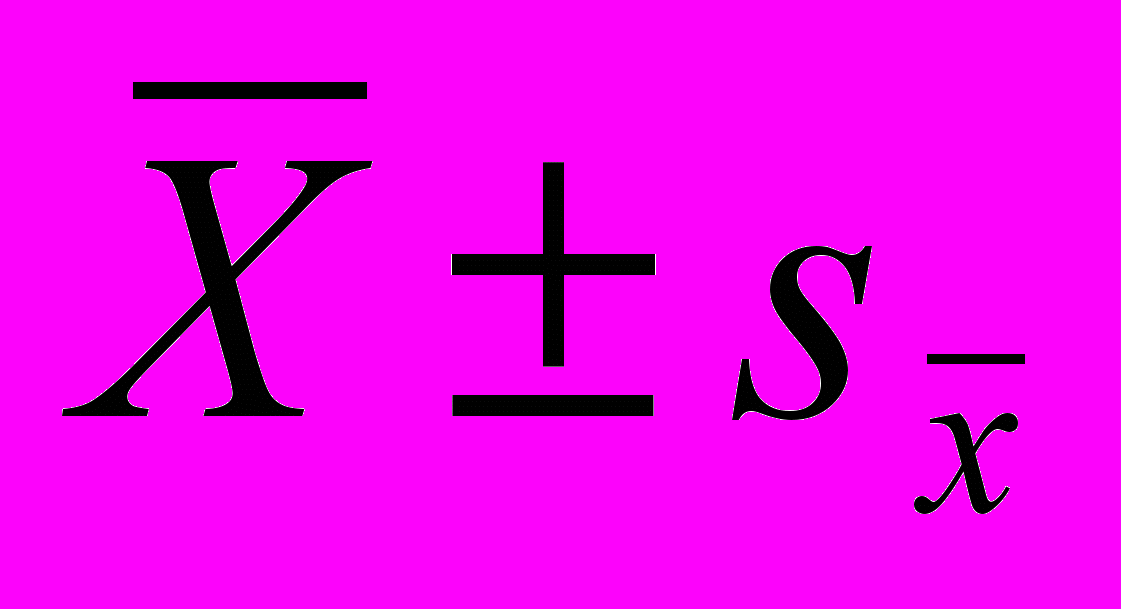 )
)| Показатель | Группы ПМК | Здоровые (n=40) | |
| с наличием А25, В27, В35 (n=50) | с отсутствием А25, В27, В35 (n=69) | ||
| ФВ ЛЖ, % | 66,7±1,2* | 69,1±0,5 | 72,4±2,1 |
| ИЛП, см/м2 | 1,7±0,05*/** | 1,5±0,02* | 1,2±0,03 |
| ИКДО, мл/м2 | 55,0±4,8* | 54,0±1,8* | 43,2±1,3 |
| ИММЛЖ, г/м2 | 82,1±1,3*/** | 70,0±3,0* | 57,3±1,5 |
| УИ, мл/м2 | 34,4±3,8 | 39,2±1,7* | 29,9±1,3 |
* – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).
У обладателей антигенов А25, В27, В35 регистрировалось снижение фракции выброса левого желудочка, тогда как в группе ПМК с отсутствием указанных HLA-маркеров сократительная функция не отличалась от контроля. Кроме того, у носителей указанных антигенов выявлены максимальные значения индексов левого предсердия и массы миокарда левого желудочка.
Очевидно, что за больными ПМК с высокой сывороточной концентрацией аутоантител к коллагенам I и II типов, FGF-b, ЕТ-1 и/или имеющими в HLA-антигенном составе А25, В27, В35 необходимо плановое динамическое наблюдение.
Полученные данные развивают представление о детерминированности изменений сердца при ДСТ, в генезе которых ведущую роль играют факторы, связанные с нарушением обмена веществ наследственной и регуляторной природы.
Нами предложен алгоритм стратификации групп риска развития ремоделирования миокарда в популяции больных ПМК (рис. 7). Представленная схема демонстрирует различия риска развития ремоделирования миокарда.
Как уже было отмечено, наиболее выраженные структурно-функциональные и/или иммуно-эндотелиальные отклонения определялись в случаях пролабирования митрального клапана II степени, сочетания ПМК с аневризмой межпредсердной перегородки, при миксоматозной дегенерации ПМК, митральной регургитации II степени, что позволяет стратифицировать больных с указанными вариантами ПМК в группу риска ремоделирования миокарда.
Исходя из данных о максимальных уровнях антителообразования к коллагенам I и II типов, TGF-β1 и FGF-b у больных ПМК с воронкообразной деформацией грудной клетки, сколиозом, плоскостопием и гипермобильностью суставов, есть основания полагать, что при ПМК I степени с наличием в фенотипе указанных костно-мышечных дисплазий также имеются условия для ремоделирования внеклеточного матрикса миокарда.
Отсутствие в фенотипе пациентов с ПМК I степени клинически значимых костно-мышечных дисплазий диктует необходимость определения в сыворотке крови аутоантител к коллагенам I и II типов, FGF-b, ЕТ-1 и/или типирование HLA-А25, В27, В35. Случаи повышения перечисленных сывороточных иммуно-эндотелиальных маркеров и/или наличия в иммуногенетической структуре антигенов А25, В27, В35 позволяют формировать группу риска развития ремоделирования миокарда.
Наконец, отсутствие у пациентов с ПМК I степени указанного набора иммуно-эндотелиальных маркеров может характеризовать вариант нормы.


ВДГК, сколиоз, пло-скостопие, ГМС




Имеются
Отсутствуют
Повышенное содержание в крови ААТ к коллагенам I и II типов, FGF-b, ЕТ-1 и/или типирование HLA-А25, В27, В35





Нет
Есть


Рис. 7.1. Алгоритм стратификации групп риска развития ремоделирования миокарда в популяции больных ПМК.
Выявлены особенности внешнего фенотипа и нарушений регуляторных механизмов при ПМК, ассоциированном с некоторыми патологическими состояниями и заболеваниями.
Высокая распространенность (25,7%) полисегментарного остеохондроза у молодых пациентов с ПМК позволяет предположить, что дефект соединительнотканных структур, лежащий в основе диспластических проявлений, приводит к более быстрому развитию и прогрессированию дегенеративно-дистрофических изменений. В этой связи интересны полученные данные об очень высоких уровнях сывороточных антител к коллагенам I и II типов у больных ПМК с остеохондрозом (рис. 8).
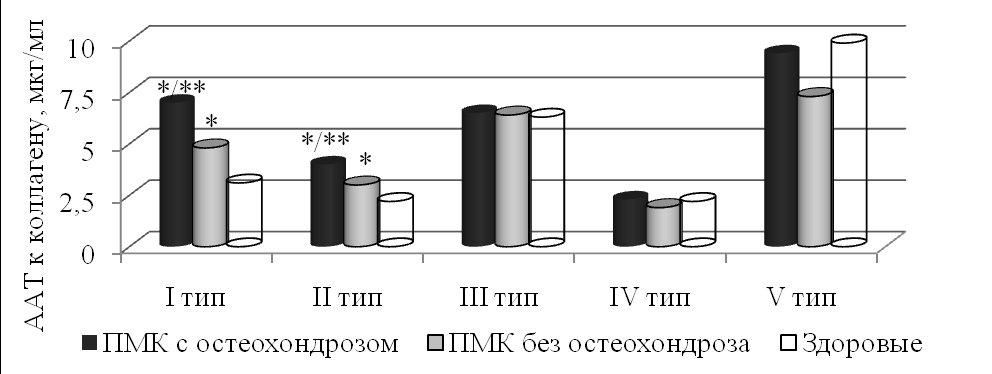 Рис. 8. Концентрация аутоантител к коллагену у больных ПМК с учетом остеохондроза. * – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).
Рис. 8. Концентрация аутоантител к коллагену у больных ПМК с учетом остеохондроза. * – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).Процесс повышенного образования антител к коллагенам I и II типов у больных ПМК с остеохондрозом может быть обусловлен как повреждением опорных структур при биомеханической перегрузке из-за неполноценности коллагена, так и генетическими дефектами, затрагивающими продукцию «костного» и «хрящевого» типов коллагена. Последние могут приводить к независимому развитию остеохондроза.
Генетическую предрасположенность к гипертензивным реакциям на стресс отражает «гипертония белого халата» (Гаджиев А.Н., 2004). В этой связи логично предположить, что выявленная нами высокая скорость утреннего подъема АД у больных ПМК с «гипертонией белого халата» обусловлена значительной активизацией симпато-адреналовой системы и является следствием генетически детерминированного ослабления защиты от гипертензиогенных факторов.
Больные ПМК с «гипертонией белого халата» характеризовались адреналиновой и АДФ-индуцированной гиперагрегацией и более высокими показателями коллагеновой агрегации по сравнению с пациентами без «гипертонии белого халата», а также повышенной концентрацией ЕТ-1 и сниженной – 6-keto-PGF1α в крови. Очевидно, что пациенты с ПМК при наличии «гипертонии белого халата» могут рассматриваться в качестве группы риска по развитию стабильной артериальной гипертензии в связи с ролью эндотелиальной дисфункции в еë формировании и прогрессировании.
У больных ПМК с «гипертонией белого халата» отсутствовали свойственные в целом группе ПМК низкие показатели индекса Кетле, массы и площади поверхности тела (табл. 9), что, возможно, свидетельствует о влиянии на уровень АД в числе прочих факторов и массы тела, определяемой взаимодействием генетических и средовых влияний.
Таблица 9
^ Антропометрические параметры у больных ПМК с учетом
«гипертонии белого халата» (
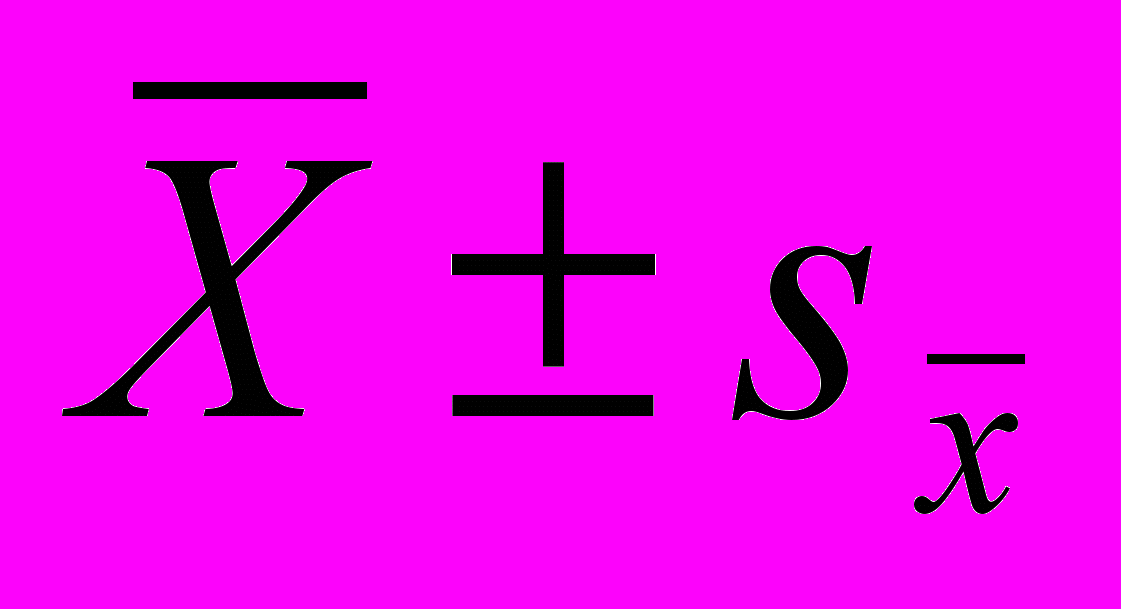 )
)| Антропометрические параметры | Больные ПМК | Здоровые (n=10) | |
| с «гипертонией белого халата» (n=25) | без «гипертонии белого халата» (n=10) | ||
| Рост, см | 176,7±3,8 | 171,8±1,7 | 178,2±1,3 |
| Масса тела, кг | 70,5±2,8 | 60,3±1,4*/** | 71,9±1,2 |
| Индекс Кетле, кг/м2 | 22,9±0,7 | 19,1±0,3*/** | 22,2±0,3 |
| Площадь поверхности тела, м2 | 1,9±0,05 | 1,8±0,07* | 2,0±0,03 |
| Окружность запястья/ длина II пальца | 2,0±0,05 | 2,0±0,03 | 2,1±0,04 |
| Размах рук/рост | 1,03±0,01 | 1,02±0,02 | 1,02±0,04 |
* – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).
В фенотипе больных ПМК с ортостатической недостаточностью, наоборот, наблюдалось преобладание роста над массой тела. В случаях этой комбинации выявлено повышенное содержание ростовых пептидов, особенно основного фактора роста фибробластов (табл. 10), принимающих участие в регуляции сосудистого тонуса.
Таблица 10
^ Уровень ростовых факторов у больных ПМК с учетом ортостатической недостаточности (
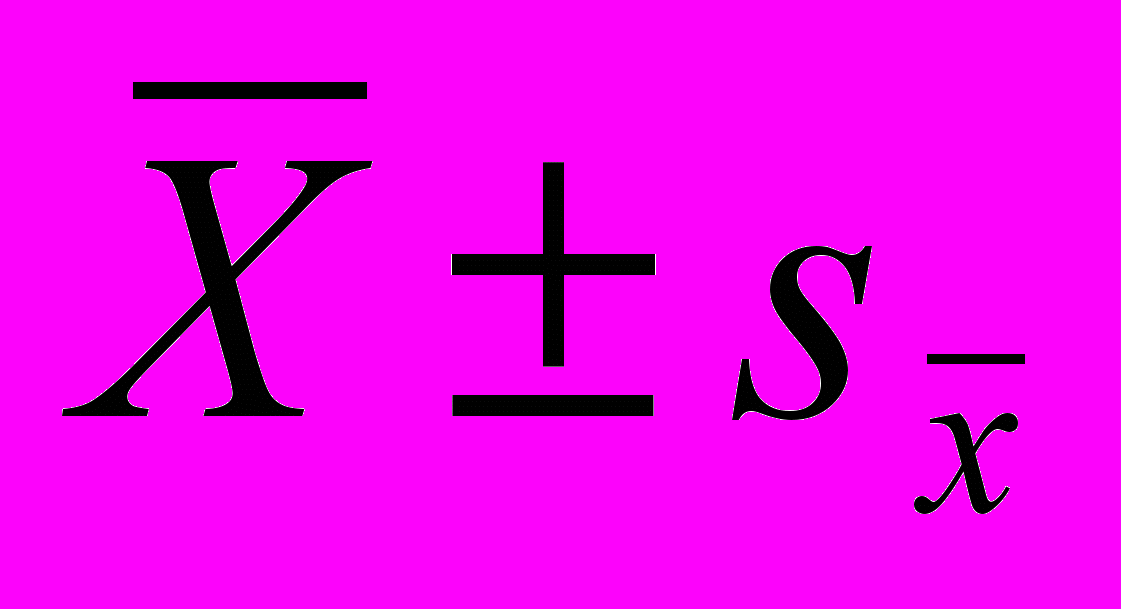 )
)| Ростовой фактор | Больные ПМК | Здоровые (n=20) | |
| с ортостатической недостаточностью (n=36) | с нормальным вегетативным обеспечением (n=20) | ||
| TGF-1, нг/мл | 3,7±0,9* | 4,1±0,6* | 0,5±0,2 |
| FGF-b, пг/мл | 44,6±3,3*/** | 35,6±2,9* | 15,6±2,8 |
* – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравниваемых группах ПМК (критерий Ньюмена-Кейлса).
Повышенное содержание TGF-β1 и FGF-b отражает модуляцию гладкомышечных клеток и преобладание фенотипа синтеза, что может служить предпосылкой для дальнейшего формирования артериальной гипертензии с учетом клинических данных о смене эпизодов гипотонии у больных ДСТ со стабильной артериальной гипертензией (Яковлев В.М. и соавт., 2005; Suthanthiran М. et al., 2000). Артериальная гипотензия в ответ на ортопробу у больных ПМК при высоких уровнях ростовых факторов может быть связана со сниженной чувствительностью тканей к влиянию TGF-β1 и FGF-b при уменьшении экспрессии мембранных рецепторов.
Генетически предопределенные дефекты в созревании и дифференцировке мезенхимальных производных влияют на структуру и функциональную целостность клеточных мембран, обусловливая дисфункцию тромбоцитов, эндотелия, провоцирующих в определенных условиях развитие гемостазиологических осложнений. Подтверждением этому являются изменения в системе гемостаза у пациентов с ДСТ при наличии и отсутствии геморрагических эпизодов.
У больных ПМК с геморрагиями множественных локализаций отмечены изменения в соотношении ТхВ2/6-keto-PGF1 в сторону преобладаниия тромбоксана. Нарушение физиологического равновесия простаноидов у больных с геморрагиями можно объяснить реактивными (компенсаторными) сдвигами системы гемостаза в ответ на хроническую кровопотерю аналогично случаям гипертромбоцитоза и гиперагрегации тромбоцитов, наблюдаемых у пациентов с пролапсом митрального клапана и геморрагическим синдромом (Остроумова О.Д. и соавт., 2002; Домницкая Т.М., 2007).
Особенности фенотипа в виде сниженной массы тела и высокого уровня внешней стигматизации, выявленные нами у больных ПМК с геморрагиями, могут быть использованы в качестве скрининга для стратификации группы риска в отношении склонности к кровоточивости или возникновения кровотечений при наличии провоцирующих моментов (например, операций, назначения лекарственных средств, влияющих на гемостаз).
Генетически детерминированная дисплазия соединительной ткани обсуждается в качестве одного из факторов, модифицирующих течение сахарного диабета (Чернышова Т.Е. и соавт., 2008).
Таблица 11
^ Эндотелиальные маркеры с учетом наличия ПМК и сахарного диабета I типа (
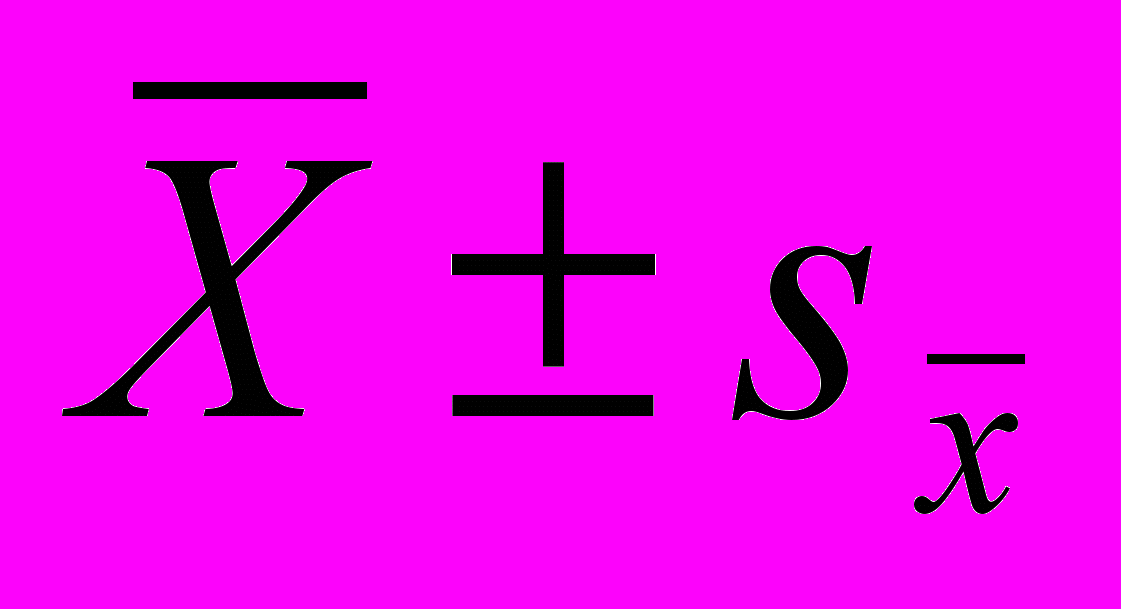 )
)| Эндотелиальные факторы | Сахарный диабет I типа с ПМК (n=20) | Сахарный диабет I типа без ПМК (n=10) | ПМК без сахарного диабета (n=140) | Здоровые (n=20) |
| ЕТ-1, пг/мл | 40,3±3,8 | 31,2±5,2 | 30,2±4,7 | 24,8±2,3 |
| TxB2, пг/мл | 86,7±2,0* | 75,3±4,2 | 66,3±3,5 | 56,4±3,2 |
| 6-keto-PGF1α, пг/мл | 67,1±5,2 | 75,2±2,4 | 59,7±2,7 | 54,2±4,7 |
| TxB2/6-keto-PGF1α | 1,4±0,1 | 1,0±0,3 | 1,1±0,1 | 1,1±0,01 |
| vWF, % | 123,2±12,5 | 120,5±12,5 | 94,6±3,0*/** | 125,0±6,7 |
* – р<0,05 в сравнении со здоровыми; ** – р<0,05 в сравнении с другими группами больных (критерий Ньюмена-Кейлса).
Более высокая активность фактора Виллебранда у наблюдаемых нами больных ПМК с сахарным диабетом I типа по сравнению с ПМК без этой патологии свидетельствует о модифицирующем влиянии диабета на функциональный фенотип эндотелия больных ПМК. В этом же контексте следует рассматривать тенденцию к повышению ЕТ-1 и очевидное преобладание уровня ТхВ2 над 6-keto-PGF1α у больных сахарным диабетом I типа и ПМК по сравнению с больными диабетом без ПМК (табл. 11).
Нарушение сбалансированной продукции эндотелиальных факторов приводит к изменениям в системе тромбоцитарного гемостаза, что нашло отражение в данных о повышении у больных сахарным диабетом функциональной активности тромбоцитов.
Следует отметить, что дисбаланс эндотелиально-тромбоцитарных факторов у больных ПМК с сахарным диабетом I типа был зарегистрирован на фоне достижения компенсации углеводного обмена. Как известно, прогрессирование сосудистых осложнений сахарного диабета может наблюдаться и у больных с хорошо компенсированным процессом, что делает вполне правомочным обсуждение роли генетических факторов в происхождении и сроках манифестации ангиопатий. В этой связи наличие врожденных структурных дефектов соединительной ткани при ПМК в совокупности с признаками свойственной этому состоянию эндотелиальной дисфункции в виде повышения ЕТ-1 и преобладания продукции ТхВ2 над простациклином, предположительно, может создавать условия для более высоких темпов развития у больных сахарным диабетом сосудистых осложнений.
Указания на корреляцию тяжести воспалительных заболеваний носоглотки с выраженностью деформаций позвоночника и грудной клетки (Викторова И.А., 2006) обосновывает суждение о взаимосвязи инфекционно-воспалительных заболеваний и соединительнотканных нарушений (Яковлев В.М. и соавт., 2005). Нами установлен у больных ПМК и хроническим тонзиллитом высокий уровень внешний стигматизации (> 7 стигм) и значительное снижение содержания в крови IFN-γ и TNF-α, что может рассматриваться с позиций нарушенного ответа организма на действие патогенных факторов. В иммуногенетической структуре больных ПМК и хроническим тонзиллитом, по нашим данным, преобладали антигены А29, В35 и фенотипы А2/А25, Cw3/Cw5. Следовательно, особенности иммуногенетической структуры у пациентов с ПМК связаны с наличием не только диспластических проявлений, но и характерных иммунологических сдвигов, что открывает новые возможности прогнозирования возникновения и рецидивирующего течения инфекционно-воспалительных заболеваний у больных ПМК на основе иммуногенетических маркеров.
Таким образом, клинико-патогенетический анализ у больных ПМК с позиции дисплазии соединительной ткани позволяет рассматривать ПМК в пространстве полигенной системной тканевой патологии. Обсуждение ПМК в качестве самостоятельного диспластического синдрома по сути определяет решение вопросов взаимосвязи психо-вегетативной дисфункции, внешних и висцеральных признаков ДСТ, иммуно-эндотелиальных и иммуногенетических отклонений с точки зрения понимания патогенеза соединительнотканных расстройств. Такое решение проблемы ПМК, с одной стороны, позволяет стратифицировать пациентов с учетом эхокардиографических критериев, что сохраняет конкретное указание на клапанную патологию сердца, непосредственно определяющую развитие ряда сердечно-сосудистых осложнений, а, с другой, обусловливает необходимость выявления экстракардиальных диспластических проявлений, нарушений обмена веществ наследственной и регуляторной природы, нередко имеющих самостоятельное клиническое и прогностическое значение.
