В. А. Отеллин официальные оппоненты член-корреспондент рамн
| Вид материала | Автореферат |
- В педагогическом взаимодействии, 811.25kb.
- Методология формирования экономического механизма развития сельскохозяйственного производства, 922.36kb.
- Бахметьев Владимир Иванович Ведущая организация : Государственное общеобразовательное, 587.63kb.
- Автореферат на соискание ученой степени, 643.39kb.
- Модели регионализма и регионализации восточной азии, 1934.71kb.
- И. Г. Петровский (председатель), академик, 5955.05kb.
- Функция почек при нефротуберкулезе по данным радионуклидного исследования, 553.43kb.
- Пленарные заседания, 339.22kb.
- Хроническая мигрень: клиника, патогенез, лечение 14. 00. 13. Нервные болезни, 1344.11kb.
- Сергиев Владимир Петрович Член-корреспондент рамн, доктор медицинских наук, профессор, 829.91kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Влияние иммобилизационного стресса матери на развитие отделов головного мозга крыс.
Уровень стероидных гормонов (глюкокортикоидов и половых) в крови матери имеет существенное значение для нормального развития плодов. Изменение гормонального баланса в ту или другую сторону, возникающего при воздействии разного рода стрессов на мать, как правило, приводит к существенным нарушениям различных функциональных систем ее потомков.
В развитии стресса существенная роль принадлежит глюкокортикоидам и серотонину, которые соответственно называют гормоном и медиатором стресса и уровень которых при этом значительно меняется. Результатом пренатального стресса является, в частности, изменение уровня серотонина и снижение его оборота в ряде структур головного мозга (Poland R.E., et al., 1995; Muneoka K. et al, 1997). Серотонин является одним из главных модуляторов гипоталамо-гипофизарно-адренокортикальной системы, как матери, так и плода, участвующей в ответе на стресс. Попытка в настоящей работе изучить влияние дисбаланса кортикоидов и серотонина, возникающего при материнском стрессе, на развитие отделов головного мозга млекопитающих объясняется отсутствием в доступной нам литературе данных о клеточных механизмах, характере и тканевых характеристиках нарушений развития мозга.
Материнский стресс во время формирования отделов головного мозга вызывает каскад структурно-функциональных реакций, при этом выявляются непосредственные реакции эмбриональной нервной ткани на стресс и отдаленные его последствия, представленные структурными изменениями во всех исследованных формациях головного мозга и сохраняющиеся в постнатальном онтогенезе.
Непосредственные реакции эмбриональной нервной ткани в ответ на
стресс матери.
Однократная процедура стрессирования матери на 16 сутки беременности достаточно быстро (через 3 часа и 1 сутки) вызывает реакцию развивающейся нервной ткани на стресс, которая приводит к апоптотической гибели часть клеток. В основном, гибель нейробластов регистрируется в развивающихся неокортексе, среднем и продолговатом мозге. Утрата части нейробластов в популяциях клеток последних, несомненно, будет сказываться на формировании и развитии структур этих отделов мозга и их клеточном составе.
Отдаленные последствия воздействия стресса матери в структурной организации отделов головного мозга у потомства крыс.
Аномальное развитие neocortex выявлено у животных, пренатально переживших материнский стресс, на 25, 40 и 90 постнатальные сутки, при этом характерными нарушениями цитоархитектоники во всех изученных областях коры (area frontalis, area parietalis, area temporalis, area occipitalis) было: истончение и разреженность всех слоев, особенно глубоких (V и VI), снижение в них количества клеток, в том числе, больших пирамидных нейронов, недоразвитие нейропиля, нарушение ядерно-цитоплазматического соотношения в нейронах, а также присутствие диффузной единичной гибели клеток во всех слоях neocortex. У животных, достигших половозрелого возраста (90 постнатальные сутки), все структурные изменения в neocortex, отмеченные в препубертатный и пубертатный периоды, сохраняются, более того к этому сроку происходит утрата больших пирамидных нейронов в слое V и появление нейронов с вакуолизированной цитоплазмой. Материнский стресс у животных, развивавшихся на фоне дефицита серотонина, приводит к аналогичным изменениям в кортикальных структурах.
Значительные нарушения выявлены в аrea cingularis. У потомков всех возрастов, пренатально перенесших материнский стресс, в передней и задней подобластях лимбической коры присутствуют аналогичные изменения характерные для neocortex (истончение и разреженность как слоев верхнего комплекса (II-III-IV), так глубоких слоев (V и VI), снижение количества клеток в слоях, уменьшение размеров клеточных тел и объема цитоплазмы). В задней лимбической подобласти эти нарушения более выражены. У крыс, развивавшихся на фоне дефицита серотонина и пренатально перенесших материнский стресс, в аrea cingularis наряду со сходными нарушениями, по мере увеличения постнатального возраста (в пубертатный период и у половозрелых животных), в верхних слоях (II-III-IV) задней лимбической подобласти происходит еще большее снижение количества нейронов, уменьшение размеров клеток и изменение их формы, часто приобретающей неправильные очертания.
Хронический стресс матери приводит у потомков к изменению структуры всех формаций hippocampus. В полях СА1, СА3 и СА4 слои пирамидных нейронов истончены. Единичные диффузно рассеянные погибшие пирамидные нейроны и клетки гранулярного слоя fascia dentata встречаются на протяжении всего постнатального периода, а также у животных, достигших половозрелого возраста. Такая отсроченная постепенная гибель клеток в результате приводит к утрате значительной части нейронов в формациях hippocampus у взрослых животных. Достаточно высокую чувствительность клеток hippocampus к кортикоидам, обнаруженную в нашем исследовании, по-видимому, можно объяснить содержанием самой высокой плотности глюкокортикоидных рецепторов нейронами всех формаций hippocampus по сравнению с клетками других структур головного мозга (Wan S.L., Liao M.Y., Sun K., 2002; Weinstock, 2005). Более того, их количество в лимбических областях еще более повышается после иммобилизационного стресса матери (Kanitz E., Otten W., Tuchscherer M., et al., 2003). Результатом этого может быть изменение функционального состояния нейронов в отделах hippocampus. Обнаруженные нами структурные изменения и дегенеративные процессы в формациях hippocampus могут быть одной из основных причин нарушения физиологических и поведенческих реакций у животных. Отмечено, что разного рода психические расстройства и неврологические заболевания: шизофрения, депрессия, эпилепсия, болезнь Альцгеймера и т.д., сопровождаются изменениями в структуре отделов hippocampus (Fujioka A., Fujioka T., Ishida Y., et al., 2006; Fenoglio K.A., Brunson K.L., Baram T.Z., 2006; Dhikav V., Anand K.S., 2007).
Отмеченное нами снижение количества пирамидных нейронов в формациях hippocampus следует расценивать как результат остановки пролиферации клеток во всех полях и fascia dentata hippocampus после пренатального стресса, вызывающей резкое уменьшение его объема (Isgor C., Kabbaj M., Akil H., 2004; Yu I.T., Lee S.H., LeeY.S., Son H., 2004). Наряду с этим выявлен факт присутствия в пубертатный период значительного количества незрелых клеток в hippocampus (Liu H., Kaur J., Dashtipour K., et al., 2003), который дает основание предположить, что после стрессового воздействия основная масса клеток не способна осуществить дифференцировку должным образом и остается в незрелом состоянии. Вероятно, последствием этого может быть отсроченная гибель клеток в этих структурах.
Показано, что у животных, развивавшихся на фоне дефицита серотонина и переживших пренатальный стресс, структурные изменения в формациях hippocampus более выражены. Во всех полях и, особенно, fascia dentata слои нейронов истончены, присутствуют диффузно рассеянные погибшие, как пирамидные нейроны, так и клетки гранулярного слоя. Взаимные контролирующие влияния серотонина и кортикоидов в нейрогенезе в период пренатального развития крайне мало изучены. Известно лишь то, что у пренатально стрессированных крыс происходит снижение уровня серотонина в hippocampus за счет подавления избыточным кортикостероном серотонинергической трансмиссии путем снижения экспрессии 5-НТА1 рецепторов. С другой стороны, серотонин через 5-НТ7 рецепторы вызывает транскрипцию mRNA глюкокортикоидных рецепторов в hippocampus (Andrews M.H., Kostaki A., Setiawan E., 2004), недостаток кортикостероидов нарушает развитие серотонинергической иннервации в hippocampus и neocortex (Leret M.L., Peinado V., Suarez L.M., et al., 2004). Как видно, существуют достаточно сложные механизмы тесного взаимодействия уровней серотонина и глюкокортикоидных гормонов, необходимых для нормального нейрогенеза и созревания мозга, нарушение корреляции уровней которых при материнском стрессе может приводить к аномалиям развития отделов мозга, что еще раз подтверждается результатами настоящего исследования.
Впервые показано, что материнский стресс сказывается на морфо- функциональном состоянии нейронов моноаминергических ядер substantia nigra и nucleus raphe dorsalis. Структурные изменения и гибель клеток в них регистрируются в пренатальный и постнатальный (препубертатный, пубертатный) периоды, а также сохраняются у животных, достигших половозрелого возраста.
а
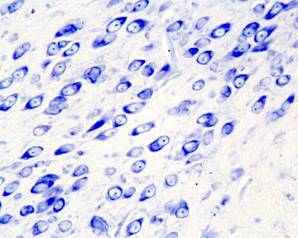
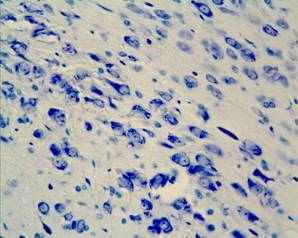
У 25 суточных крысят после пренатального стрессирования в substantia nigra zona compacta обнаружено снижение количества клеток, присутствие нейронов с вакуолизированной цитоплазмой (рис.1). С увеличением постнатального возраста (в пубертатный период и у половозрелых животных) происходит усиление дегенеративных процессов при этом возрастает количество нейронов, имеющих тяжелые изменения и погибших клеток, одновременно происходит сокращение общего количества нейронов, составляющих структуру. Оказалось, что у подопытных животных в пубертатный период количество дофаминсинтезирующих нейронов сокращается почти в 2 раза, вероятно, результатом этого будет снижение объема синтеза дофамина и его оборота в организме.
б


а
Рис. 1. Мозг крысы, фрагмент substantia nigra zona compacta на 25 постнатальные сутки, (а) контроль, (б) после пренатального стрессирования; вакуолизация цитоплазмы нейронов (стрелка). Окраска по Нисслю. Увел. ок.х 10, об.х 40.
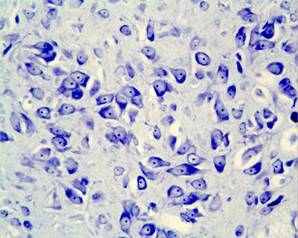
Более выраженные структурные изменения в substantia nigra zona compacta были выявлены в пубертатном периоде и у взрослых животных, развивавшихся на фоне дефицита серотонина и пренатально перенесших материнский стресс. Значительное сокращение количества нейронов, соответствующих норме, и увеличение клеток с тяжелыми изменениями ядра и цитоплазмы, а также погибших нейронов (рис.2) могут быть результатом нарушения формирования самой серотонинергической системы и снижения синтеза серотонина, мишенью которого являются дофаминергические нейроны, их развитие и дифференцировка, а, следовательно, и формирование substantia nigra в целом.
Регулирующие влияния дофамина в эмбриогенезе достаточно известны. Дифференцировка дофаминергических нейронов в substantia nigra zona compacta и становление проекций к развивающимся отделам мозга в норме происходит довольно рано (Hu Z., Cooper M., Crockett D.P., et al., 2004; Van Kampen J.M., Robertson H.A., 2005; Deng D.R., Djalali S., Holtje M., et al. 2007). Нарушение развития и интеграции дофаминергических проекций в конечный мозг, изменение становления
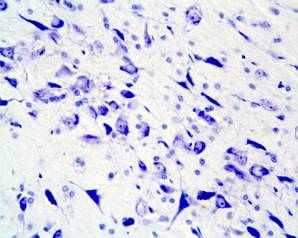

Рис. 2. Мозг крысы, substantia nigra zona compacta на 90 постнатальные сутки после пренатальной деплеции серотонина и стрессирования; вакуолизация цитоплазмы нейронов (короткая стрелка), сморщенные гиперхромные нейроны (длинная стрелка). Окраска по Нисслю. Увел. ок.х10; об.х 40.
кортикостриатных и кортиколимбических путей, нарушение дофаминергической иннервации hippocampus после пренатального стресса (Berger M.A., Barros V.G., Sarchi M.I., et al, 2004; Scott S.A., Diaz N.M., Ahmad S.O., 2007) может, отчасти, объяснять обнаруженные в данном исследовании нарушения развития кортикальных структур и hippocampus.
В развитии дофаминергической системы принимает участие большое количество активных факторов (различные типы ростовых факторов, нейротрофины, представители семейства TGF-beta, IGFs, стероидные гормоны и т.д.), которые включаются в регуляцию развития и дифференцировки клеток этой нейральной системы. Механизмы, лежащие в основе этих процессов сложны, комплексны и включают взаимодействия с другими факторами, стимулирующими эти процессы, а также требуют активации ненейральных клеток, таких как астроциты. Одной из мишеней глиального нейротрофического фактора (GDNF) являются дофаминергические нейроны. Этот, один из самых мощных трофических факторов, способствует нормальной функции дофаминергических нейронов и их выживанию, однако эта специфическая его функция утрачивается в пубертатный период (Kholodilov N., Yarygina O., Oo T.F., et al., 2004; (.Li L., Su Y., Zhao C., et al., 2006; Kipp M., Karakay S., Pawlak J., et al., 2006). Не исключено, что обнаруженное в нашем исследовании нарушение глиогенеза после пренатального стресса, может вносить свой вклад в изменение структуры substantia nigra zona compacta и недостаточное поддержание жизнеспособности дофаминергических нейронов. Транскрипционные факторы, недавно выделенных генов (HNF3alpha, synaptotagmin 1 и Ebf3), экспрессия которых обнаружена в вентральном среднем мозге, являются необходимыми для постмитотической дифференцировки и выживания дофаминэргических нейронов. При этом их экспрессия продолжается до периода полового созревания (Thuret S., Bhatt L., O΄Leary D.D., et al., 2004). Не исключено, что избыточный уровень кортикоидов, являющихся ядернотропными гормонами и воздействующими на плод после пренатального стрессирования, могут влиять на экспрессию этих генов, оказывая непрямое влияние на дифференцировку дофаминергических нейронов и их выживание. Обнаруженное в настоящем исследовании уменьшение размеров нейронов и их отсроченная гибель вполне могут быть результатом нарушения процесса дифференцировки нейронов. Более того, как видно из установленных фактов, экспрессия некоторых генов и функциональная активность нейротрофических факторов в развитии имеют место только до периода полового созревания. Учитывая, с одной стороны, прекращение функциональной активности некоторых нейротрофических факторов, а с другой, изменение гормонального фона, пубертатный период можно считать критическим для проявления и усугубления пренатально сформированных аномалий, что и подтверждают представленные нами данные.
Ранимость дофаминергической системы достаточно известна. Атрофию дофаминергических нейронов у взрослых могут вызвать воздействия таких повреждающих факторов как гипоксия, применение лекарственных препаратов (нейролептиков), воздействие химических веществ и т.д., а также возрастные изменения. Несмотря на большое число исследований, изучающих механизмы, лежащие в основе этих явлений, и использование различных моделей на животных, фундаментальный вопрос: когда происходят первичные нарушения, приводящие к атрофии дофаминергические нейроны, в раннем периоде развития, последующем онтогенезе или они связанны с возрастными изменениями, остается открытым. Однако существует мнение, что дегенеративные процессы в substantia nigra zona compacta у взрослых индивидуумов и в пожилом возрасте являются следствием патологических процессов, происходивших в более раннем онтогенезе (Lang A.E., 2007). Последствия материнского стресса в пренатальный период развития потомства могут являться первоначальной причиной, вызывающей нарушения белкового обмена, оксидативный стресс, увеличение содержания железа, измененние гомеостаза Са+², т.е. выявленные факторы, приводящие к ускоренной утрате нейронов в substantia nigra zona compacta и нигростриатной дегенерации (Lang A.E., 2007). Причиной дофаминергической нейродегенерации в substantia nigra zona compactа может быть также окислительное повреждение нуклеиновых кислот (цитоплазматической RNA и митохондриальной DNA). Не исключено, что частичное распыление или полная утрата вещества Ниссля, а также вакуолизация цитоплазмы у части нейронов substantia nigra zona compacta, выявленные в настоящем исследовании после пренатального стрессирования, являются результатом окислительного повреждения нуклеиновых кислот, следствием которого, в свою очередь, является нарушение синтетических процессов. Важно отметить, что значительное количество общего продукта окисления нуклеиновых кислот (8-hydroxyguanosine) присутствует в цитоплазме нейронов substantia nigra zona compacta и соответствует распределению нейродегенерации у пациентов с болезнью Паркинсона (Zhang J., Perry G., Smith M.A., et al., 1999).
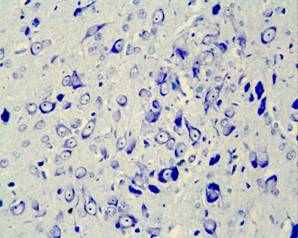
а
б
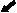
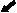
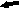
Рис. 3. Мозг крысы, nucleus raphe dorsalis на 25 постнатальные сутки, (а) контроль, (б) после пренатального стрессирования; вакуолизация цитоплазмы нейронов (короткая стрелка), сморщенные гиперхромные клетки (длинная стрелка), Окраска по Нисслю.
Увел. ок.х 10; об.х 40.
Хронический пренатальный стресс является причиной значительного повреждения структуры nucleus raphe dorsalis. Обнаружены характерные нарушения: уменьшение размеров nucleus raphe dorsalis, снижение общего количества клеток, изменение соотношения разных типов нейронов. У животных в препубертатный период присутствуют клетки с вакуолизированной цитоплазмой, а также диффузная единичная гибель нейронов (рис.3). С увеличением постнатального возраста (в пубертатный период и у половозрелых животных) сокращается количество нейронов соответствующих норме, снижается число серотонинсинтезирующих нейронов и увеличивается число клеток, имеющих тяжелые изменения ядра и цитоплазмы, а также погибших. У животных, развивавшихся на фоне дефицита серотонина и пренатально перенесших материнский стресс, подобные нарушения более выражены, при этом в nucleus raphe dorsalis резко снижается число клеток синтезирующих серотонин. По мере увеличения постнатального возраста (90 суток) наблюдается усиление дегенеративных процессов, следствием которых является резкое уменьшение размеров nucleus raphe dorsalis ядра, количества в нем нейронов и, часто, его полное разрушение (рис.4). По-видимому, широко участвуя в механизмах стресса, сама серотонинергическая система является объектом воздействия гормонов стресса.
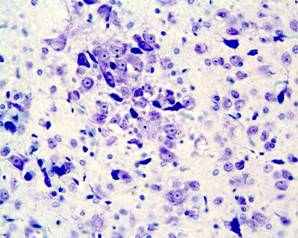
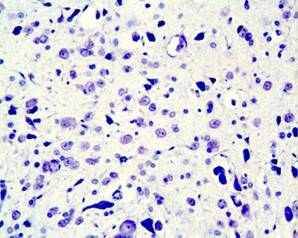
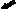
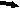
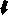
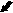



а
б
Рис.4. Мозг крысы, nucleus raphe dorsalis, на 90 постнатальные сутки после пренатальной деплеции серотонина и стрессирования; снижение количества нейронов, (а) вакуолизация цитоплазмы, деформация ядер (короткая стрелка), погибшие нейро- ны (длинная стрелка); (б) опустошение структуры. Окраска по Нисслю. Увел. ок.х10; об.х40.
Влияние синтетического глюкокортикоида дексаметазона на развитие отделов головного мозга крыс.
Широкий спектр морфофункциональных нарушений в отделах головного мозга крыс обнаружен после пренатального введения синтетичес-кого глюкокортикоида дексаметазона. Очевидным был как дозозависимый, так и стадиоспецифический эффект воздействия дексаметазона.
Наибольшие структурные нарушения в neocortex, а именно, истончение и разряжение слоев, снижение в них количества клеток, уменьшение размеров клеточных тел и объема цитоплазмы, гибель нейронов, выявлены при введении дексаметазона в обеих используемых дозах (1мг/кг и 3мг/кг) на более ранних и поздних постимплантационных стадиях (13 и 19 эмбриональные сутки), при этом чувствительность развивающегося neocortex к глюкокортикоидам на поздних сроках пренатального развития оказалась более высокой.
Значительные изменения в аrea cingularis обнаружены при введении дексаметазона в обеих дозах и на всех исследованных стадиях (13, 16 и 19 эмбриональные сутки). Полученные данные выявили отличия в степени повреждения подобластей лимбической коры, из которых задняя подобласть имеет более выраженные нарушения (истончение и разряжение всех слоев II-VI, резкое снижение в них количества клеток, уменьшение
размеров клеточных тел и объема цитоплазмы). Наши данные интересно сопоставить в результатами, полученными другими авторами и показавшими, что пренатальное введение синтетических глюкокортикоидов (дексаметазона и бетаметазона) в дозах более низких, чем используются в клинике или эквивалентных им, имеет отдаленные эффекты и также приводит у крыс к уменьшению числа и размеров нейронов в неокортексе, нарушению пролиферации в субвентрикулярной зоне и гиппокампе ( Kreider M.L., Tate C.A., Cousins M.M., et al., 2006; Bruschettini M., van den Hove D.L., Gazzolo D., et al., 2006). Вероятно, нарушение или задержка процессов пролиферации клеток-предшественников после пренатального введения дексаметазона является причиной обнаруженных нами изменений в развитии формаций hippocampus. Об этом свидетельствует и значительное истончение слоев пирамидных нейронов в полях СА1, СА2, СА3, СА4 и fascia dentatа (рис.5,6). Известно, что эндогенные и синтетические глюкокортикоиды и серотонин влияют на экспрессию глюкокортикоидных рецепторов во время развития формаций hippocampus. Значительное снижение экспрессии mRNA глюкокортикоидных рецепторов в нейронах hippocampus при введении дексаметазона влечет за собой подъем уровней экспрессии 5-НТ1а и 5-НТ2 рецепторов к серотонину в neocortex и hippocampus (Slotkin T.A., Kreider M.L., Tate C.A., 2006; Erdeljan P., Andrews M.H., McDonald J.F., et al., 2005). При этом в гиппокампе существенно снижаются концентрации глиального белка S100-beta (Bruschettini M., van den Hove D.L., Gazzolo D., et al., 2005), через который осуществляется непрямое действие серотонина на пролиферацию и дифференцировку нейронов этих структур. Можно предположить, что обнаруженные нами нарушения развития формаций hippocampus могут быть связаны с дисбалансом глюкокортикоидных гормонов и серотонина, которые оказывают существенное влияние на развитие neocortex и формации hippocampus, что еще раз подтверждают представленные данные.
Исследование характера изменений в substantia nigra после пренатального введения дексаметазона выявило существование в развитии этой структуры различных периодов чувствительности нейронов к дексаметазону. Как оказалось, введение дексаметазона на более ранних и более поздних стадиях пренатального развития (13 и 19 эмбриональные сутки) вызывает глубокие повреждения, включающие изменение соотношения разных типов клеток, уменьшение размеров клеточных тел, появление нейронов, имеющих тяжелые изменения ядра и цитоплазмы. Воздействие дексаметазона в середине пренатального периода (16 эмбриональные сутки) не оказывает значительных изменений в структуре substantia nigra zona compacta.

А
Б
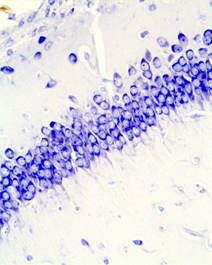
Рис. 5. Гиппокамп крысы на 60 постнатальные сутки, поле СА1: А - контроль; Б- после пренатального введения дексаметазона в дозе 3 мг/кг на 16 эмбриональный день. Окраска по Нисслю.Увел.ок.х 10; об. х 40.
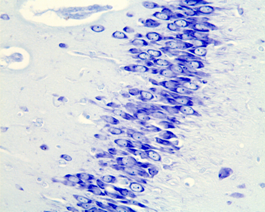
А
Б
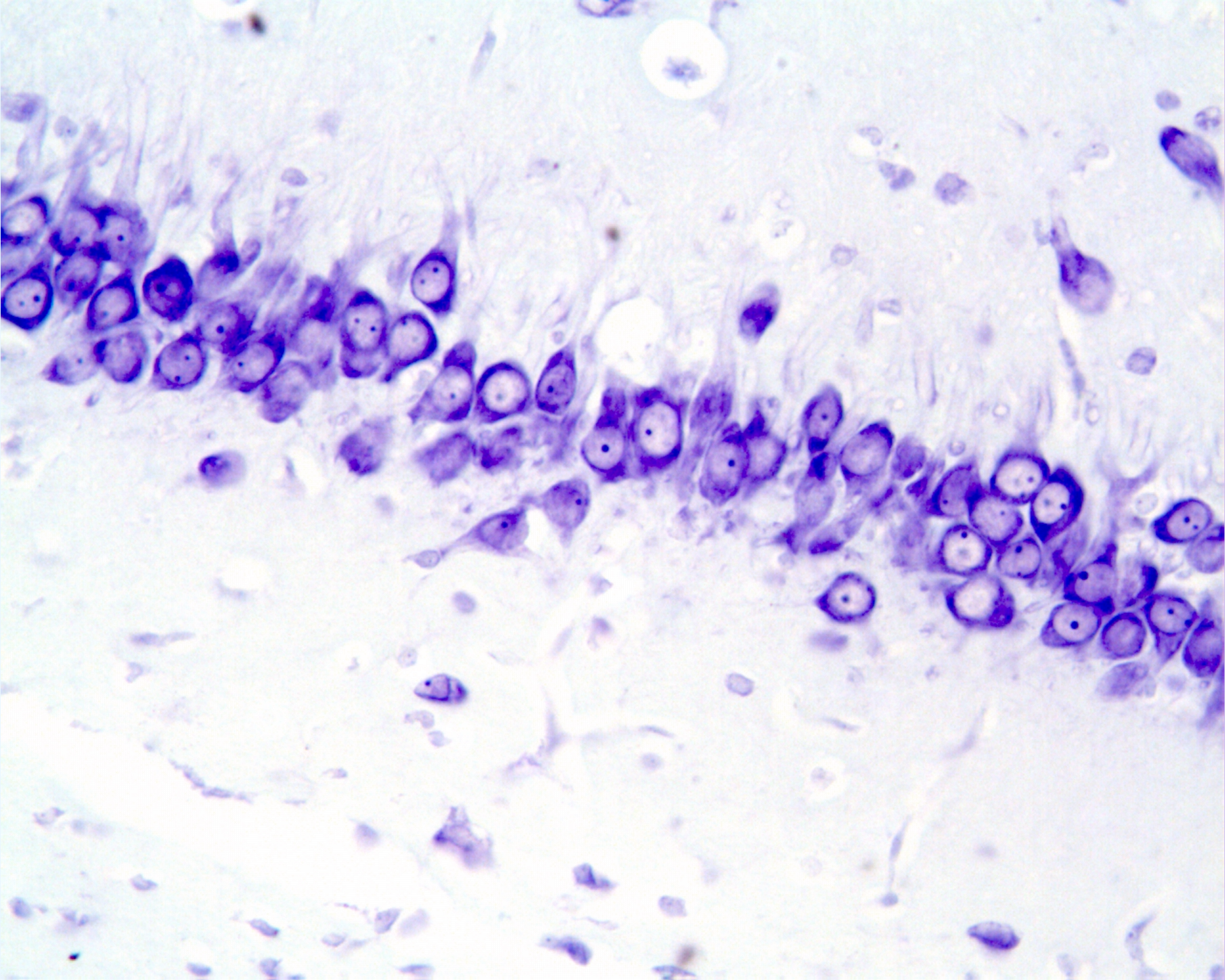
Рис.6. Гиппокамп крысы на 60 постнатальные сутки, поле СА3: А-контроль; Б- после пренатального введения дексаметазона в дозе 3 мг/кг на 16 эмбриональный день.Окраска по Нисслю.Увел.:ок.х 10; об. х 40.
Особого внимания заслуживают изменения в nucleus raphe dorsalis, выявленные после пренатального введения дексаметазона. Значительные структурные нарушения (снижение количества нейронов, уменьшение размеров клеток, вакуолизация цитоплазмы и гибель части нейронов) имеют место при воздействии препарата в обеих используемых дозах на всех исследованных сроках развития, при этом поздние сроки пренатального развития (19 эмбриональные сутки) оказываются гораздо чувствительнее к глюкокортикоидам. Введение препарата в это время приводит к значительной отсроченной гибели нейронов и клеточному опустошению nucleus raphe dorsalis, и, часто, к его разрушению. Это может быть связано с определенными особенностями и темпами развития структуры, хотя в целом причина остается неизвестной.
Таким образом, показано, что развивающийся мозг млекопитающих является высоко чувствительным к повышенному уровню глюкокортикоидных гормонов как эндогенных, высвобождающихся при стрессе матери во время беременности, так и экзогенных, при введении их синтетических аналогов. Повреждающий эффект избыточного уровня глюкокортикоидов значительно выражен в исследованных структурах головного мозга. При этом, вероятно, нарушается синтез и взаимодействие нейротрансмиттеров таких как серотонин и дофамин, вследствие чего, возможно возникновение их вторичного дефицита, который будет сказываться непосредственно на развитии и созревании мозга. К тому же гибель клеток в neocortex, лимбических структурах и моноаминергических ядрах в постнатальный период может свидетельствовать о том, что повышенный уровень глюкокортикоидных гормонов и дефицит нейротрансмиттеров изменяют процессы дифференцировки нейронов. В результате значительная часть нейронов разных отделов мозга к концу пренатального периода развития не способна осуществить полноценную, соответствующую данной стадии развития, дифференциацию, что, в последующем, может приводить их к отсроченной гибели. Вероятно, этим объясняется то, что аномалии развития, выявленные в препубертатный период, сохраняются в течение дальнейшего постнатального онтогенеза, а также у животных, достигших половозрелого возраста. Нарушения морфогенетических процессов в сочетании с гибелью клеток в центральных отделах головного мозга, усиливающейся с увеличением постнатального возраста, приводит к значительному сокращению количества нейронов в структурах мозга у взрослых индивидуумов. Повышенный уровень глюкокортикоидных гормонов во время эмбрионального периода может изменять программу развития мозга плода, повышая возможность возникновения нейропатологий после рождения.
