Хроническая мигрень: клиника, патогенез, лечение 14. 00. 13. Нервные болезни
| Вид материала | Автореферат |
- Календарно-тематический план лекций по курсу «Общая хирургия и анестезиология», 98.95kb.
- Методические рекомендации для практического занятия, 78.17kb.
- 1. Параректальные свищи. Этиология. Патогенез. Классификация. Клиника. Диагностика., 80.83kb.
- Методические рекомендации для практического занятия №10, 101.99kb.
- Список рекомендуемой литературы основная алексеев А. А., Лавров В. А. Ожоговая септикотоксемия:, 100.55kb.
- Тема Абсцесс, гангрена легкого и бронхоэктатическая болезнь, 394.58kb.
- Обследование и лечение в сеуле клиника Святой Марии, 23.92kb.
- Атеросклероз: эпидемиология, факторы риска, этиология, патогенез, клиника и диагностика, 225.03kb.
- Учебное пособие для студентов 6-го курса и врачей-интернов Волгоград, 2001, 256.4kb.
- 10 Билеты к экзамену по внутренним болезням для студентов 5 курса педиатрического факультета, 86.65kb.
На правах рукописи
Артеменко Ада Равильевна
Хроническая мигрень:
клиника, патогенез, лечение
14.00.13. – Нервные болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва 2009 г.
Работа выполнена в ГОУ ВПО Московская Медицинская Академия
имени И.М. Сеченова Росздрава
Научный консультант:
доктор медицинских наук, профессор Орлова Ольга Ратмировна
Официальные оппоненты:
Член-корреспондент РАМН, доктор медицинских наук, профессор Карлов Владимир Алексеевич
доктор медицинских наук, профессор Левин Олег Семенович
доктор медицинских наук Рачин Андрей Петрович
Ведущая организация:
Российский Университет Дружбы Народов
Защита состоится « » ________________2009 года в _____ часов на заседании диссертационного совета Д. 208. 040. 07. Московской Медицинской Академии им. И.М. Сеченова по адресу: 119991, Москва, ул. Трубецкая, д. 8, стр. 2.
С диссертацией можно ознакомиться в Фундаментальной библиотеке Московской Медицинской Академии им. И.М. Сеченова по адресу: 117998, Москва, Нахимовский проспект, д. 49.
Автореферат разослан « » ______________________ 2009 года.
Ученый секретарь
диссертационного совета Д. 208. 040. 07.
доктор медицинских наук, профессор Дамулин Игорь Владимирович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Мигрень – одно из самых известных и распространенных неврологических заболеваний, встречающихся во взрослой популяции со средней частотой 12% [Lipton, 2001]. Хроническая мигрень (ХМ), являясь известной клинической проблемой, была выделена в отдельную форму головной боли только в 2004 году в Международной классификации головной боли второго пересмотра. Хроническая мигрень отнесена к осложнениям мигрени.
Мигрень, не являясь фатальным заболеванием, значительно снижает качество жизни пациентов [Осипова, 2003]. Всемирная Организация Здравоохранения относит мигрень к группе наиболее дезадаптирующих хронических заболеваний. Финансово-экономические затраты, связанные с временной нетрудоспособностью, а также с диагностикой и лечением мигрени огромны и сравнимы с затратами при сердечно-сосудистых заболеваниях [Stovner et al., 2007; Burton et al., 2009].
При ХМ головные боли становятся практически ежедневными (более 15 дней в месяц), что приводит к ещё более тяжелой дезадаптации пациентов, нарастанию прямых и непрямых затрат, связанных с мигренью, что имеет большое фармако-экономическое и медико-социальное значение [Goldberg, 2005; Steiner et al, 2007].
Количество пациентов с ХМ в общей популяции составляет от 0,4% до 2,4% [Castillo, 1999; Katsarava et al., 2008; Scher et al., 2009]. ХМ также относят к категории хронических ежедневных головных болей – наиболее сложной в диагностическом и терапевтическом смысле группе цефалгий, где ХМ составляет от 55% до 87% всех случаев [Katsarava et al, 2004; Bigal et al., 2008].
Большая распространенность ХМ среди лиц молодого трудоспособного возраста, выраженная дезадаптация и снижение качества жизни пациентов, социально-экономические последствия определяют интерес к этой проблеме [Осипова, Табеева, 2007; Латышева, Филатова, 2008; Bigal, Lipton, 2008]. Особо следует отметить трудности в диагностике и терапии этой давно известной, но недавно выделенной в отдельную форму головной боли [Алексеев, 2006; Rothrock, 2008; Silberstein et al., 2009].
До конца не ясны патогенетические механизмы ХМ, среди которых активно обсуждаются дисфункция антиноцицептивных систем ЦНС, изменение возбудимости коры головного мозга, периферическая и центральная сенситизация [Латышева, 2009; Pietrobon et al., 2003; Goadsby, Hargreaves, 2008; Aurora, 2009]. При определении риска развития ХМ рассматриваются: роль депрессии, тревоги, злоупотребления лекарственными препаратами для купирования приступов головной боли, дисфункции перикраниальных мышц и другие факторы [Bussone G., 2003; Bigal, Lipton, 2006; Katsarava et al., 2007; Dodick et al., 2009].
Недостаточно разработаны вопросы терапии ХМ: стандартные профилактические схемы лечения мигрени оказались мало эффективными, что потребовало дифференцированных и патогенетически обоснованных подходов к терапии.
Цель исследования
Изучение клинических особенностей хронической мигрени, уточнение ее патогенетических механизмов и разработка оптимальных подходов к лечению.
Задачи исследования:
- Определить социо-демографический портрет пациентов с ХМ.
- Выявить клинические особенности пациентов с ХМ в сравнении с мигренью без ауры c частыми приступами с учетом данных анамнеза, степени дезадаптации и нарушения качества жизни.
- Оценить значимость использования лекарственных препаратов для купирования головной боли как возможного фактора риска развития ХМ.
- Выявить основные коморбидные расстройства у больных с ХМ.
- Оценить патогенетическую роль возбудимости коры головного мозга по данным транскраниальной магнитной стимуляции (ТМС).
- Оценить состояние ноцицептивных и антиноцицептивных систем на уровне ствола головного мозга по параметрам RIII компонента МР и НФР.
- Уточнить роль мышечно-тонической дисфункции перикраниальных и шейных мышц при ХМ по данным клинико-нейрофизиологического тестирования.
- Оценить эффективность и выявить предикторы положительного ответа для трех видов профилактического лечения, воздействующих на разные звенья патогенеза ХМ: антиконвульсанта последнего поколения топирамата, антидепрессанта – селективного ингибитора обратного захвата серотонина и норадреналина – дулоксетина и локального миорелаксанта длительного действия – ботулинического токсина типа А (БТА).
Научная новизна
Впервые проведен детальный клинико-неврологический анализ репрезентативной группы пациентов ХМ с выявлением клинических особенностей и вариантов течения заболевания. Уточнены клинические критерии диагностики ХМ и перечень коморбидных заболеваний и нарушений.
Впервые проведен анализ феномена «фоновой» головной боли при ХМ. Использование клинико-нейрофизиологического подхода показало что феномен «фоновой» головной боли является одним из клинических проявлений центральной сенситизации.
Проведенное исследование показало, что ХМ является результатом многоуровневых нарушений функционального состояния нервной системы, оценить которое возможно только при комплексном нейрофизиологическом обследовании. Корковые нарушения проявляются изменением возбудимости корковых нейронов зрительной и, в меньшей степени, моторной коры; дисфункция ноцицептивных систем на уровне ствола мозга выявляется по изменению порога RIII-компонента МР, в то время как нарушение габитуации RIII-компонента свидетельствует о недостаточности антиноцицептивных влияний.
Вовлечение периферической нервной системы подтверждается облигатными длительно существующими мышечно-тоническими и миофасциальными нарушениями в перикраниальных и шейных мышцах, что свидетельствует о сенситизации периферических ноцицепторов на этом уровне.
Впервые показана значимая роль сенситизации периферических ноцицепторов миофасциальных перикраниальных структур в поддержании болевого синдрома при ХМ. Регресс проявлений периферической и центральной сенситизации при снижении болевой афферентации миофасциальных перикраниальных структур в ответ на введение БТА доказывает патогенетическое значение периферической сенситизации в поддержании центральной сенситизации.
Эффективность профилактического лечения ХМ не зависит от наличия/отсутствия фактора злоупотребления лекарственными препаратами для купирования приступа головной боли. Это справедливо для всех оцениваемых видов терапии, направленных на три звена патогенеза ХМ: антиконвульсанта последнего поколения топирамата, действующего преимущественного на корковом уровне; антидепрессанта группы селективного ингибитора обратного захвата серотонина и норадреналина дулоксетина, влияющего на церебральные антиноцицептивные системы и БТА.
Практическая значимость работы
- Для успешной терапии ХМ необходимо выявлять и корректировать наиболее значимые для формирования низкого качества жизни такие коморбидные нарушения как: тревога, другие хронические болевые синдромы экстракраниальной локализации, вестибулопатия и астения.
- Выявленные предикторы эффективности трех использованных препаратов для профилактического лечения ХМ облегчают подбор адекватной фармакотерапии в ежедневной клинической практике.
- Профилактическое лечение ХМ должно быть направлено на восстановление первичного паттерна заболевания – мигрени с эпизодическими приступами.
- У пациентов с ХМ, злоупотребляющих препаратами для купирования приступа головной боли, положительный эффект профилактического лечения может быть достигнут без проведения предварительной детоксикации.
Положения, выносимые на защиту:
- ХМ является результатом многоуровневых нарушений функционального состояния нервной системы с вовлечением коры и ствола головного мозга, а также ноцицепторов миофасциальных перикраниальных структур. Многоуровневые изменения лежат в основе клинических проявлений, объективно подтверждающихся результатами комплексного нейрофизиологического и анкетного тестирования.
- ХМ является обратимым состоянием. Патогенетически обоснованное профилактическое лечение позволяет добиться клинического улучшения с восстановлением первичного эпизодического паттерна головной боли, способствует регрессу функциональных нарушений нервной системы поддерживающих хронический паттерна головной боли при ХМ.
- Периферическая сенситизация ноцицепторов миофасциальных перикраниальных структур лежит в основе облигатных для ХМ персистирующих мышечно-тонических и миофасциальных нарушений и играет значимую роль в поддержании хронического болевого синдрома, являясь важным звеном патогенеза ХМ.
- Фактор злоупотребления лекарственными препаратами для купирования приступа головной боли не оказывает значимого влияния на эффективность профилактического лечения независимо от механизма действия выбранного препарата у пациентов с ХМ.
Внедрение результатов в практику.
Материалы диссертации используются при обследовании и лечении пациентов с ХМ и МбезА с частыми приступами в Отделе патологии вегетативной нервной системы ГОУ ВПО ММА им. И. М. Сеченова, на кафедре нервных болезней ФППОВ ГОУ ВПО ММА им. И. М. Сеченова при подготовке врачей-интернов, ординаторов и на циклах усовершенствования неврологов, в Клинике головной боли и вегетативных расстройств академика А. Вейна, в Академической клинике неврологии «Сесиль+».
Апробация работы. Основные положения диссертации доложены и обсуждены на II-ом Международном конгрессе «Восстановительная медицина и реабилитация 2005» (Москва, 2005), XIII Российский национальный конгресс «Человек и лекарство» (Москва, 2006), 8-ом Международном конгрессе Европейской Федерации головной боли (Валенсия, 2006), Российской научно-практической конференции с международным участием «Головная боль-2007» (Москва, 2007), Научно-практической конференции «Транскраниальная магнитная стимуляция и вызванные потенциалы мозга в диагностике и лечении болезней нервной системы» (Москва, 2007), Первом Всероссийском съезде врачей восстановительной медицины «РеаСпоМед 2007» (Москва, 2007), Научно-практической конференции «Современные аспекты нейрореабилитации» (Москва, 2007), XIII Конгрессе Международного общества головной боли (Стокгольм, 2007), Научно-практической конференции «Высокие технологии в терапии и реабилитации заболеваний нервной системы» (Москва, 2008), 6-ой международной конференции “Токсины 2008” (Бавено, 2008), 102-ом симпозиуме Международного центра биокибернетики Польской академии наук «Стимуляция мозга: транскраниальная и глубокая, старое и новое» (Варшава, 2009), Межрегиональной научно-практической конференции «Головная боль – актуальная междисциплинарная проблема» (Смоленск, 2009), Республиканской научно-практической конференции «Новые диагностические и лечебные технологии в неврологии» (Уфа, 2009).
Публикации: по теме диссертации опубликована 61 печатная работа, в том числе 7 статей в журналах, рецензируемых ВАК. Материалы диссертации вошли в практическое руководство для врачей «Методические основы транскраниальной магнитной стимуляции в неврологии и психиатрии», в монографию «Болевые синдромы в неврологической практике», в Медицинскую технологию «Лечение хронических головных болей препаратом Лантокс» и Медицинскую технологию «Лечение миофасциальных болевых синдромов препаратом Лантокс».
Структура и объем диссертации. Диссертация изложена на 195 страницах машинописного текста и состоит из введения, 4 глав (обзор литературы, материала и методов, изложения экспериментальной части собственных исследований и обсуждения полученных результатов), выводов, практических рекомендаций, библиографического указателя использованной литературы, включающего 166 источников литературы (из них 36 отечественных и 130 зарубежных) и приложения. Диссертация иллюстрирована 49 таблицами и 26 рисунками.
Материал и методы исследования
В исследовании приняли участие 392 человека, из них 362 пациента (Основная группа – 183 пациента с ХМ, Группа сравнения – 179 пациентов с МбезА с частыми приступами) и 30 здоровых испытуемых (Группа контроля).
Критериями включения в исследование были: 1) Возраст от 18 лет до 60 лет; 2) Соответствие диагноза хронической мигрени критериям МКГБ-IIR 2006 года [Headache Classification Committee, 2006] за исключением пункта лекарственного злоупотребления – для Основной группы; и соответствие диагноза МбезА критериям МКГБ-II 2004 года.
Критериями исключения из исследования были: 1) наличие других типов ГБ; 2) наличие текущего органического неврологического заболевания; 3) наличие эндогенного психического заболевания; 4) алкоголизм, наркомании или злоупотребление бензодиазепинами; 5) дебют мигрени старше 50 лет.
При оценке клинико-демографических и нейрофизиологических показателей исследование было одномоментным. При оценке разных видов профилактического лечения исследование носило проспективный характер. После клинико-неврологического исследования все пациенты проходили анкетное тестирование и нейрофизиологическое исследование (табл. 1).
Таблица 1. Участники исследования.
| Показатели | Число больных | Возраст, лет |
| Клинико-демографические показатели: ХМ МбезА | 183 179 | 40,912,3 36,311,6 |
| Эффективность топирамата: ХМ МбезА | 68 32 | 40,912,1 38,610,0 |
| Эффективность дулоксетина: ХМ | 46 | 43,612,5 |
| Эффективность БТА (Allergan): ХМ МбезА | 70 40 | 41,711,9 38,211,1 |
Методы исследования
1. Клинико-неврологический: жалобы, анамнез, дневники головной боли, общеклинический и неврологический осмотры, в т.ч. пальпация перикраниальных и шейных мышц, рутинное параклиническое и инструментальное обследование для исключения симптоматических ГБ.
2. Анкетное тестирование включало стандартный набор из анкет и опросников. По шкале Бэка определялся уровень депрессии; по тесту Спилбергера (адаптация Ю.Л. Ханина) – личностная и реактивная тревожность. По Шкале балльной оценки проявлений синдрома вегетативной дистонии выявляли частоту и выраженность вегетативных нарушений. Также использовали Анкету субъективной оценки нарушений сна, Комплексный болевой опросник, Опросник качества жизни, Шкалу жизненных событий Холмса-Рея. Для оценки выраженности степени дезадаптации пациентов применялся Опросник оценки дезадаптации при мигрени (MIDAS).
3. Исследование мигательного рефлекса было использовано для оценки возбудимости тригеминальной системы по порогам регистрации МР по стандартной методике на электромиографе Keypoint (фирма Medtronic, Дания). Анализировались порог перцепции электрического стимула, пороги возникновения RI, RII и RIII компонентов МР, габитуация амплитуды RIII компонента.
4. Транскраниальная магнитная стимуляция использовалась для оценки возбудимости моторной коры по порогу ВМО. Возбудимость зрительной коры оценивали по порогу появления фосфенов. Определяли порог ВМО для правого/левого полушарий, число пациентов имеющих фосфены и порог фосфенеза; использован магнитный стимулятор MS6000 (фирмы ESAOTE Biomedica).
5. Исследование ноцицептивного флексорного рефлекса (НФР). Порог боли и его динамику на фоне лечения у пациентов ХМ и МбезА оценивали по НФР при электростимуляции икроножного нерва на миографе “Keypoint Portable” (фирмы Medtronic). Определяли порог боли, порог рефлекса и отношение порога боли и порога рефлекса.
6. Накожная ЭМГ мышц использовалась для оценки состояния лобных, височных, задне-шейных и трапециевидных мышц с обеих сторон.
Статистический анализ
Статистический анализ проводился с помощью программы Statistica 6.0 for Windows. Для определения средних величин и стандартных отклонений использовалась программа описательной статистики. Достоверность групповых различий для совокупностей оценивали с помощью U-критерия Уилкоксона-Манна-Уитни. Для выявления связи переменных применялся ранговый коэффициент корреляции Спирмена. Достоверными считались различия при p<0,05. Все показатели приведены в формате Мσ.
Для выявления предикторов эффективности каждого из использованных методов лечения проводился сравнительный анализ подгрупп пациентов ХМ: подгруппа 1 – пациенты с отсутствием/низкой эффективностью профилактического лечения, оцениваемого по снижению числа дней с ГБ/мес менее чем на 30%; подгруппа 2 – пациенты со средней (число дней с ГБ/мес меньше на 30-50%) и высокой (число дней с ГБ/мес меньше 50% и более) эффективностью профилактического лечения. Статистический анализ проводился по 260 клинико-анамнестическим и 25 показателям инструментальных исследований, 70 показателям анкетных исследований.
Результаты исследования и их обсуждение
Общая характеристика пациентов групп с ХМ и МбезА с частыми приступами. Группа пациентов с ХМ представлена на 92,9% женщинами среднего возраста (40,912,3 лет), 73% состояли в браке и 85% имели детей. Высшее образование было у 95%, работали 90% со средним и высоким уровнями дохода в 95% случаев. Самой частой причиной развития ХМ пациенты считали стрессовые события в личной жизни (64,6%) и длительный период напряженной работы (54,5%). В группе ХМ, по сравнению с группой МбезА с частыми приступами, ещё реже встречались мужчины (7% и 14% соответственно), пациенты были старше (средний возраст 40,9 года и 36,3 года, соответственно), 3% имели инвалидность, чаще представлены овдовевшие женщины (5% и 0,5% пациентов, соответственно). Среди «биологических» провокаторов тяжелого течения мигрени (ХМ или МбезА с частыми приступами) пациенты отмечали прием препаратов половых гормонов, вторые/третьи роды и наступление менопаузы.
Анализ коморбидных расстройств и сопутствующих заболеваний при ХМ показал, что 5 факторов (тревога, другие хронические болевые синдромы экстракраниальной локализации, вестибулопатия, астения, дисфункция перикраниальных мышц) встречаются более чем у 90% пациентов и могут считаться облигатными для ХМ. Достоверно чаще в группе ХМ относительно МбезА представлены: депрессия (57,7% и 39,9% соответственно), нарушения сна (70,8% и 43,6%), артериальная гипертония (14,6% и 5,2%), панические атаки/гивервентиляционные кризы (35,4% и 21,1%), ожирение (31,2% и 21,1%), межприступная фото- и фоносенситивность (72,9% и 34,2% соответственно).
В группе ХМ выявлен специфический паттерн перехода первичной МбезА в хроническую ежедневную или почти ежедневную ГБ через период, условно названный «ухудшением» первичной ГБ, когда учащались приступы мигрени и увеличивалось потребление лекарств для купирования приступа, реже отмечалась рвота в типичных приступах ГБ, появлялись редкие тяжелые длительные приступы ГБ слабо чувствительные к приему таблеток и требующие постельного режима; также появлялась тревога ожидания тяжелого приступа, страх развития некупируемой сильной ГБ и страх не справиться с подобной ситуацией. Период трансформации первичной ГБ в ХЕГБ длился в среднем 2,7 лет. Для ХМ достоверно характерен более ранний дебют МбезА, более длительный анамнез МбезА и частая наследственность по мигрени. Средний возраст дебюта ХМ – 38,1 лет; средняя длительность ХМ – 4,0 года.
В группе ХМ среднее число болевых дней в месяц было 26 (табл. 2). Из них 12,9 дней пришлось на приступы ГБ, соответствующие критериям МбезА.
Таблица 2. Характеристика пациентов ХМ и МбезА с частыми приступами.
| № | Показатель | ХМ (n=183) | МбезА (n=179) |
| 1. | Число дней с ГБ/мес | 26,04,1* | 8,93,5 |
| 2. | Приступы МбезА: дни в месяц | 12,95,7* | 8,93,5 |
| | длительность, часы | 9,73,7 | 8,04,2 |
| | интенсивность ГБ, баллы | 5,80,7* | 7,30,8 |
| | латерализация ГБ, % пациентов правая/левая/двусторонняя | 54/ 25/ 5 | 44/ 35/ 8 |
| 3. | Тяжелые приступы МбезА: дни в мес | 4,82,9* | 2,92,0 |
| | длительность, сутки | 1,52,3 | 1,81,9 |
| | интенсивность ГБ, баллы | 9,20,7 | 9,50,6 |
| 4. | Число факторов-провокаторов ГБ | 11,81,2* | 7,11,4 |
| 5. | % пациентов, с фоновой ГБ | 77,0% | - |
| | Число дней/мес с фоновой ГБ | 26,04,1 | - |
| | Интенсивность фоновой ГБ, баллы | 3,40,8 | - |
Различия между группами: * – р0,01; – р0,06 (тенденция).
Характерно, что у пациентов с ХМ достоверно более частые приступы мигрени провоцировались достоверно большим числом факторов, имелась тенденция к затяжному течению, интенсивность боли в среднем была ниже, чем в группе МбезА. Однако число дней с тяжелыми ГБ, с болью максимальной интенсивности и выраженной дезадаптацией - достоверно выше в группе ХМ.
У 77% пациентов группы ХМ выявлялся феномен «фоновой» ГБ (табл. 2), развитие которой совпадало с дебютом ХМ. «Фоновая» ГБ – это постоянно присутствующая ГБ постоянной интенсивности, любой локализации и характера, но обязательно «привязанная»/или пересекающаяся с приступом МбезА. Оказалось, что «фоновая» ГБ не совпадает с болью в приступе мигрени ни по локализации (из 76% случаев нет совпадения в 64,8%), ни по качественным характеристикам боли (100% случаев), ни по интенсивности боли и по сопровождающим симптомам, а также мало- или нечувствительна к любым обезболивающим препаратам.
Пациенты с ХМ в среднем применяли препараты для купирования ГБ 25,2 дня в месяц, что соответствовало злоупотреблению. Число доз препаратов, применявшихся как в типичных, так и при тяжелых приступах ГБ было достоверно выше при ХМ, пациенты чаще и в большем количестве употребляли комбинированные аналгетики и триптаны (р0,01), но злоупотребление касалось лишь приема комбинированных аналгетиков (табл. 3). Больше пациентов с ХМ прибегало к парентеральным НПВС в тяжелых приступах ГБ (р0,01). До 85,8% пациентов с ХМ, принимали препараты с психотропными веществами/психолептиками; 71,6% пациентов с ХМ злоупотребляли препаратами для купирования ГБ, из них 71% – аналгетиками, 8% – триптанами, а 21% – и аналгетиками и триптанами одновременно. Средняя продолжительность лекарственного злоупотребления составила 4,1 года, и не превышала длительности ХМ (4,0 года). Злоупотребляемые препараты имели низкую эффективность: у 89,5% пациентов ХМ интенсивность ГБ снижалась до «терпимой».
В группе МбезА злоупотребление лекарствами отмечено в 19,0% случаев и в основном касалось злоупотребления аналгетиками (62,5%). Относительно группы ХМ, при МбезА больше пациентов злоупотребляли триптанами (р0,01). Средний период злоупотребления при МбезА был 2,5, а период «ухудшения» с частыми приступов ГБ в среднем составил 4,6 года.
Таблица 3. Препараты для купирования ГБ, используемые пациентами с ХМ и МбезА с частыми приступами.
| № | Показатель | ХМ (n=183) | МбезА (n=179) |
| 1. | НПВС/простые анальгетики | | |
| | число таблеток/ в месяц | 5,912,2 | 4,08,6 |
| | дни приема препаратов/ в месяц | 4,38,1 | 2,13,9 |
| | число доз/ сутки в приступе МбезА | 1,10,5 | 1,40,8 |
| | в тяжелом приступе МбезА | 1,30,8 | 2,11,1 |
| | при фоновой ГБ | 0,70,4 | - |
| | парентеральное введение: % пациентов число дней в месяц | 70,0* 2,40,8 | 35,0 2,10,9 |
| 2. | Комбинированные анальгетики | | |
| | число таблеток/ в месяц | 43,946,1* | 11,612,9 |
| | дни приема препаратов/ в месяц | 15,811,3* | 5,04,9 |
| | число доз/ в сутки: в типичном приступе МбезА | 2,01,4 | 2,10,8 |
| | в тяжелом приступе МбезА | 2,91,6 | 2,71,1 |
| | при фоновой ГБ | 1,31,0 | - |
| 3. | Триптаны | | |
| | число таблеток/ в месяц | 7,515,6* | 2,65,4 |
| | дни приема препаратов/ в месяц | 5,08,2* | 2,03,7 |
| | число доз/ в сутки: в типичном приступе МбезА | 0,90,7 | 1,10,4 |
| | в тяжелом приступе МбезА | 1,60,7 | 1,60,7 |
| | при фоновой ГБ | 0 | - |
| 4. | Показатели по всем препаратам | | |
| | число таблеток/ в месяц | 57,844,9* | 17,111,5 |
| | дни приема препаратов/ в месяц | 25,28,6* | 9,26,1 |
| | число доз/ в сутки: в типичном приступе МбезА | 2,71,2* | 1,60,8 |
| | в тяжелом приступе МбезА | 4,38,3* | 3,01,0 |
| | при фоновой ГБ | 1,11,0 | - |
различия между группами ХМ и МбезА: * – р0,01; – р0,06 (тенденция).
Результаты инструментальных исследований. По данным ТМС выявлялись различия между ХМ и контролем по показателям порогов ВМО и фосфенеза, р0,01 (табл. 4). Достоверно группы ХМ и МбезА отличались лишь по числу больных, у которых выявлен фосфенез.
При регистрации МР, по сравнению с контролем в группе ХМ отмечен низкий порог и нарушение габитуации RIII компонента (р0,01), в т.ч. у 31,2% пациентов с ХМ габитуация была минимальной или отсутствовала (табл. 4). Сходные изменения выявлены при сравнении МбезА с контролем, но грубые нарушения габитуации RIII-компонента встречались реже – у 17,8% пациентов.
Исследование НФР при ХМ, по сравнению с нормой выявило снижение порога боли, порога НФР и отношения порог боли/порог рефлекса (табл. 4). Результаты ЭМГ показали, что в состоянии расслабления у всех пациентов с ХМ и МбезА в перикраниальных и шейных мышцах имеется низкоамплитудная активность, свидетельствующая о мышечно-тонических нарушениях. По сравнению с ХМ, в группе МбезА, имелись более высокие показатели амплитуды биопотенциалов для лобных мышц и височных мышц (р0,01).
Данные анкетного тестирования. Опросник оценки дезадаптации при мигрени (MIDAS) выявил максимальную, 4-ю степень, дезадаптации при ХМ и МбезА. Абсолютные суммарные показатели MIDAS в группе ХМ в несколько раз превышали пограничное значение для 4-ой степени дезадаптации.
Несмотря на высокую степень дезадаптации, связанной с ГБ, в группе ХМ средние показатели по Шкале депрессии Бэка соответствовали легкой степени, показатель качества жизни – умеренной степени снижения. Это подтвердили данные комплексного болевого опросника: сохранялся жизненный контроль, при высокой поддержке значимого человека на фоне умеренного влияния боли на разные сферы жизни и степень эмоционального страдания. Анкетные показатели тревожности соответствовали выраженной степени. Оценка по анкете СВД также соответствовала выраженной степени. Показатели Анкеты количественной оценки субъективных характеристик сна подтверждали наличие инсомнии. По Шкале жизненных событий Холмса-Рея средний суммарный показатель по группе ХМ был >150 баллов, что соответствовало высокому риску развития психосоматических заболеваний.
Таблица 4. Результаты нейрофизиологического исследования при ХМ и МбезА
| № | Показатель | ХМ, n=183 | МбезА, n=179 | Норма, n=30 |
| 1. | ТМС: | | | |
| | Порог ВМО ( %): прав.полушарие лев. полушарие | 41,56,4 40,46,7* | 43,46,5 46,36,6 | 44,93,5 45,04,0 |
| | Наличие фосфенеза, % пациентов | 84,0* | 71,9` | 90,0 |
| | Порог фосфенеза (%) | 54,910,9 | 59,513,7 | 60,97,9 |
| 2. | Мигательный-RIII рефлекс: | | | |
| | Порог перцепции (мА) | 1,50,29 | 1,50,25 | 1,5±0,5 |
| | Порог RI-компонента (мА) | 5,81,9 | 6,11,4 | 5,6±1,4 |
| | Порог RII-компонента (мА) | 3,30,8 | 3,00,7 | 3,1±1,3 |
| | Порог RIII-компонента (мА) | 8,62,2 | 8,31,7` | 9,6±1,5 |
| | Габитуация (% пациентов): нет | 3,1* | 0 | 0 |
| | габитуация RIII-компонента < 50% | 28,1* | 17,8` | 4,7 |
| | габитуация RIII-компонента >50% | 31,2 | 25,0` | 10,0 |
| | полная габитуация | 37,5* | 57,2` | 85,3 |
| 3. | НФР: | | | |
| | Порог рефлекса | 8,2±1,7 | - | 10,3±1,7 |
| | Субъективный порог боли | 6,8±2,8 | - | 9,8±1,8 |
| | Порог боли/порог рефлекса | 0,83±0,15 | - | 0,950,2 |
р0,01 – * между ХМ и МбезА; – между ХМ и нормой; ` МбезА и нормой.
Анализ пациентов ХМ, злоупотребляющих (ХМ+ЛЗ) и незлоупотребляющих (ХМ-ЛЗ) препаратами для купирования ГБ, показал, что пациенты в подгруппах ХМ+ЛЗ (71,6%), по сравнению с подгруппой ХМ-ЛЗ (28,4%) были старше, чаще имели инвалидность, более высокий индекс массы тела, чаще имели наследственность по мигрени. Пациенты ХМ+ЛЗ чаще принимали препараты для лечения других заболеваний. Приступы МбезА провоцировались достоверно большим числом факторов, чаще выявлялись признаки тревоги, депрессии, нарушений сна, хронические болевые синдромы в области шеи, спины и поясницы. В подгруппе ХМ+ЛЗ отмечалось более позднее развитие основных событий болевого анамнеза жизни: позже дебютировала первичная ГБ (мигрень без ауры) и в более старшем возрасте развивалась ХМ (р0,01). Длительность анамнеза первичной ГБ и ХМ также была выше, как и общая длительность приема препаратов для купирования ГБ, как аналгетиков, так и триптанов (р0,01). При этом длительность периода злоупотребления препаратами для купирования ГБ соответствовала длительности анамнеза ХМ. Все основные клинические характеристики болевого синдрома были достоверно тяжелее в подгруппе ХМ+ЛЗ.
По данным ТМС в подгруппе ХМ+ЛЗ, по сравнению с подгруппой ХМ-ЛЗ, пороги ВМО для правого и левого полушарий были ниже (р=0,06), а порог фосфенеза был выше (р=0,06). Однако степень различий между группами по обоим показателям не достигала достоверности. По данным МР различия между подгруппами ХМ+ЛЗ и ХМ-ЛЗ касались только показателя габитуации RIII-компонента: в подгруппе ХМ+ЛЗ достоверно чаще габитуация отсутствовала или была менее 50%. Показатели ЭМГ перикраниальных мышц достоверно не различались между подгруппами ХМ+ЛЗ и ХМ-ЛЗ; ЭМГ-активность в покое регистрировалась во всех исследованных мышцах и наибольшие значения отмечены симметрично для обеих височных мышц. Подгруппа ХМ+ЛЗ характеризовалась достоверно более высокими показателями по всем пунктам MIDAS, что указывало на более тяжелую дезадаптацию. Показатель депрессии по Опроснику Бэка был достоверно выше, как и показатели реактивной и личностной тревожности по тесту Спилбергера. Также подгруппа ХМ+ЛЗ характеризовалась достоверно более высоким показателем по Шкале жизненных событий Холмса-Рея.
Исследование эффективности топирамата в профилактическом лечении ХМ состояло из фазы титрования (3 недели) и фазы лечения (9 недель). Начальная доза топирамата была 25мг/сут с последующим наращиванием дозы по 25мг в неделю до однократной целевой дозы 100мг. Весь комплекс клинико-нейрофизиологических и анкетных исследований проводился до и после лечения. На 15, 30 и 60 дни лечения планировались визиты пациента для клинической оценки и контроля ведения дневника головной боли и лечения. Из 68 пациентов четверо отказались от лечения. В группе МбезА курс лечения топираматом закончили все 32 включенных в исследование пациента.
Рис. 1. Число дней с ГБ в месяц при ХМ и МбезА на лечении топираматом
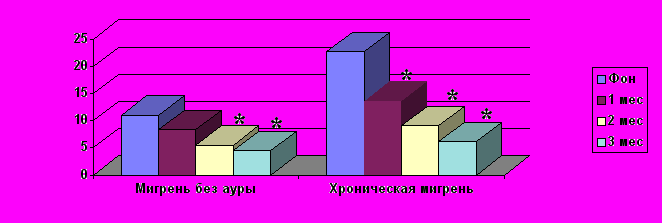
* – отличия от фоновых показателей (до лечения) (p < 0,05)
При ХМ прием топирамата привел к уменьшению числа дней с ГБ в месяц с 22,77,7 до 13,64,5 (p<0,05) в первый, до 9,13,6 (p<0,001) во второй и до 6,21,8 (p<0,001) в третий месяцы лечения (рис. 1). Таким образом, на фоне лечения топираматом среднее число дней с ГБ в месяц снизилось на 16,5 дней (p<0,001). Число респондеров составило 60,9% (для 3-го месяца лечения). Число приступов мигрени достоверно снижалось, начиная со 2-го месяца лечения: с 12,53,0 до 8,23,1 (p<0,05), а к окончанию лечения до 3,82,2; p<0,05. Интенсивность боли в приступе снижалась с 6,21,3 до 6,01,5 (p<0,08) в 1-й и до 5,01,2 (p<0,01) – во 2-ой месяцы, сохраняясь на этом уровне в течение 3-го месяца лечения (p<0,01). Наиболее заметно снижалась частота тяжелых приступов мигрени: с 5,71,7 до 1,52,7 (p<0,01) в 1-й, до 0,80,7 (p<0,001) – во 2-ой и до полного регресса в 3-й месяцы лечения (рис. 2).
Рис. 2 Число дней с тяжелыми приступами ГБ в месяц при ХМ и МбезА на лечении топираматом.

* – отличия от фоновых показателей (до лечения) (p < 0,05)
Прием топирамата снижал число пациентов с «фоновой» ГБ в группе ХМ, с 77% до 25% (p<0,01) через 1 месяц лечения, до 11,1% (p<0,001) через 2 и до полного регресса через 3 месяца лечения (p<0,001). Интенсивность «фоновой» ГБ снижалась с 3 баллов до 2 баллов (p<0,01) в 1-й и до 1 балла (p<0,01) во 2-ой месяцы. Общее число принимаемых таблеток для купирования ГБ уменьшалось с 52,512,8 до 14,99,2 (p<0,001) в 1-ый месяц, и с 13,46,0 во 2-ой месяц до 4,72,5 в 3-й месяц (p<0,001); число дней с приемом таблеток в месяц снизилось с 21,55,4 до 8,95,0 в 1-й месяц (p<0,01), до 7,33,0 во 2-ой и до 4,02,6 в 3-й месяцы (p<0,001). После приема топарамата в группе ХМ снижалась встречаемость и выраженность кожной аллодинии в зоне ГБ в приступе и в межприступном периоде, приводил к регрессу «фоновой» ГБ, исчезновению тяжелых длительных приступов, малочувствительных к препаратами для купирования приступа, что указывает на снижение центральной сенситизации болевых нейронов 2-го порядка.
На лечении топираматом снижалась встречаемость и интенсивность хронических болей экстракраниальной локализации, кожной аллодинии вне головы/лица, восстанавливалась эффективность привычных аналгетиков/триптанов, что вероятно связано со снижением центральной сенситизации болевых нейронов 3-го порядка.
На фоне лечения в группе МбезА снижалось число дней с ГБ в месяц с 11,02,5 до 8,43,7 (p<0,05) в 1-ый месяц, до 5,53,5 (p<0,001) во 2-ой и до 4,53,5 (p<0,001) в 3-й месяцы лечения. Число респондеров составило 56,2% (18 пациентов). Уменьшалась частота приступов, начиная с 8,41,8 до 5,62,8 (p<0,05) в 1-ый, до 4,41,9 (p<0,01) во 2-ой и до 3,62,6 (p<0,01) в 3-й месяцы.
При ХМ положительная клиническая динамика сочеталась с улучшением показателей качества жизни и показателей КБО по шкалам интенсивности боли, интерференции боли и степени эмоционального страдания (p<0,01). Наиболее показательной была динамика по MIDAS: суммарный показатель снизился с 96,7 до 10,5 дней (p<0,001) – пациенты из IV степени тяжести переходили во II степень с незначительной дезадаптацией. Показатели депрессии, тревоги, нарушений сна, вегетативных нарушений достоверно не изменились. В группе МбезА отмечена сходная динамика.
Лечение топираматом в группе ХМ привело к повышению порогов ВМО для правого полушария на 4,65,3%, для левого – на 4,26,7%, p<0,001 (табл. 5). Порог фосфенеза увеличился на 15,96,2% (p<0,001). После лечения топираматом в группе ХМ нет корреляции числа дней с ГБ в месяц и порогов ВМО и фосфенеза. Получена обратная корреляция (ρ=0,355, p=0,01) между изменением числа дней с ГБ/мес и изменением порогов фосфенеза ХМ (до и 3 месяца после лечения). Получена обратная корреляция между числом дней с ГБ/мес и абсолютными показателями порогов ВМО как до, так и после лечения (коэффициент корреляции Спирмена): 1) порог ВМО для правого полушария до лечения – ρ=0,534, p=0,002; 2) порог ВМО для левого полушария после лечения – ρ=0,565, p=0,003; 3) порог ВМО для левого полушария до лечения – ρ=0,523, p=0,002; 4) порог ВМО для левого полушария после лечения – ρ=0,429, p=0,005.
Таким образом, клинический эффект топирамата при ХМ объясняется не только его влиянием на возбудимость зрительной коры, но также связан с его влиянием на возбудимость моторной коры. Низкие пороги ВМО могут считаться предикторами эффективности топирамата при ХМ.
В группе МбезА отмечены сходные изменения показателей ТМС относительно с группой ХМ (табл. 6). Пороги появления ВМО для правого полушария повысились на 4,35,1% (p<0,001), а для левого – на 4,26,9% (p<0,005). Порог фосфенеза возрос на 12,35,9% (p<0,001). Число пациентов с наличием фосфенеза увеличилось (p<0,01). Результаты свидетельствовали об однонаправленных изменениях в обеих группах ХМ и МбезА – прием топирамата снижал возбудимость моторной и зрительной коры.
Таблица 5. Возбудимость коры в группе ХМ (n=64) при лечении топираматом.
| Показатель | До лечения (%) | После лечения (%) |
| Порог ВМО, правое полушарие | 43,17,1 | 47,77,6* |
| Порог ВМО, левое полушарие | 45,38,2 | 49,510,2* |
| Наличие фосфенеза, % пациентов | 80,0 | 93,8* |
| Порог фосфенеза | 52,512,5 | 68,412,3* |
* – p<0,001 – отличия от фоновых показателей (до лечения)
Анализ изменений числа дней с ГБ в месяц и порогов фосфенеза при лечении топираматом в группе МбезА выявил обратную корреляцию (ρ=0,553, p=0,002; рис. 3). Т.е., эффект топирамата при МбезА не объясняется его влиянием только на возбудимость зрительной коры. Нет корреляции между изменением дней с ГБ в месяц и изменением порога ВМО для правого (ρ=0,115, p=0,53;) и левого полушария (ρ=0,03, p=0,83).
Таблица 6. Возбудимость коры при МбезА (n=32) при лечении топираматом
| Показатель | До лечения (%) | После лечения (%) |
| Порог ВМО для правого полушария | 43,87,5 | 48,19,6* |
| Порог ВМО для левого полушария | 43,47,0 | 47,610,1 |
| Наличие фосфенеза, % пациентов | 71,9 | 80,2* |
| Порог фосфенеза | 59,511,0 | 71,912,3* |
