Хроническая мигрень: клиника, патогенез, лечение 14. 00. 13. Нервные болезни
| Вид материала | Автореферат |
- Календарно-тематический план лекций по курсу «Общая хирургия и анестезиология», 98.95kb.
- Методические рекомендации для практического занятия, 78.17kb.
- 1. Параректальные свищи. Этиология. Патогенез. Классификация. Клиника. Диагностика., 80.83kb.
- Методические рекомендации для практического занятия №10, 101.99kb.
- Список рекомендуемой литературы основная алексеев А. А., Лавров В. А. Ожоговая септикотоксемия:, 100.55kb.
- Тема Абсцесс, гангрена легкого и бронхоэктатическая болезнь, 394.58kb.
- Обследование и лечение в сеуле клиника Святой Марии, 23.92kb.
- Атеросклероз: эпидемиология, факторы риска, этиология, патогенез, клиника и диагностика, 225.03kb.
- Учебное пособие для студентов 6-го курса и врачей-интернов Волгоград, 2001, 256.4kb.
- 10 Билеты к экзамену по внутренним болезням для студентов 5 курса педиатрического факультета, 86.65kb.
* – p<0,01 – отличия от фоновых показателей (до лечения)
В группах ХМ и МбезА на лечении топираматом выявлялось повышение порогов RIII компонента МР, что предполагает ингибиторное действие топирамата на сенситизированные болевые нейроны 2-го порядка (нейроны ядра тройничного нерва) у пациентов ХМ и МбезА. Также увеличивалось число пациентов с габитуацией RIII компонента, что указывает на повышение активности антиноцицептивных систем ствола мозга. ЭМГ не выявила достоверных изменений показателей для перикраниальных и шейных мышц до и после лечения топираматом в группах ХМ и МбезА.
Рис. 3. Корреляция изменений дней с ГБ в месяц и изменения порогов фосфенеза при лечении топираматом в группе МбезА.
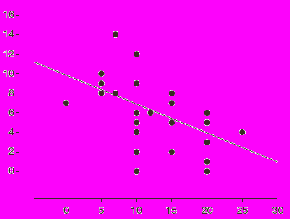
Выявлены следующие предикторы эффективности топирамата при ХМ:
- наличие тяжелых приступов МбезА; 2) кожная аллодиния в приступе МбезА; 3) наличие «фоновой» ГБ; 4) низкая эффективность предыдущего профилактического лечения; 5) низкие пороги ВМО и фосфенеза.
Сравнение пациентов с ХМ злоупотребляющих и не злоупотребляющих препаратами для купирования приступа ГБ показало, что факт злоупотребления не влияет на эффективность профилактического лечения топираматом.
Исследование эффективности дулоксетина в профилактическом лечении ХМ проводилось при монотерапии дулоксетином 60 мг/сут в течение 3 месяцев с комплексным клинико-нейрофизиологическим и анкетным тестированием до/после лечения. На фоне лечения дулоксетином снижалось среднее число дней с ГБ/мес с 25,85,3 до 10,5±3,9 дней (p<0,001) – в 3-й месяц лечения. Снизилась частота приступов мигрени с 11,3±3,8 до 6,8±2,5 (p<0,001) в 3-й месяц лечения. Уменьшилось количество дней приема препаратов для купирования ГБ: с 25,1±4,9 дней до 7,5±3,9 дней (p<0,001)– в 3-й месяц лечения. Снижалось число таблеток, принимаемых для купирования ГБ: с 46,6,0±14,7 до 8,5±10,6 таблеток (p<0,001) – в 3-й месяц лечения. Также снизилась интенсивность как «фоновой» ГБ – с 3,3±1,9 до 1,0±1,3 баллов (p<0,001), так и ГБ в приступе – с 6,4±2,5 до 4,1±1,9 баллов (p<0,01).
Число респондеров на лечении дулоксетином составило 50,0%. Достоверная динамика клинических показателей группы ХМ на лечении дулоксетином наблюдалась уже к концу 1-го месяца терапии. Регрессировали аллодиния на голове, лице, шее и руках и экстракраниальные хронические болевые синдромы. Снижались тревога, депрессия, проявления вегетативной дистонии, нарушений сна, улучшались показатели КБО, качества жизни в группе ХМ (табл. 7). Достоверно повышались субъективный порог боли и порог НФР. Отношение порог боли/порог НФР оставалось сниженным – 0,84±0,12. Увеличение порогов субъективной болевой чувствительности и НФР косвенно подтверждают повышение активности норадренергической и серотонинергической антиноцицептивных систем мозга. Нормализация порога и восстановление габитуации RIII предполагают влияние дулоксетина на активность антиноцицептивных систем ствола головного мозга (табл. 8).
Таблица 7. Анкетные показатели в группе ХМ на лечении дулоксетином.
Показатель, баллы | До лечения | После лечения |
| Опросник Бэка | 10,83,7 | 3,81,9** |
| Опросник Спилбергера реактивная тревожность личностная тревожность | 41,28,8 48,99,6 | 35,48,0** 38,78,8* |
| Опросник СВД | 58,57,4 | 26,56,7* |
Анкета нарушений сна | 17,84,9 | 21,16,3*** |
| Анкета качества жизни | 3,51,0 | 2,40,8* |
* p < 0,001; ** < 0,01; *** p < 0,05 – различия от показателей до лечения.
На лечении дулоксетином достоверно увеличивалось число пациентов, у которых выявлен фосфенез; порог фосфенеза снижался (p<0,01); значимых изменений порогов появления ВМО не отмечено. ЭМГ показатели перикраниальных мышц достоверно не менялись.
Таблица 8. Показатели МР в группе ХМ на лечении дулоксетином (n=46).
| Показатели | До лечения | После лечения |
| Порог RIII-компонента (мА) | 8,82,1 | 9,91,8* |
| % пациентов с габитуацией RIII | | |
| Отсутствует | 3,1 | 0* |
| Менее 50% | 57,0 | 19,0* |
| Более 50% | 28,7 | 25,0* |
| полная | 11,2 | 56,0* |
* p < 0,01 – различия от показателей до лечения (фон)
Выявлены следующие предикторы эффективности дулоксетина при ХМ: 1) наличие клинических признаков тревоги; 2) наличие клинических признаков депрессии; 3) наличие клинических признаков астении; 4) жалобы на нарушение ночного сна; 5) наличие панических атак; 6) жалобы на хронические болевые синдромы экстракраниальной локализации.
Фактор злоупотребления лекарственными препаратами для лечения приступа ГБ при ХМ не оказывал значимого влияния на эффективность профилактического лечения дулоксетином.
Исследование эффективности БТА в профилактическом лечении ХМ и МбезА проводилось в два этапа. На первом этапе у 70 пациентов с ХМ и 40 пациентов с МбезА оценивалась эффективность однократного введения 100 ЕД БТА. Комплексное клинико-нейрофизиологическое и анкетное тестирование проводилось до и через 3 месяца после введения БТА. На втором этапе оценивали эффективность повторных введений БТА: через 6 и 12 месяцев после первой инъекции.
При однократном введении БТА в группе ХМ число дней с ГБ/мес снижалось с 25 до 21– в 1-й месяц, до 16 – во 2-й и до 15 – в 3-й месяцы (рис. 4).
Рис. 4. Число дней с ГБ/мес после однократного введения БТА в группе ХМ (n=70) и группе МбезА (n=40).
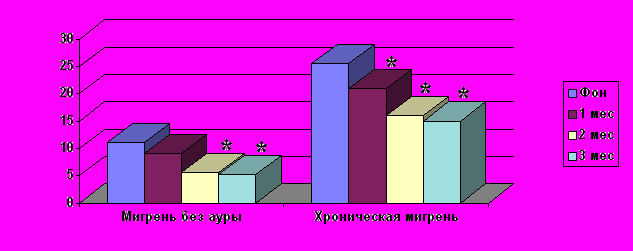
* – достоверные отличия от показателей до лечения (p < 0,05)
Интенсивность ГБ в приступе снижалась с 6,0 баллов до 5,5 баллов – в 1-й месяц, до 4,5 баллов (p<0,05) – во 2-й месяц и оставалось на этом уровне на 3-м месяце после инъекции БТА. Число таблеток препаратов для купирования ГБ снижалось с 60 до 45 таблеток (p<0,05) – в 1-й месяц, до 30 таблеток (p<0,01) – во 2-ой и до 25 таблеток (p<0,01) – в 3-й месяцы.
В группе МбезА с частыми приступами после введения БТА (рис. 4) число дней с ГБ/мес снижалось с 11,0 до 9,1 – в 1-й месяц, до 5,6– во 2-й и до 5,2 – в 3-й месяцы. Интенсивность боли в приступе снижалась с 7,3 баллов до 7,0 баллов в 1-й месяц, до 6,0 баллов (p<0,05) – во 2-й и до 5,5 балла (p<0,05) – в 3-й месяцы. Число таблеток для купирования ГБ менялось только со 2-го месяца (с 14 до 10 штук, p<0,05), а в 3-й месяц уже составляло 6 таблеток (p<0,01).
В группах ХМ и МбезА с частыми приступами динамика показателей анкетного тестирования была одинаковой: снижались показатели депрессии по Шкале Бэка, реактивной тревожности по Тесту Спилбергера, улучшалось качество жизни и показатели КБО (p<0,01).
Миорелаксирующий эффект БТА опережал начало обезболивающего действия на 2-3 недели. Катамнез показал, что обезболивающий эффект сохранялся до 6 месяцев (в среднем – 3,6 месяца). Выявляемые клинически мышечно-тонические нарушения в перикраниальных мышцах после однократного введения БТА значительно снижались и эффект удерживался до 3 месяцев. После однократного введения БТА у всех пациентов в группах ХМ и МбезА ЭМГ-активность перикраниальных мышц достоверно регрессировала (табл. 9).
После введения БТА, наряду с клиническим улучшением, отмечена нормализация порога и частичное восстановление габитуации RIII компонента МР (табл. 10).
Динамика числа респондеров была следующей: в группе ХМ: 27%, 40% и 41,4% через 1, 2 и 3 месяца, соответственно; в группе МбезА с частыми приступами: 29%, 48% и 50% через 1, 2 и 3 месяца, соответственно.
Таблица 9. ЭМГ-показатели через 3 месяца после однократного введения БТА в группе ХМ (n=70).
| Показатель справа/слева, мкВ | До лечения | После лечения |
| Лобная мышца | 20,09,1* /19,49,0* | 0 |
| Височная мышца | 26,77,6*/26,96,9* | 3,33,3/3,53,1 |
| Задне-шейная группа мышц | 14,99,0/14,69,4 | 15,09,2/14,78,9 |
| Трапециевидная мышца | 9,99,3*/9,47,4* | 5,05,2/5,14,8 |
* – p<0,01 – достоверные отличия от фоновых показателей
Таблица 10. Показатели МР в группе ХМ на лечении препаратом БТА (n=20).
| Показатели | До лечения | После лечения |
| Порог RIII-компонента (мА) | 8,42,2 | 9,61,6* |
| Габитуация RIII, % пациентов: нет | 5,0 | 0* |
| менее 50% | 55,0 | 25,0* |
| Более 50% и полная | 30,0 и 10,0 | 50,0* и 25,0* |
* p < 0,01 – различия от показателей до лечения (фон)
Выявлены следующие предикторы эффективности лечения БТА при ХМ: 1) напряжение и болезненность перикраниальных мышц при пальпации; 2) низкоамплитудная ЭМГ-активность покоя перикраниальных мышц; 3) кожная аллодиния в приступе ГБ; 4) низкая эффективность предыдущего профилактического лечения ХМ; 5) средние и низкие показатели тревоги по Тесту Спилбергера; 6) средние и низкие показатели депрессии по Шкале Бэка; 7) средние и низкие показатели вегетативных нарушений по Анкете вегетативных нарушений.
Во втором этапе исследования участвовали 30 пациентов с ХМ, которым повторно вводили 100 ЕД БТА в те же мышцы через 6 и 12 месяцев после первой процедуры. После второй процедуры в группе ХМ снизилось число дней с ГБ/мес с 22,2 до 19,0 – в 1-й месяц и до 13,9 (p<0,01) – в 3-й месяц после повторного введения БТА. Таким образом, после второй процедуры часть пациентов с ХМ перешли в группу с эпизодическими ГБ, перешагнув порог ГБ в 15 дней/мес. Однако, через 6 месяцев после второй процедуры число дней с ГБ/мес вновь увеличилось, и пациенты вернулись к исходному паттерну ХМ.
К сроку третьей процедуры введения БТА имелось достоверно меньшее число дней с ГБ в месяц по сравнению с показателем перед первым и вторым введением: 25,6 дней, 22,2 дней и 17,5 дней, соответственно. После третьей процедуры динамика изменения числа дней с ГБ/мес была такой же, как и после второй процедуры. Число дней с ГБ/мес снижалось с 17,5 до 15,0 – в 1-й и до 9,6 (p<0,01) –в 3-й месяцы после третьего введения БТА. Катамнез показал, что положительная динамика стабильно сохраняется в течение 6-ти месяцев и пациенты продолжают оставаться в группе МбезА с эпизодическими приступами: число дней с ГБ в месяц через 6 месяцев после последней инъекции составило 10,5 дней.
Число таблеток для купирования ГБ после второй процедуры в группе ХМ снижалось с 52,8 таблеток до 38,0 таблеток – в первый месяц и до 20,1 таблеток (p<0,01) – в третий месяц. К сроку третьей процедуры БТА пациенты употребляли достоверно меньше таблеток по сравнению с аналогичным показателем перед первым и вторым введением БТА: 60,9 таблеток, 52,8 таблеток и 38,5 таблеток, соответственно. После третьей инъекции число таблеток, применяемых для купирования приступов, снижалось с 38,5 таблеток до 31,0 таблеток – в 1-й и до 19,2 таблеток (p<0,01) – в 3-й месяцы. Мышечно-тонические нарушения перикраниальных и шейных мышц при ХМ, выявляемые пальпаторно, значительно регрессировали после введения БТА.
Через 6 месяцев после каждой процедуры введения БТА мышечно-тонические нарушения возвращались, что подтверждалось пальпацией и данными ЭМГ-обследования. Каждая последующая процедура введения БТА снижала мышечно-тонические нарушения не менее чем на 3 месяца. Число респондеров при лечении пациентов с ХМ введением БТА было следующим: 41,8% – после 1-ой, 50,0% – после 2-ой и 56,8% – после 3-ей процедур.
Заключение
Результаты анализа клинических, психометрических и анкетных показателей свидетельствуют о многоуровневых функциональных нарушениях нервной системы, участвующих в патогенезе хронической мигрени, а именно:
1) Гипервозбудимость коры головного мозга:
- максимальное число провоцирующих факторов приступа при ХМ – сенситивность к стимулам разных модальностей (зрительные, слуховые, ольфакторные, вестибулярные, эмоционально-аффективные и др.);
- повышенная чувствительность к свету, звукам, вестибулярным нагрузкам в межприступный период.
2) Центральная сенситизация болевых тригеминальных нейронов 2-го порядка:
- кожная аллодиния в приступе в зоне ГБ;
- «фоновая» ГБ, совпадающая по локализации с ГБ в приступе;
- кожная аллодиния в области головы и лица в межприступном периоде и при «фоновой» ГБ;
- неэффективность или низкая эффективность анальгетиков и триптанов, даже при условии адекватной дозы и своевременности приема;
- появление тяжелых длительных приступов мигрени, малочувствительных к лечению препаратами для купирования приступа.
3) Центральная сенситизация болевых таламических нейронов 3-го порядка:
- экстракраниальные хронические боли, высококоморбидные ХМ;
- кожная аллодиния за пределами головы/лица в приступе мигрени;
- кожная аллодиния за пределами головы/лица в межприступный период;
- «фоновая» головная боль, не совпадающая с ГБ в приступе по локализации, качественным характеристикам, интенсивности, сопутствующим симптомам, эффекту анальгетиков и триптанов.
4) Периферическая сенситизация ноцицепторов миофасциальных перикраниальных структур:
- облигатные длительно существующие мышечно-тонические и миофасциальные нарушения в перикраниальных и шейных мышцах;
- регресс мышечно-тонических и миофасциальных нарушений при снижении болевой афферентации в ответ на введение БТА.
5) Изменение эмоциональной, когнитивной и поведенческой модуляции боли. Вовлечение перечисленных уровней косвенно подтверждается изменением следующих анкетных показателей:
- снижение качества жизни;
- выраженная дезадаптация, связанная с ГБ;
- тревога, депрессия, вегетативные нарушения, нарушения сна;
- влияния ГБ на разные сферы жизни пациентов.
Комплексный клинико-нейрофизиологический анализ и анкетное тестирование показали, что для пациентов с ХМ+ЛЗ характерен достоверно более тяжелый синдром ГБ и степень дезадаптации. При этом, несмотря на достоверно более выраженные тревогу и депрессию относительно пациентов с ХМ-ЛЗ, уровни этих нарушений соответствовали легкой и умеренной степеням. Возможно, выбранный пациентами с ХМ+ЛЗ режим приема обезболивающих препаратов позволял справляться с тяжелым болевым синдромом и, тем самым, поддерживать работоспособность (до 95% из них продолжали активно работать) и удовлетворительный уровень качества жизни на фоне достоверно большего числа стрессовых жизненных событий.
Анализ фактора применения обезболивающих препаратов для купирования приступа мигрени в подгруппе ХМ+ЛЗ показал, что длительный регулярный прием препаратов на протяжении 18 лет не приводил к хронизации мигрени даже в подгруппе пациентов, применявших исключительно комбинированные анальгетики с входящими в их состав психолептиками. Развитию ХМ предшествовал период ухудшения течения первичной ГБ с нарастанием частоты и тяжести приступов и снижением эффективности купирующих приступ ГБ препаратов, длившийся в подгруппе ХМ+ЛЗ в среднем 2,7 года. Период ухудшения течения первичной МбезА и дебют ХМ совпадали со значимыми стрессовыми событиями в жизни пациентов и в дальнейшем с поддержанием большого количества стрессовых событий на протяжении длительного периода времени, что было подтверждено показателями Шкалы жизненных событий Холмса-Рея. Среди вероятных причин, способствующих развитию и стабильному поддержанию более тяжелого болевого синдрома при ХМ в подгруппе ХМ+ЛЗ, можно обсуждать:
- наследственность (семейный анамнез мигрени у 84% пациентов в подгруппе);
- возрастной фактор (поздний дебют первичной МбезА, более поздний дебют ХМ, более старший возраст пациентов подгруппы ХМ+ЛЗ);
- фактор длительности заболевания (длительность анамнеза первичной ГБ и анамнеза ХМ была достоверно выше);
- биологический/метаболический фактор (достоверно чаще дебют ХМ совпадал с наступлением менопаузы, пациенты имели достоверно более высокий индекс массы тела, чаще отмечался регулярный прием лекарственных препаратов по поводу соматических заболеваний);
- стрессовый фактор (значимые стрессовые события в дебюте ХМ и большое количество стрессовых событий на протяжении длительного периода времени).
В исследовании показана высокая клиническая эффективность длительного приема топирамата по 100 мг/сутки в лечении ХМ: статистически значимо снижались основные показателей тяжести мигрени (общего количества дней с ГБ в месяц, частоты и интенсивности приступов, особенно тяжелых приступов МбезА, а также количества препаратов, применяемых для купирования ГБ и регрессу «фоновой» ГБ). Отмечен высокий показатель числа респондеров (по критерию снижения количества дней с ГБ в месяц на 50% и более) – 60,9% в группе ХМ и 56,8% в группе МбезА с частыми приступами.
Терапевтический эффект топирамата развивался быстро, в течение первого месяца лечения. Медленное титрование дозы топирамата давало возможность амбулаторным пациентам хорошо и удовлетворительно переносить возникающие побочные эффекты и постепенно приспосабливаться к ним. Наряду с клиническим улучшением прием топирамата вызывал изменения параметров ТМС и мигательного рефлекса как в группе ХМ, так и группе МбезА. Характер изменений указывал на многоуровневое воздействие топирамата в ЦНС у пациентов ХМ и МбезА: на уровне коры головного мозга – снижение возбудимости нейронов моторной и зрительной коры, на уровне ствола головного мозга – воздействие на сенситизированные болевые нейроны второго порядка (нейроны собственного ядра тройничного нерва) и повышение активности антиноцицептивных систем ствола головного мозга.
Исследование эффективности дулоксетина в лечении ХМ показало его эффективность. Отмечено достоверное улучшение по всем клиническим параметрам, число респондеров составило 50,0%. Терапевтический эффект развивался медленно, только со второго месяца лечения. Наиболее значимыми для пациентов побочными эффектами были тошнота, тревога, повышение АД и дневная сонливость. Однако ни один из пациентов не прервал лечения из-за побочных эффектов, которые были преходящими и быстро регрессировали после отмены препарата. Прием дулоксетина приводил к достоверному повышению и субъективного порога боли, и порога НФР, а также к нормализации порога RIII компонента МР и восстановлению габитуации RIII компонента (по данным МР), что являлось косвенным подтверждением повышения активности норадренергической и серотонинергической антиноцицептивных систем мозга – основного механизма противоболевого действия антидепрессанта двойного действия. Хотя дулоксетин не обладает непосредственным аналгетическим действием, курсовой прием препарата приводил не только к снижению количества дней с ГБ в месяц, но и к достоверному уменьшению интенсивности ГБ. Таким образом, дулоксетин оказывает положительное влияние на основные клинические проявления ХМ и выраженность коморбидных нарушений. Клиническая эффективность дулоксетина вероятно связана с многоуровневым влиянием препарата на патогенетические механизмы ХМ: 1) влияние на активность антиноцицептивных систем на уровне ствола мозга, что выявлено при нейрофизиологическом тестировании; 2) влияние на активность ноцицептивных систем головного мозга (снижение центральной сенситизации болевых нейронов 2-го и, вероятно, 3-го порядка, что доказывается регрессом «фоновой» ГБ и аллодинии в области головы/ лица/ шеи/ рук, купированием хронических болевых синдромов другой локализации); 3) влияние на эмоциональную, когнитивную и поведенческую модуляцию боли, что проявляется снижением уровней тревоги, депрессии, регрессом пароксизмальных и перманентных вегетативных нарушений, нарушений сна и приводит к снижению влияния боли на различные сферы жизни пациента.
Исследование эффективности БТА при лечении ХМ показало, что однократное введение препарата БТА приводит к достоверному улучшению основных клинических показателей. Как правило, клинический «обезболивающий» эффект развивался более медленно, отставлено от миорелаксирующего действия БТА на 2-3 недели. Выявленный факт показывает, что миорелаксирующий и обезболивающий эффекты БТА напрямую не связаны между собой, что подтверждает наличие других механизмов обезболивающего действия БТА. Наряду с клиническим улучшением в группе ХМ на лечении БТА достоверно менялись показатели ЭМГ и мигательного рефлекса. Характер изменений указывал на многоуровневое воздействие препарата БТА: 1) снижение периферической сенситизации; 2) снижение центральной сенситизации на уровне ствола головного мозга; 3) повышение активности антиноцицептивных систем ствола головного мозга. В результате исследования выявлено, что наилучшие клинические результаты получены при повторных введениях БТА (трижды через шесть месяцев). Показатель респондеров после третьей инъекции – 56,8%. Повторное введение препаратов БТА пациентам с ХМ позволяет перевести их из группы ХЕГБ в группу с эпизодическими приступами мигрени, вернув паттерн первичной головной боли.
Сравнение подгрупп пациентов злоупотребляющих и незлоупотребляющих лекарственными препаратами для купирования ГБ не выявило достоверных различий по всем тестируемым клиническим параметрам. Таким образом, фактор злоупотребления лекарственными препаратами для лечения приступа ГБ при хронической мигрени не оказывал значимого влияния на эффективность профилактического лечения ни одного из исследованных препаратов.
ВЫВОДЫ
- Российская популяция пациентов с хронической мигренью имеет следующие социо-демографические характеристики: представлена в 92,9% случаев женщинами активного возраста (69% в возрасте 30-55 лет; средний возраст – 40,912,3 лет), имеющих благополучный семейный (73% в браке, 85% имеют детей) и социальный статусы (95% с высшим образованием, 90% работает, 95% со средним и высоким уровнями дохода). Субъективными причинами развития хронической мигрени в 64,6% являлись стрессовые события в личной жизни пациентов и период длительной напряженной работы, часто с ненормированным рабочим днем – в 54,5%; 84% пациентов обращались амбулаторно к врачам разных специальностей в среднем 3,4 раза в год; 71% пациентов обращались за скорой медицинской помощью в среднем 1,6 раз в месяц по поводу тяжелого приступа головной боли на фоне неэффективного использования «привычных» препаратов для купирования приступа.
- Для пациентов с хронической мигренью характерны следующие основные коморбидные расстройства: 1) тревога; 2) другие хронические болевые синдромы; 3) вестибулопатия; 4) астения и 5) напряжение перикраниальных мышц, каждое из которых отмечалось у 90% пациентов и более, что делает их облигатными для данной группы. Достоверно чаще в группе хронической мигрени, в сравнении с группой мигрени без ауры с частыми приступами, выявляются депрессия, нарушения сна, панические атаки/гивервентиляционные кризы, артериальная гипертония, ожирение, дискинезия желчевыводящих путей и/или холецистит.
- У всех пациентов с хронической мигренью в анамнезе выявлен специфический паттерн перехода первичной мигрени без ауры в хроническую ежедневную или почти ежедневную головную боль через период трансформации первичной головной боли. Период трансформации характеризуется учащением приступов мигрени, что сопровождалось повышенным потреблением лекарств для купирования головной боли, появлением тяжелых длительных приступов головной боли, малочувствительных к лечению таблетками и требующих постельного режима, развитием «фоновой» головной боли, при том, что рвота в приступах отмечалась реже и появлялась тревога ожидания тяжелого приступа, страх развития некупируемой сильной боли и страх самостоятельно не справиться с описанной ситуацией. Средняя продолжительность периода трансформации первичной головной боли в хроническую мигрень составляет 2,7 года.
- При хронической мигрени общее количество болевых дней в месяц составляло 26 дней, из них 12,9 дней приходилось на приступы, соответствующие критериям мигрени без ауры. По сравнению с группой мигрени без ауры с частыми приступами, в группе хронической мигрени приступы мигрени были достоверно чаще, с тенденцией к более затяжному течению, но менее интенсивные, провоцировались достоверно большим количеством факторов. Число дней с тяжелыми приступами мигрени с развитием максимальной интенсивности боли и выраженной дезадаптации было достоверно выше в группе хронической мигрени.
- У 77% пациентов с хронической мигренью выявлен феномен «фоновой» головной боли – постоянно присутствующей головной боли постоянной интенсивности, любой локализации и характера, но обязательно «привязанной»/или пересекающейся с приступами мигрени. Дебют «фоновой» головной боли совпадал с дебютом хронической мигрени, являясь одним из маркеров изменения привычного течения первичной головной боли. «Фоновая» головная боль не совпадала с ГБ приступа мигрени ни по локализации (у 76% пациентов), ни по качественным характеристикам боли (у 100% пациентов), ни по интенсивности болевого синдрома, ни по сопровождающим симптомам. «Фоновая» головная боль малочувствительна или нечувствительна к любым обезболивающим препаратам, и вероятнее всего вызвана развитием центральной сенситизации на уровне второго и, вероятно, третьего болевых нейронов.
- При хронической мигрени и мигрени без ауры с частыми приступами имеется сходная картина: по основным дескрипторам боли в приступе, локализации головной боли в приступе, сопровождающим симптомам, провоцирующим факторам, что подтверждает единство этих двух состояний. При хронической мигрени, по сравнению с мигренью без ауры, достоверно реже отмечается рвота и сонливость в приступе мигрени, а феномен аллодинии и необходимость постельного режима – отмечены достоверно чаще.
- Злоупотребление лекарственными препаратами для купирования головной боли при хронической мигрени отмечено у 71,6% пациентов. Из них 71% злоупотребляли аналгетиками, 8% – триптанами, 21% – злоупотребляли аналгетиками и триптанами одновременно. Средняя продолжительность лекарственного злоупотребления составила 4,1 года, что соответствовало длительности хронической мигрени как таковой (4,0 года). В группе хронической мигрени чрезмерно принимаемые препараты имели низкую эффективность: у 89,5% пациентов снижалась интенсивность боли до «терпимой».
- При хронической мигрени, по сравнению с контролем, выявлены следующие нейрофизиологические изменения: снижение порогов вызванных корковых моторных ответов и фосфенеза, снижение порога RIII компонента мигательного рефлекса, отсутствие/нарушение габитуации RIII компонента, появление низкоамплитудной ЭМГ-активности перикраниальных мышц. Независимо от информативности полученных нейрофизиологических изменений не выявлено биологических маркеров хронической мигрени вследствие значительных межиндивидуальных различий.
- Для профилактического лечения хронической мигрени из исследованных препаратов наиболее эффективным оказался топирамат: количество респондеров составило 60,9%. Предикторами эффективности топирамата являются: наличие тяжелых приступов мигрени без ауры с развитием аллодинии, низкая эффективность лекарственных препаратов для купирования острой боли, наличие «фоновой» головной боли интенсивностью от 4 баллов и выше, низкие пороги коркового вызванного моторного ответа и фосфенеза.
- При хронической мигрени на фоне лечения топираматом по данным ТМС достоверно снижается как возбудимость зрительной, так и в меньшей степени моторной коры. Между изменением числа дней с ГБ в месяц и изменением порогов фосфенеза на лечении топираматом выявлена обратная корреляция (ρ=0,553, p=0,002), что не позволяет объяснить эффективность топирамата при хронической мигрени его влиянием только на возбудимость коры головного мозга. Нормализация порога RIII компонента мигательного рефлекса и восстановление габитуации RIII компонента предполагают влияние топирамата на сенситизированные болевые нейроны второго порядка (нейроны собственного ядра тройничного нерва).
- При хронической мигрени лечение дулоксетином является эффективным и приводит к достоверному снижению числа дней с головной болью в месяц, снижению частоты приступов головной боли, а также снижению количества препаратов, применяемых для купирования головной боли; показатель респондеров – 50,0%. Предикторами эффективности дулоксетина при хронической мигрени являются наличие выраженных коморбидных расстройств – тревоги, депрессии, астении, нарушений сна, панических атак, хронических болевых синдромов экстракраниальной локализации.
- Прием дулоксетина при хронической мигрени достоверно повышает субъективный порог боли и порог ноцицептивного флексорного рефлекса, а также нормализует порог RIII компонента и восстанавливает габитуацию RIII компонента мигательного рефлекса. Положительный эффект дулоксетина предполагает его влияние на активность антиноцицептивных систем головного мозга – как норадренергической, так и серотонинергической.
- При хронической мигрени эффективно лечение препаратом ботулинического токсина типа А. Наилучшие клинические результаты получены при повторных введениях препарата. Число респондеров составляет 41,8% – после первой процедуры, 50,0% – после второй и 56,8% – после третьей процедуры. Предикторами эффективности ботулинического токсина типа А при хронической мигрени являются: напряжение и болезненность перикраниальных мышц при пальпации, низкоамплитудная ЭМГ-активность перикраниальных мышц, кожная аллодиния, малая эффективность предыдущего лекарственного профилактического лечения, отсутствие или легкая степень коморбидных расстройств.
- Противоболевой эффект ботулинического токсина типа А, оцениваемый по данным клинического интервью, дневникам головной боли и анкетным данным и его миорелаксирующее действие по степени снижения ЭМГ-активности, не совпадают по времени относительно момента введения препарата и длительности эффекта. Выявленный факт показывает, что миорелаксирующий и обезболивающий эффекты ботулинического токсина типа А напрямую не связаны между собой, что подтверждает наличие других механизмов обезболивающего действия препарата.
- Сравнение подгрупп пациентов злоупотребляющих и незлоупотребляющих лекарственными препаратами для купирования приступа головной боли не выявило достоверных различий между группами пациентов по всем клиническим параметрам. Фактор злоупотребления лекарственными препаратами при хронической мигрени не оказывает значимого влияния на эффективность профилактического лечения взятых в исследование препаратов, причем, независимо от механизма их действия.
