Липатова людмила Валентиновна
| Вид материала | Автореферат |
СодержаниеСодержание работы Результаты исследования |
- Волков Владимир Анатольевич, председатель Исполкома ма «Большой Урал» Бабушкина Людмила, 387.91kb.
- Калита Людмила Ивановна учитель информатики высшей категории сш №23 Ленинского р-на, 237.8kb.
- Панова Людмила Валентиновна моу «Большегривская сош» урок, 48.23kb.
- Липатов Петр Иванович, учитель биологии; Липатова Людмила Николаевна, учитель биологии, 620.01kb.
- Доклад «Наша новая школа: состояние, проблемы и направления развития общего образования, 237.2kb.
- «Метод проектов как одна из форм ученического исследования на уроках литературы», 461.96kb.
- Муниципальный конкурс "Учитель года России 2007" Нововаршавский муниципальный район, 276.74kb.
- Липатов Петр Иванович, учитель биологии; Липатова Людмила Николаевна, учитель биологии, 763.93kb.
- Ким Виктория Валентиновна, 144.46kb.
- Методические рекомендации подготовлены кафедрой интегрированных маркетинговых коммуникаций, 539.08kb.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Обследовано 304 пациента в возрасте от 17 до 62 лет, средний возраст пациентов составил 21,4±7,3. Все обследованные разделены на три группы.
Первую (98 человек) составили больные с верифицированной симптоматической эпилепсией, имеющие структурно-органические изменения головного мозга, выявленные методом МРТ. Для классификации эпилепсии и типов припадков была использована классификация эпилепсии и эпилептических синдромов Международной Лиги по борьбе с эпилепсией 1981 года (Киото). По возрасту пациенты этой группы были распределены следующим образом: до 25 лет – 56 (57,1 %) пациента, от 26 до 35 лет – 26 (26,5 %) и более 35 лет – 16 (16,3 %). Возраст дебюта заболевания равен 12,73±6,87 лет, при этом минимальный возраст дебюта припадков был 1 год, а максимальный – 34 года. У 56,1 % больных эпилепсией первые припадки появились до 16 лет. Средняя длительность заболевания составила 10,63±7,45 лет. Парциальной эпилепсией страдали 78 человек (79,5 %), генерализованной - 20 (20,4 %) больных. По частоте припадков больные распределились следующим образом: частыми припадками (более 1 в неделю) страдали 17 человек (17,3 %); более одного приступа в месяц имели 52 человека (53,1 %); несколько раз в год – 18 (18,3 %); менее 1 в год - 11 (11,2 %). Таким образом, у большинства наблюдаемых пациентов с эпилепсией отмечались частые припадки (70,4 %), у 9 пациентов (9,2 %) они имели склонность к серийному течению, 29,5 % обследованных имели редкие припадки. У 41 % больных имели место припадки бессудорожного характера (простые и сложные парциальные, абсансы), у остальных (59 %) отмечалось сочетание судорожных и бессудорожных припадков. Полиморфные припадки были представлены сочетанием абсансов, миоклонических и тонико-клонических припадков при генерализованной эпилепсии, простых и сложных парциальных, вторично генерализованных судорожных приступов - при парциальной.
В группе больных с первично-генерализованной формой эпилепсии в 5,1 % наблюдений (5 человек) отмечены абсансы (типичные у 1, атипичные у 5), в 4 % - тонические, в 19 % - тонико-клонические припадки. У пациентов с парциальной эпилепсией наибольший удельный вес занимали приступы с вегетативными, сенсорными и с психическими симптомами (у 24, 26 и 15 больных соответственно). Вторично генерализованные припадки были отмечены у 55,1 % пациентов. Простые парциальные приступы отмечались у больных в 1,4 раза чаще сложных парциальных припадков.
Больные эпилепсией были разделены на две подгруппы: первую (51 человек) составили пациенты с контролируемой эпилепсией (КЭ), хорошим контролем приступов, вторую (47 человек) - больные с труднокурабельной, резистентной эпилепсией (НКЭ).
Вторую группу (110 человек) составили больные с резидуально-органическими заболеваниями ЦНС, подтвержденными объективными нейровизуализационными методами, проявляющиеся разнообразием цереброгенных астенических нарушений, преимущественно, функционального регистра - от астенических реакций до неврозоподобных, без припадков и других пароксизмальных состояний (РЭ).
Третья группа (96 человек) являлась группой сравнения (контролем), соcтояла из лиц с резидуально-органическими заболеваниями ЦНС, диагностированными параклиническими методами, в структуру симптомокомплекса которых входили, помимо вышеописанных синдромов у пациентов второй группы, пароксизмальные состояния неэпилептического круга (парасомнии, синкопальные состояния, мигрени, вегетативно-висцеральные пароксизмы), которые принять считать коморбидными эпилепсии заболеваниями (РЭПС).
Методы исследования
1. Метод клинического наблюдения. Клиническое обследование пациентов включало детальное изучение данных анамнеза их жизни и заболевания, выявление факторов риска пре-, пери-, и постнатального периодов, предикторов заболевания, подробно изучались имеющиеся медицинские сведения. Тщательно анализировались жалобы больных, оценивался соматический и психоневрологический статус по общепринятой в классической неврологии методике. Психологическое исследование осуществлялось с применением цифровой корректурной пробы, методики запоминания 10 слов, Бентон–теста (VRT), теста WAIS, MMPI. Для бальной оценки тяжести эпилептических припадков использовалась шкала NHS-3 (Национальная Британская шкала), для изучения динамики клинического состояния пациента применялась шкала общего клинического впечатления СGI (Clinical Global Improvement). Этот же метод использовался при анализе эффективности лечения больных.
2. Методы нейровизуализации. А. Магнитно-резонансная томография (МРТ). Исследование проводилось на магнитно-резонансном томографе Universal-Max (ВНИИКТ, USA–Россия) с напряженностью магнитного поля 0,15 Тесла на отделении лучевой диагностики Санкт-Петербургского психоневрологического научно - исследовательского института им. В.М. Бехтерева. МРТ проводили по общепринятой методике в трех проекциях (аксиальной, сагиттальной и коронарной) в режиме Т1 (время релаксации спин-решеточное), Т2 (время релаксации спин - спиновое) и протонной плотности с получением Т1- и Т2-взвешенных изображений головного мозга. Ориентация срезов осуществлялась по стандартной методике с учетом применения контрастного усиления. Выраженность морфологических изменений оценивалась с помощью МРТ-морфометрического исследования. Оценивали очаговые изменения, атрофический процесс, наличие зон лейкоареоза, расширения пространств Вирхова-Робина, измерялись индексы третьего желудочка (ИТЖ), четвертого желудочков (ИЧЖ), индексы передних рогов и центральных отделов боковых желудочков (ИЦО), размеры межполушарной щели и латеральных цистерн (Верещагин Н.В., 1986 г.).
Г. Рентгенография черепа. Обзорная краниография черепа проводилась в 2 проекциях (сагиттальной и боковой), оценивались размеры и общая конфигурация черепа, структура черепных костей, состояние швов, выраженность сосудистого рисунка, физиологические и патологические обызвествления, форма и размер турецкого седла, признаки повышения внутричерепного давления, аномалии черепа.
В. Электроэнцефалография (ЭЭГ). ЭЭГ-исследование с накожным наложением электродов проводилось на цифровом электроэнцефалографе «Телепат» (Санкт-Петербург) и анализаторе электрической активности мозга с топографическим картированием “Энцефалан–131-01”, (Россия), рег. № 94/271-71. Исследование осуществлялось с 8 симметричных точек на поверхности головы в покое и после проведения стандартных нагрузочных ЭЭГ-проб (ритмической фотостимуляции с возрастающей частотой световых импульсов от 1 до 20 Гц при гипервентиляции в течение 2 минут). Равновеликие участки электроэнцефалограмм обработаны статистически (вычисление спектра мощности основных ритмов). Кроме того, 37 обследуемым дополнительно проводили скальповую ЭЭГ после депривации сна. В качестве нормы была взята ЭЭГ с доминирующим альфа-ритмом, индексом до 75 %, регулярным по частоте, модулированным по амплитуде до 40-60 мкВ, с хорошо выраженными зональными различиями, бета- активностью высокой и средней частоты, низкого индекса, асинхронного характера, малой амплитуды (до 10 мкВ) и одиночными медленными волнами. На втором этапе, кроме изучения средних гармоник альфа-, бета-, тета- и гамма- диапазонов ЭЭГ, проводилось топографическое картирование спектров мощности в заданных диапазонах частот, а также оценка нестационарной спектральной плотности ЭЭГ.
В. Транскраниальная допплерография сосудов головного мозга (ТКДГ). Функциональное состояние церебральной гемодинамики исследовалось методом на приборе «Diadop-500» производства фирмы Technics (Франция) по общепринятой методике (Aaslid R., 1982). Оценка показателей мозгового кровотока у больных проводилась путем сравнения с нормальными величинами у здоровых (Андреев А.В., Никитин Ю.М., Труханов А.И., 1988), проводилась также сравнительный анализ абсолютных значений линейной скорости кровотока (V ср.) по магистральным сосудам, пульсационного индекса (Pi) и коэффициента асимметрии с показателями здоровых людей.
Г. Иммунологические методы. а. Долабораторное обследование. Для выявления клинических синдромов вторичной иммунологической недостаточности была использована классификация, разработанная сотрудниками МЗ РФ под руководством академика Р.В. Петрова. На первом этапе больные были обследованы с помощью «карты диагностики иммунологической недостаточности при иммуноэпидемиологических исследованиях взрослого населения» (Петров Р.В., Орадовская И.В., 1989) включающей серию эпидемиологических, санитарно-гигиенических, анамнестических и клинических сведений. Для статической обработки использовалась шкала, позволяющая оценить иммунологический анамнез в баллах (Пухлик Б.М., 1992). Для клинико-иммунологических исследований психоневрологических больных использовалась схема оценки иммунного статуса, предложенная Р.В. Петровым, Р.М. Хаитовым, Б.В. Пинегиным (1994). Применялись скрининговые и уточняющие методы иммунодиагностики (Кетлинский С.А., Калинина Н.М., 1998).
б. Лабораторное обследование пациента позволяло идентифицировать дефекты компонентов иммунной системы, определить уровень иммунных нарушений, что крайне важно для назначения индивидуальной схемы лечения с включением иммуноориентированной терапии.
Иммунологическое исследование осуществлялось в нейроимунологической лаборатории Института Мозга Человека РАН (Санкт-Петербург), руководитель лаборатории - проф. И.Д. Столяров. Иммунологические исследования выполнялись по стандартным методикам (Фримель Г. (ред.), 1987; Кетлинский С.А., Калинина Н.М., 1998). Для определения состояния иммунной системы в периферической крови определялись следующие количественные и функциональные показатели:
- Численность (в процентах) Т- и В- лимфоцитов в периферической крови (общего числа лимфоцитов, процентного и абсолютного числа зрелых Т-лимфоцитов - CD3+, двух основных субпопуляций - хелперов CD4+ и киллеров-супрессоров CD8+; В-лимфоцитов CD20+; иммунорегуляторного индекса (ИРИ) - отношение CD4+/CD8+;
- Концентрация сывороточных иммуноглобулинов классов А, G, М (IgА, IgG, IgМ);
- Фагоцитарной активности полиморфноядерных лейкоцитов (процент клеток-фагоцитов и средней способности каждого фагоцита к поглощению)
- Чувствительность (сенсибилизации) лейкоцитов к нейроспецифическим антигенам (белку S–100, антигену нейрональных мембран, основному белку миелина, Gal–C-I) с использованием реакция торможения адгезии лейкоцитов (LAТ-leucocytes adhesion test).
- Концентрация в плазме крови циркулирующих иммунных комплексов.
Определение субпопуляций лимфоцитов с использованием моноклональных антител проводили с помощью метода цитометрии, непрямой иммунофлуоресценции, лимфотоксического теста. Экспрессию мембранных маркеров на лимфоцитах определяли к следующим детерминантам: СD3+, СD4+, СD8+, СD20+.
Бактерицидное действие фагоцитирующих клеток определялось с помощью теста восстановления нитросинего тетразолия (НСТ-тест), который основан на способности восстановления поглощенного фагоцитом растворимого красителя нитросинего тетразолия в нерастворимый диформазан. Оценивался спонтанный НСТ-тест с интактными полиморфноядерными лейкоцитами, не подвергавшимися воздействию стимуляторов, и стимулированный. Показатели интенсивности НСТ-теста выражали в процентах и условных единицах.
Уровни сывороточных иммуноглобулинов определялись методами иммунопреципитации в геле по Mancini et al. (1970), в основе которого используется радиальная иммунодиффузия в геле, содержащем моноспецифические сыворотки против иммуноглобулинов G, A, M. Уровни иммуноглобулинов рассчитывали после построения калибровочной кривой, выражающей зависимость между уровнем иммуноглобулинов и диаметром колец преципитации и выражали в мг/мл.
Циркулирующие иммунные комплексы (ЦИК) в крови исследовали методом спектрофотометрии сыворотки крови, обработанной полиэтиленгликолем (Белокриницкий Д.В., 1987).
Организационная и методическая помощь при проведении некоторых этапов исследования оказывалась нейроиммунологом з.д.н. РФ, проф. О.А. Васильевой.
3. Статистическая обработка материала. Для определения достоверности различий результатов использовали t-критерий Стьюдента для парных связанных и непарных выборок (Большев Л.Н., Смирнов Н.В., 1983). Для выявления связей между параметрами проводили корреляционный анализ. Достоверность различий при изучении качественных показателей определяли с помощью F-критерия Фишера (Плохинский Н.А., 1970). Различие считали достоверным при p<0,05. F-критерий и хи-квадрат для таблиц сопряженности признаков, -преобразователь Фишера, корреляционный, факторный, дисперсионный и дискриминантный анализ (Лакин Г.Ф., 1990). Метод хи-квадрата, где определяли для всех пар таблицы сопряженности признаков и строили нулевую гипотезу о независимости переменных, показывает вероятность сопряженности исследуемых параметров, основанную на различном распределении лиц с данным признаком в сравниваемых группах.
Для выявления взаимосвязи между исследуемыми показателями данные обрабатывались также с использованием линейного корреляционного анализа. При представлении данных на гистограммах и в таблицах, если это не оговорено особо, использовался 95 %-ный доверительный интервал (р<0,05) для среднего значения показателей выборки (Xср2 mx). Значимость корреляционных связей исследуемых параметров определялась значениями коэффициента корреляции r от 0,4 до 1,0 при достоверности уровня (Р) не выше 0,05. Обработка данных осуществлялась с помощью пакета прикладных программ «Statistica» 5,0 (Бобриков В.П., 1998) и Microsoft Excel 2000 для статистической обработки в среде Windows.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для дебюта заболевания большинства больных эпилепсией, отягощенной энцефалопатией, характерна полиэтиологичность (выявлена у 57,1 % пациентов). Ведущими инициирующими заболевание факторами были черепно-мозговые травмы (31,6 %), нейроинфекции и другие инфекционные заболевания (63,2 %), очаги хронической инфекции выявлены (29,5 %). Отягощенный эпилепсией наследственный анамнез выявлен у 6,1 % больных эпилепсией. 72 % больных эпилепсией были рождены в первых родах, причем у 34 человек (34,6 %) этой группы были диагностированы клинические варианты пре – и перинатальной энцефалопатии. Фебрильные судороги отмечены у 11,2 % у больных эпилепсией.
В группе больных эпилепсией ведущей жалобой было наличие припадков, на втором месте - головных болей (63,3 %), нарушений сна (47,9 %), снижения когнитивных функций (36,7 %) и аффективной неустойчивости (29,6 %).
Неврологический статус обследованных характеризовался наличием рассеянной, неярко выраженной, органической микросимптоматики: нарушением черепно–мозговой иннервации (у 16,5 % больных), легкой пирамидной недостаточностью (у 19,6 %), чувствительных расстройств (5,1 %), нарушением координации (11,2 %) в виде легкого мозжечкового (8,2 %) и экстрапирамидного синдромов (3,1 %), вегетативной дисфункцией (вегетативно-сосудистой недостаточностью и дистонией, вегетативно-висцеральными кризами) – у 52 %, нарушением высших мозговых функций в виде когнитивного дефицита различной степени выраженности (84,6 %), нарушением аффекта (32,3 %).
Для психического статуса больных эпилепсией характерны нарушения психики органического характера (эпилептического, аффективного, шизоидного и других), проявлявшиеся соответствующими поведенческими, эмоционально-волевыми, интеллектуально–мнестическими личностными нарушениями: ослаблением памяти (у 50 % обследованных), медлительностью (42,8 %), снижением интеллекта (47,9 %), обстоятельностью (32,6 %), вязкостью (42,8 %), склонностью к детализации (11,2 %), многоречивостью (8,1 %), конкретностью мышления (12,2 %), тенденцией к снижению настроения вплоть до уровня депрессии (12,2 %), ипохондричностью (7,1 %), снижением критики к своему состоянию (11,2 %).
При обзорной краниографии была у 45,2 % больных эпилепсией были выявлены признаки внутричерепной гипертензии в виде усиления пальцевых вдавлений в костях свода, уплощения дна передней черепной ямки, усиления сосудистого рисунка, вен диплоического вещества, кальцификатов - обызвествления шишковидной железы, falx cerebri, у одного пациента была обнаружена остеома лобной кости.
У 92,8 % обследованных методом транскраниальной допплерографии больных эпилепсией зарегистрированы функциональные нарушения церебральной гемодинамики в виде дистонии по гипотоническому типу (35,7 %), гипертоническому (30,9 %), смешанному (26,2 %) типам. Признаки венозной дисциркуляции и нарушения венозного оттока из полости черепа обнаружены у 45,2 %.
Сравнительный анализ МРТ–картины пациентов исследуемых групп позволил выявить ряд отличительных особенностей у больных эпилепсией по сравнению с контрольными группами. У них достоверно чаще отмечались аномалии развития головного мозга (Денди–Уокера, Арнольда–Киари, дисгенезии, сосудистые мальформации), ликворной системы (Mega cisterna magna, Cavum Vergae) - у 17,3 % против 7,9 % у пациентов с РЭПС и 3,6 % - с РЭ, очаговые изменения (у 24,4 %, 15,6 % и 7,2 %, соответственно). Поражение гиппокампа отмечено у 15,3 % больных эпилепсией (у 7,1 % - атрофического характера, у 8,2 % - в виде глиоза). У 2,1 % больных из группы РЭПС также выявлен глиоз гиппокампа, у пациентов с РЭ изменений гиппокампа не выявлено.
Наружная гидроцефалия в виде атрофических изменений коры головного мозга, расширения субарахноидальных ликворных пространств, отсутствия четкой демаркации между серым и белым веществом головного мозга и мозжечка отмечена у 80,6 % больных эпилепсией, 77,1 % пациентов с РЭПС и у 59,1 % - РЭ. Внутренняя гидроцефалия в виде расширения тел и рогов боковых, третьего и четвертого желудочков, цистерн основания головного мозга выявлена у 64,2 % (в том числе боковых желудочков - у 41,8 %) больных эпилепсией, у 40,6 % (27,1 %) пациентов с РЭПС и у 19,1 % (13,6 %) - РЭ.
У больных резистентной эпилепсией, в сравнении с курабельной формой заболевания, отмечены более выраженные патологические морфологические изменения головного мозга: внутренняя гидроцефалия была обнаружена у 89,3 % (против 41 % с контролируемой эпилепсией), причем в первом случае преобладала гидроцефалия умеренной и выраженной степени (57,4 % и 8,5 %), во втором - незначительной и средней степени (19,6 % и 9,8 % соответственно), атрофические изменения субарахноидальных пространств - у 93,6 % и 68,6 %, очаговые изменения головного мозга – у 34,0 % и 15,7 %, аномалии развития – у 21,2 и 13,7 % , изменения гиппокампа - у 8,5 и 1,9 % соответственно.
Диффузные нарушения биоэлектрической активности (БЭА) различной степени выраженности, свидетельствующие о неустойчивости функционального состояния коры головного мозга, были зафиксированы у всех больных эпилепсией. На фоне этих изменений регистрировались очаговые нарушения БЭА в правом полушарии у 42,8 %, в левом – 44,9 % или в обоих полушариях – у 12,2 %. В 74,5 % наблюдений локальные изменения были распределены в височной и прилегающих к ней областях. У 96,9 % были обнаружены пароксизмоподобные и пароксизмальные изменения, включая наличие специфической эпилептиформной активности. В спонтанной записи эти феномены отмечались у 35,7 %, при функциональных нагрузках (гипервентиляции, фотостимуляции) – у 61,2 %. Совпадение очаговых нарушений ЭЭГ с фокусом пароксизмальных изменений обнаружено у большинства больных эпилепсией – у 80 человек (81,6 %). Пароксизмальная активность чаще выявлялась в фоновой записи у больных с плохо контролируемыми припадками (в 53,2 % случаев), по сравнению с хорошо курабельными (19,6 %), процент выявления ПА повышался при проведении функциональных проб при ЭЭГ – исследовании до 74,5 %. Локализация очаговых и пароксизмальных изменений по полушариям в двух группах практически не отличалась. При резистентной эпилепсии также чаще встречались мультифокальность (42,5 % и 7,8 %) и вторичная билатеральная синхронизация (ВБС) патологических изменений ЭЭГ (80,8 % и 45,1 %).
В фоновой записи ПА не выявлялась у 79,1 % и 32,3 % пациентов из групп с РЭ И РЭПС, регистрировалась в фоне - у 7,3 % и 25,0 %, при ФН – у 13,6 % и 42,7 %, соответственно. Cовпадение органических ЭЭГ – изменений с очагами пароксизмальной активности отмечено у 69,5 % пациентов из группы с РЭ и 75,4 % – РЭПС.
У 96,9 % больных эпилепсией были обнаружены различные нейроспецифические антигены (НАГ), в группе пациентов с РЭПС - 90,7 %, РЭ - 76,4 %. Сравниваемые группы значительно различались по количеству и составу выявленных у пациентов НАГ: для больных с РЭ и РЭПС была характерна моно– и олигосенсибилизация, в то время как у больных эпилепсией чаще выявлялась олиго- и полисенсибилизация к нейроантигенам. НАГ-«негативными» оказались только 3,1 % больных эпилепсией, 9,3 % - с РЭ и 23,6 % - РЭПС. Один НАГ обнаружен у 43,8 % больных эпилепсией, 47,2 % - РЭПС, 48,9 % - РЭ; два НАГ определялись у 32,6 %, 30,2 % и 14,5; три - у 15,3 %, 9,3% и 9,1 %; все четыре исследуемых НАГ – у 5,1 %, 2,1 и 1,8 %, соответственно (рис. 1).
Выявлены различия в подгруппах больных с различными вариантами течения эпилепсии по количеству НАГ - позитивных пациентов: у пациентов с хорошим контролем приступов отмечалась менее выраженная аутонейросенсибилизация: у 3,9 % больных они не обнаруживались совсем, а у большинства (50,9 %) – только один НАГ. Соответствующие показатели в группе с резистентной эпилепсией составили 2,1 % и 36,2 %. Два НАГ обнаружены у 29,4 % и 36,2 %, три – у 13,4 % и 17,0 %, четыре - у 1,9 % и 8,5 %, соответственно. Таким образом, для группы пациентов с резистентной эпилепсией характерно наличие полинейросенсибилизации.
У большинства пациентов всех групп посредством постановки реакции торможения гемагглютинации иммуноцитов в присутствии нейроспецифических антигенов (РТАЛ) был выявлен белок S – 100: 89,4 % - в группе больных эпилепсией, что в 1,5 – 2,2 раза превышало показатели контрольных групп (41,9 % - при РЭ; 59,7 % - РЭПС). К ОБМ было сенсибилизировано 47 % больных. Наиболее частой комбинацией НАГ было сочетание ОБМ с другим маркером нейроглии - белком S-100 и ядерным НАГ Gal-C-I (по 60,8 %), реже – с мембранозным белком (17,3 %).
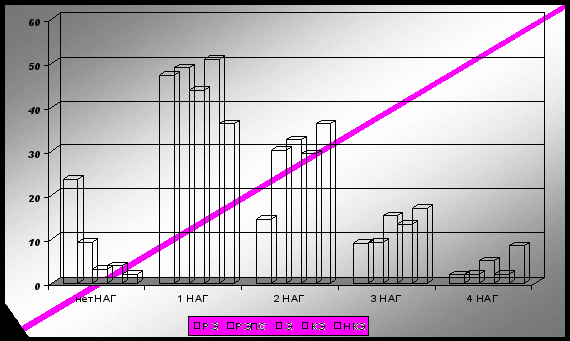
Рис. 1. Процентное распределение пациентов сравниваемых групп по количеству выявленных у них нейроантигенов
Примечание: РЭ – группа больных с резидуальными органическими заболеваниями головного мозга; РЭПС - группа больных с резидуальными органическими заболеваниями головного мозга и пароксизмальными состояниями неэпилептической природы; Э - группа больных эпилепсией; КЭ – подгруппа больных контролируемой эпилепсией; НКЭ – подгруппа больных неконтролируемой эпилепсией.
Полученные результаты свидетельствуют о наличии деструктивного процесса в ЦНС при эпилепсии, при этом преимущественно страдает нейроглиальное звено, отвечающее за проведение нервного импульса и трофику нейронов. ОБМ выявлен у 46,3 % больных эпилепсией, Gal-С-I - у 41,0 %, что в 1,2 - 1,5 раза превышало аналогичные значения в группах РЭ и РЭПС: 17,6 %, 25,9 % и 33,7 %, 27,0 %, соответственно. Однако соотношение сенсибилизированных пациентов к мембранозному белку было обратным: наибольшее количество НАГ-«позитивных» отмечалось в группах РЭ и РЭПС (16,2 % и 16,8 %), а в группе больных эпилепсией - только 9,5 %.
Таким образом, полученные данные свидетельствуют о том, что при эпилепсии в патогенетический механизм болезни вовлекается, преимущественно, нейроглиальное звено, и выраженность аутоиммунных нарушений максимальна при резистентной форме этого заболевания: белок S–100 выявлялся у 86,0 % и 93,3 %, ОБМ – у 30 % и 47,5 %, Gal-С-I – у 32,0 % и 51,1 % обследуемых в сравниваемых подгруппах, соответственно. Мембранозный антиген несколько чаще определялся при курабельной форме эпилепсии: у 10,0 % пациентов с КЭ против 8,9 % с РЭ.
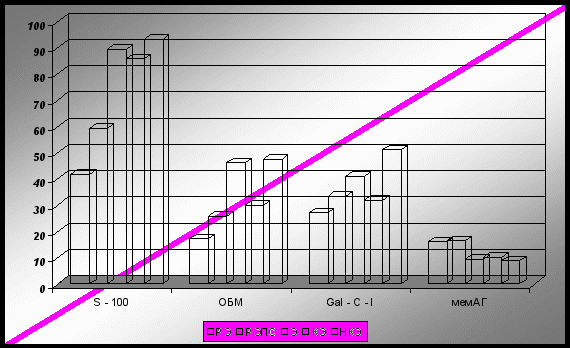
Рис. 2. Нейроантигенный «пейзаж» у больных эпилепсией и групп сравнения (в %)
У больных эпилепсией определялись более высокие показатели ИАЛ для всех НАГ (0,66-0,71), что является доказательством наличия аутоиммунного деструктивного процесса в ЦНС с нарушением проницаемости ГЭБ и несостоятельностью НАГ-элиминирующих механизмов. Наибольшая сенсибилизация отмечена к белку S–100 (0,61-0,68) и ОБМ (0,65-0,69) и Gal–C-I (0,64-0,70) – структурным элементам и маркерам нейроглии, что свидетельствует о значительном повреждении белого вещества.
Таблица 1.
Сенсибилизация лимфоцитов к различным нейроантигенам (индекс адгезии) у больных эпилепсией и группах сравнения (M ± m)
| НАГ | РЭ | РЭПС | Э | КЭ | НКЭ |
| S–100 | 0,78 ± 0,04 | 0,72 ±0,02 | 0,66 ±0,02 | 0,68 ± 0,07 | 0,61 ± 0,09 |
| МемАГ | 0,76 ± 0,07 | 0,74 ± 0,05 | 0,71 ±0,01 | 0,73 ± 0,01 | 0,68 ± 0,03 |
| Gal–C-I | 0,75 ± 0,02 | 0,73 ± 0,03 | 0,69 ±0,02 | 0,70 ± 0,02 | 0,64 ± 0,07 |
| ОБМ | 0,77 ± 0,03 | 0,75 ± 0,02 | 0,68 ± 0,02 | 0,69 ± 0,02 | 0,65 ± 0,03 |
Примечание: p < 0,05 при сравнении показателей у больных эпилепсией с контрольной группой.
Выявлены различия показателей ИАЛ в подгруппах больных эпилепсией: у пациентов с малокурабельными формами эпилепсии определяется более высокий уровень сенсибилизации лимфоцитов к НАГ, что отражает большую напряженность аутоиммуных процессов и недостаточность - санирующих. Средние значения индекса адгезии лимфоцитов (ИАЛ) в присутствии всех изучаемых нейроспецифических антигенов, указанные в таблице 1, в группах пациентов с РЭ и РЭПС находились в пределах нижней границы нормы (0,72-0,78), что свидетельствует о компенсированном или субкомпенсированном процессе элиминации НАГ из организма.
У больных эпилепсией отмечается количественный дефицит циркулирующих в периферической крови общего пула Т-лимфоцитов (CD3+). Установлен факт наличия дефицита Т-хелперов (CD4+), являющихся лимфокин - секретирующими клетками, а также снижение количества Т-супрессоров/киллеров (CD8+-лимфоцитов). Настоящие изменения приводили к количественному сдвигу иммунорегуляторного индекса (CD4+/CD8+) в сторону снижения, прежде всего за счет субпопуляции лимфоцитов класса CD4+. Проявления дисфункции особенно выражены при резистентной ее форме, для которой характерны снижение цитолитической активности естественных киллеров и уменьшение их количества, изменение функции Т-лимфоцитов (CD3+, CD4+, CD8+) и В–лимфоцитов. Для пациентов с резистентной эпилепсией были характерны наиболее низкие показатели общих лимфоцитов CD3+ (45,75±9,7), их субпопуляций CD4+ и CD8+ (25,06±8,44 и 20,87±4,76 %, соответственно), иммунорегуляторного индекса (1,23±0,43), снижение показателей фагоцитоза: значения базального и стимулированного НСТ–теста и их резервного коэффициента в группе РЭ примерно на 25 % ниже аналогичных показателей в группе КЭ, что свидетельствует об угнетении цитолитических функций Т–звена иммунитета в условиях нарушения проницаемости ГЭБ и полинейросенсибилизации. Содержание В-лимфоцитов в группе больных резистентной эпилепсией также было снижено (17,85±2,45 при КЭ и 17,16±0,93 – НКЭ), при этом отмечалась некоторая фазность процесса: увеличение количества иммуноглобулинов сывороточного спектра в группе больных с курабельной эпилепсией, снижение их количества в группе больных с резистентной эпилепсией: показатели IgA равны 2,23±1,33 и 1,51±1,16, IgG - 12,82±4,02 и 10,77±3,61, IgM - 1,46±1,01 и 1,35±0,67, соответственно. Эти закономерности, по-видимому, отражают стадии иммунной защиты в условиях нейроантигенной стимуляции: реактивную и гипореактивную, когда истощаются защитные функции, при этом увеличивается количество ЦИК при НКЭ, которые составили 0,088 ± 0,036 у. е. в сравнении с 0,069±0,062 у. е. - при КЭ.
В группе пациентов курабельной эпилепсией установлены значимые отрицательные корреляции между В-лимфоцитами и показателями фагоцитоза: CD20+ и НСТ–стимулированным (r=- 0,66); CD20 + и РК НСТ–теста (r=-0,61), что, в условиях угнетения фагоцитарной функции, свидетельствует об активации гуморального звена (коэффициент корреляции между CD20+ и IgG составляет 0,42). Положительная корреляция между количеством плазматических клеток и IgG могут быть проявлением аутосенсибизации, т. к. к классу IgG относятся белки антител, ответственные за реакции иммунного ответа замедленного типа. Сильная отрицательная корреляционная зависимость отмечена между ИРИ/CD8+ (r=-0,82), положительная - между РК НСТ-теста и IgG (r=0,73), CD20+ и НСТ–стимулированным (r=-0,66). Эти данные отражают ситуацию, когда при недостаточности клеточно-фагоцитарного звена активизируется гуморальное. В группе пациентов резистентной эпилепсией корреляции иммунных показателей несколько отличаются от группы больных с курабельной эпилепсией: усиливается дисбаланс между общим количеством лимфоцитов и их субпопуляциями – Т-хелперами и Т-супрессорами (коэффициент корреляции между CD3+ и CD4+ равен 0,87; между CD3+ и CD8+ равен 0,44, CD4+ и ИРИ – 0,7; CD3+/ИРИ – 0,55). Прослеживается положительная корреляция между содержанием цитотоксических лимфоцитов и иммуноглобулинов класса G и А (r=0,58 и r=0,51, соответственно), что свидетельствует о сопряженности как клеточного, так и гуморального звеньев иммунитета в условиях полинейросенсибилизации.
При сравнительной оценке иммунного статуса больных эпилепсией и контрольных групп выявляется ряд закономерностей: углубление Т- и В- клеточного дефицита в первой группе в сравнении с группами РЭ и РЭПС. Содержание общего количества зрелых Т-лимфоцитов составило 61,33±7,70, 57,46±7,45 и 49,42±14,65 %, соответственно. Отмечается изменение нормального соотношения субпопуляций лимфоцитов СD4+/СD8+ во всех группах, а также нарастание дисбаланса между субпопуляциями Т–клеток в группах РЭ и РЭПС и Э. Количество Т-хелперов класса СD4+ в группе эпилепсии составило 28,69±9,67, содержание цитотоксических лимфоцитов СD8+ было равно 21,56±6,19, иммунорегуляторный индекс (ИРИ) - 1,36±0,56. Соответствующие показатели СD4+ в группе РЭ и РЭПС составили 36,67±9,11 и 34,46±7,54 %, СD8+ - 23,12±6,09 % и 22,11±5,91 %; ИРИ - 1,79±1,48 и 1,68±0,71.
Таблица 2.
Иммунный статус групп больных эпилепсией и групп сравнения
(M ± m)
| Иммунные параметры | РЭ | РЭПС | Э | КЭ | НКЭ |
| СD3+, % | 61,33 ± 7,70 | 57,46 ± 7,45 | 49,42 ± 14,65* | 54,94 ± 11,31 | 45,75 ± 9,7* |
| СD4+, % | 36,67 ± 9,11 | 34,46 ± 7,54 | 28,69 ± 9,67* | 30,27 ± 8,11 | 25,06 ± 8,44* |
| СD8+, % | 23,12 ± 6,09 | 22,11 ± 5,91 | 21,56 ± 6,19 | 22,87 ± 8,56 | 20,87 ± 4,76 |
| ИРИ | 1,70 ± 1,48 | 1,68 ± 0,71 | 1,36 ± 0,56* | 1,44 ± 0,79* | 1,23 ± 0,43* |
| НСТ баз., % | 23,87 ± 17,11 | 20,69 ± 16,46 | 18,81 ± 12,79* | 25,75 ± 19,89 | 15,48 ±13,61* |
| НСТ стим., % | 55,83 ± 20,98 | 45,21 ± 22,66 | 34,17 ± 25,21* | 39,37 ± 34,27* | 32,75± 23,02* |
| РК НСТ-теста | 3,17 ± 2,16 | 2,45 ± 2,33 | 1,86 ± 1,46* | 1,56 ± 0,96* | 1,95 ± 1,88* |
| СD20+, % | 18,52 ± 3,99 | 17,96 ± 3,01 | 17,56 ± 1,63 | 17,85 ± 2,45 | 17,16 ± 1,93 |
| IgA, Г/л | 2,49 ± 2,04 | 2,03 ± 0,86 | 1,81 ± 1,61* | 2,23 ± 1,33 | 1,51 ± 1,16* |
| IgG, % | 11,47 ± 7,43 | 11,35 ± 5,91 | 10,83 ± 5,23 | 12,82 ± 4,02 | 10,77 ± 3,61 |
| IgM, % | 1,29 ± 0,87 | 1,21 ± 0,79 | 1,34 ± 0,79 | 1,46 ± 1,01 | 1,35 ± 0,67 |
| ЦИК, у.е. | 0,059 ± 0,028 | 0,068 ± 0,055 | 0,075 ± 0,048 | 0,069 ± 0,062 | 0,088 ± 0,036* |
Примечание: * - р <0,05 в сравнении с контрольной группой.
Функциональная активность лимфоцитов, оцениваемая посредством теста восстановления нитросинего тетразолия (НСТ-тест) нейтрофильными лейкоцитами, была снижена у больных всех групп. У больных эпилепсией зафиксировано значительное ослабление внутриклеточного метаболизма лимфоцитов: показатели фагоцитарной функции лимфоцитов у них были достоверно меньше: резервный коэффициент НСТ-теста был в 1,3-1,7 раза ниже аналогичных показателей в группах РЭ и РЭПС за счет уменьшения как базального НСТ–теста, значения которого составили 18,81±12,79 %; 20,69±16,46 и 23,87±17,11 %; так и стимулированного (34,17±25,21; 45,21±22,66 и 55,83±20,98 %, соответственно).
Угнетение фагоцитоза может быть обусловлено первичным дефектом или глубокой перестройкой аппарата фагоцитирующих клеток под влиянием различных сывороточных факторов, в роли которых могут выступать антигены, антитела, иммунные комплексы, продукты нарушения клеточного метаболизма и обменных процессов.
Иммунологические нарушения являются фоном для развития ряда патологических состояний, что подтверждается наличием приведенных ниже клинических иммунопатологических синдромов (Табл. 3).
Таблица 3.
Встречаемость иммунопатологических синдромов у больных эпилепсией и групп сравнения (абс.ч. и %)
| ИПС | РЭ | РЭПС | Э | КЭ | НКЭ |
| 1. Инфекционный синдром 1.1. ЛОР 1.2. БЛС 1.3 ЖКТ 1.4. МВС 1.5. рецидивир. ОРВИ | 53 (48,2) 12 (10,9) 9 (8,18) 11 (10,0) 2 (0,2) 19 (17,3) | 65 (67,7) 23 (23,9) 8 (8,3) 9 (9,3) 3 (3,1) 22 (22,9) | 79 (80,6) 35 (35,7) 13 (13,2) 24 (24,5) 7 (7,1) 34 (34,6) | 35 (68,6) 11 (21,5) 4 (7,8) 6 (11,7) 1 (1,9) 14 (27,4) | 44 (93,6) 24 (51,1) 9 (19,1) 18 (38,2) 6 (12,7) 20 (42,5) |
| 2. Аутоиммунный синдром 2.1. аллергический 2.2. эндокринопатии | 11 (10,0) 7 (6, 4) 4 (3,6) | 25 (26,0) 15 (15,6) 10 (10,4) | 43 (43,8) 25 (25,5) 18(18,4) | 17 (33,3) 9 (17,6) 8 (15,6) | 26 (55,3) 16 (34,0) 10 (21,2) |
| 3. Сочетание ИПС | 29 (26,3) | 49 (51,0) | 74 (75,5) | 31 (60,7) | 43 (91,4) |
Примечание: ЛОР - заболевания ЛОР - органов, БЛС - заболевания бронхолегочной системы, МВС - заболевания мочевыделительной системы.
Установлено, что ведущим иммунопатологическим синдромом у больных всех групп является инфекционный синдром, проявляющийся частыми ОРВИ, хроническими воспалительными заболеваниями ЛОР-органов, рецидивирующей герпетической инфекцией, хроническими заболеваниями мочевыводящих путей и прочими. Инфекционный синдром диагностирован у 80,6 % больных эпилепсией (68,6 % - при КЭ и 93,6 % - НКЭ), у 48,2 % пациентов с РЭ, у 67,7 % - с РЭПС. Аутоиммунный синдром отмечен у 43,8 % больных эпилепсией (33,3 % и 55,3 % - в подгруппах с КЭ и НКЭ, соответственно), у 10,0 % пациентов с РЭ и 26,0 % - РЭПС. Аллергический синдром выявлен у четверти больных эпилепсией (25,5 %), чаще наблюдался при НКЭ (34 %), отмечен только у 17,6 % больных с КЭ. В группе с РЭ он выявлялся у 6,4 %, РЭПС - 15,6 %. Клиническим проявлением аллергического синдрома были атопический дерматит, поллинозы, пищевая, лекарственная и другие виды аллергии в виде крапивницы, в редких случа-ях - отеков Квинке. Достаточно часто у больных эпилепсией аутоиммунный синдром проявлялся эндокринопатиями, они отмечены у 18,4 % пациентов (15,6 % при КЭ и 21,2 % - НКЭ).
В структуре эндокринопатий на первом месте находятся заболевания щитовидной железы (аутоиммунный тиреоидит Хашимото, диффузное или очаговое поражение щитовидной железы с эутиреозом или нарушением функции), затем – нарушение продукции половых гормонов, проявляющееся у женщин нарушением менструального цикла и репродуктивной функции, гипер- и гипопролактинемией, у мужчин – нарушениями половой функции; нарушение углеводного обмена (снижение толерантности к глюкозе, сахарный диабет). В группах пациентов с РЭ и РЭПС эндокринные нарушения выявлены у 3,6 % и 10,4 % , соответственно. У большинства больных отмечалось сочетание ИПС инфекционного синдрома и АИС (26,3 % - при РЭ, 51,0 % - РЭПС, 75,5 % - Э, 60,7 % - КЭ, 91,4 % - НКЭ).
Разработаны принципы иммунотерапии (ИТ) больных эпилепсией с нарушенной функцией иммунной системы, в основу которых положены принципы индивидуальности и комплексности с учетом патогенетических особенностей развития заболевания.
При проведении комплексной ИТ больным с нарушенной функцией иммунной системы основополагающими на всех этапах лечения иммунокорректорами являлись следующие положения: 1) постановка достоверного клинического диагноза и определение характера иммунной патологии с обязательным учетом сопутствующих заболеваний, применение традиционных базисных фармакологических средств, в частности антиэпилептических препаратов, проводилось в комплексе со специализи-рованной патогенетической иммунокоррекцией; 2) индивидуальный подбор иммунотропных препаратов в зависимости от степени иммунных нарушений, причем, стартовый препарат определялся врачом в соответствии с выявленными дефектами в системе иммунитета. Для больных с длительно протекающими и часто рецидивирующими иммунопатологическими процессами использовалось несколько иммуномодуляторов, имеющих различные клетки - мишени в иммунной системе; 3) последовательность и дозированность медикаментозной и немедикаментозной терапии. Оптимальным считалось сочетанное применение методов и сочетание препаратов, обладающих одной направленностью, но имеющих различные механизмы действия; 4) пролонгированность и цикличность проведения курсов иммунокоррекционных мероприятий. Количество циклов определяется степенью иммунных нарушений; 5) сроки начала иммунокоррекции - с момента установления иммунной патологии.
Тактика ИТ предусматривала использование совокупности средств и методов, направленных на достижение главной цели - восстановление нарушенных функций иммунной системы и, следовательно, улучшение здоровья и качества жизни больного. Применялись две стратегии иммунокоррекции - экстраиммунная и специфическая иммунная терапии, каждая из которых была дифференцированной, рациональной, последовательной и дозированной, не превышающей адаптационные способности больного. Задачей экстраиммунной терапии было восстановление иммунной системы опосредованно. Она была направлена на снижение напряжения адаптационных и биохимических механизмов в организме за счет выведения вредных веществ и введения компонентов, необходимых для его нормального функционирования за счет снижения антигенной нагрузки на организм, выведения антигенов-аллергенов из организма, санации очагов хронической инфекции, неспецифической десенсибилизации, применения витаминов и микроэлементов, адаптогенов и биостимуляторов, восстановления функции желудочно-кишечного тракта. Задачей специфической иммунной терапии было воздействие на пораженные звенья иммунитета.
Таблица 4.
Динамика иммунных показателей у больных эпилепсией в сравнении с пациентами с резидуально-органическими заболеваниями головного мозга в процессе иммунотерапии
| Иммунные параметры | До лечения | После ИК | РЭ |
| СD3+, % | 49,42 ± 14,65 | 56,82 ± 7,58* | 61,33 ± 7,70 |
| СD4+, % | 28,69 ± 9,67 | 31,3 ± 4,67 | 36,67 ± 9,11 |
| СD8+, % | 21,56 ± 6,19 | 22,64 ± 5,69 | 23,12 ± 6,09 |
| ИРИ (СD4+/СD8+) | 1,36 ± 0,56 | 1,56 ± 0,93 | 2,29 ± 1,71 |
| НСТ баз., % | 18,81 ± 12,79 | 22,94 ± 17,43* | 23,87 ± 17,11 |
| НСТ стим., % | 34,17 ± 25,21 | 47,89 ± 26,51* | 55,83 ± 20,98 |
| РК НСТ-теста | 1,86 ± 1,46 | 2,28 ± 1,75* | 3,17 ± 2,16 |
| СD20+, % | 17,56 ± 1,63 | 18,6 ± 1,78 | 18,52 ± 3,99 |
| IgA, Г/л | 1,81 ± 1,61 | 1,79 ± 0,84 | 2,49 ± 2,04 |
| IgG, % | 10,83 ± 5,23 | 10,93 ± 2,65 | 11,47 ± 7,43 |
| IgM, % | 1,34 ± 0,79 | 1,7 ± 0,24 | 1,29± 0,87 |
| ЦИК, у.е. | 0,075 ± 0,048 | 0,066 ± 0,049 | 0,059 ± 0,028 |
Примечание: * p < 0,05 при сравнении иммунных показателей больных эпилепсией до и после иммунотерапии
В Табл. 4 отражена динамика иммунных показателей у больных эпилепсией в процессе иммунокоррекционных мероприятий. Отмечены отчетливые положительные сдвиги в виде увеличения числа общих лимфоцитов и их субпопуляций – Т-хелперов и Т-супрессоров, при этом показатель ИРИ достигает нижней границы нормы, более состоятельным становится фагоцитоз: увеличиваются значения базального и стимулированного НСТ–теста, РК НСТ–теста достигает значения 2,28±1,75. Активируется В-звено: увеличивается количество плазмоцитов, сывороточных иммуноглобулинов А, G, М. За счет проведения специфической десенсибилизации и гемосорбции, восстановления нормального функционирования иммунного статуса содержание нейроантигенов у большинства НАГ–«позитивных» пациентов в периферической крови достигает нормальных пределов (0,7-1,33), либо титр выявленных НАГ значительно снижается.
Отмечена положительная динамика клинических параметров до и после иммунокоррекции у больных эпилепсией, оцениваемых в баллах по шкалам NHS-3 и CGI: тяжесть припадков уменьшилась с 14,25±3,61 баллов до 7,94±2,98, что свидетельствует о снижении тяжелых и осложненных припадков, суммарный балл по шкале общего клинического впечатления составил 4,09±1,73 и 2,54 ± 1,36, соответственно, то есть сместился из диапазона умеренных и выраженных расстройств в область легких и умеренных.
Таблица 5.
Динамика клинических показателей у больных эпилепсией и пациентов с резидуально-органическими заболеваниями головного мозга с пароксизмальными состояниями в процессе иммунотерапии (в баллах)
| Группы сравнения | NHS-3-1 | NHS-3-2 | CGI-1 | CGI-2 |
| Э | 14,25 ± 3,61 | 7,94 ± 2,98* | 4,09 ± 1,73 | 2,54 ± 1,36* |
| НКЭ | 17,75 ± 3,07 | 9,27 ± 1,54* | 6,20 ± 1,04 | 3,46 ± 1,18* |
| КЭ | 8,87 ± 0,78 | 6,23 ± 1,82 | 3,91 ± 1,22 | 2,07 ± 0,95 |
| РЭПС | - | - | 2,71 ± 1,33 | 1,83 ± 1,48 |
Примечание: NHS-3-1 – оценка тяжести эпилептических припадков до иммунотерапии (ИТ), NHS-3– 2- после ИТ; CGI-1 - оценка общего клинического впечатления до ИТ; CGI–2 - после ИТ; *р < 0,05 сравниваемых показателей до и после ИТ.
Особенно выраженной положительная динамика этих показателей была в группе больных с НКЭ (Табл. 5). В результате оптимизации терапии иммунокорректорами удалось получить полный контроль припадков у 68 человек (69,4 %), у 18 человек (18,4 %) достичь 75 % редукции числа припадков, у 10 (10,2 %) – 50 % , только у 2 больных (2,0 %) – менее 50 %. Показатели CGI в группе пациентов с РЭПС были равны 2,71±1,33 и 1,83±1,48, что также отражает разную степень выраженности улучшения состояния больных. Применение иммунокоррекции позволило редуцировать клинические проявления иммунопатологических синдромов, сделать больных доступными для медикаментозного лечения базовыми препаратами вследствие улучшения их переносимости.
ЗАКЛЮЧЕНИЕ
Полученные результаты исследования свидетельствуют о том, что у больных эпилепсией, отягощенной энцефалопатией, имеется иммунологический дисбаланс, проявляющийся клиническими синдромами вторичной иммунной недостаточности и лабораторными синдромами ИДС с преимущественной недостаточностью клеточного звена и фагоцитарной функции лейкоцитов с явлениями аутосенсибилизации к мозговым нейроантигенам. В иммунной системе больных эпилепсией наблюдаются как количественные, так и функциональные нарушения. Проявления дисфункции выражаются в иммуносупрессии популяций и субпопуляций Т-лимфоцитов, утрате свойственного норме баланса между Т-хелперами и Т-супрессорами, нарушении их количественного соотношения, снижении цитолитической активности естественных киллеров, угнетении функциональной активности сегментоядерных нейтрофилов и В-лимфоцитов в виде гипоиммуноглобулинемии G, М и A. Анализ корреляционных взаимосвязей параметров иммунной системы больных эпилепсией показал наличие плеяды достоверных связей между иммунологическими параметрами, утрату свойственного норме баланса между Т-хелперами и Т-супрессорами, содержанием IgА, IgG и IgM. Наиболее существенным результатом является своеобразие дефекта в системе естественной цитотоксичности на фоне гиперсенсибилизации к нейроантигенам, что влечет за собой ряд эффектов, способствующих срыву аутотолерантности и развитию аллергических и аутоиммунных клинических проявлений. Выявлено своеобразие нейроантигенного пейзажа при эпилепсии, установлено, что в деструктивный процесс вовлекается, преимущественно, нейроглиальное звено, ответственное за миелинизацию и проведение нервного импульса.
При сравнении значений корреляции иммунных показателей в группах больных с курабельной и резистентной формами эпилепсии обращает внимание усиление зависимости между показателями Т-клеточного звена (субпопуляциями Т-лимфоцитов, ИРИ, РК НСТ-теста) и показателями гуморального - CD20+, IgА у больных с резистентной формой заболевания. Положительная корреляционная связь между содержанием цитотоксических лимфоцитов и IgG, отрицательная – между ИРИ, НСТ-базальным характерна только для этой группы пациентов, что свидетельствует о том, что у них усиливается гуморальный ответ, который может быть отражением не только процессов физиологической защиты, но и аутоагрессии.
Следует отметить наличие определенной динамики ряда иммунных показателей в подгруппах больных с различными вариантами течения: большая депрессия всех параметров в группе больных с резистентной эпилепсией, в то время как у пациентов с контролируемой эпилепсией отмечались более высокие, по отношению к параметрам общей группы больных эпилепсией, показатели субпопуляций Т-клеток и фагоцитоза, СD20+, увеличение количества иммуноглобулинов сывороточного спектра IgA, IgG и IgM, при этом ряд данных в этой подгруппе сравним с аналогичными в группах РЭ и РЭПС (СD3+, СD8+, СD20+, IgA). Полученные результаты и выявленная навигация параметров, по – видимому, отражают фазы иммунной защиты в условиях чрезмерной нейроантигенной стимуляции: реактивную, направленную на восстановление гомеостаза, и гипореактивную, свидетельствующую об истощении защитных механизмов.
Клинически данные иммунопатологические синдромы характеризуются наличием синдрома вторичной иммунной недостаточности (ВИН) и аутоиммунных синдромов, которые усиливают тяжесть клинических проявлений основного заболевания, снижают эффективность базисной терапии, приводят к возникновению лекарственно резистентных форм заболевания.
В результате иммунокоррекции было достигнуто уменьшение клинических признаков ИДС: снижение частоты и выраженности рецидивов инфекционно - аллергических проявлений; нормализация или улучшение исходно измененных лабораторных показателей иммунитета; преодоление терапевтической резистентности у больных, повышение эффективности лечения основными препаратами (в частности, АЭП) и улучшение контроля припадков у больных эпилепсией, а также, в ряде случаев, снижение доз АЭП и переход на меньшее количество АЭП.
Таким образом, представляется патогенетически обоснованным использование иммунокоррекции у больных эпилепсией с клинико-лабораторными признаками иммунного дисбаланса.
