Г. Р. Хасанова общая характеристика работы
| Вид материала | Автореферат диссертации |
- Содержание лекций Модели местного самоуправления в России Местное самоуправление:, 786.51kb.
- Общая характеристика работы актуальность работы, 336.09kb.
- Общая характеристика работы актуальность работы, 236.99kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Задачи физического воспитания детей дошкольного возраста. Общая характеристика средств, 34.6kb.
- Реферат по курсу: экология на тему: Общая характеристика экосистем, как, 726.64kb.
- Научная работа студентов, 2153.55kb.
- Научная работа студентов, 2114.42kb.
- Общая характеристика работы актуальность работы, 487.01kb.
Таблица 7
Показатели антибактериальных Ig G к кишечной микрофлоре в сыворотке крови детей
с гастродуоденальной патологией (мкг/мл)
| Диагноз | № | IgG к представителям кишечной микрофлоры | |||||||
| E.coli | Ps.aeruginosa | Pr.mirabilis | Bifidobacterium spp. | Bacteroides fragilis | Klebsiella pneumoniae | Candida albicans | S.aureus | ||
| Поверхностный гастродуоденит n=76 | 1 | 22,57 | 12,21 | 23,84 | 5,82 | 2,91 | 37,97 | 80,79 | 29,05 |
| (10,63-38,43) | (4,32-31,1) | (7,89-66,21) | (2,91-9,8) | (0,58-5,82) | (17,25-79,72) | (11,62-209,8) | (11,6-78,31) | ||
| Гипертрофический гастродуоденит n=48 | 2 | 29,66 | 15,00 | 26,29 | 8,62 | 2,91 | 62,21 | 123,94 | 37,09 |
| (9,38-62,39) | (5,98-33,74) | (10,17-67,64) | (5,52-19,17) | (0,58-9,01) | (28,14-21,61) | (49,21-14,16) | (15,75-23,82) | ||
| Эрозивный гастродуоденит n=55 | 3 | 33,80 | 16,31 | 16,25 | 5,82 | 2,18 | 42,69 | 57,78 | 34,45 |
| (12,96-65,24) | (7,78-39,45) | (6,12-32,82) | (2,91-13,69) | (0,58-5,82) | (15,95-72,42) | (16,97-257,6) | (10,72-14,27) | ||
| ЯБДПК | | 26,00 | 19,51 | 27,22 | 11,42 | 1,54 | 44,43 | 78,16 | 68,12 |
| n=31 | 4 | (11,04-88,02) | (9,05-35,53) | (5,82-54,29) | (7,18-31,87) | (0,29-6,03) | (13,8-295,06) | (26,49-18,67) | (7,03-179,02) |
| Контроль | | 12,87 | 12,37 | 19,30 | 3,57 | 0,00 | 37,47 | 22,41 | 18,75 |
| n=20 | к | (8,1-21,39) | (5,03-38,61) | (9,23-28,16) | (1,81-7,95) | (0-2,99) | (18,98-84,11) | (8,4-34,72) | (9,93-32,58) |
| p1-k | | 0,08 | 0,708 | 0,325 | 0,187 | 0,007 | 0,819 | 0,007 | 0,049 |
| p2-k | | 0,018 | 0,624 | 0,104 | 0,016 | 0,004 | 0,159 | 0 | 0,027 |
| p3-k | | 0,001 | 0,191 | 0,715 | 0,04 | 0,039 | 0,161 | 0,007 | 0,042 |
| p4-k | | 0,02 | 0,307 | 0,418 | 0,002 | 0,138 | 0,817 | 0,001 | 0,086 |
| p1-3 | | 0,052 | 0,08 | 0,379 | 0,446 | 0,291 | 0,352 | 0,745 | 0,787 |
| p1-4 | | 0,22 | 0,034 | 0,997 | 0,005 | 0,306 | 0,7 | 0,188 | 0,53 |
| p2-3 | | 0,534 | 0,618 | 0,096 | 0,286 | 0,145 | 0,997 | 0,074 | 0,614 |
| p2-4 | | 0,778 | 0,252 | 0,459 | 0,121 | 0,186 | 0,756 | 0,7 | 0,941 |
| p1-2 | | 0,231 | 0,219 | 0,344 | 0,116 | 0,6 | 0,128 | 0,039 | 0,404 |
| p3-4 | | 0,621 | 0,899 | 0,851 | 0,035 | 0,834 | 0,513 | 0,501 | 0,97 |
Следует отметить, что у детей с хронической гастродуоденальной патологией, независимо от глубины поражения слизистой, было обнаружено статистически значимое повышение титра антител всех трех классов к Candida albicans относительно группы контроля. Обращает на себя внимание наиболее высокие показатели IgM у больных с эрозивным и язвенным поражением слизистой желудка и ДПК по сравнению с неэрозивными формами гастродуоденита. Полученные результаты свидетельствуют о важной роли дрожжеподобных грибов рода Candida в развитии деструктивных форм ГДП, что может быть связано c высокой агрессивностью, обусловленной наличием ферментов патогенности (уреаза, каталаза, гемолизин и др.) и цитотоксичностью грибов рода Candida.
Важным представляется факт обнаружения достоверно высоких показателей IgM и IgG к антигенам индигенной микрофлоры - Bifidobacterium spp. и Bacteroides fragilis, причем ЯБДПК характеризовалась наибольшей концентрацией IgG к бифидобактериям. Высокие титры антител к облигатной микрофлоре у больных с ГДП, особенно при ЯБДПК, рассматриваются как неблагоприятный фактор, поскольку в условиях дисбактериоза, индигенные микроорганизмы могут проявлять патогенные свойства. Повышенные титры антител к бифидобактериям расцениваются некоторыми исследователями как маркер дисбактериоза кишечника (Аниховская И.А. и соавт., 2005).
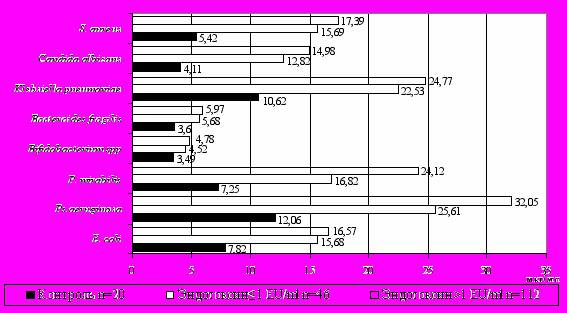
При исследовании напряженности антибактериального иммунитета в зависимости от уровня эндотоксина, у детей с концентрацией эндотоксина более 1 EU/ml отмечались достоверно высокие показатели Ig M ко всем изучаемым микроорганизмам относительно контрольной группы в отличие от детей с физиологической эндотоксинемией (рис. 1).
*
*
*
*
*
*
*
*
*
*
*- p<0,05 при сравнении с контрольной группой
Рисунок 1. Показатели сывороточных IgM к кишечной микрофлоре у детей с гастродуоденальной патологией в зависимости от уровня эндотоксина в сыворотке крови
Увеличение продукции антител при повышении уровня системной эндотоксинемии может являться как отражением снижения барьерных функций слизистых ЖКТ и транслокации антигенов соответствующих микроорганизмов в системный кровоток, так и следствием поликлональной активации под действием эндотоксина, что подтверждается результатами корреляционного анализа, показавшего параллельное изменение содержания антиэндотоксиновых и антибактериальных антител в сыворотке крови.
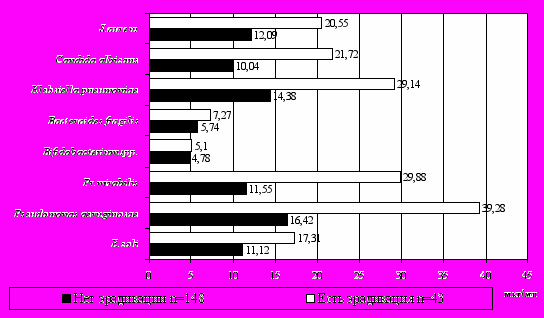
Высокие показатели антител к кишечной микрофлоре, обнаруженные у детей с хронической гастродуоденальной патологией могут быть обусловлены проведенной эрадикационной терапией и применением антимикробных препаратов. По данным анамнеза 90% обследованных больных неоднократно принимали антимикробные препараты, из них 22% детей проводилась эрадикационная терапия. Впервые установлено статистически значимое повышение титра IgM к большинству УПМ кишечника (E.coli, Ps.aeruginosa, Proteus mirabilis, Candida albicans, S.aureus, Streptococcus spp.), IgG к E.coli и Klebsiella pneumoniae у детей с эрадикацией H.p. в анамнезе по сравнению с детьми без таковой (рис. 2).
*
*
*
*
*
*- p<0,05
Рисунок 2. Показатели сывороточных антиэндотоксиновых и антибактериальных Ig M у детей с гастродуоденальной патологией в зависимости от
наличия эрадикации H.pylori в анамнезе
Полученные результаты, скорее всего, связаны с ростом УПМ на фоне угнетения индигенной микрофлоры при применении антибиотиков и антисекреторных препаратов. Вызванная ими дестабилизация микробиоценозов часто характеризуется сдвигом в сторону грамнегативных бактерий, являющихся устойчивыми ко многим антибиотикам широкого спектра действия. Высокие показатели преимущественно IgM характеризуют стойкие изменения микробиоценоза ЖКТ.
Микрофлора кишечника и гепатобилиарная система являются основными системами, во взаимодействии которых осуществляются процессы детоксикации организма. Нарушение взаимодействия этих систем инициирует функциональные и структурные изменения в них. Дисмоторика желчного пузыря и протоков, развитие на этом фоне воспалительного процесса способствуют застою, сгущению и изменениям физико-коллоидных свойств желчи, снижающих ее бактерицидность. Снижение желчеоттока приводит к нарушению процессов пищеварения и дискинезии толстой кишки, которые обусловливают формирование дисбактериоза. В связи с этим, представляло интерес изучение маркеров микроэкологических нарушений у детей с ГДП в зависимости от формы билиарной патологии.
Следует отметить, что у 90% детей, имеющих ЖКБ, наряду с поверхностным гастродуоденитом, регистрировались выраженные изменения состава микрофлоры толстой кишки, соответствующие II-Ш степени дисбактериоза. Установлено, что у данных больных общая Ig-расщепляющая активность – 12,48 (9,98-12,73) мгIg/час/г кала была достоверно выше показателей детей с дисфункцией билиарного тракта - 9,63 (9-10,33) мгIg/час/г кала (p<0,05). Выявлена взаимосвязь между уровнями общей Ig-расщепляющей активности, активности тиоловых протеиназ и характером содержимого желчного пузыря, что указывает на повышение активности Ig- расщепляющих ферментов по мере усугубления коллоидальной нестабильности желчи (r=0,476, p<0,01; r=0,415, р<0,05). При ЖКБ установлены сильные корреляционные связи между уровнем общей Ig-расщепляющей активности копрофильтратов и содержанием лактобактерий (r=-0,739, p=0,023) и атипичных штаммов E.coli: лактозонегативных (r=0,733, p=0,025) и гемолизирующих (r=0,711, p=0,032) в кишечном содержимом.
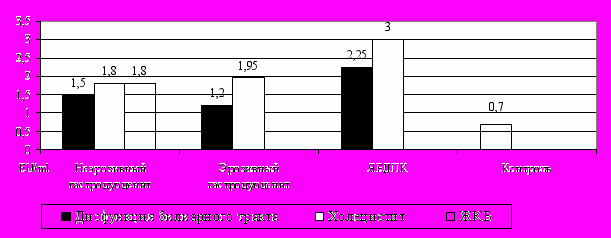
Показано, что у детей, имеющих воспалительные заболевания желчного пузыря – хронический холецистит и ЖКБ – выявлялись достоверно высокие уровни эндотоксина в сыворотке крови относительно контрольной группы (p<0,05). У детей с дисфункцией билиарного тракта показатели эндотоксина не превышали физиологических значений (p>0,05) (рис. 3).
*
*
*
*
*- p<0,05 при сравнении с контрольной группой
Рисунок 3. Содержание эндотоксина в сыворотке крови детей с гастродуоденальными заболеваниями в зависимости от формы билиарной
патологии
Высокие уровни эндотоксина в сыворотке крови детей с билиарным «сладжем»- негомогенным содержимым (1,8 (1,2-2,93) EU/ml, р=0,01) и осадком (1,5 (0,9-3) EU/ml, р=0,009), конкрементами (1,8 (1,18-2,24) EU/ml, р=0,01) по сравнению с контролем, а также обнаруженная корреляционная связь между концентрацией эндотоксина и содержимым желчного пузыря (r=0,3, р=0,01) свидетельствуют о важной роли желчеобразования и желчевыделения в механизмах элиминации эндотоксина из кровотока.
Важным представляется факт, что уровень эндотоксина у больных ЖКБ коррелировал со степенью дисбактериоза кишечника (r=0,748, p=0,013) и содержанием бифидобактерий (r=-0,69, p=0,027).
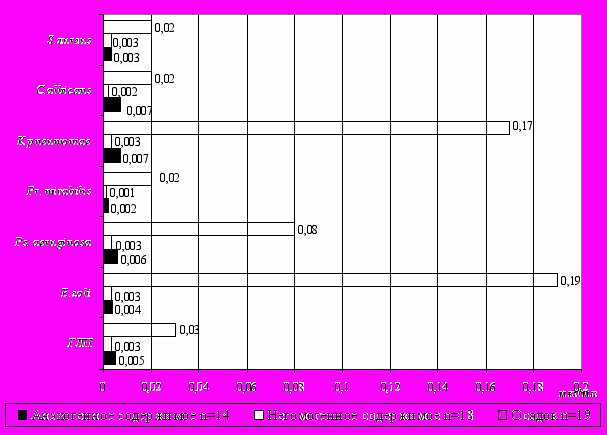
Нарушение симбиоза, изменение микрофлоры и повреждение слизистой оболочки желчного пузыря обусловливает появление антибактериальных антител, способных перекрестно реагировать с антигенами тканей желчного пузыря. При изучении показателей местного антиэндотоксинового и антибактериального иммунитета в дуоденальном секрете (порции В и С) 51 ребенка с неэрозивными формами хронического гастродуоденита выявлены достоверно высокие уровни IgA к эндотоксину и некоторым УПМ (E.coli, Pseudomonas aeruginosa, Proteus mirabilis, Candida albicans, Staphylococcus аureus) у детей с осадком в желчном пузыре относительно детей с анэхогенным содержимым и эхогенной взвесью (рис. 4).
*
*
*
*
*
*
*
*
*
*- p<0,05 по отношению к группе с осадком в желчном пузыре
Рисунок 4. Содержание антиэндотоксиновых и антибактериальных IgA в порции В дуоденального секрета у детей с гастродуоденальной патологией в зависимости от содержимого желчного пузыря
Установленные сильные корреляционные взаимосвязи между содержанием IgA к ГЛП (r=0,78, p<0,05), Pr. mirabilis (r=0,732, p<0,05), S. аureus (r=0,72, p<0,05) в порции В дуоденального секрета и степенью дисбактериоза кишечника, а также между концентрацией IgA к S.aureus и его ростом в толстой кишке (r=0,714, p<0,05) указывают на непосредственное отношение кишечной микрофлоры к формированию и поддержанию активности местного иммунитета. Высокий уровень специфических IgA на фоне дисбактериоза кишечника объясняется компенсаторным увеличением дифференцировки плазматических клеток – продуцентов Ig A в ответ на избыточный рост УПМ в толстой кишке.
В ходе проведения корреляционного анализа установлены прямые связи между концентрацией эндотоксина в сыворотке крови и уровнем сериновых протеиназ (r=0,383; p=0,006), а также содержанием антител к отдельным представителям кишечной микрофлоры в сыворотке крови и уровнем Ig-расщепляющих протеиназ копрофильтратов, а именно: активностью сериновых протеиназ и Ig A к ГЛП (r=0,32, p=0,008), Candida albicans(r=0,3, p=0,014) и Streptococcus spp. (r=0,47, p=0,027); Ig G к Bifidobacterium spp. (r=0,37, p=0,006) и Bacteroides fragilis (r=0,27, p=0,042), а также общей Ig - расщепляющей активностью и Ig A к E.coli (r=0,27, p=0,028); активностью тиоловых протеиназ и Ig M к Streptococcus spp. (r=0,56, p=0,007), что свидетельствует о снижении барьерной функции слизистых пищеварительного тракта под влиянием Ig-расщепляющих ферментов, которое приводит к транслокации индигенных и условно-патогенных микроорганизмов и/или их антигенов в системный кровоток. Необходимо подчеркнуть, что с экспрессией сериновых протеаз связывают патогенность грамотрицательных бактерий.
Одним из важных антимикробных механизмов защиты желудочно-кишечного тракта является кислотно-пептический фактор, снижение которого способствует активации мукозной микрофлоры. Снижение кислотопродукции в желудке и, как следствие, уменьшение или исчезновение бактерицидных свойств желудочного сока приводит к массивному поступлению микрофлоры в нижележащие отделы пищеварительного тракта.
С целью оценки функциональной активности слизистой желудка у детей с хронической ГДП проведено комплексное определение показателей ПГ I, постпрандиального Г-17, а также IgG к H.pylori в сыворотке крови.
Исследование уровня пепсиногена I дает информацию о состоянии желез тела и фундального отдела желудка. Установлено, что уровень пепсиногена I соответствовал норме у 13 детей с поверхностным ХГД (59,1%), 26 больных с гипертрофическим ХГД (70,3%), 18 детей с эрозивным ХГД (72%) и 7 больных ЯБДПК (58,3%), Рχ2=0,98. Следует отметить, что при деструктивных формах ГДП наблюдалась тенденция к росту числа детей с гиперпепсиногенемией (поверхностный ХГД 14%, гипертрофический ХГД 16%, эрозивный ХГД 27%, ЯБДПК 42%), что подтверждалось выявленной прямой корреляционной связью между уровнем пепсиногена I в сыворотке крови и глубиной поражения слизистой оболочки желудка и двенадцатиперстной кишки (r=0,284, p=0,005).
Средние показатели ПГ I у больных с гипертрофическим, эрозивным ХГД и ЯБДПК были достоверно выше, чем у пациентов с поверхностной формой гастродуоденита (р<0,05) (табл. 8). Поскольку концентрация ПГ I в сыворотке крови отражает уровень ферментообразования в теле и фундальном отделе желудка, следовательно, состояние главных клеток желез слизистой желудка в целом, на основании полученных данных можно сделать заключение о наиболее высокой их активности у больных с выраженными воспалительными изменениями.
Низкий уровень ПГ I (<40 мкг/мл) рассматривается как косвенный признак атрофии слизистой тела желудка (Sipponen P. et al., 2002). Концентрации ПГ I ниже нормы в сыворотке крови встречались только у детей с поверхностным (n=6, 27,3%) и гипертрофическим ХГД (n=3, 8,1%), рχ2=0,03.
При оценке распределения детей в зависимости от уровня постпрандиального гастрина-17, нормальные показатели определялись у 12 детей с поверхностным гастродуоденитом (54,5%), 21 больного с гипертрофическим ХГД (56,8%), 18 – с эрозивным ХГД (72%) и 6 детей с ЯБДПК (50%), рχ2=0,98. Гипергастринемия была выявлена у 7 детей с поверхностным ХГД (32%), 10 с гипертрофическим ХГД (37%), 4 больных с эрозивным ХГД (16%) и 2 детей с ЯБДПК (17%).
У 12 (15,4%) детей с ХГД (3 - поверхностный, 6 - гипертрофический, 3- эрозивный ХГД) и 4 (33%) больных ЯБДПК наблюдался низкий уровень постпрандиального гастрина-17, рχ2=0,65. При анализе показателей гастрина-17 в зависимости от формы ГДП статистически значимые различия не были обнаружены (р>0,05). Поскольку постпрандиальный гастрин-17 косвенно свидетельствует о функциональном и морфологическом состоянии антрального отдела желудка, его снижение, при условии инфицирования H.р., который, как известно, поражает преимущественно этот отдел, может расцениваться как признак атрофии антрального отдела.
Таблица 8
Показатели пепсиногена I и постпрандиального гастрина-17 у детей с различными формами гастродуоденальной патологии
| Показатели | Хронический гастродуоденит | ЯБДПК | ||
| Поверхностный | Гипертрофический | Эрозивный | ||
| n=22 | n=37 | n=25 | n=12 | |
| ПГ I, мкг/л | 73,93* | 88,6 | 92,49 | 113 |
| | (59,71-87,22) | (74,85-103,1) | (78-116,1) | (75,48-133,79) |
| Г-17, пмоль/л | 4,11 | 6 | 5,2 | 2 |
| | (2,52-21,63) | (3,55-18) | (2,8-11,2) | (1,23-7,75) |
*р<0,05 при сравнении со всеми группами
Согласно рекомендованному алгоритму диагностики (Di Mario et al., 2004), на основании одновременного определения в сыворотке крови показателей ПГ I, постпрандиального Г-17 и антител к Н.pylori были выделены 4 следующие группы.
1 группу составили 42 ребенка (43,7%), которые имели нормальные показатели ПГ I и постпрандиального Г-17, из них у 34 детей определялись диагностические титры антиНРIgG.
Во 2 группу - группу риска по развитию язвенной болезни - вошло 29 больных (27,1%) с высокими показателями ПГ I и постпрандиального Г-17, так как избыточное высвобождение гастрина в ответ на стимуляцию, наряду с повышенным содержанием пепсиногена I в сыворотке крови, также является генетическим фактором, обусловливающим наследственное предрасположение к язвенной болезни.
16 детей (16,6%) с низким уровнем постпрандиального Г-17 в сочетании с диагностическими титрами IgG к H.pylori составили 3 группу с предполагаемой атрофией слизистой антрального отдела желудка.
В 4 группу с предполагаемой атрофией слизистой тела желудка вошли 9 больных (9,4%) со сниженным уровнем ПГ I.
При сопоставлении результатов комплексного определения пепсиногена I, постпрандиального гастрина-17 и титров антиНРIgG с данными морфологического исследования атрофия антрального отдела желудка была подтверждена гистологически у 7 детей 11 обследованных (63,6%). Предполагаемая атрофия тела желудка не подтвердилась при гистологическом исследовании ни у одного ребенка, в связи с чем, сниженный уровень пепсиногена I у данных детей расценивался как показатель снижения функциональной активности главных клеток, а не как маркер атрофических изменений в слизистой тела желудка.
Установлено, что дети с высоким уровнем постпрандиального гастрина-17 имели более низкую активность Ig-расщепляющих тиоловых ферментов в копрофильтратах (5,39 (2,95-7,63) мгIg/час/г кала) по сравнению с больными с нормальным или сниженным уровнем гастрина-17 (8,31 (5,03-9,36) мгIg/час/г кала), р=0,02, что подтверждалось выявленной обратной корреляционной связью между данными показателями (r=-0,53, р<0,001). Полученные результаты позволяют предположить микроэкологические нарушения у детей с низкими значениями постпрандиального гастрина-17. Высокая активность тиоловых ферментов, в свою очередь, может свидетельствовать о сниженном кислотном потенциале желудка, что должно учитываться в диагностике и тактике лечения больных с гастродуоденальной патологией.
Впервые у детей с хроническими гастродуоденальными заболеваниями получены данные, касающиеся комплексного исследования важнейших характеристик функционального состояния слизистой желудка и напряженности антиэндотоксинового и антибактериального иммунитета.
Установлено, что при снижении уровня постпрандиального Г-17 в сыворотке крови, свидетельствующего об атрофии слизистой антрального отдела желудка, наблюдается рост титра суммарных антиэндотоксиновых (r=0,38, p=0,006) и антибактериальных антител к отдельным условно-патогенным микроорганизмам (Proteus mirabilis, S. аureus), что связано с уменьшением количества выделяемой соляной кислоты, которая препятствует размножению патогенной и условно-патогенной микрофлоры в желудке (табл. 9).
Таблица 9
Показатели суммарных антител к кишечной микрофлоре у детей с гастродуоденальной патологией в зависимости от уровня постпрандиального гастрина-17 (мкг/мл)
| Суммарные антитела | Уровень постпрандиального гастрина-17 | p | ||
| Гастрин-17↓ n=7 | Гастрин-17 N n=31 | Гастрин-17↑ n=15 | ||
| 1 | 2 | 3 | ||
| ГЛП | 5,15 | 6,56 | 6,76 | p1-2-3=0,38 |
| | (4,13-5,99) | (4,71-8,76) | (4,94-8,81) | |
| E.coli | 3,5 | 4,45 | 4,93 | p1-2-3=0,87 |
| | (3,11-7,86) | (3,42-7,19) | (3,69-6,75) | |
| Ps. aeruginosa | 6,09 | 5,2 | 7,48 | p1-2-3=0,4 |
| | (4,64-7) | (4,2-7,26) | (5,68-9,01) | |
| Pr.mirabilis | 6,26 | 2,23 | 3,03 | p1-2-3=0,01 |
| | (3,38-7,16) | (1,67-3,5) | (2,66-3,8) | p1-2=0,01 |
| S.aureus | 9,79 | 7 | 7,98 | p1-2-3=0,08 |
| | (8,92-10,93) | (5,84-8,8) | (6,19-10,61) | p1-2=0,03 |
| Streptococcus spp. | 5,15 | 5,74 | 5,61 | p1-2-3=0,22 |
| | (4,15-5,44) | (4,76-7,73) | (4,45-6,74) | |
| Klebsiella pneumoniae | 27,69 | 23,7 | 24,59 | p1-2-3=0,98 |
| (21,41-38,58) | (18,77-41,47) | (21,45-30,53) | | |
| Candida albicans | 7,68 | 8,38 | 7,89 | p1-2-3=0,63 |
| | (6,27-12,15) | (5,25-12,02) | (5,13-9,72) | |
| Bacteroides fragilis | 1,95 | 2,25 | 2,25 | p1-2-3=0,24 |
| | (1,67-2,19) | (1,89-2,75) | (1,93-2,93) | |
| Bifidobacterium spp. | 2,09 | 2,45 | 2,27 | p1-2-3=0,23 |
| (1,17-2,3) | (1,82-3,35) | (1,78-2,68) | | |
В зависимости от уровня пепсиногенемии, достоверно различались показатели суммарных антител к Proteus mirabilis, E.coli и Bifidobacterium spp.. Установлены достоверно высокие уровни антибактериальных антител как при сниженной концентрации пепсиногена I (E.coli, Bifidobacterium spp.), так и при гиперпепсиногенемии (Proteus mirabilis) по сравнению с детьми с нормальным содержанием пепсиногена I в сыворотке крови (табл. 10). Кроме того, обнаружена прямая корреляционная связь между показателями пепсиногена I и содержанием антител к Proteus mirabilis: (r=0,31, р=0,023).
Сравнительный анализ содержания суммарных антибактериальных антител в зависимости от функционального состояния слизистой желудка по результатам GastroPanel показал, что у детей с хронической ГДП на фоне изменений секреторного потенциала, косвенно свидетельствующих об атрофии или риске развития деструктивных поражений слизистой гастродуоденальной зоны, наблюдается высокая напряженность антибактериального иммунитета к представителям кишечной микрофлоры по сравнению с детьми с нормальным функциональным состоянием (табл. 11).
Таблица 10
Показатели суммарных антител к кишечной микрофлоре у детей с гастродуоденальной патологией в зависимости от уровня пепсиногена I (мкг/мл)
| Суммарные антитела | Уровень пепсиногена I | p | ||
| Пепсиноген I↓ n=7 | Пепсиноген I N n=35 | Пепсиноген I ↑ n=11 | ||
| 1 | 2 | 3 | ||
| ГЛП | 7,13 | 6,12 | 7,63 | p1-2-3=0,43 |
| | (3,43-7,97) | (4,44-8,05) | (5,23-9,62) | |
| E.coli | 7 | 3,78 | 5,79 | p1-2-3=0,05 |
| | (5,43-11,21) | (3,41-6,52) | (3,43-7,15) | p1-2=0,02 |
| Ps. aeruginosa | 4,07 | 6,24 | 6,09 | p1-2-3=0,21 |
| | (4,03-4,42) | (4,53-9,92) | (4,31-7,58) | |
| Pr.mirabilis | 2,37 | 2,48 | 3,88 | p1-2-3=0,01 |
| | (1,76-4,41) | (1,89-3,46) | (3,23-6,87) | p2-3=0,002 |
| S.aureus | 7,41 | 7,16 | 9,79 | p1-2-3=0,27 |
| | (6,15-10,24) | (5,8-9,23) | (6,76-10,88) | |
| Streptococcus spp. | 5,87 | 5,46 | 5,61 | p1-2-3=0,8 |
| | (5,09-8,31) | (4,45-6,82) | (4,58-6,61) | |
| Klebsiella pneumoniae | 37,71 | 25,44 | 24,59 | p1-2-3=0,48 |
| (21,53-46,93) | (18,3-33,16) | (21,45-43,29) | | |
| Candida albicans | 8,38 | 8,84 | 5,92 | p1-2-3=0,82 |
| | (5,57-9,31) | (5,23-12,02) | (5,12-9,78) | |
| Bacteroides fragilis | 2,83 | 2,15 | 2,25 | p1-2-3=0,14 |
| | (2,82-3,19) | (1,86-2,58) | (1,9-2,47) | |
| Bifidobacterium spp. | 2,48 | 2,36 | 2,1 | p1-2-3=0,03 |
| (2,33-6,8) | (1,68-3,35) | (1,89-2,56) | p1-2=0,04 | |
Таблица 11
Показатели суммарных антител к кишечной микрофлоре у детей с гастродуоденальной патологией в зависимости от функционального состояния слизистой оболочки желудка (мкг/мл)*
| Суммарные антитела | Группа по результатам GastroPanel | p | |||
| Группа 1 | Группа 2 | Группа 3 | Группа 4 | ||
| n=23 | n=16 | n=7 | n=7 | ||
| 1 | 2 | 3 | 4 | ||
| E.coli | 3,69 | 5,28 | 3,5 | 7 | p1-4=0,023 |
| | (3,14-6,42) | (3,72-6,27) | (3,11-7,86) | (5,43-11,21) | |
| S.aureus | 6,49 | 8,64 | 9,79 | 7,41 | p1-2=0,04 |
| | (5,8-7,96) | (6,3-10,78) | (8,92-10,93) | (6,15-10,24) | p1-3=0,007 |
| Bacteroides fragilis | 2,1 | 2,34 | 1,95 | 2,83 | p3-4=0,029 |
| (1,58-2,51) | (2,23-2,7) | (1,67-2,19) | (2,82-3,19) | p2-3=0,025 | |
| Proteus mirabilis | 2,21 | 3,17 | 6,26 | 2,37 | p1-3=0,003 |
| (1,67-3,03) | (2,74-3,76) | (3,38-7,16) | (1,76-4,41) | p1-2=0,012 | |
* в таблице представлены только данные с достоверными различиями
Примечание: группа 1 - ПГ I и Г-17 N, IgG к Н.р.N/↑; группа 2 - ПГ I ↑, Г-17 ↑, IgG к Н.р.N/↑
группа 3 – Г-17↓, IgG к Н.р ↑; группа 4 –ПГ I ↓, IgG к Н.р.N/↑.
Полученные результаты свидетельствуют о развитии микроэкологических нарушений в пищеварительном тракте, которые, в свою очередь, оказывают неблагоприятное влияние на функции желудка, тем самым отягощая течение и способствуя хронизации гастродуоденальной патологии, что подтверждает теоретические данные Уголева А.М. (1991) о возможной активации ацидопептической агрессии и усиления интрагастрального протеолиза вследствие избытка экзогенного гистамина, возникающего при развитии дисбактериоза кишечника.
Особую актуальность в детской гастроэнтерологии имеет решение задач прогнозирования течения и исхода гастродуоденальных заболеваний у детей и подростков. Результаты исследований показали, что неоднократные госпитализации в рамках диспансерного наблюдения и применение инвазивных методов диагностики, таких как эзофагогастродуоденоскопия, а также использование современных схем лечения не позволяют предотвратить развитие и рецидивирование деструктивных поражений слизистой эзофагогастродуоденальной зоны.
В результате динамического наблюдения за 112 детьми с различными формами гастродуоденальной патологии сроком от 1 до 5 лет были получены следующие данные. У детей с неэрозивными гастродуоденитами (n=58) в 78% случаев (n=45) отмечена положительная динамика с отсутствием клинической симптоматики и минимальными эндоскопическими изменениями слизистой гастродуоденальной зоны. У 13 больных (22%) динамика была отрицательной – в 3-х случаях был диагностирован рефлюкс-эзофагит II степени, наряду с выраженным распространенным гастродуоденитом, у 7 детей – эрозивный гастродуоденит и у 3-х больных впервые была диагностирована язвенная болезнь двенадцатиперстной кишки. У детей с эрозивным гастродуоденитом (n=33) в 60% случаев (n=20) наблюдалась положительная динамика - у этих детей при повторном эндоскопическом исследовании в рамках диспансерного наблюдения выявлялись признаки поверхностного гастродуоденита. Отрицательная динамика отмечена у 13 детей (40%) и выражалась в форме рецидива эрозивного гастродуоденита или возникновения эрозий в желудке/двенадцатиперстной кишке в 9 случаях и формированием язвенной болезни двенадцатиперстной кишки у 4 больных с эрозиями в ДПК.
В отличие от детей с хроническими гастродуоденитами, только у трети детей с язвенной болезнью двенадцатиперстной кишки (6 из 21) наблюдалась положительная клиническая и эндоскопическая динамика. У большинства больных (n=15, 71%) заболевание приобрело рецидивирующее течение, с ежегодными обострениями, сопровождающимися развитием эрозий в желудке/двенадцатиперстной кишке, а в одном случае – язвы желудка.
С помощью метода пошаговой логистической регрессии разработаны математические модели, в которые вошли наиболее значимые показатели, по которым можно судить о риске развития эрозивных и язвенных поражений слизистой гастродуоденальной зоны (табл. 12, 13).
Таблица 12
Показатели математической модели прогноза гастродуоденальной
патологии (1)
| Показатели | Коэффициенты регрессии | ст. ошибки | p |
| Пепсиноген 1, мкг/л | 0,05 | 0,00 | 0,03 |
| Группа по GastroPanel* | -2,24 | 1,20 | 0,02 |
| Количество проведенных эрадикаций Н.р. | 1,96 | 0,63 | 0,01 |
| Уровень суммарных антител к Candida albicans в сыворотке крови, мкг/мл | 0,22 | 0,01 | 0,02 |
| Константа | -4,78 | 4,77 | 0,01 |
*Примечание: группа 1 - ПГ I и Г-17 N, IgG к Н.р.N/↑; группа 2 - ПГ I ↑, Г-17 ↑, IgG к Н.р.N/↑
группа 3 – Г-17↓, IgG к Н.р ↑; группа 4 –ПГ I ,IgG к Н.р.N/↑.
Формула для подсчета математической модели (1) имеет следующий вид:
1/(1+exp(-((Пепсиноген 1)*0,05-(Группа по GastroPanel)*2,24+(Количество проведенных эрадикаций)*1,96+(Суммарные антитела к Candida albicans в сыворотке крови, мкг/мл)*0,22-4,78)).
Математическая модель (1) обладает прогностической способностью 93%, Sp модели составила – 83%, Se - 82%, PPV – 64%, PNV – 92% при пороговом значении 0,25.
Таблица 13
Показатели математической модели прогноза гастродуоденальной
патологии (2)
| Показатели | Коэффициент регрессии | ст. ошибки | р |
| Ig M к ГЛП, мкг/мл | -0,08 | 0,001 | 0,01 |
| Ig M к S. aureus, мкг/мл | 0,05 | 0,0004 | 0,015 |
| Пол (ж=0, м=1) | 2,31 | 0,765 | 0,004 |
| Количество проведенных эрадикаций Н.р. | 1,06 | 0,125 | 0,001 |
| Константа | -2,99 | 0,781 | 0,0004 |
Формула для подсчета математической модели (2) имеет следующий вид:
1/(1+exp(-((Ig M S. aureus)*0,05- (Ig M ГЛП) *0,08 +(Пол) *2,31 + (Количество проведенных эрадикаций) *1,06-2,99)).
Математическая модель (2) обладает предсказательной способностью 89%, Sp модели составила – 79%, Se - 84%, PPV – 69%, PNV – 90% при пороговом значении 0,36.
Дифференцированный подход к назначению препаратов с пробиотической функцией для коррекции дисбактериоза у детей с гастродуоденальной патологией является перспективным направлением, так как позволяет не только восстанавливать микробиоценоз слизистых желудочно-кишечного тракта, но и воздействовать на этиологический фактор заболевания, как непосредственно, так и опосредованно через стимуляцию факторов местной иммунной защиты.
Для профилактики и коррекции микроэкологических нарушений у детей с хронической гастродуоденальной патологией применялись синбиотики («Ферросан А/С», Дания) - биологически активный комплекс «Бифиформ® Малыш» представляющий комбинацию Lactobacillus GG, Bifidobacterium lactis, витаминов В1 и В6 и «Бифиформ Комплекс», содержащий Lactobacillus rhamnosus GG, Lactobacillus acidophilus, Bifidobacterium lactis и инулин. «Бифиформ Комплекс» применялся у детей старше 12 лет. В зависимости от проводимого лечения дети с ГДП были разделены на две клинические группы – основную, в комплекс лечения которой был включен синбиотик («Бифиформ® Малыш» - 29 детей, из них 20 - с ХГД, 9 – с ЯБДПК; «Бифиформ Комплекс» - 34 ребенка с ХГД) и группу сравнения (n=60, среди них 53 ребенка с ХГД, 7 – с ЯБДПК). Все дети получали терапию, согласно общепринятым стандартам лечения гастродуоденальной и билиарной патологии. В основной группе на 2 день пребывания в стационаре в комплекс традиционной терапии назначался синбиотик в возрастной дозировке курсом 10 дней. Оценка эффективности синбиотиков проводилась на основании изучения динамики клинической симптоматики, исследования кала на дисбактериоз, определения активности Ig-расщепляющих ферментов в копрофильтратах и показателей эндотоксина, антиэндотоксиновых и антибактериальных антител в сыворотке крови.
Установлено, что у детей с неэрозивными гастродуоденитами на фоне приема синбиотиков, наряду с положительной клинической и лабораторной динамикой по данным микробиологического анализа кала (рост бифидобактерий и типичных эшерихий), статистически значимо снизилась общая Ig-расщепляющая активность с 9,56 мгIg/час/г кала до 8,45 мгIg/час/г кала и активность тиоловых ферментов с 7,41 мгIg/час/г кала до 5 мгIg/час/г кала, p<0,05). Полученные результаты позволяют использовать метод определения Ig-расщепляющей активности копрофильтратов не только в качестве диагностики дисбиоза кишечника, но и для мониторинга его состояния после проведенной терапии.
Отмечено отчетливое положительное влияние синбиотических комплексов на напряженность антиэндотоксинового иммунитета у детей с ХГД, выражающееся достоверным увеличением уровня антиэндотоксиновых IgA с 0,019 мкг/мл до 0,022 мкг/мл и IgM с 7,37 мкг/мл до 10,55 мкг/мл, р<0,05. Данные изменения носят адаптивный характер, препятствуя избыточному поступлению эндотоксина в системный кровоток. В группе сравнения статистически значимых различий изучаемых показателей не наблюдалось.
Таким образом, применение синбиотиков в комплексной терапии детей с хроническими гастродуоденитами существенно повышает эффективность лечения, что подтверждено как клиническими результатами, так и выявленными положительными сдвигами со стороны маркеров микроэкологического состояния желудочно-кишечного тракта.
Совокупность полученных данных позволила разработать теоретические положения и выдвинуть концепцию о роли системных изменений микроэкологии желудочно-кишечного тракта, сопровождающихся эндотоксиновой агрессией и высокой напряжённостью антиэндотоксинового и антибактериального иммунитета, в патогенетической цепи развития хронической гастродуоденальной патологии у детей и определить нарушения, на коррекцию которых должны быть направлены дополнения в стандартную схему терапии, и в первую очередь на восстановление защитного барьера слизистой пищеварительного тракта и предупреждение поступления избыточных количеств бактериальных антигенов, в том числе эндотоксина в системный кровоток (схема 1).
Инфекционный фактор
Лекарственный фактор
Нейро-психические факторы
Алиментарный фактор
Наследственный
фактор





Гастродуоденальная патология
Билиарная патология
Микроэкология ЖКТ
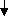
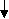

Гастрит
Дуоденит
Дисфункция билиарного тракта
Желчнокаменная болезнь
Хронический холецистит
Язвенная
болезнь ДПК
Язва желудка

Дисбактериоз
Атрофичес-кий гастрит
Антиэндотоксиновая защита
Эндотоксин
Активность Ig-расщепляющих протеиназ





Поликлональная
активация В-клеток
Антибактериальный
иммунитет к кишечной микрофлоре

Схема 1. Этиопатогенетические факторы развития и прогрессирования гастродуоденальной патологии у детей
Специализированное
обследование
Направление в специализированный стационар
