В. В. Шилов Доктор медицинских наук
| Вид материала | Автореферат |
- Лицензированная медсестра, Эрик Ван Вийнгаерден, доктор медицинских наук, Херман Боббаерс,, 1773.58kb.
- Гришина Наталья Владимировна доктор психологических наук, профессор Чермянин Сергей, 1836.72kb.
- «Дагестанская государственная медицинская академия Федерального агентства по здравоохранению, 546.66kb.
- В. О. Бернацкий доктор философских наук, профессор; > А. А. Головин доктор медицинских, 5903.36kb.
- «Российский научный центр восстановительной медицины и курортологии Росздрава», 372.3kb.
- Лазерная фотодинамическая терапия ожоговых ран (экспериментальное исследование) 14., 295.89kb.
- Демидчик Ю. Е. доктор медицинских наук, член-корр. Нанб, профессор, ректор Белмапо,, 970.61kb.
- Халиф Игорь Львович Доктор медицинских наук, профессор Бредихина Наталия Андреевна, 579.47kb.
- Рохлина Майя Леоновна доктор медицинских наук, профессор Игонин Андрей Леонидович доктор, 564.38kb.
- Рецензенты: доктор медицинских наук А. М. Иваницкий, доктор медицинских наук, 4659.36kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Исследование эффективности субстратных антигипоксантов
при их назначении в разные сроки для лечения
острой церебральной недостаточности
Тяжесть состояния больных с острыми отравлениями, находящихся в критическом состоянии, обусловлена специфическим действием яда на нейромедиаторные системы, а также неспецифическими изменениями – гипоксией, эндотоксикозом и иммуносупрессией. Пусковым фактором церебральной недостаточности при острых отравлениях являются специфические механизмы действия ядов, т.е. тяжелых токсические поражения головного мозга с нарушениями его регулирующих функций систем жизнеобеспечения.
Ведущим синдромом острого периода тяжелых отравлений веществами седативно-гипоксического действия являлись синдромы выключения сознания: кома (65%), сопор (22 %), оглушение (11%). В 12% случаев клиничсекая картина определялась доминирование острой психопатологической продуктивной симптоматикой (сумеречные расстройства сознания, инкогерентное помрачение, галлюциноз, делирий). Отмечали сочетание развития комы с резким угнетением дыхания, что клинически проявлялось урежением частоты дыхания и глубины дыхания. В 20,6 % не стабильность показателей центральной гемодинамики обуславливалась их декомпенсацией на нарастающие явления гипоксии. В 21,7% отмечено развитие отека легких, в 24,5 % – отека набухания головного мозга, в 7,4% случаях – развитие аспирационного синдрома, в 4,1 % – синдрома длительного сдавления. Клиническая картина отравлений в группе больных с минимально выраженными метаболическими нарушениями характеризовалась более доброкачественным течением, что проявлялось меньшей длительностью коматозного состояния, более редким развитием вторичных лёгочных осложнений. В результате это обусловило меньшую летальность в данной группе больных (табл. 1).
На фоне лечения у большинства больных с коматозными формами интоксикации намечалась обратная динамика синдромов. В зависимости от характера, выраженности и длительности психических расстройств течение посткоматозного периода было условно разделено на неосложненное и осложненное. При неосложненном течении выход из состояния комы начинался с восстановления дыхания и кровообращения, а затем, восстанавливались зрачковые и корнеальные рефлексы, повышался мышечный тонус, оживлялись сухожильные рефлексы. По мере прояснения сознания формировалось сопорозное состояние, сменявшееся сомноленцией. Выход из комы в 67,8 % случаев был продолжительным и сопровождался разнообразными психическими расстройствами смешанной психопатологической структурой наблюдавшегося синдрома: делириозно-аментивные, аментивно-онирические картины.
Клиническая картина периода резидуальных нарушений может быть разделена на два варианта. В первом случае в периоде восстановления наблюдались астенические расстройства (72 %), а во втором на их фоне определялись отчетливые психоорганические нарушения (28 %).
Исследование влияния цитофлавина на течение церебральной недостаточности было выполнено на двух группах больных, поступивших в отделение реанимации с острыми тяжелыми отравлениями нейротропными ядами. Распределение больных по группам осуществлено следующим образом (табл. 2): в одну группу вошли больные, в интенсивной терапии которых был использован цитофлавин в ранние сроки (88 человек); группу сравнения составили больные, которым цитофлавин применялся на фоне декомпенсированного состояния кислородтранспортных систем (44 больных). Следует отметить, что под «ранним» использованием цитофлавина мы понимаем его применение на фоне сохранности систем транспорта кислорода, то есть при компенсации гипоксии кислородотранспортными системами. «Позднее» использование цитофлавина подразумевает включение препарата в интенсивную терапию на фоне декомпенсации кислородтранспортных систем, что происходит, в основном, на догоспитальном этапе.
Таблица 2
Эффективность цитофлавина в зависимости от срока его включения
в интесивную терапию острых тяжёлых отравлений
| Показатель | «Раннее» применение | «Позднее» применение |
| Время экспозиции яда, ч | 7,8 3,9 | 19,9 3,3 |
| Длительность коматозного состояния, ч | 29,7 5,9 | 47,3 5,2* |
| Частота развития пневмонии, абс. (%) | 24 ( 27) | 31 ( 71) |
| Длительность пребывания в ОРИТ, ч | 65,3 8,1 | 118,5 15,4* |
| Летальность, абс. (%) | 8 (9) | 13 (30) |
Примечание: * – различия параметров между группами достоверны (p<0.05).
При «раннем» включении цитофлавина в терапию церебральной недостаточности при острых тяжелых отравлениях нейротропными ядами наблюдается сокращение длительности коматозного состояния на 40 %, снижение количества осложнений (в частности, пневмонии) на 44 %, времени нахождения в отделении реанимации на 45 %. Иная картина складывалась при использовании цитофлавина на фоне выраженных нарушений системы транспорта кислорода: не сокращалась длительность коматозного состояния, оставалась высокой частота развития вторичных лёгочных осложнений, что обусловливало большую продолжительность критического периода. Летальность в первой группе больных была на 21 % ниже (табл.2).
При исследовании показателей кислородного баланса организма установлено выраженное снижение потребления кислорода без отличий между исследуемыми группами, однонаправленное снижение коэффициентов использования (табл. 3).
Таблица 3
Влияние цитофлавина, назначенного в разные сроки после острых тяжёлых отравлениий, на динамику показателей тканевого компонента транспорта кислорода и кислородтранспортной функции крови
| Показатель | Группы исследования | |
| «Раннее» применение | «Позднее» применение | |
| 1-е сутки | ||
| VО2, мл/мин×м2 | 92,5 ± 5,1 | 93,3 ± 7,4* |
| КИО2, мл/л | 16,5 ± 1,3 | 15,9 ± 1,8* |
| аvDО2, мл/л | 32,9 ± 2,2 | 34,3 ± 5,4* |
| КУО2, % | 23,3 ± 1,8 | 24,3 ± 2,3* |
| 2-е сутки | ||
| VО2, мл/мин×м2 | 115,9 ± 5,5 | 92,8 ± 5,9* |
| КИО2, мл/л | 19,7 ± 1,5 | 15,6 ± 1,5* |
| аvDО2, мл/л | 40,1 ± 2,5 | 35,1 ± 2,7* |
| КУО2, % | 26,6 ± 1,5 | 22,4 ± 1,8* |
| 3-и сутки | ||
| VО2, мл/мин×м2 | 134,8 ± 4,2 | 93,6 ± 6,1* |
| КИО2, мл/л | 25,6 ± 1 | 18,4 ± 1,7* |
| аvDО2, мл/л | 43,8 ± 2,9 | 37,1 ± 3,1* |
| КУО2, % | 26,2 ± 2,1 | 21,5 ± 1,7* |
| 4-е сутки | ||
| VО2, мл/мин×м2 | 137,5 ± 3,1 | 104,7 ± 7,4* |
| КИО2, мл/л | 28,3 ± 1,6 | 21,1 ± 1,8* |
| аvDО2, мл/л | 51,6 ± 2,1 | 38,6 ± 3,2* |
| КУО2, % | 32,5 ± 2,4 | 23,1 ± 2,1* |
| 5-е сутки | ||
| VО2, мл/мин×м2 | 139,3 ± 4,9 | 115,6 ± 5,5* |
| КИО2, мл/л | 27,6 ± 1 | 21,7 ± 2* |
| аvDО2, мл/л | 51,2 ± 1,6 | 40,2 ± 3,9* |
| КУО2, % | 31,8 ± 1,4 | 24,2 ± 3,6* |
Примечание: * – различия параметров между группами достоверны (p<0.05).
В IV исследуемой группе глубина и длительность гипоксического состояния при острых тяжелых отравлениях сказывалась на дальнейшем течении химической травмы. На 3-и сутки в IV группе показатель потребления кислорода и коэффициент его использования продолжали оставаться низкими. В III группе показатели находились в пределах нормальных величин.
Динамика изменений концентрации лактата также свидетельствовала о более выраженной коррекции тканевого метаболизма при гипоксии у больных с церебральной недостаточностью, получавших цитофлавин. На 2-е сутки в III группе отмечали снижение уровня лактата с 4,9 ± 1,18 ммоль/л до 2,51 ± 0,77 ммоль/л (показатели здоровых доноров – 1,23 ± 0,31 ммоль/л), тогда как в IV группе уровень лактата с 3,99 ± 0,57 ммоль/л имел тенденцию к дальнейшему росту и составил 4,57 ± 0,88 ммоль/л (показатели здоровых лиц – 1,4 ± 0,24), что свидетельствовало о прогрессировании метаболических нарушений у больных IV группы. На 3-и сутки в III группе продолжала сохраняться тенденция к снижению уровня лактата и его значения составили 2,22± 0,77 ммоль/л (показатели здоровых лиц – 1,28 ± 0,25,), тогда как в IV группе сохранялся повышенный уровень лактата – 4,12 ± 0,65 ммоль/л.
Таким образом, «раннее» использование цитофлавина позволило устранить метаболические последствия гипоксии в более ранние сроки, тогда как использование цитофлавина на фоне нарушений процессов доставки кислорода не влияло на глубину гипоксических нарушений.
Несмотря на специфические механизмы действия ядов данной группы общим конечным результатом действия нейротропных веществ является развитие гипоксии тканей. В формировании данных механизмов поражений немаловажное место занимают процессы активации свободнорадикального окисления и нарушения функции системы антиоксидантной защиты, в том числе и системы глутатиона, как ведущей ее составляющей.
Представленные в таблице 4 сведения демонстрируют, что «раннее» применение цитофлавина позволило предотвратить снижение содержания восстановленного глутатиона в эритроцитах пациентов, которое достигало максимума на 2-е сутки нахождения в стационаре (на 33,7 % в IV группе). Кроме того, на 3-и сутки в эритроцитах больных IV группы отмечали тенденцию к росту содержания ВГ по сравнению с 1-ми сутками исследования, что также не отмечалась в эритроцитах лиц V группы. Действительно, в эти сроки у больных III группы содержание ВГ превышало показатели 1-х суток нахождения в стационаре на 15 %, тогда как в эритроцитах лиц IV группы было ниже на 8,8 %. Соответственно, при сравнении показателей пациентов III и IV групп на 3-и сутки, концентрация ВГ в эритроцитах была достоверно выше (на 20,8 %) в III группе. На 4-е сутки исследования динамика нарастания уровня ВГ с достоверными отличиями от исходных значений IV группы была отмечена в III группе исследования. Следовательно, «раннее» использование цитофлавина в терапии острой церебральной недостаточности, вызванной отравлениями нейротропными веществами, приводило к повышению уровня основного антиоксиданта клетки – восстановленного глутатиона.
Таблица 4
Динамика изменений восстановленного глутатиона (ВГ), глутатионпероксидазы (ГП) и концентрации малонового диальдегида (МДА) в эритроцитах при острых тяжелых отравлениях (нмоль/г гемоглобина) в зависимости от срока применения цитофлавина
| Показатель | Группы больных | |
| «Раннее» применение | «Позднее» применение | |
| 1-е сутки | ||
| ВГ, мкмоль/г Hb | 3,817 0,215 | 3,844 0,239* |
| ГП, мин/(мин×г Hb) | 4,04 0,433 | 3,903 0,515* |
| МДА, нмоль/г Hb | 11,22 0,87 | 9,97 1,16* |
| 2-е сутки | ||
| ВГ, мкмоль/г Hb | 4,34 0,287 | 2,218 0,314* |
| ГП, мин/(мин×г Hb) | 4,644 0,443 | 3,74 0,405* |
| МДА, нмоль/г Hb | 8,43 0,95 | 11,69 1,08* |
| 3-и сутки | ||
| ВГ, мкмоль/г Hb | 4,29 0,28 | 2,362 0,257* |
| ГП, мин/(мин×г Hb) | 5,154 0,543 | 3,804 0,501* |
| МДА, нмоль/г Hb | 7,47 1,02 | 11,42 0,92* |
| 4-е сутки | ||
| ВГ, мкмоль/г Hb | 4,89 0,28 | 3,062 0,572* |
| ГП, мин/(мин×г Hb) | 5,824 0,344 | 4,1 0,315* |
| МДА, нмоль/г Hb | 6,27 0,83 | 10,33 1,25* |
| 5-е сутки | ||
| ВГ, мкмоль/г Hb | 5,61 0,31 | 3,566 0,257* |
| ГП, мин/(мин×г Hb) | 5,754 0,542 | 4,2 0,354* |
| МДА, нмоль/г Hb | 5,47 0,82 | 9,32 1,15* |
Примечание: * – различия параметров между группами достоверны (p<0.05).
Таким образом, использование цитофлавина на фоне компенсированного состояния кислородтранспортных систем в комплексной терапии токсических поражений головного мозга приводило к снижению интенсивности протекания процессов перекисного окисления липидов.
Для оценки влияния срока использования цитофлавина на параметры биоэлектрической активности (БЭА) была проведена отдельная серия исследований (в 18 случаях проводилась «ранняя» инфузия цитофлавина, в 17 – «поздняя»). В данный раздел вошли результаты анализа ЭЭГ у больных с тяжелыми отравлениями депримирующими веществами, которые не оказывают специфического действия на биоэлектрогенез (Александров М.В., 2007).
В целом в группе больных с «ранним» использованием цитофлавина параметры спонтанной ЭЭГ и реактивности мозга отражали большую «сохранность» нейродинамики в исходе острого периода, чем у больных группы сравнения. Обращало на себя внимание относительно низкое число больных с выраженной межполушарной асимметрией. Так, в этой подгруппе представленность больных с межполушарной асимметрией по доминирующей частоте более, чем на 1 Гц, составила лишь 10.58.5 %, а в группе сравнения – 28.512.5 (p<0.05).
ЭЭГ-признаками внутричерепной гипертензии выступают выраженная синхронизация БЭА в дельта-дипазоне частот, в результате чего ЭЭГ принимает вид «машинообразного» ритма: дельта-ритм «жесткой» частоты (2-3 Гц) и высокой амплитуды (Александров М.В., 2002). В наблюдаемых группах были выбраны больные, у которых были зарегистрированы явные ЭЭГ-стигматы внутричерепной гипертензии. Длительность регистрации ЭЭГ-стигматов синдрома внутричерепной гипертензии у больных с «ранним» началом инфузионной терапии с включением цитофлавина была меньше, чем у больных с поздним введением препарата (12,6±5,6 ч против 22,3±8,2 ч соответственно, р‹0,05).
Полученные результаты позволяют сделать вывод, что только раннее включение препарата цитофлавин в терапию позволяет существенно ускорить восстановление нейродинамики у тех больных, у которых течение токсической энцефалопатии осложнено выраженным отеком мозга.
Таким образом, своевременное введение цитофлавина больным с тяжелой токсической энцефалопатией при отравлениях веществами депримирующего действия способствует быстрому восстановлению оптимальной нейродинамики и реактивности ЦНС. При этом, вероятно, предпочтительным сроком является введение цитофлавина тем больным, которые поступают на этап специализированного лечения в первые 8-12 ч с момента отравления.
Экспериментальное обоснование сроков введения субстратных
антигипоксантов при интенсивной терапии
острой церебральной недостаточности
Для проверки выдвинутой гипотезы о целесообразности использования субстратных антигипоксантов на фоне сохранного уровня достатвки кислорода тканям было выполнено экспериментальное исследование.
Внутрижелудочное зондовое введение этанола и водной суспензии атипичного нейролептика – азалептина – в дозах 1.5 ЛД50 вызывало у крыс выраженное угнетение потребления кислорода (табл.5). Минимальные значения исследуемого показателя фиксировали к концу 6-го часа от момента введения нейролептика. Восстановление газообмена до исходного уровня у выживших животных удавалось наблюдать лишь через сутки от начала интоксикации. Падение интенсивности потребления кислорода до 40% от уровня, измеренного у интактных особей непосредственно перед введением им азалептина, являлось неблагоприятным прогностическим признаком и сопровождалось гибелью животных. Была выявлена очевидная связь между угнетением потребления кислорода, формирующимся через 30 минут от начала интоксикации и проявлениями тяжелой формы нарушений неврологического статуса и высшей нервной деятельности у экспериментальных животных.
На следующем этапе выполнения данного исследования изучали влияние на газообмен отравленных животных препаратов, вводимых с лечебной целью в период сформировавшейся депрессии потребления кислорода. Поскольку к ожидавшимся лечебным свойствам препарата янтарной кислоты – цитофлавина – могла быть причастна его способность поставлять субстрат для сукцинатдегидрогеназы, данный препарат был апробирован в дозах, при которых тканевые концентрации янтарной кислоты могли бы превысить константу Михаэлиса (Кm) для сукцинатдегидрогеназы, составляющую в разных тканях крыс от 0,1 до 0,37. Доза пирацетама при внутрибрюшинном введении в период сформировавшейся депрессии газообмена составляла 300 мг/кг.
Цитофлавин, вводимый в это время, не оказывал положительного влияния на процесс восстановления уровня газообмена, более того, до 30% животных в группах, получавших как цитофлавин, так и пирацетам погибали в течение 1-3 часов от момента введения данных препаратов. В то же время у животных, не получавших названных средств, с первого часа и до окончания наблюдения получены значимо более высокие показатели уровня потребления кислорода (табл.5).
Таблица 5
Влияние цитофлавина (5 ммоль/кг) и пирацетама (300 мг/кг)
на потребление кислорода у животных с тяжелым отравление этанолом (1.5 ЛД50)
(% от исходного уровня)
| Препараты | Сроки после введения этанола, ч | |||
| 0,5 | 1,0 | 3,0 | 6,0 | |
| Сроки после введения лечебных средств, ч | ||||
| 0,5 | 2,5 | 5,5 | ||
| Контроль (NaCl) | 40 7 | 55 2* | 52 4* | 51 4* |
| Цитофлавин | 38 5 | 32 3 | 32 2 | 33 2 |
| Пирацетам | 32 2 | 27 1 | 29 1 | 27 1 |
Примечание: *- различия параметров между группами достоверны (р< 0,05).
Анализ полученных данных позволил предположить, что в данных условиях к концу первого получаса от момента интоксикации в тканях отравленных животных развиваются метаболические нарушения, препятствующие реализации лечебного действия назначаемых препаратов.
В связи с этим на втором этапе выполнения настоящего раздела исследовались пути оптимизации сроков введения цитофлавина или пирацетама для лечения тяжелых расстройств функций центральной нервной системы, вызванной интоксикацией алкоголем. В связи с этим была предпринята попытка более раннего назначения этих препаратов.
Введение этанола в дозе 100 мМ/кг вызывало гибель 70-85 % лабораторных животных в срок 6-12 ч. Использование на фоне интоксикации этанолом цитофлавина в дозе 0.5 мМ/кг не вызывало значимых изменений параметров летальности, что побудило нас существенно увеличить дозу препарата. Цитофлавин в дозе 5 мМ/кг (по сукцинат-аниону), введенный через 15 мин после введения этанола в дозе 1.5 ЛД50, обеспечивал условное «снижение» дозы в 4.4 раза. Раннее назначение пирацетама не повышало выживаемость экспериментальных животных.
Рисунок 1
Влияние срока введении нейрометаболических средств на выживаемость крыс при тяжелой интоксикации этанолом (1.5 ЛД50)
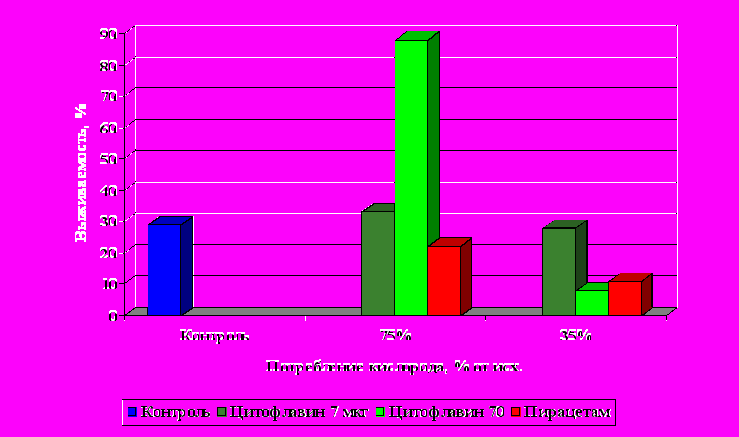
Динамика ЭЭГ отражала результы исследования: раннее введение цитофлавина снижало индекс эпилептиформной активности. Введение пирацетама, наоборот, сопровождалось усилением патологических феноменов на ЭЭГ.
Полученные данные свидетельствуют, во-первых, о необходимости применения средств метаболической коррекции на основе энергетических субстратов (в частности – производных янтарной кислоты) в ранний период – до формирования глубоких нарушений в системе энергетического обеспечения функций нейронов. Во-вторых, субстратные антигипоксанты должны применяться в дозах, обеспечивающих создание среднетканевых концентраций, позволяющих насытить ферментные системы субстратом окисления. Особого подхода требует назначение ноотропов из группы пирацетама при изучаемых состояниях. Применение ноотропных средств (пирацетама) оправдано лишь при признаках восстановленияфункионирования механизмов биоэлектрогенеза в головном мозге.
Концепция рациональной нейрометаболической терапии
В результате проведенных клинических и экспериментальных исследований нами предложен следующий алгоритм нейрометаболической терапии, которая, на наш взгляд, позволит существенно уменьшить тяжесть метаболических расстройств головного мозга, связанных как с действием токсического агента, так и с присоединившимися гипоксическими повреждениями:
1 этап – восстановление процессов доставки кислорода к тканям;
2-й этап – нейропротекторы (сразу после обеспечения адекватной доставки кислорода): в/в цитофлавин 20 мл в разведении на 200 мл 20% глюкозы;
3-й этап – ноотропные средства (при появлении признаков пробуждения – клинических или электроэнцефалографических): в/в церебролизин 10 мл или пирацетам 20 мл;
4-й этап – вазоактивные препараты (с учётом особенностей действия токсиканта на ауторегуляцию мозгового кровотока: после регистрации ультразвуковой допплерографии): при гиперперфузии дополнительных назначений вазоактивных препаратов не проводили; при гипоперфузии – нимотоп.
С целью подтверждения эффективности данной схемы нами проведено дополнительное клиническое исследование.
Таблица 6
Оценка эффективности нейрометаболической терапии (НМТ)
у больных с острыми тяжёлыми отравлениями
| Показатель | Группы больных | |
| РациональнаяНМТ | Группа сравнения | |
| Время экспозиции яда, ч | 16,9 2,2 | 14,1 2,7 |
| Длительность комы, ч | 28,8 10,2 | 64,5 15,1* |
| Частота развития пневмонии, абс. (%) | 42 (27,6) | 54 (49,1) |
| Длительность психотических расстройств, ч | 15,5±4,2 | 8,3±2,5* |
| Выраженность астении, отн. ед. | 64,1±3,3 | 23,0±4,9 * |
| Психоорганический синдром, абс. | 54 | 7 |
| Длительность пребывания больных в ОРИТ, ч | 63,7 9,2 | 117,2 17,2* |
| Число умерших, абс. (%) | 15 (9,9) | 28 (25,5) |
Примечание: * – различия параметров между группами достоверны (р< 0,05).
В клинической картине отравлений в группе, в интенсивную терапию которых была включена схема рациональной нейрометаболической терапии, отмечали уменьшение явлений неврологического дефицита, проявлявшееся сокращением длительности коматозного состояния почти в 2 раза – с 65,5±11,1 часа до 38,8±10,2 часа (табл. 6). Также отмечено снижение частоты развития вторичных лёгочных осложнений на 21 %. Больные, в схему стандартного лечения которых была включена рациональная нейрометаболическая терапия, легче и быстрее проходили период астении после восстановления сознания, у них в 8 раз реже развивался психоорганический синдром. Всё это приводило к уменьшению средней длительности пребывания в реанимационном отделении почти в 2 раза – со 117 до 63 часов.
Таким образом, выявлены существенные положительные клинические сдвиги при включении схемы рациональной нейрометаболической терапии в стандартную схему интенсивного лечения больных с церебральной недостаточностью вследствие острых тяжёлых отравлений.
Из показателей кислородтранспортной функции крови и тканевого компонента транспорта кислорода было отмечено выраженное снижение потребления кислорода, однонаправленное снижение коэффициентов его использования у больных, в комплексном лечении которых применена схема рациональной нейрометаболической терапии (табл. 7).
Таблица 7
Влияние рациональной нейрометаболической терапии на показатели кислородтранспортной функции крови и тканевого компонента транпорта кислорода у больных с острыми отравлениями нейротропными ядами
| Показатель (обследованная группа) | Контрольная группа | Срок наблюдения | ||
| 1-е сутки | 2-е сутки | 3-и сутки | ||
| VО2, мл/мин×м2 (V) | 148,8 15,8 | 88,56,3* | 117,97,2* | 123,16,8 |
| VО2, мл/мин×м2 (VI) | 148,8 15,8 | 80 6,1* | 75,76,5* | 66,68,7* |
| КИО2, мл/л (V) | 37,8 0,4 | 13,91,1* | 20,11,3* | 22,11,3* |
| КИО2, мл/л (VI) | 37,8 0,4 | 12,11,9* | 11,81,1* | 11,71,7* |
| аvDО2, мл/л (V) | 52,9 3,5 | 31,613,0* | 39,62,4* | 44,82,2* |
| аvDО2, мл/л (VI) | 52,9 3,5 | 35,63,6* | 29,63,5* | 29,73,0* |
| КУО2, % (V) | 28,0 2,1 | 21,32,2* | 26,41,6 | 29,51,2 |
| КУО2, % (VI) | 28,0 2,1 | 25,82,8* | 21,32,8* | 20,72,2 |
Примечание: * – различия параметров между группами достоверны (р< 0,05).
Наиболее интересным изменением, на наш взгляд, являлось увеличение артериовенозной разницы по кислороду, по-видимому, за счет умеренного снижения парциального напряжения в смешанной венозной крови, что свидетельствует об улучшении усвоения кислорода тканями на фоне инфузии нейрометаболических препаратов (вероятно, в первую очередь, сукцинатсодержащего препарата – цитофлавина).
Таким образом, наиболее полно эффекты использования нейрометаболической терапии отражаются на показателях кислородтранспортной функции крови и тканевого компонента транспорта кислорода, что подтверждается ростом таких показателей, как потребление кислорода, коэффициент его использования и утилизации, а также увеличением артериовенозной разницы по кислороду. Однако следует отметить, что эффективность использования данной терапии проявляется только в условиях адекватной доставки кислорода к тканям.
Гипоксия при остром отравлении нейротропными ядами выполняет роль пускового фактора, в результате действия которого формируются процессы, резко усиливающие токсическое воздействие, что обусловлено вовлечением в процесс широкого круга биологических систем, в том числе нарушений свободнорадикального окисления.
Факт снижения содержания МДА в эритроцитах пациентов V группы уже в достаточной мере свидетельствует о наличии антиоксидантных свойств у нейрометаболических препаратов (в первую очередь, по всей видимости, сукцинатсодержащих). Тем не менее, механизм данного антиоксидантного воздействия может быть раскрыт лишь при исследовании состояния системы антиоксидантной защиты. Наиболее важным показателем оценки состояния данной системы является концентрация восстановленного глутатиона в клетке.
Таблица 8
Влияние рациональной нейрометаболической терапии на динамику концентрации малонового диальдегида (МДА) и восстановленного глутатиона (ВГ) при острых тяжелых отравлениях нейротропными ядами
| Показатель | Группы больных | |
| Рациональная НМТ | Группа сравнения | |
| 1 сутки | ||
| МДА, нмоль/г Hb | 10.21 0.87* | 7.71 1.16 |
| ВГ, мкмоль/г Нb | 2.717 0.135 | 2.844 0.219 |
| 2 сутки | ||
| МДА, нмоль/г Hb | 10.43 0.94 | 9.96 0.99 |
| ВГ, мкмоль/г Hb | 2.74 0.187* | 2.309 0.134* |
| 3 сутки | ||
| МДА, нмоль/г Hb | 8.47 0.82* | 10.32 0.95* |
| ВГ, мкмоль/г Hb | 3.09 0.18* | 2.662 0.157* |
Примечание: * – различия параметров между группами достоверны (р< 0,05).
Представленные в таблице 8 сведения демонстрируют, что применение схемы рациональной нейрометаболической терапии в комплексном лечении острых тяжёлых отравлений, сопровождающихся развитием церебральной недостаточности, позволяло предотвратить снижение содержания восстановленного глутатиона в эритроцитах пациентов. Кроме того, на 3-и сутки в эритроцитах больных V группы отмечена тенденцию к росту содержания ВГ по сравнению с 1-ми сутками исследования, что не отмечалось в эритроцитах лиц VI группы. Следовательно, использование рациональной нейрометаболической терапии в комплексном лечении острых тяжелых отравлений приводило к повышению уровня основного антиоксиданта клетки – восстановленного глутатиона.
Благодаря наличию антигипоксантных и антиоксидантных свойств, использование нейрометаболических препаратов по предложенной схеме в стандартной интенсивной терапии позволяет нарушить цепь патологических событий при церебральной недостаточности, связанных с глубоким угнетением и нарушением метаболизма ЦНС, а также развитием в дальнейшем гипоксии тканей, которая приводит к усугублению нарушений тканевого метаболизма, снижению активности системы антирадикальной защиты и активации перекисного окисления липидов.
При поступлении у всех больных регистрировали повышение концентрации олигопептидов во всех исследуемых средах, которое было более выраженным в артериальной крови в отличие от венозной, что свидетельствует о поражении метаболических функций легких.
2-е сутки проведения комплексного лечения при включении схемы рациональной нейрометаболической терапии характеризовались снижением концентрации олигопептидов в плазме, на эритроцитах артериальной и венозной крови с одновременным их повышением в моче. Параллельно с этими изменениями отмечали снижение артериовенозной разницы по концентрации олигопептидов, что свидетельствовало о восстановлении детоксицирующей функции легких.
Способность нейропротекторов различных фармакологических групп моделировать активность различных участков дыхательной цепи митохондрий клеток, в том числе и клеток иммунной системы, позволило предположить возможность ограничивать с их помощью развитие тяжелых иммунных нарушений, что и было подтверждено проведённым исследованием.
Влияние рациональной нейрометаболической терапии
на исход персистирующего вегетативного состояния
Разработанная схема была апрбирована в случаях крайних форм церебральной недостаточности - персистирующих вегетативных состояниях, вызванных тяжелым отравлением.
В данном разделе были обследованы 17 больных с вегетативными состояниями, развившимися в исходе экзотоксической комы. В 14 случаях кома была вызвана передозировкой опиатов, в 2 случаях – поражением продуктами горения полимерными материалами, в 1 случае – тяжелым отравлением неустановленным ядом депримирующего действия.
Все больные были разделены на две группы. В первую группу вошли больные, которые проходили лечение до 2007 г. Этим больным применялась стандартная терапия. Лечение вегетативного состояния велось в соответствии с протоколом, рекомендованным Научно-исследовательским нейрохирургическим институтом им. А.Л. Поленова: сочетание «фармакологического зондирования» бензодиазепинами с так называемой «полимодальной стимуляцией» (фотостимуляция, аудиостимуляция, массаж и т.д.).
Во вторую группу вошли больные, которым стандартная терапия и протокол ведения вегетативного состояния были адаптированы в соответствии с разработанной концепцией нейрометаболической защиты: 1) до восстановления спонтанного дыхания больные не получали ноотропные препараты; 2) при восстановлении спонтанного дыхания больные, находившиеся в коме более трех суток, одновремненно получали церебролизин 30 мл в сутки, пирацетам 12 г в сутки; 3) для «фармакологичсекой стимуляции» применяли феназепам в дозе 1 мг 4 раза в сутки; 4) для активации мозгового кровотока вводили нимотоп в дозе 300 мг в сутки и кавинтон (винпоцетин) 15 мг в сутки. Введение сосудистых препаратов осуществляли под контролем допплерографического мониторинга: критерием служила нормальная сосудистая реактивность. Выбор нимотопа был обусловлен представлениями об эксайт-токсичности ионов кальция и их участии в процессах апаптоза нейронов. Выбор феназепама был продиктован тем обстоятельством, что полимодальная стимуляция и активация восходящей системы стола приводит к формированию эпилептиформных стигматов. Феназепам в отличие от других бензодиазепинов обладает более мощным действием на нейронные констелляции, формирующие эпилептиформную активность.
Сравнение летальности в группах показывает, что летальность в группе наблюдения (рациональная НМТ) была достоверно ниже, чем в группе сравнения: 5 летальных исходов из 7 человек в группе с НМТ и 9 из 10 – в группе сравнения (p<0.05 по U-критерию).
Регистрация спонтанной и вызванной биоэлектрической активности у больных с вегетативными состояниями выявила следующие особенности. Согласно Протоколу, рекомендованному для ведения больных в вегетативном состоянии, наибольшую прогностическую валидность имеют результаты «фармакологического зондирования»: положительный тест с ЭЭГ-реактивностью в ответ на введение бензодиазепинов. Его точность оценивается в 95% в группе больных с черепно-мозговой травмой. В группе больных с вегетативными состояниями, вызванными экзотоксической комой, из 17 больных положительный бензодиазепиновый ЭЭГ-тест регистрировался у 15 больных. У всех троих выживших больных тест был положительным, остальные 12 умерли. Такие результаты, очевидно, отражают особенности течения церебральной недостаточности: реактивность на введение фармакологических препаратов у больных даже в запредельной коме сохраняется достаточно долго.
Стимулы могут быть ранжированы по своей способности вызывать ЭЭГ-активацию: в ряду «фотостимуляция-боль-фармакологический зонд» способность вызывать активацию возрастает (Александров М.В, 2002, 2008). У 5 больных в вегетативном состоянии регистрировалась ЭЭГ-реакция в ответ на болевую стимуляцию и даже - в ответ на ритмическую фотостимуляцию. Трое из таких больных выжили. Оценка корреляционных связей между исходом вегетативного состояния и уровнем ЭЭГ-реактивности показала, что между параметром «ЭЭГ-реактивность в ответ на ритмическую фотостимуляцию» и вероятностью восстановления сознания при вегетативном состоянии выявляется сильная положительная связь: непараметрический коэффициент корреляции составил 0.75.
Таким образом, результаты нейрофизиологических исследований позволяют считать, что вегетативное состояние выступает одной из форм проявления церебральной недостаточности при тяжелом отравлении веществами с нейротоксическим действием. Вегетативное состояние развивается в результате формирования в коре очагов застойного чрезмерного возбуждения, подавляющих нижележащие структуры мозга. Лимитирующим фактором успешности НМТ у больных в вегетативном состоянии является размер пула сохранных нейронов коры и степень повоеждения таламо-кортикального взаимодействия. Одним из положительных прогностических критериев является ЭЭГ-реактивность в ответ на внешнюю стимуляцию.
ВЫВОДЫ
1. Нейрометаболическая терапия оказывает существенное влияние на течение и исход острых тяжёлых отравлений. Эффективность нейрометаболической терапии в значительной степени зависит от определённой последовательности применения нейропротекторов из разных фармакологических групп с учётом периодов течения острой церебральной недостаточности.
2. Ведущим механизмом развития церебральной недостаточности при тяжёлых отравлениях является острая дисфункция центральной нервной системы, возникающая в результате воздействия как специфических, так и неспецифических механизмов поражения головного мозга. К специфическим механизмам относится избирательное действие вещества на отдельные рецепторы, доза и экспозиция токсиканта. Неспецифические (универсальные) механизмы включают в себя расстройства биоэлектрической активности, нарушения мозгового кровотока, метаболические расстройства, нарушения процессов свободнорадикального окисления, эндогенную интоксикацию и иммуносупрессию на фоне гипоксии.
3. Комплексная диагностика церебральной недостаточности при острых тяжёлых отравлениях включает использование следующих методов: клиническую синдромологическую оценку, нейрофизиологический мониторинг (регистрация спонтанной и вызванной биоэлектрической активности, параметров мозгового кровотока), оценку тяжести гипоксии, эндотоксикоза, метаболических нарушений, иммунодиагностику.
4. Цитофлавин в дозе 770 мг/кг при использовании в качестве нейропротектора в экспериментальной модели острых тяжёлых отравлений белых беспородных крыс этанолом (1,5 ЛД50) и атипичным нейролептиком азалептином (1,5 ЛД50) на фоне декомпенсированной гипоксии повышает летальность животных с 70 % до 100 % и с 75 % до 100 % соответственно. Напротив, лечебное применение цитофлавина в этих моделях в ранние сроки (до развития некомпенсированной гипоксии) предотвращает развитие генерализованных судорог и повышает выживаемость лабораторных животных на 60 %.
5. Пирацетам в максимально разрешённой дозе 300 мг/кг при его применении на фоне выраженных проявлений гипоксии в экспериментальной модели тяжёлого отравления этанолом (1,5 ЛД50) белых беспородных крыс повышает летальность животных с 70 % до 100 %.
6. Результаты экспериментальных и клинических исследований свидетельствуют о том, что применение нейрометаболических средств при острых тяжёлых отравлениях нейротропными веществами на фоне нарушения доставки кислорода тканям не повышает эффективность детоксикационной терапии.
7. Максимальный эффект нейрометаболической терапии достигается при дифференцированном использовании фармакологических препаратов в следующей последовательности: на первом этапе после восстановления адекватной доставки кислорода – нейропротекторы (субстратные антигипоксанты); на втором этапе при регистрации электроэнцефалографических и клинических признаков пробуждения больного – ноотропные препараты; на третьем этапе при восстановлении реактивности сосудов головного мозга – вазоактивные препараты. Использование предложенного алгоритма позволяет добиться сокращения длительности критического состояния (на 35,4 %), снижения частоты развития вторичных лёгочных осложнений (на 25 %), длительности психотических расстройств (на 44,7 %). В результате летальность при тяжёлых отравлениях снижается с 15,6 % до 9,5 %.
8. Основными лабораторно-инструментальными диагностическими критериями эффективности нейрометаболической терапии являются: нормализация амплитудно-частотных параметров биоэлектрической активности головного мозга, восстановление ауторегуляции мозгового кровотока; уменьшение метаболических расстройств, уменьшение уровня эндотоксикоза, нормализация процессов перекисного окисления липидов и иммунного статуса организма.
9. Разработанная схема рациональной нейрометаболической терапии позволяет достигать положительного лечебного эффекта при крайне тяжёлой степени острых отравлений, сопровождающихся развитием церебральной недостаточности по типу персистирующего вегетативного состояния.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. У больных с острыми отравлениями в критическом состоянии назначение любых нейрометаболических препаратов должно проводиться только в условиях обеспечения адекватной доставки кислорода тканям.
2. В интенсивной терапии острых тяжёлых отравлений нейрометаболические средства следует использовать в максимально разрешённых дозировках.
3. Последовательность введения нейрометаболических препаратов должна учитывать период течения церебральной недостаточности: в остром периоде после восстановления адекватной доставки кислорода – нейропротекторы (субстратные антигипоксанты); в подостром периоде при электроэнцефалографических и клинических признаках пробуждения больного – ноотропные препараты; при восстановлении реактивности сосудов головного мозга – вазоактивные препараты.
4. Научные исследования по проблеме церебральной недостаточности при острых тяжелых отравлениях целесообразно продолжить для уточнения механизмов дисфункции и процессов восстановления интеграции структур головного мозга при действии веществ с различными механизмами действия.
