Повідомлення про повторне оприлюднення (після врахування пропозицій та зауважень) проекту наказу Міністерства охорони здоров’я "Порядок визначення серологічних маркерів віл інфекції та забезпечення якості досліджень"
| Вид материала | Документы |
- Повідомлення про повторне оприлюднення (після врахування пропозицій та зауважень) проекту, 5067.63kb.
- Повідомлення про оприлюднення, 952.82kb.
- Виконання обласної програми забезпечення профілактики віл-інфекції, лікування, догляду, 347.56kb.
- Прекваліфікація вооз національних лабораторій з контролю якості лікарських засобів, 118.95kb.
- Перелік нормативно-правових актів, затверджених міністерством охорони здоров'я україни, 21.68kb.
- Аналіз регуляторного впливу проекту наказу Міністерства фінансів України, 201.2kb.
- На виконання Загальнодержавної програми забезпечення профілактики віл-інфекції, лікування,, 2720.84kb.
- Зметою забезпечення якісного проведення щорічних дитячих оглядів дітей та підлітків, 70.92kb.
- Про виконання Міської програми забезпечення профілактики віл-інфекції, лікування, догляду, 151.48kb.
- Міністерство охорони здоров'я україни нака, 1248.35kb.
Порядок визначення серологічних маркерів ВІЛ - інфекції та
забезпечення якості досліджень
ЗАГАЛЬНІ ПОЛОЖЕННЯ
Вступ
На початку нового тисячоліття інфекція пов’язана з вірусом імунодефіциту людини залишається однією з провідних медико-соціальних проблем України. Це пов'язано з поведінковою особливістю розповсюдження вірусу імунодефіциту людини (далі – ВІЛ) переважно серед осіб репродуктивного віку, важким перебігом хвороби, відсутністю засобів специфічної імунопрофілактики, великими економічними витратами та іншими чинниками, що характеризують високу соціальну значимість цієї хвороби. В умовах розширення доступу до широкомасштабної антиретровірусної терапії, яка сприяє подовженню тривалості та покращенню якості життя ВІЛ-позитивної людини, основні заходи, що спрямовані на зниження темпів розповсюдження інфекції, повинні бути зосереджені на попередженні зараження вірусом, своєчасності його виявлення, організації лікування, догляду та підтримки хворих із забезпеченням контролю дотримання зменшення людських, соціальних та економічних збитків, негативного впливу ВІЛ-інфекції на суспільство.
Перспективи підвищення ефективності запобігання боротьби з цією інфекцією в значній мірі пов'язані з впровадженням сучасних методів лабораторної діагностики, яка базується, перш за все, на методах виявлення противірусних антитіл (далі – АТ), індикації вірусу, його антигенів (далі – АГ), генного матеріалу, інших компонентів вірусу. Найбільшого впровадження в теперішній час набули методи визначення специфічних антитіл за допомогою імуноферментного аналізу (далі – ІФА). З моменту розробки тестів для виявлення антитіл до ВІЛ в 1985 році з’явилась можливість діагностики цієї інфекції. Серологічні (від лат. serum — сироватка) методи діагностики на наявність антитіл до ВІЛ здійснюються в межах скринінгових та верифікаційних досліджень, і визначають рівень розповсюдження ВІЛ-інфекції.
Скринінг (англ. screen - ретельно відбирати, сортувати, тобто виявляти підозрілих та відсівати здорових осіб) - методичний підхід, який застосовують для обстеження населення чи окремих його контингентів для виявлення певного захворювання.
Верифікація (від лат. verus – істинний, facere – робити) –методичний підхід, який застосовують для підтвердження отримання специфічного результату щодо наявності ВІЛ-інфекції на підставі надання об‘єктивних доказів наявності захворювання.
Серологічна діагностика ВІЛ-інфекції протягом тривалого періоду залишається основною при виявленні ВІЛ-інфікованих осіб та базується або на визначенні сумарного спектру антитіл та антигену ВІЛ, або сумарного спектру антитіл за допомогою імуноферментного аналізу. Позитивні зразки сироваток потребують подальшого тестування в підтверджувальних (верифікаційних) дослідженнях відповідно до визначених алгоритмів здійснення таких досліджень. Перевагою імуноферментного методу тестування в порівнянні з методом імунного блоту (далі – ІБ) є те, що ІФА тест-системи мають більш високу чутливість, облік результатів тестування здійснюється за допомогою приладів, у зв'язку з чим проведення підтверджувальних досліджень із застосуванням їх комбінації на сьогодні вважається більш доцільним. Крім цього, використання комбінації ІФА тест-систем для верифікації зменшує вартість досліджень.
Нажаль, мають місце ситуації, коли тестування методом ІФА потребує тривалого часу для отримання результату тесту з лабораторії. В такому випадку метод ІФА є нераціональним для діагностики ВІЛ-інфекції у осіб з високим ризиком інфікування ВІЛ та вагітних, оскільки тривале отримання результату негативно впливає на залучення цих осіб до проведення первинних профілактичних заходів та профілактики передачі ВІЛ від матері до дитини. Для проведення оперативних заходів із запобігання розповсюдженню ВІЛ-інфекції, аналіз повинен бути проведений максимально швидко. В останні роки для цього розроблені та набувають вагоме значення прості/швидкі тести (далі – ШТ) для дослідження на антитіла до ВІЛ. Тривалість дослідження одного зразку від 15 до 40 хвилин.
Метод імунного блоту (western - західний, blot - пляма) доцільно застосовувати при поглибленому клініко-лабораторному обстеженні вагітних та дітей, народжених ВІЛ-інфікованими матерями при взятті їх на облік у відповідній медичній установі (обласні, міські центри профілактики та боротьби зі синдромом набутого імунодефіциту людини (далі – СНІДом) або інші установи, яким надані функції здійснення лабораторної діагностики ВІЛ) та в окремих випадках при проведенні підтверджувальних досліджень.
Достовірність та надійність отриманих результатів тестування залежить від правильно побудованої програми забезпечення якості досліджень, оцінки якості тест-систем та підбору тестів, що будуть використовуватись при проведенні підтверджувальних досліджень.
Мета проведення серологічної діагностики ВІЛ-інфекції.
На сьогодні існує декілька методичних підходів до проведення скринінгових досліджень на ВІЛ. У відповідності до рекомендацій Всесвітньої організації охорони здоров’я (далі – ВООЗ) (1997, 2004), тестування на антитіла до ВІЛ проводять з метою:
- забезпечення безпеки трансфузій/трансплантацій (безпеки донорської крові, її продуктів, органів, тканин, сперми, яйцеклітин);
- діагностики ВІЛ-інфекції, в тому числі й серед цільових груп населення ;
- епідеміологічного нагляду.
Завдання щодо реалізації мети.
Для реалізації зазначеної мети визначають певний порядок проведення та послідовність первинних(скринінгових) та підтверджувальних (верифікаційних) досліджень при тестуванні різних груп населення в залежності від їх уразливості щодо інфікування ВІЛ та рівня розповсюдження ВІЛ-інфекції. Такий Порядок проведення серологічної діагностики ВІЛ-інфекції (далі – Порядок) розроблений з урахуванням сучасних принципів та методик дослідження, є обов’язковим для використання у роботі лікарів-лаборантів, лікарів-вірусологів, мікробіологів, лаборантів та інших фахівців, що здійснюють лабораторну діагностику ВІЛ-інфекції.
Фінансове забезпечення реалізації Порядку.
Реалізація Порядку здійснюватиметься в рамках Загальнодержавної та регіональних програм з питань ВІЛ-інфекції/СНІДу за рахунок коштів державного, місцевих бюджетів та інших донорських асигнувань, дозволених законодавством України.
Координація роботи та контроль за реалізацією Порядку.
Координація роботи та контроль за реалізацією Порядку покладається на Референс-лабораторію діагностики ВІЛ-інфекції при Українському центрі профілактики і боротьби зі СНІДом МОЗ України.
Термін реалізації Порядку визначається наказом про його затвердження.
- ПОРЯДОК ПРОВЕДЕННЯ СКРИНІНГОВИХ ДОСЛІДЖЕНЬ
Для проведення скринінгових досліджень використовують як тест-системи для твердофазного імуноферментного аналізу (далі – ТІФА), так і ШТ. Для тестування донорської крові, донорів органів, тканин, клітин використовують лише тест-системи, що дозволяють одночасно виявляти як антитіла до ВІЛ ½, так і антиген р 24 ВІЛ.
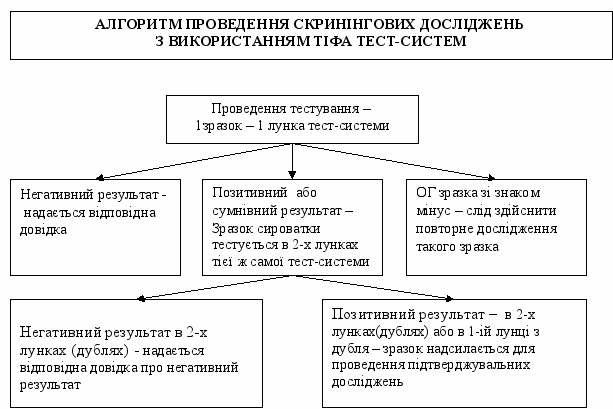
1.1. ПОРЯДОК ПРОВЕДЕННЯ СКРИНІНГОВИХ ДОСЛІДЖЕНЬ ІЗ ЗАСТОСУВАННЯМ ТЕСТ-СИСТЕМ ТІФА
1.1.1. Дані про пацієнтів, зразки сироваток крові яких надійшли в лабораторію, реєструють в Журналі реєстрації надходження зразків сироваток крові для проведення скринінгових досліджень на АТ до ВІЛ (форма первинної облікової документації № 502-3/0).
1.1.2.Перед початком тестування заповнюють протокол дослідження, де на схемі планшету вказують плановану послідовність внесення проб. Перед оцінкою кінцевих результатів досліджень слід впевнитись, що негативні, позитивні контролі, а також контроль кон’югату (в тих тест-системах, де цей контроль використовується) відповідають визначеним в інструкції значенням. Результати тестування реєструють в Журналі протоколу проведення досліджень (форма первинної облікової документації № 498-3/0).
У випадках, коли показник оптичної густини (далі – ОГ) контрольних зразків тест-системи не відповідає критеріям, визначеним в інструкції, облік результатів не проводять і дослідження повторюють. У випадках, коли отримано результат ОГ зі знаком «мінус», здійснюють повторне тестування зразка.
1.1.3. Після проведення тестування роблять запис про результати досліджень в Журналі реєстрації надходження зразків сироваток крові для проведення скринінгових досліджень на АТ до ВІЛ (форма первинної облікової документації № 502-3/0).
1.1.4. При отриманні негативного результату досліджень на кожного пацієнта надається довідка про результати досліджень на АТ до ВІЛ (форма первинної облікової документації № 503-5/0).
1.1.5. При отриманні позитивного або сумнівного результату досліджень, зразки сироваток з такими результатами тестують вдруге в двох лунках тест-системи, на якій проводили скринінгові дослідження. При отриманні при повторному тестуванні негативних результатів в 2-х лунках (дублях), зразок сироватки вважається таким, що не містить АТ до ВІЛ. Пацієнту надається довідка про результати досліджень на АТ до ВІЛ (форма первинної облікової документації № 503-5/0).
1.1.6. Зразки сироваток, що мають позитивний результат після повторного тестування або в одній лунці з дубля, потребують проведення підтверджувальних (верифікаційних) досліджень. Дані про пацієнтів, зразки сироваток яких підлягають проведенню підтверджувальних досліджень, реєструють в Журналі реєстрації зразків крові, що направляються для проведення підтверджувальних досліджень на АТ до ВІЛ (форма первинної облікової документації № 502-4/0). Кожен зразок сироваток супроводжується направленням на проведення підтверджувальних досліджень (форма первинної облікової документації № 249-4/0).
В лабораторії, що здійснює скринінгові та підтверджувальні дослідження, дані про пацієнтів, зразки сироваток яких підлягають проведенню підтверджувальних досліджень, реєструють в Журналі реєстрації зразків, що надійшли для проведення підтверджувальних досліджень (форма первинної облікової документації № 498-6/0).
1.1.7. Зразки сироваток крові дітей, народжених ВІЛ-інфікованими матерями, супроводжуються направленням на проведення досліджень (форма первинної облікової документації № 249-5/0).
1.1.8. В тих випадках, коли немає можливості доставити зразки сироваток, що потребують проведення підтверджувальних досліджень у відповідну лабораторію протягом 72 годин, сироватки переносять в пластикові пробірки з пробкою об’ємом 1,5-2,0 мл, заморожують при температурі мінус 20°С. Доставку таких зразків здійснюють в замороженому стані в спеціальних контейнерах з хладоагентом.
Форми облікової документації для донорів визначаються окремими нормативними документами в службі крові.
- ПОРЯДОК ПРОВЕДЕННЯ СКРИНІНГОВИХ ДОСЛІДЖЕНЬ З ЗАСТОСУВАННЯМ ШТ
1.2 Порядок проведення досліджень з застосуванням ШТ.
Тестування за допомогою ШТ на постійній основі проводять для всіх груп населення, окрім донорів крові, органів, клітин, тканин, сперми та інших біологічних матеріалів, а також дітей у віці до 18 місяців, народжених ВІЛ-інфікованими матерями. В залежності від мети обстеження для тестування використовують два ШТ відповідно до алгоритму їх послідовного використання або один ШТ.
Два ШТ використовують:
- при обстеженні осіб з метою видачі довідки про наявність або відсутність антитіл до ВІЛ в протитуберкульозних, дерматовенерологічних та наркологічних закладах охорони здоров’я, визначених наказом Міністерства охорони здоров’я України від 06.07.2006 р. № 446;
- при обстеженні осіб з метою видачі довідки про наявність або відсутність антитіл до ВІЛ в лікувально-профілактичних закладах (далі – ЛПЗ) невеликих населених пунктів, де відсутні лабораторії, що здійснюють тестування методом ІФА;
- в пологових будинках при обстеженні жінок з невідомим ВІЛ-статусом з метою призначення АРВ-профілактики;
- при обстеженні осіб, що перебувають в місцях позбавлення волі, з метою встановлення ВІЛ-статусу;
- при реалізації програм тестування в уразливих групах щодо інфікування ВІЛ (виконання проектів неурядових установ та організацій);
- в ЛПЗ МОЗ України, що надають послуги добровільного консультування та тестування (далі - ДКТ).
Один ШТ використовують:
- при обстеженні донорської крові в окремих, ургентних випадках, визначених відповідними нормативними документами, затвердженими наказами МОЗ України;
- при проведенні дозорних епідеміологічних досліджень 2-го покоління уразливих щодо інфікування ВІЛ груп населення (споживачі ін'єкційних наркотиків, робітники комерційного сексу, чоловіки, що мають секс з чоловіками тощо);
- в пологових будинках при обстеженні жінок з невідомим ВІЛ-статусом з метою призначення антиретровірусної (далі – АРВ) профілактики за відсутності можливості провести тестування двома ШТ;
- в аварійних ситуаціях на робочому місці (тестування пацієнта та медичного працівника).
Дослідження на ВІЛ-інфекцію із застосуванням ШТ проводиться після отримання інформованої згоди особи на добровільній основі та проведення до тестового консультування відповідно до Порядку, затвердженого наказом Міністерства охорони здоров’я України від 19.08.2005 № 415.
Матеріалом для дослідження на наявність антитіл до ВІЛ за допомогою ШТ є зразок цільної крові (з пальця або вени), сироватки або плазми крові.
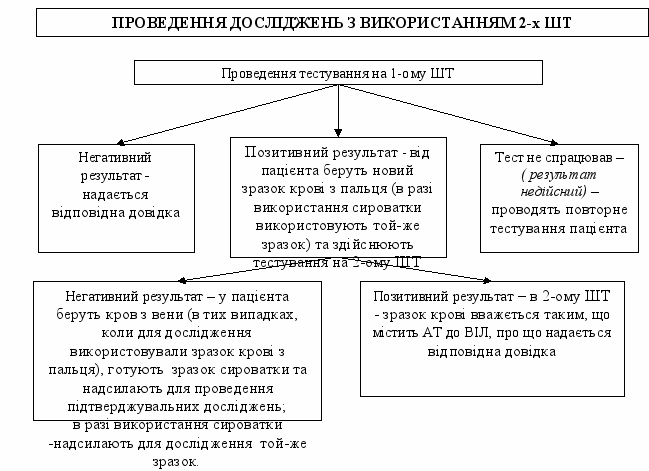
1.2.1. Порядок проведення скринінгових досліджень
з підтвердженням 2-им ШТ
Тестування на 2-х ШТ здійснюють на тестах двох різних виробників: 1-ий тест – з найвищим показником чутливості, 2-ий ШТ - з найвищим показником специфічності.
1.2.1.1. Перед початком тестування зразків крові з пальця відомості щодо особи вносять в Журнал реєстрації результатів досліджень за допомогою швидких тестів (форма первинної облікової документації № 510-6/0).
При тестуванні зразка сироватки дані щодо особи реєструють в Журнал реєстрації зразків сироваток крові, що надійшли для проведення досліджень на АТ до ВІЛ за допомогою 2-х ШТ (форма первинної облікової документації № 498-5/0).
1.2.1.2. Забір крові, підготовку ШТ та процедуру проведення тестування здійснюють відповідно до вимог інструкції про застосування ШТ. Інтерпретацію отриманих результатів здійснюють у відповідності до критеріїв, зазначених в інструкції. Облік результатів здійснюють лише протягом зазначеного в інструкції часового проміжку. Здійснювати облік результатів після закінченого визначеного терміну заборонено.
1.2.1.3. Результат дослідження оцінюють згідно з інструкцією із застосування ШТ і реєструють в Журналі реєстрації результатів досліджень за допомогою ШТ (форма первинної облікової документації № 510-6/0) та в Журналі протоколу проведення дослідження швидкими тестами (форма первинної облікової документації № 510-7/0) для зразків крові з пальця.
При тестуванні зразка сироватки крові результати реєструють в Журналі реєстрації зразків сироваток крові, що надійшли для проведення досліджень на АТ до ВІЛ за допомогою 2-х ШТ (форма первинної облікової документації № 498-5/0).
1.2.1.4. При отриманні негативного результату на 1-ому ШТ:
- при тестуванні зразка сироватки пацієнту надається довідка про результати дослідження на наявність антитіл до ВІЛ (форма первинної облікової документації № 503-4/0);
- при тестуванні зразка цільної крові лікар проводить післятестове консультування та видає особі довідку про відсутність антитіл до ВІЛ-інфекції за результатами тестування ШТ (форма первинної облікової документації № 503-4/о).
1.2.1.5. При отриманні позитивного результату на 1-ому ШТ здійснюють додаткове дослідження зразка сироватки другим ШТ іншого виробника. В разі тестування зразка крові з пальця, у пацієнта відразу здійснюють додаткове дослідження нового зразка цільної крові.
1.2.1.6. При отриманні позитивного результату на 2-му ШТ особі надається довідка про наявність АТ до ВІЛ (форма первинної облікової документації № 503-5/0). Особу направляють до відповідного регіонального центру СНІДу з метою додаткового обстеження та взяття на диспансерний облік.
1.2.1.7. При отриманні негативного результату тестування в 2-ому ШТ зразка цільної крові у пацієнта здійснюють забір крові з вени для направлення на проведення підтверджувальних досліджень.
При тестуванні зразка сироватки крові – для проведення підтверджувальних досліджень надсилають той же зразок. Дані про пацієнтів реєструють в Журналі реєстрації зразків крові, що направляються для проведення підтверджувальних досліджень на АТ до ВІЛ (форма первинної облікової документації № 502-4/0). Кожен зразок сироваток супроводжується направленням на проведення підтверджувальних досліджень (форма первинної облікової документації № 249-4/0).
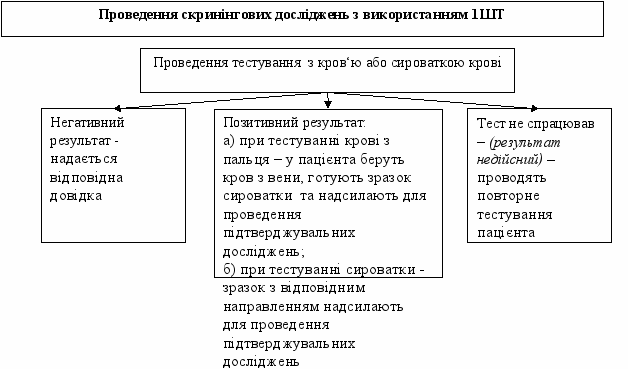
1.2.2. Порядок проведення скринінгових досліджень з використанням 1 ШТ
1.2.2.1 Перед початком тестування здійснюють реєстрацію даних на пацієнта в Журналі реєстрації надходження зразків сироваток крові для проведення скринінгових досліджень на АТ до ВІЛ (форма первинної облікової документації № 502-3/0) .
1.2.2.2. Забір крові, підготовку ШТ та процедуру проведення тестування здійснюють відповідно до вимог інструкції про застосування ШТ. Інтерпретацію отриманих результатів здійснюють у відповідності до критеріїв, зазначених в інструкції. Облік результатів здійснюють лише протягом зазначеного в інструкції часового проміжку. Здійснювати облік результатів після закінченого визначеного терміну заборонено.
1.2.2.3. Результати тестування реєструють в Журналі протоколу проведення досліджень (форма первинної облікової документації № 510-7/0).
1.2.2.4. При отриманні негативного результату на кожного пацієнта виписується довідка про результати дослідження на наявність антитіл до ВІЛ (форма первинної облікової документації № 503-4/0).
1.2.2.5. Всі зразки сироваток, що мають позитивний результат, потребують проведення підтверджувальних (верифікаційних) досліджень. Кожен зразок сироваток супроводжується направленням на проведення підтверджувальних досліджень (форма первинної облікової документації № 249-4/0) та реєструють в Журналі реєстрації зразків крові, що направляються для проведення підтверджувальних досліджень на АТ до ВІЛ (форма первинної облікової документації № 502-4/0).
Зразки надсилають у відповідну лабораторію, якій надано право здійснювати підтверджувальні дослідження.
1.2.2.6. При отриманні позитивного результату зі зразком крові з пальця, у пацієнта здійснюють забір крові з вени та направляють цей зразок для проведення підтверджувальних досліджень. Кожен зразок сироваток супроводжується направленням на проведення підтверджувальних досліджень (форма первинної облікової документації № 249-4/0) та реєструють в Журналі реєстрації зразків крові, що направляються для проведення підтверджувальних досліджень на АТ до ВІЛ (форма первинної облікової документації № 502-4/0).
2. ПОРЯДОК ПРОВЕДЕННЯ ДОСЛІДЖЕНЬ ДІТЕЙ, НАРОДЖЕНИХ ВІЛ-ІНФІКОВАНИМИ МАТЕРЯМИ
У зв’язку з впровадженням в Україні молекулярно-біологічних методів ранньої діагностики ВІЛ-інфекції у дітей, народжених інфікованими матерями, серологічні дослідження на наявність антитіл до ВІЛ здійснюють наступним чином:
2.1. Перше обстеження дитини, народженої жінкою з встановленим ВІЛ-прозитивним статусом, здійснюють при народженні в пологовому будинку. Для цього здійснюють забір крові в пробірку закритого типу (аналог «вакутайнера») об’ємом 2,0 -2,5 мл з наповнювачем для отримання сироватки. Зразок надсилають в лабораторію для проведення тестування з направленням для проведення досліджень на наявність АТ до ВІЛ зі зразком крові дитини, народженої ВІЛ-інфікованою матір’ю (форма первинної облікової документації № 249-5/0).
У випадках, коли вагітній тестування на ВІЛ вперше проводиться в пологовому будинку та у якої за результатами тестування ШТ виявлено позитивний результат, зразок сироватки такої жінки та її новонародженої дитини надсилають в лабораторію для проведення досліджень методом ІФА.
2.2. При взятті дитини на диспансерний облік у відповідному центрі СНІДу здійснюють дослідження зразка сироватки за допомогою 3-х альтернативних ТІФА-тест-систем. При отриманні позитивних результатів на 3-х тест-системах, надається довідка (форма первинної облікової документації № 503-6/0). Подальше обстеження дитини здійснюють відповідно до діючих в Україні нормативних документів, затверджених Міністерством охорони здоров’я України.
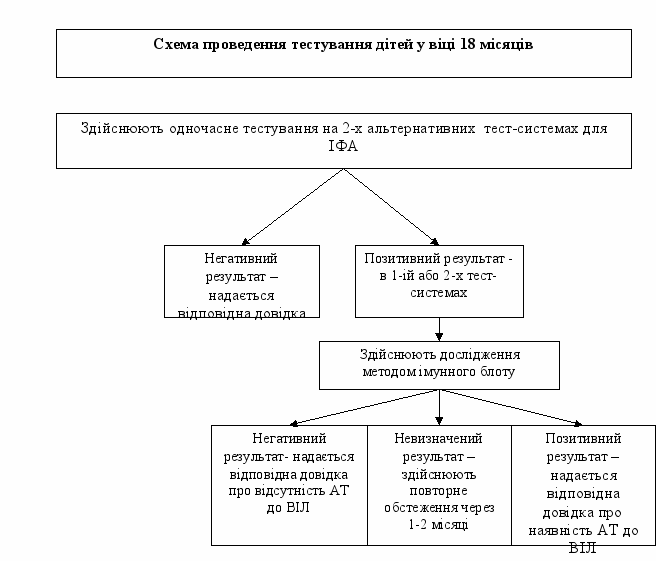
2.3. Тестування дитини у віці 18 місяців методом ІФА здійснюють на 2-х альтернативних тест-системах (1-а - для одночасного виявлення АТ до ВІЛ 1/2 та АГ р24 ВІЛ-1, 2-а - з найвищим показником специфічності). При отриманні негативних результатів тестування дитині надається довідка (форма первинної облікової документації № 503-6/0). Подальшого обстеження дитина не потребує.
За наявності позитивних результатів в 2-х або 1-ій тест-системі ІФА, здійснюють додаткове дослідження методом імунного блоту.
2.4. При отриманні позитивного результату в 2-х тест-системах для ІФА та імунному блоті, зразок сироватки вважається таким, що містить АТ до ВІЛ, про що надається відповідна довідка (форма первинної облікової документації
№ 503-7/0).
2.5. У разі отримання невизначених результатів досліджень дітей у віці 18 місяців методом імунного блоту, рекомендовано продовжити обстеження дітей до 20-24 місяців, про що надається довідка (форма первинної облікової документації № 503-7/0).
2.6. У випадках, коли дитина, народжена ВІЛ-інфікованою жінкою, має 2 позитивні результати щодо наявності провірусної дезоксирибонуклеіноваої кислоти (далі – ДНК) ВІЛ, або якщо дитині призначена антиретровірусна терапія (далі – АРТ) у віці до 18 місяців, така дитина не потребує обстеження методом ІФА та імунного блоту у віці 18 місяців, оскільки вона вже має ВІЛ-статус.
- ПІДТВЕРДЖУВАЛЬНІ ДОСЛІДЖЕННЯ
Підтверджувальні (верифікаційні) дослідження - дослідження, що здійснюють зі зразком, позитивним в первинних скринінгових дослідженнях. Проведення підтверджувальних досліджень здійснюється на альтернативних тест-системах, що відрізняються від тестів, на яких проводили скринінгові дослідження (тест-системи інших виробників тестів).
Тактику проведення підтверджувальних досліджень в Україні для лабораторій, що здійснюють такі дослідження, визначає Референс-лабораторія діагностики ВІЛ-інфекції Українського центру з профілактики і боротьби зі СНІДом (далі - Референс-лабораторія) відповідно до зазначених в Положенні про лабораторію функціональних обов’язків.
Проведення підтверджувальних досліджень здійснюють відповідно до рекомендацій, що надаються Референс-лабораторією на кожний поточний рік, де визначається перелік алгоритмів та тест-систем, що використовуються в алгоритмі, та критерії позитивності для кожної тест-системи. Зміна стратегії та тактики підтверджувальних досліджень залежить від спектру тестів, зареєстрованих в Україні, зміни рівня розповсюдження ВІЛ в окремих групах населення, впровадження нових методів діагностики ВІЛ.
ПОРЯДОК ПРОВЕДЕННЯ ПІДТВЕРДЖУВАЛЬНИХ ДОСЛІДЖЕНЬ
Використання комбінації ТІФА та/або ШТ, дозволяє отримати надійні та достовірні результати при проведенні підтверджувальних досліджень щодо наявності серологічних маркерів ВІЛ. В алгоритмі підтвердження застосовують тест-системи, що дозволяють виявляти антитіла до ВІЛ ½ та антиген р24 ВІЛ-1 як в форматі комбінованих тестів, так і окремо для кожного з компонентів (антитіл або антигену).
3.1. Відомості щодо особи, зразок якої надійшов для проведення підтверджувальних досліджень, реєструють в журналі (форма первинної облікової документації 498-6/0).
3.2. Перед початком тестування заповнюють протокол дослідження (форма первинної облікової документації 498-3/0), де на схемі планшету вказують плановану послідовність внесення проб. Всі зразки тестують на першій підтверджувальній тест-системі.
3.3. В разі отримання негативних результатів зразки сироваток розцінюють як такі, що не містять антитіл до ВІЛ ½. Про це надається довідка (форма первинної облікової документації 503-8/0). Зразки з позитивними результатами потребують подальшого тестування з використанням алгоритмів, наведених в цьому документі.
3.4. В разі отримання позитивних результатів при проведенні підтверджувальних досліджень надається довідка (форма первинної облікової документації 503-9/0).
3.5. При отриманні невизначених (сумнівних) результатів надається довідка про необхідність повторного обстеження пацієнта через 2 тижні (форма первинної облікової документації 503-10/0).
3.6. При проведенні підтверджувальних досліджень з використанням тест-системи для імунного блоту, надається довідка (форма первинної облікової документації 503-7/0).
3.7. Зразки сироваток, що надійшли в лабораторію для проведення підтверджувальних досліджень, після проведення тестування зберігають протягом 1 року в морозильній камері при мінус 20С в пластикових пробірках з кришками.
Зразки сироваток з негативними результатами в підтверджувальних дослідженнях, після закінчення терміну зберігання, можуть бути знезаражені.
Зразки з позитивними результатами тестування (навіть на 1-ій з тест-систем) можуть зберігатись в лабораторії без обмеження терміну. Оптимальною температурою для їх зберігання є мінус 70 С.
Всі зразки, що зберігаються в банку сироваток, реєструють в журналі (форма первинної облікової документації 498-7/0).
3.2. Алгоритми проведення підтверджувальних досліджень
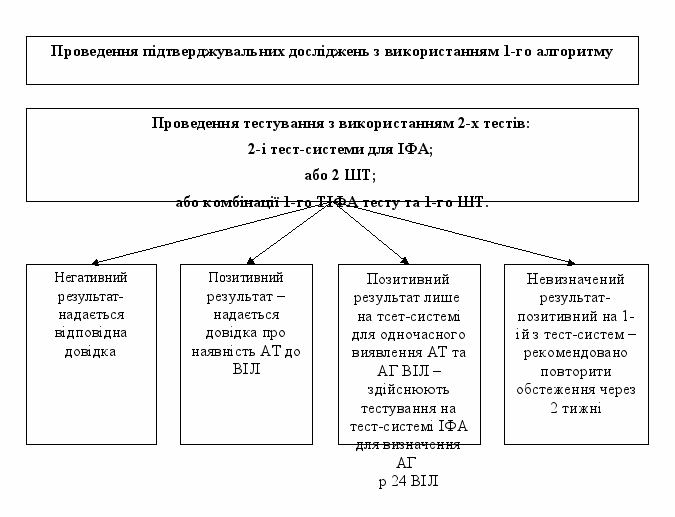
3.2.1. Проведення підтверджувальних досліджень з використанням 1-го алгоритму.
Алгоритм передбачає послідовне використання 2-х альтернативних тестів.
- 2-і тест-системи для ТІФА – 1-а тест-система з найвищою чутливістю для одночасного виявлення АТ та АГ до ВІЛ, 2-а тест-система з найвищим показником специфічності;
- 2 ШТ – 1-ий з найвищим показником чутливості, 2-ий – з найвищим показником специфічності;
- комбінації 1-го ТІФА тесту та 1-го ШТ тест-система ІФА - з найвищою чутливістю для одночасного виявлення АТ та АГ до ВІЛ, ШТ - з найвищим показником специфічності.
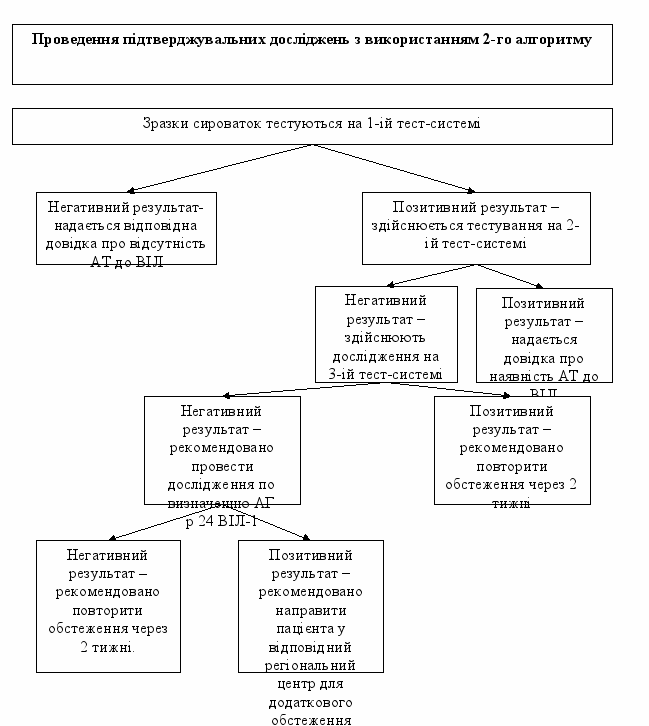
3.2.2. Проведення підтверджувальних досліджень з використанням 2-го алгоритму.
Алгоритм передбачає послідовне використання 3-х тест-системи ТІФА:
- 1-а тест-система - для одночасного виявлення АТ та АГ до ВІЛ;
- 2-а тест-система - для визначення АТ класу IgG;
- 3-я тест-система - для визначення АТ класів IgA, IgM та IgG.
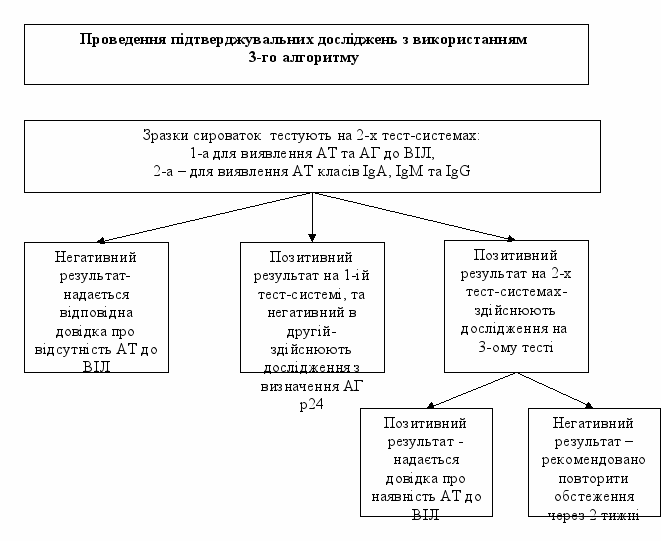
3.2.3. Проведення підтверджувальних досліджень з використанням 3-го алгоритму.
Алгоритм передбачає використання 3-х ТІФА:
- тестування зразка одночасно здійснюють на 2-х тест-системах: 1-а тест-система для одночасного виявлення АТ та АГ до ВІЛ, 2-а тест-система для визначення АТ класів IgA, IgM та IgG;
- після отримання результатів додатково здійснюють дослідження з використанням 3-ї тест-системи, що визначає АТ класу IgG.
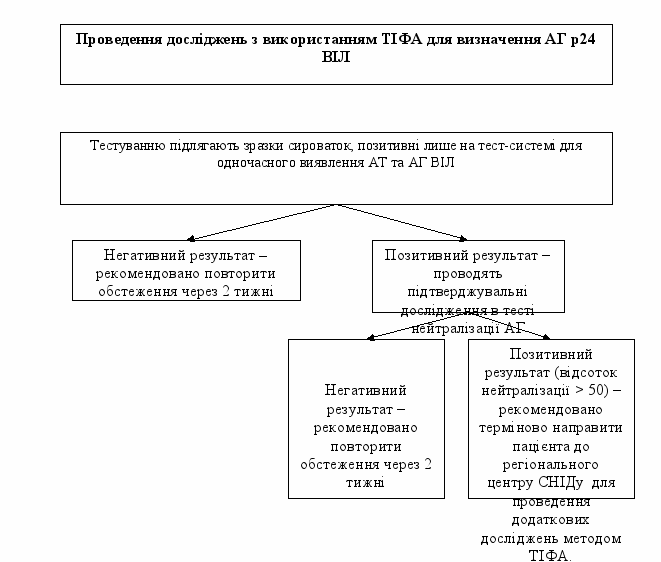
3.2.4. Проведення підтверджувальних досліджень з використанням тест-системи для визначення АГ р24 ВІЛ-1
Тести для виявлення антигену р-24 ВІЛ надають можливість визначати вільний антиген в сироватці або плазмі крові. Цей тест можливо використовувати для тестування пацієнтів на ранній стадії ВІЛ-інфекції або ВІЛ-інфікованих на стадії прогресування захворювання. Крім цього, цей тест використовують додатково при проведення підтверджувальних досліджень.
3.2.4.1. При отриманні позитивного результату при тестуванні зразків сироваток лише на тест-системі для одночасного визначення антитіл до ВІЛ ½ та антигену р24 ВІЛ-1, здійснюють додаткове дослідження з використанням ТІФА тест-системи для визначення антигену р24 ВІЛ-1.
3.2.4.2. При отриманні негативного результату при визначенні антигену p24 ВІЛ-1, пацієнт потребує повторного обстеження через 2 тижні, про що надається довідка (форма первинної облікової документації № 503-10/0).
3.2.4.3. У разі отримання позитивного результату при визначенні антигену p24 ВІЛ-1 зразок додатково досліджують в тесті нейтралізації (конфірматорний тест). Пацієнти, у яких отримано позитивний результат в тесті нейтралізації АГ (> 50%), повинні бути терміново направлені до відповідного регіонального центру СНІДу для додаткового обстеження за допомогою ТІФА.
3.2.4.4. При отриманні негативного результату в тесті нейтралізації рекомендовано повторити обстеження пацієнта через 2 тижні (форма первинної облікової документації № 503-10/0).
3.3. ПРОВЕДЕННЯ ДОСЛІДЖЕНЬ З ВИКОРИСТАННЯМ методу імунного блоту
Імунний блот (вестерн блот) - метод, що дозволяє виявляти антитіла до окремих антигенів ВІЛ та є найбільш специфічним тестом. Хоча цей тест широко використовується в лабораторіях, сьогодні він вважається допоміжним (уточнюючим) при проведенні підтверджувальних досліджень, оскільки є досить вартісним.
3.3.1. Проведення досліджень та інтерпретацію результатів тестування методом ІБ здійснюють відповідно до порядку, зазначеному в інструкції до тесту.
3.3.2. Дослідження методом імунного блоту здійснюють в наступних випадках:
- при обстеженні дітей, народжених ВІЛ-інфікованими матерями, у віці 18 місяців (за наявності позитивних результатів ТІФА);
- діти у віці 18 місяців та старше, яким вперше проводили тестування на АТ до ВІЛ (за наявності позитивних результатів ТІФА);
- при обстеженні вагітних жінок при взятті на диспансерний облік;
- при проведенні підтверджувальних досліджень з використанням різних алгоритмів тестування відповідно до критеріїв, визначених на поточний рік в рекомендаціях Референс - лабораторії.
4. Обстеження пацієнтів при взятті на диспансерний облік
Всі пацієнти, у яких вперше були виявлені АТ до ВІЛ (дорослі та діти, які вперше були виявлені, як інфіковані, у віці після 18 місяців) перед взяттям на диспансерний облік у відповідному центрі СНІДу, повинні пройти друге тестування.
4.1. Від пацієнта беруть кров та направляють в лабораторію, що здійснює підтверджувальні дослідження з відповідним направленням (форма первинної облікової документації № 249-6/0) для проведення досліджень методом ІФА (ідентифікація особи).
4.2. Відомості щодо особи вносять в Журнал реєстрації результатів досліджень при тестуванні пацієнтів, які стають на диспансерний облік (форма первинної облікової документації № 498-8/0).
4.3. Зразки сироваток одночасно досліджуються з застосуванням 2-х альтернативних ІФА діагностикумів або 2-х альтернативних ШТ.
4.4. В разі отримання позитивних результатів зразки сироваток розцінюються як такі, що містять антитіла до ВІЛ, про що пацієнту надається довідка (форма первинної облікової документації № 503-9/0) .
4.5. При обстеженні вагітних жінок, які стають на диспансерний облік, та дітей, у яких АТ до ВІЛ вперше були виявлені у віці після 18 місяців, дослідження здійснюють методом ТІФА на 2-х альтернативних тест-системах та методом імунного блоту (ІБ) довідка (форма первинної облікової документації № 503-7/0).
5. ПОРЯДОК ВЗЯТТЯ КРОВІ ТА ОФОРМЛЕННЯ НАПРАВЛЕНЬ ДЛЯ ПРОВЕДЕННЯ ДОСЛІДЖЕНЬ
5.1. Матеріалом для лабораторного дослідження методом ІФА з застосуванням ТІФА є сироватка або плазма крові; при застосуванні ШТ – цільна кров, сироватка або плазма. Для досліджень методом ІФА взяття крові здійснюють в пробірку закритого типу (аналог «вакутайнера» для дослідження сироватки без наповнювача, або з активатором згортання) об’ємом 5,0 -5,5 мл для отримання сироватки. Пробірку підписують - ПІБ пацієнта або реєстраційний номер згідно з Журналом реєстрації взяття крові для проведення досліджень на АТ до ВІЛ (форма первинної облікової документації № 498/9-0).
5.2. Пробірки, до відправлення в діагностичну лабораторію, зберігають в холодильнику при температурі +4-6° С. В тих випадках, коли кров може бути направлена в діагностичну лабораторію протягом 24-72 годин після взяття, відбирати зразки сироваток не треба.
Примітка.
За відсутності можливості взяти кров у спеціальні пробірки закритого типу, відокремлення сироватки від еритроцитів здійснюють не пізніше, ніж через 3 години після взяття крові наступним чином:
- пробірку зі зразком крові ставлять в термостат на 30 хв. при температурі +37оС для швидкого формування фібринового згортку;
- після цього відокремлюють згорток від стінок пробірки скляною паличкою (для кожного зразка окрема скляна паличка);
- проби крові на 1 годину ставлять у холодильник при температурі +4 …8оС;
- надалі зразки крові центрифугують 5 хв. при 1500 -3.000 об/хв.;
- відбирають зразки сироваток лише одноразовими інструментами в пластикові пробірки з кришкою об’ємом 1,5-1,5 мл та зберігають до відправлення в лабораторію в холодильнику при +4…6оС. Зразки сироваток крові повинні бути направлені в лабораторію протягом 24-72 годин після забору крові.
Забір та транспортування матеріалу для досліджень методом ІФА здійснює персонал, який пройшов інструктаж з цього питання.
5.3. При направленні на дослідження зразків крові дітей віком до 24 місяців в графі «вік» слід вказувати день, місяць та рік народження.
5.4. В пункті забору крові заповнюють направлення на проведення досліджень на наявність АТ до ВІЛ (форма первинної облікової документації
№ 249-7/0), з яким зразок сироватки надсилається у відповідну лабораторію.
5.5. Доставка матеріалу в лабораторію для дослідження здійснюється у спеціальних контейнерах або сумках-холодильниках, стійких до дії дезінфектантів. На дно цих ємностей поміщають адсорбуючий матеріал (марлева серветка, тканина, вата тощо). Штатив з пробірками поміщають в сумку-холодильник або в контейнер з холодовими агентами.
5.6. Направлення на проведення дослідження зразку крові на наявність АТ до ВІЛ упаковують окремо від проб. Ємкості з матеріалом повинні бути промарковані відповідно до направлення. Забороняється обертати направлення навколо ємкості з об'єктом досліджень, вкладати в контейнер.
5.7. В кожній медичній установі визначають осіб, на яких покладають функції доставки зразків сироваток у діагностичну лабораторію.
