Молекулярно-генетические методы и компьютерные технологии в системе эпидемиологического надзора за хантавирусными инфекциями 14. 00. 30 эпидемиология 03. 00. 06 вирусология
| Вид материала | Автореферат диссертации |
- Мониторинг микробиоценозов влагалища в системе эпидемиологического надзора при инфекционно-воспалительных, 633.15kb.
- Мониторинг микробиоценозов влагалища в системе эпидемиологического надзора при инфекционно-воспалительных, 642.63kb.
- Эпидемиологического надзора за малярией, 514.35kb.
- Нормативно-методическая и законодательная база деятельности государственного санитарно-эпидемиологического, 55.14kb.
- Модели эволюции. Генетические алгоритмы, 361.44kb.
- Молекулярно-генетические механизмы активации тромбоцитов и чувствительности к антиагрегантным, 3372.01kb.
- Дудина кристина Рубеновна хроническая hвv-инфекция: молекулярно-генетические методы, 574.63kb.
- Приказ Первого заместителя председателя Агентства Республики Казахстан по делам здравоохранения, 601.07kb.
- Доклад Управления Роспотребнадзора по Республике Коми об осуществлении государственного, 688.51kb.
- План основных организационных мероприятий управления федеральной службы по надзору, 3516.32kb.
Методы исследований. В работе были использованы эпидемиологические, молекулярно-генетические, иммуносерологические, вирусологические методы, а также методы статистического анализа.
Основой методологии нашего исследования был комплексный эпидемиологический подход, включающий эпизоотологическое и эпидемиологическое обследование природных и эпидемических очагов ГЛПС, молекулярно-генетическую характеристику выявленных изолятов хантавирусов, а также анализ полученных данных с помощью современных компьютерных программ и ГИС-технологии.
В работе использовали информационно-аналитическую систему «COMPASS» ссылка скрыта, разработанную Институтом проблем передачи информации РАН (ИППИ РАН). Система «КОМПАС» реализована в виде программы на языке Java 1.5. Объектами анализа служили районы Липецкой области (картографические данные) и связанные с ними атрибутивные данные (эпидемиологические показатели). Информационная база данных «ГЛПС в Липецкой области» была сформирована в формате таблиц Microsoft Excel, в которые включены предварительно отобранные для анализа показатели. Перед началом работы в системе «КОМПАС» таблицы данных были преобразованы в формат базы данных – dbf, кроме этого были созданы дополнительные конфигурационные файлы, содержащие алгоритмы для работы с данными и их анализа.
Для проведения молекулярно-генетических исследований (экстракции РНК, обратной транскрипции, ПЦР-анализа и других этапов исследования) использовали отдельные реактивы и коммерческие наборы производства «АмплиСенсТМ» (ФГУН ЦНИИ эпидемиологии).
Тотальную РНК из легочных суспензий и цельной крови выделяли по модифицированному методу Хомчинского, используя для этого компоненты коммерческих наборов «РИБО-золь-В» и «РИБО-сорб» (производство ФГУН ЦНИИ эпидемиологии). РНК из плазмы крови больных ГЛПС и культуральной (вируссодержащей) жидкости выделяли методом нуклеосорбции в присутствии гуанидинтиоцианата, используя набор «РИБО-сорб». Обратную транскрипцию проводили со случайными праймерами с использованием набора «Реверта-L» (производство ФГУН ЦНИИ эпидемиологии). Для постановки ПЦР и секвенирования изолятов РНК использовались наборы специфичных и универсальных праймеров, разработанных в ходе настоящей работы. Для выбора праймеров и зондов использовали программы Oligo 330, Primer Premier 5, Vector NTI 9, ресурсы интернета и веб-сайты - ссылка скрыта, ссылка скрыта и ссылка скрыта (BLAST, GenBank).
Выявление специфического антигена в материале от мелких млекопитающих осуществляли с использованием коммерческой диагностической тест-системы "Хантагност" (производство ФГУП ПИПВЭ им. М.П. Чумакова РАМН). Выявление специфических антител класса М и G у больных ГЛПС осуществляли с помощью непрямого метода флюоресцирующих антител, используя для этой цели коммерческую тест-систему «Культуральный поливалентный диагностикум ГЛПС для непрямого МФА» (производство ФГУП ПИПВЭ им. М.П.Чумакова РАМН).
ОСНОВНЫЕ ЭПИДЕМИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ГЛПС
В РОССИЙСКОЙ ФЕДЕРАЦИИ
Ежегодно на территории РФ регистрируется 5-7 тысяч случаев ГЛПС; средний многолетний показатель заболеваемости (за 1995-2007 гг.) составляет 5,35 на 100 тысяч населения, уровень летальности - 0,5 %. Наибольшая заболеваемость отмечалась в 1997 год, когда число заболевших достигало более 20000 человек (14,3 на 100 тыс.).
При анализе динамики ГЛПС в РФ становится очевидным отсутствие тенденции к снижению уровня заболеваемости, а также существование циклических подъёмов на фоне ежегодно регистрируемых случаев этой инфекции (рис. 1).
Наиболее активные природные очаги ГЛПС располагаются в лесной ландшафтной зоне в умеренных широтах Европейской части РФ (территория Приволжского федерального округа - ПФО), где ежегодные показатели заболеваемости составляют от 8 до 67 (в среднем - 32) на 100 тысяч населения.
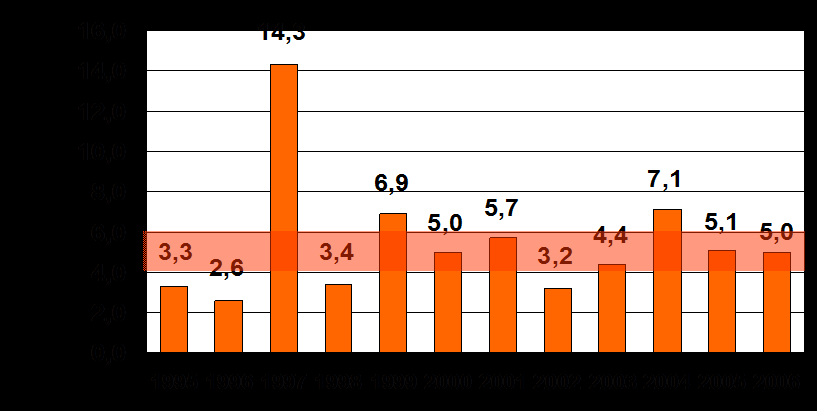
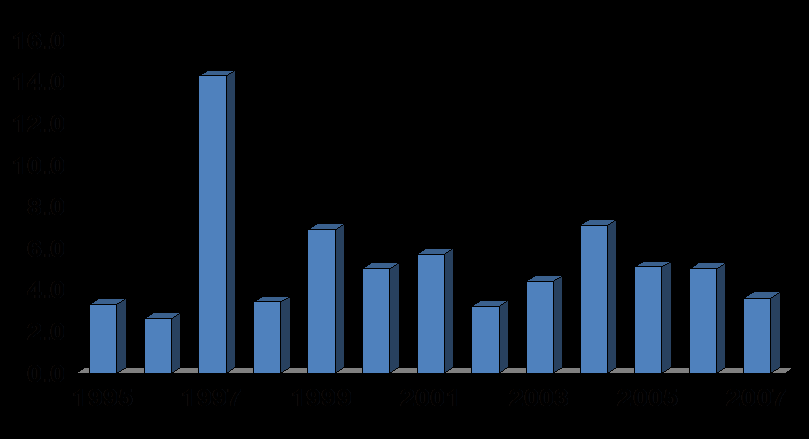
Рисунок 1. Динамика заболеваемости ГЛПС в Российской Федерации.
Заболеваемость в субъектах ПФО ассоциирована преимущественно с хантавирусом Пуумала, основным резервуаром которого является рыжая полевка. Оптимум ареала этого вида, приуроченный к широколиственным и смешанным лесам умеренной зоны, территориально совпадает с расположением крупных населенных пунктов, что значительно увеличивает риск заражения людей и уровень заболеваемости в целом. За период с 1996 по 2006 гг. по сравнению с предыдущим 10-летием (с 1985 по 1995 гг.) заболеваемость в субъектах этого округа возросла в 1,5 раза. В этот период было зарегистрировано около 82000 случаев, что составляло почти 90% от общего числа случаев зарегистрированных в Российской Федерации.
В настоящее время второе место по заболеваемости занимает Центральный федеральный округ, при этом случаи ГЛПС регистрируются во всех 18 административных областях. За период с 1996 по 2006 гг. в регионах этого округа было зарегистрировано 4237 случаев, заболеваемость по сравнению с предыдущим десятилетием возросла почти в 2 раза. Обращает внимание тот факт, что в период с 1998 по 2004 гг. добавилось 5 новых субъектов (Курская, Брянская, Липецкая, Тамбовская и Белгородская области), входящих в ЦФО, в которых стали регулярно регистрироваться случаи ГЛПС, в том числе в виде вспышек.
Помимо заболеваемости, связанной с вирусом Пуумала, в Центральном федеральном округе наиболее часто регистрируются случаи ГЛПС, ассоциированные с вирусом Добрава. При этом зарегистрированные в последние годы резкие подъёмы заболеваемости в ряде областей были вызваны преимущественно этим вирусом.
Анализ заболеваемости ГЛПС в Уральском, Северо-Западном, Сибирском и Дальневосточном федеральных округах показал, что за период с 1996 по 2006 гг. по сравнению с предыдущим десятилетием число заболевших и показатель заболеваемости на 100 тысяч практически не изменились.
Проведенный статистический анализ динамики заболеваемости за последние восемь лет (1999 – 2007 гг.) не позволил выявить тенденцию к её снижению в большинстве федеральных округов и в РФ, в целом. Установлено, что динамика заболеваемости в ЦФО существенно отличается от таковой в других округах в связи с тем, что её рост стал наблюдаться только в последние годы.
Осуществление эпиднадзора за ГЛПС в современных условиях можно представить как комплекс мероприятий, разработанных в соответствии с иерархическими уровнями эпидемического процесса (В.Б. Коротков с соавт. 1996). Мониторинг за эпидемическим процессом включает регистрацию всех лабораторно подтверждённых с помощью серологических методов случаев ГЛПС, описание клинических форм инфекции, изучение иммунологической структуры населения, включая группы риска.
Слежение за эпизоотическим процессом является неотъемлемым компонентом эпиднадзора за ГЛПС. Параметры эпизоотического процесса включают данные о составе и численности основных носителей хантавирусов, их инфицированности. Традиционно используемые в эпизоотологических исследованиях иммунологические методы (ИФА) позволяют за короткий промежуток времени провести массовый скрининг популяций мелких млекопитающих на наличие хантавирусного антигена и оценить уровень их инфицированности. На основе данных эпидемиолого-эпизоотологического надзора прогнозируется заболеваемость, оценивается эпидобстановка, принимаются управленческие решения о проведении противоэпидемических мероприятий, оценивается эффективность профилактических мероприятий.
Очевидно, что неспецифическую профилактику, которая сводится преимущественно к мерам по сокращению численности диких грызунов в ходе осуществления широкомасштабных дератизационных мероприятий в конкретных природных очагах ГЛПС, следует проводить на основе информации о циркулирующих там типах хантавирусов, вызывающих заболевания у людей. Известно, например, что заражения, связанные с вирусом Пуумала, происходят преимущественно в летне-осенний период (июль-октябрь), тогда как случаи ГЛПС, ассоциированные с вирусом Добрава, отмечаются главным образом в зимний период (декабрь-февраль). Прежде всего, эти различия обусловлены биологическими особенностями (циклами размножения) рыжей полёвки и полевой мыши, являющимися основными носителями вирусов Пуумала и Добрава на территории России.
Широко применяемые в системе эпиднадзора иммуносерологические исследования не позволяют определить спектр циркулирующих в природных очагах хантавирусов, определить перечень основных носителей, являющихся главными источниками инфицирования людей. В настоящее время информация о разнообразии и таксономической принадлежности хантавирусов, являющихся потенциальными возбудителями ГЛПС, для большинства административных регионов РФ отсутствует. Дератизационные мероприятия в природных очагах, как правило, проводятся по единой схеме, без учёта популяционных особенностей и биологических циклов носителей хантавирусов, что значительно снижает их эффективность.
Очевидно, что сохраняющаяся напряжённая эпидобстановка по заболеваемости ГЛПС требует улучшения системы эпидемиологического надзора, что предусматривает, в частности, совершенствование информационно-аналитического компонента, в том числе оптимизации схемы лабораторной диагностики хантавирусных инфекций.
РАЗРАБОТКА МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МЕТОДОВ ДЛЯ ОПТИМИЗАЦИИ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ГЛПС
Существующая схема дифференциации видовой принадлежности хантавирусов на основе традиционных иммуносерологических и вирусологических методов является сложной, трудоёмкой и малоэффективной. С учётом установленной взаимосвязи тяжести заболевания ГЛПС у людей и инфицированием определённым серо-(гено) типом хантавирусов, идентификация инфекционного агента заболевания представляет определённую эпидемиологическую значимость. Молекулярно-генетические методы являются существенным подспорьем при проведении таких исследований.
В связи с отсутствием на отечественном рынке, как коммерческих тест-систем, так и стандартизованных ПЦР-методик, актуальной являлась задача по разработке диагностических наборов для детекции и идентификации хантавирусов.
В ходе работы были сконструированы системы видоспецифичных и универсальных (группоспецифичных) праймеров для детекции широкого спектра штаммов хантавирусов комплекса ГЛПС – Пуумала, Добрава, Хантаан, Сеул и Тула (табл. 2). Кроме того, сконструированы количественные варианты ПЦР в режиме реального времени с зондами специфичными к вирусам Добрава и Пуумала (табл. 2), позволяющие оценивать количество вирусных копий в исследуемых биологических образцах.
Системы универсальных праймеров были сконструированы на основе кодирующей части генома – гена нуклеопротеина N (S-сегмент) и гена гликопротеина G2 (М-сегмент). Праймеры, расположенные в области двух различных локусов генома, были выбраны с целью повышения эффективности исследований, направленных на выявление как можно большего спектра вирусов комплекса ГЛПС, циркулирующих в природе, а также на обнаружение существующих в природе хантавирусов с возможной генетической вариабельностью в области выбранных мишеней. Системы видоспецифичных праймеров были разработаны на основе кодирующей области S-сегмента генома для дифференциации в ПЦР хантавирусов, наиболее широко распространённых на Европейской части РФ - Пуумала, Тула и Добрава (табл. 2).
Таблица 2.
Разработанные системы олигонуклеотидных праймеров и зондов для детекции и идентификации хантавирусов комплекса ГЛПС
| Название | Последовательность 5’-3’ | Позиции генома | Штамм, (сегмент) |
| Универсальные праймеры для детекции в ПЦР вирусов комплекса ГЛПС (Пуумала, Добрава, Хантаан, Сеул, Тула) | |||
| Hant-new | (+) TT(C/T)AA(G/A)GATGACA(C/G)(A/T/C)TC(A/T/G)TTTGAGG | (517-541) | Baskiria AF442613 (S) |
| Hant-mod | (+) AA(G/A)GATGACA(C/G)(A/T/C)TC(A/T/G)TTTGAGGAT | (520-543) | |
| Hant-kom | (+) TT(C/T)AA(G/A)GATGACA(C/G)(A/T/C)TC(A/T/G)TTTGAGGAT | (517-543) | |
| Hant-R | (-) C(T/A/G)GGTGC(A/T/C)C(A/C)(A/T/G)GCAAA(T/G/A)ACCCA | (991-970) | |
| DobrM-F | (+) ATCAATAGAAGGTGCATGGGGТTCTG | 2971-2996 | SK/Aa AY961616 (М) |
| DobrM-alter | (+) CAATAGAAGGTGCATGGGGTTCTG | 2973-2996 | |
| DobrM-R | (-) CCACATTGAGGTGCACCATCATCATA | 3297-3272 | |
| Специфичные праймеры для идентификации в ПЦР вирусов Пуумала, Добрава и Тула | |||
| Tulа_S/F | (+) AAGTACACTACAGAGCAGACGGGC | 123-146 | AF442621, (S) |
| Puum_S/F | (+) TACAAGAGAAGAATGGCAGATGCTG | 181-205 | Baskiria AF442613 (S) |
| Pum/Tul/R | (-) TCAATGGCATTCACATCAAGGAC | 323-301 | |
| inPUV_S/F | (+) CCCAGTCCACCATGAAAGCTGAAG | 551-574 | |
| inPUV_S/R | (-) CTGTGCTGGTGTCCCTGGTTTAAC | 774-751 | |
| DOBV_S/F | (+) AAGCTACTATCCGAGCCATCTCCAAC | 768-793 | Kurkino/98 AJ131673, (S) |
| DOBV_S/R | (-) GCAAAGACCCAGATTGATGATGGTGA | 961-936 | |
| Зонды для идентификации вирусов Пуумала и Добрава в ПЦР РРВ | |||
| PUM_S-Z | JOE-ACTCCCATTACTGGACTCATGATGTTACGGGAGTG- BQH-1 | 666-637 | Baskiria AF442613, (S) |
| DBR_M-Z | FAM-TGTGCACCATAACAGATGGCCATATCACATGCTGCAC-BQH1 | 3096-3065 | Saaremaa AJ009774 (М) |
Диагностическая эффективность разработанных методик (одностадийной ПЦР и «Nested»-ПЦР) оценивалась при исследовании клинического материала от больных. В исследование было включено 40 пациентов с предварительным клиническим диагнозом ГЛПС, поступивших в стационар в ранние сроки болезни (не позднее 4-го дня). Материал для анализа в ПЦР забирался у каждого больного в динамике (всего 10 раз) - в день поступления пациента в больницу, а затем через определенные интервалы до 17 дня болезни включительно (табл. 3). Для выявления сероконверсии анализ антител методом НМФА проводили дважды – в день поступления больного в стационар и через 2 недели повторно.
Таблица 3.
Оценка диагностической эффективности ПЦР и НМФА у больных ГЛПС в динамике
| День болезни | Положительные результаты в одностадийной ПЦР число (%) | Положительные результаты в Nested ПЦР число (%) | Положительные результаты в НМФА число (%) |
| 4 | 39 (97,5) | 40 (100) | 32 (80) |
| 6 | 37 (92,5) | 40 (100) | н.и.* |
| 7 | 34 (85) | 39 (97,5) | н.и. |
| 8 | 32 (80) | 36 (90) | н.и. |
| 9 | 28 (70) | 31 (77,5) | н.и. |
| 10 | 21 (52,5) | 31 (77,5) | н.и. |
| 11 | 19 (47,5) | 29 (72,5) | н.и. |
| 13 | 18 (45) | 23 (57,5) | н.и. |
| 15 | 14 (35) | 17 (42,5) | н.и. |
| 17 | 8 (20) | 14 (35) | 40 (100) |
н.и.* - не исследовали
В результате исследования клинического материала в первый день госпитализации хантавирусная РНК была выявлена методом «Nested» ПЦР у всех 40 больных ГЛПС (100%), в одностадийной ПЦР - у 39 из 40 больных (в 97,5%). Из полученных результатов, очевидно, что с высокой эффективностью (не менее 70%) можно выявлять РНК вируса в плазме крови у больных ГЛПС до 11-го дня болезни с помощью «Nested» ПЦР и до 9-го дня при использовании однораундовой ПЦР. С помощью НМФА антитела выявлялись у 32 (80%) больных в титрах (от 1/32 до 1/256) в день поступления в стационар. При повторном исследовании сывороток через 14 дней антитела были выявлены у 40 (100%) больных в титрах (от 1/64 до 1/8000). Несмотря на высокую чувствительность НМФА необходимость учета результатов по 4-х кратному нарастанию титров до некоторой степени ограничивает возможности данной методики для ранней диагностики ГЛПС.
Вирусная нагрузка при ГЛПС оценивалась в результате исследования с помощью ПЦР в режиме реального времени (ПЦР РРВ) и «Nested» ПЦР 120 образцов плазмы крови от 12 больных в динамике с 4 по 17 день болезни.
С помощью ПЦР РРВ было установлено, что на 4 день болезни у больных в крови присутствует РНК вируса в концентрациях от 4х104 до 1х106 копий/мл (табл. 4). За время наблюдения, то есть за 14 дней нахождения пациентов в стационаре, было выявлено постепенное снижение вирусной нагрузки в крови больных в 10-200 раз, в среднем – в 65 раз. Сравнимые результаты по чувствительности и динамике вирусной нагрузке были получены в «Nested» ПЦР при исследовании десятикратных разведений кДНК. Титры у большинства больных постепенно снижались с 1/1000 (4 день) до 1/10 (на 13-17 день); в среднем в 77 раз.
Таблица 4.
Оценка диагностической чувствительности ПЦР-методик и определение вирусной нагрузки у больных ГЛПС на основе ПЦР РРВ
| День болезни | Положительные результаты в ПЦР РРВ число (%) | Положительные результаты в Nested ПЦР число (%) | Средняя вирусная нагрузка копий/мл* | Вирусная нагрузка max-min копий/мл** |
| 4 | 12 (100) | 12 (100) | 410000 | 1118000-39000 |
| 6 | 12 (100) | 12 (100) | 147000 | 615000-5900 |
| 7 | 12 (100) | 12 (100) | 63000 | 382000-5000 |
| 8 | 12 (100) | 12 (100) | 27000 | 133000-3700 |
| 9 | 9 (75) | 11 (91) | 28000 | 231000-4000 |
| 10 | 9 (75) | 11 (91) | 8800 | 46000-6000 |
| 11 | 5 (42) | 7 (58) | 7200 | 85000-6700 |
| 13 | 5 (42) | 6 (50) | 14000 | 119000-4000 |
| 15 | 5 (42) | 5 (42) | 7200 | 56000-2600 |
| 17 | 4 (33) | 4 (33) | 2300 | 19600-2700 |
*- средняя величина, рассчитанная для всей исследуемой выборки образцов (12)
** - пределы вирусной нагрузки для позитивной выборки образцов
Установлено, что с 9 дня болезни вирусная нагрузка в крови больных ГЛПС начинает снижаться до уровня, соответствующего пределу детекции методики. К 17 дню болезни только у каждого третьего больного количество РНК в крови находится на уровне выше 1х103 копий/мл, что и ограничивает возможности ПЦР для диагностики ГЛПС на поздних сроках болезни (табл. 4).
Новые данные о длительности сохранения вируса в крови и концентрации вирусной РНК в клинических пробах, полученные с помощью количественных вариантов ПЦР, позволяют обосновать оптимальные сроки (период болезни), в которые наиболее целесообразно использовать молекулярно-генетических методы для мониторинга состояния больного (табл. 4). Кроме того, информация о количестве вирусной РНК в организме больного важна при назначении терапии и оценки её адекватности, особенно при тестировании новых средств специфичного лечения ГЛПС.
В ходе настоящей работы была установлена рациональность использования ПЦР-анализа для подтверждения диагноза ГЛПС в ранние сроки болезни. Диагностическая чувствительность разработанных методик (одностадийной ПЦР, «Nested» ПЦР, ПЦР РРВ) в первую неделю болезни составляет 85-100% (табл. 3, 4). В этот ранний период болезни дифференциальная клиническая диагностика вызывает, как правило, наибольшие затруднения. Использование ПЦР в более поздние сроки (на 2 неделе болезни), несмотря на снижение эффективности, является целесообразным и оправданным с целью генотипирования и определения видовой принадлежности возбудителей ГЛПС.
Таким образом, применение иммуносерологических методов, направленных на выявление сероконверсии специфических антител у больных, по-прежнему является основным подтверждающим тестом при ГЛПС («золотым стандартом диагностики»). Однако, в целях совершенствования лабораторной диагностики – для подтверждения клинического диагноза с 1 дня болезни, идентификации возбудителя, определения вирусной нагрузки у больных людей, необходимым компонентом в схеме диагностики является ПЦР-анализ.
СОВЕРШЕНСТВОВАНИЕ ЭПИЗООТОЛОГИЧЕСКОГО МОНИТОРИНГА ПРИРОДНЫХ ОЧАГОВ ГЛПС
Одна из задач исследования заключалась в оптимизации схемы эпизоотологических исследований путём включения в неё ПЦР-методик.
При исследовании около 500 проб от грызунов, отловленных в Самарской, Курской, Тамбовской, Воронежской, Липецкой, Тюменской и Омской областях методами ПЦР и ИФА выявлено, что ПЦР не уступает, а в некоторых случаях превосходит по своей диагностической эффективности иммуносерологические методы.
В связи с тем, что при проведении эпизоотологических исследований, как правило, в каждом субъекте РФ ежегодно исследуются на наличие хантавирусного антигена пробы от мелких млекопитающих в объёме от нескольких сотен до нескольких тысяч особей, не представляется целесообразным, в качестве альтернативы ИФА, использовать для этой цели молекулярно-генетические методы (из-за их более низкой производительности, высокой трудоёмкости и стоимости).
Однако, несмотря на то, что иммунологические методы являются оптимальными при эпизоотологическом мониторинге (позволяют проводить массовый скрининг проб за короткое время), их информативные возможности для дифференциации хантавирусов сильно ограничены. Настоящее исследование показало, что молекулярно-генетические методы являются наиболее эффективными и предпочтительными для идентификации и характеристики хантавирусов, циркулирующих в природе.
В этой связи оптимизированный алгоритм эпизоотологических исследований можно представить в виде следующей схемы. На первом этапе с применением ИФА осуществляется скрининг материала от грызунов на наличие антигена, проводится оценка уровня их инфицированности. На втором этапе отобранные для дальнейшего исследования положительные и сомнительные пробы изучаются с применением молекулярно-генетических методов, что позволяет определять спектр циркулирующих в данном регионе хантавирусов, а также оценивать уровень гетерогенности их популяций.
Исходя из гипотезы повсеместной географической распространённости хантавирусов (Е.А. Ткаченко с соавт. 2001), изучались возможности использования разработанных молекулярно-генетических методик для выявления «новых» природных очагов ГЛПС.
Астраханская область считалась до недавнего времени неэнзоотичным по ГЛПС регионом. Ландшафтно-географические характеристики области (50% территории занимают степи и полупустыни), отсутствие лесных массивов и низкая численность основных видов грызунов-носителей хантавирусов обусловливали отсутствие интереса к проведению исследований на наличие природных очагов хантавирусов.
В ходе работы изучались пробы от 389 мышевидных грызунов и мелких млекопитающих 9 видов, отловленных на территории Астраханской области, а также в пограничных с ней районах Калмыкии. Точки забора материала были приурочены к степной и полупустынной зонам, а также к интразональным стациям Волго-Ахтубинской поймы.
В результате проведенных молекулярно-генетических исследований в 35 пробах была выявлена РНК хантавирусов. Положительными были пробы от гребенщиковых песчанок (8), полевых мышей (22), обыкновенных полевок (4) и от 1 домовой мыши.
В результате секвенирования 18 положительных образцов была установлена их таксономическая принадлежность к виду Добрава. Все новые геноварианты характеризовались, независимо от источника выделения (вида грызуна), высокой генетической однородностью, уровень их различий варьировал в пределах от 0,4 до 2,7%. При этом выявлена значительная генетическая удалённость новых РНК-изолятов от всех известных штаммов вируса Добрава, зарегистрированных в базе данных GenBank.
Часть материала (74 пробы) были исследованы с помощью иммунологических методов в лаборатории геморрагических лихорадок Института полиомиелита и вирусных энцефалитов под руководством профессора Е.А.Ткаченко. В 4-х образцах с помощью МФА были выявлены специфические антитела к хантавирусам. В ходе дальнейших исследований по серотипированию положительных проб были определены максимальные диагностические титры антител к вирусу Добрава.
Таким образом, с использованием молекулярных технологий впервые было установлено, а затем с помощью иммунологических методов подтверждено, что на территории Астраханской области (в Енотаевском, Харабалинском, Красноярском и Лиманском районах) и в Республике Калмыкия (Юстинском районе) существуют природные очаги ГЛПС, ассоциированные с хантавирусом Добрава. При этом циркуляция новых геновариантов этого вируса была выявлена в степной, полупустынной и пойменной ландшафтно-географических зонах данного региона.
