Міністерство освіти та науки україни міністерство охорони здоров`я україни сумський державний університет медичний інститут карпенко юлія сергіївна
| Вид материала | Документы |
- Міністерство освіти та науки україни міністерство охорони здоров’я україни сумський, 964.46kb.
- Міністерство освіти та науки україни міністерство охорони здоров’я україни сумський, 1028.21kb.
- Міністерство освіти І науки україни міністерство охорони здоров’я україни сумський, 784.64kb.
- Міністерство освіти І науки україни міністерство охорони здоров’я україни сумський, 1042.47kb.
- Ерство освіти І науки україни міністерство охорони здоров’я україни сумський державний, 950.39kb.
- Міністерство освіти І науки, молоді та спорту України Міністерство охорони здоров’я, 5570.5kb.
- Я україни міністерство освіти І науки, молоді та спорту україни сумський державний, 3595.69kb.
- Я україни міністерство освіти І науки, молоді та спорту україни сумський державний, 6359.55kb.
- Міністерство охорони здоров'я україни харківський державний медичний університет застосування, 220.26kb.
- Міністерство охорони здоров’я україни національний медичний університет імені, 54.32kb.
Таблиця 3. Розподіл здорових осіб за статтю та віком.
| Стать | Вікові групи обстежених | | |||
| 18-21 рік | 22-24 роки | | |||
| Абс. | % | Абс. | % | Усього | |
| Чоловіча | 10 | 55,6±1,17 | 8 | 44,4±1,17 | 18 |
| Жіноча | 22 | 52,4±0,77 | 20 | 47,6±0,77 | 42 |
Таблиця 4. Розподіл хворих на інфаркт головного мозку за статтю та локалізацією вогнища.
| Стать | Лівопівкульна | Правопівкульна | | ||
| Абс. | % | Абс. | % | Усього | |
| Чоловіча | 32 | 41,0±0,50 | 46 | 59,0±0,50 | 78 |
| Жіноча | 38 | 61,3±0,62 | 24 | 38,7±0,62 | 62 |
Комплексне клініко-неврологічне обстеження проводили з використанням традиційних методик та тестів, використовували Скандинавську шкалу інсультів (Scandinavian Stroke Study Group) -її скорочений варіант
(Saunders et al., 1995)‒-максимальна кількість балів за цією
шкалою — 22. Сума балів 2—6 свідчить про тяжкий неврологічний
дефіцит, 7—14 — про дефіцит середнього ступеня тяжкості,
15—21 — про легкий ступінь вираженості неврологічних порушень. Також нами були використані шкала NIHSS (National Institutes of Healht Stroke Scale,
згідно з якою бал 0 характеризує нормальний стан, 34 бали — коматозний. Сумарний бал клінічних проявів від 3 до 8 свідчить про неврологічні порушення легкого ступеня тяжкості, 9—12 бали — тяжкі порушення, більше 15 — про надто тяжкий стан хворого), шкала коми Глазго (Шкала складається з трьох тестів, що оцінюють реакцію відкривання очей (E), а також мовні (V) і рухові (M) реакції. За кожен тест нараховується певна кількість балів. У тесті розплющення очей від 1 до 4, в тесті мовних реакцій від 1 до 5, а в тесті на рухові реакції від 1 до 6 балів. Таким чином, мінімальна кількість балів - 3 (глибока кома), максимальне - 15 (ясна свідомість)).
Стан вітальних функцій контролювався шляхом їх моніторування з обов’язковою консультацією терапевта, при наявності показань - кардіолога, судинного хірурга, логопеда, психотерапевта. Також усім хворим проводилось дослідження очного дна. Загальноклінічні та біохімічні лабораторні дослідження проводилися за загальноприйнятими методиками.
Структурні зміни головного мозку вивчали за допомогою мультислайдового комп’ютерного томографа SOMATOM Emotion 6 фірми Siemens і Synerview 600 S фірми Picker International. Оцінювали густину речовини головного мозку, розміри, локалізацію патологічного вогнища. Визначали зміни характерні для атрофічного процессу речовини головного мозку, ступінь розвитку та характер зовнішньої та внутрішньої гідроцефалії, зміни у шлуночках мозку. Для визначення обсягу вогнищевих змін використовували геометричну формулу еліпсоїда:
¾ π • A • B • C, де А,В,С- ½ діаметрів еліпсоїда.
Характеристика використаних психологічних методик викладена у відповідному розділі.
Розмір та структуру атеросклеротичних бляшок вивчали за допомогою ультразвукового дуплексного сканування екстра- та інтракраніальних відділів магістральних артерій голови та шиї на приладі Philips EnVisor ( фірми Philips).
Результати оброблені за допомогою методів математичної статистики з використанням пакета «Microsoft Excel’07» , що дозволив обчислити відсотки помилок. Вірогідність розходження визначали за допомогою критерія Ст’юдента.
Протокол дослідження функціональних асиметрій включав:
- паспортні дані;
- анамнестичні дані;
- самооцінка людини (правша чи лівша);
- морфологічні асиметрії рук, ніг, тіла, обличчя, очей;
- тести, при виконанні яких домінує та чи інша рука, нога;
- вимірювання сили кисті за шестибальною шкалою;
- гострота слуху;
- дослідження чутливості (больової, температурної, стереогнозу);
- дослідження мовних функцій, висновок логопеда;
- дослідження смаку;
- дослідження критичної частоти злиття світлових мерехтінь;
- психодіагностичні тести ( Коротка шкала оцінки психічного статусу-MMSE, опитувальник Бека);
- дані КТ;
- дані ультразвукового дуплексного сканування екстра- та інтракраніальних відділів магістральних артерій голови та шиї на приладі Philips EnVisor ( фірми Philips).
Нами використані загальнодоступні методики дослідження. Хворі з порушенням мовних функцій консультовані логопедом.
Для дослідження функціональних асиметрій у групі здорових людей використані методики визначення смакових відчуттів та порогу критичної частоти злиття світлових мерехтінь
З метою дослідження порогу смакових відчуттів ми використовували апарат електрогустометрії, який зручний у використанні, дає можливість дозувати подразнення, визначати порогову величину, прослідкувати динаміку смакових відчуттів. Апарат працює у трьох режимах (два автоматичних і один ручний). Під контролем вимірювального приладу можливе поступове підвищення напруги від 0 до 15 В. Подразнення подається на язик за допомогою біполярних позолочених електродів діаметром 0,8-1 мм з міжелектродною відстанню 3 мм, які прикріплені до ручки. Фізіологічні параметри струму відповідають вимогам дослідження, дають ефект сприйняття кислого [22].
Дослідження проведене у 60 здорових людей.
При порушенні зору та з метою визначення асиметрії досліджували поріг критичної частоти злиття світлових мерехтінь (КЧЗСМ). Порогова частота фотостимулів сприймається органами зору як окремі стимули, при її збільшенні стимули сприймаються як постійне сяйво. Даний метод використовувався як самостійний [104]. Дослідження проведене у 60 здорових осіб.
РОЗДІЛ ІІІ
Структурна характеристика мозкового інсульту
Одним з найважливіших етапів верифікації діагнозу мозкового інсульту є візуалізація патологічного вогнища. Всім обстеженим хворим проведена комп’ютерна томографія головного мозку. Зміни в зоні ішемічного осередку у більшості пацієнтів формуються через 36-48 годин, виняток складають великі інфаркти, що швидко формуються, які можна побачити на КТ, починаючи з 12-18 годин після розвитку мозкової катастрофи [127].
За результатами КТ-сканування у групі хворих, що вижили після гострої фази інсульту томограма мала наступний вигляд: у 63 (45%) були виявлені невеликі гіподенсивні вогнища супратенторіальної локалізації на тлі структурних змін, що відповідають судинній енцефалопатії
( невеликі поодинокі або множинні гіподенсивні вогнища, що розташовані в ділянці базальних ядер, внутрішньої капсули або перивентрикулярно, а також наявність розширення шлуночкової системи та борозен півкуль мозку) (мал10, мал.11) у 56 (40%) пацієнтів об’єм вогнищевих змін
( разом з зоною перифокального набряку) не перевищував 10 см3, у 13 (9,3%) пацієнтів був у межах 10-20 см3 (мал.12) , у 4 (2,85%)- 20-40 см3 ( мал.13). Однак у 4 (2,85%) осіб цієї групи розмір вогнища перевищував 40 см3. Тобто, у більшості хворих, візуалізовано ішемічні осередки різного розміру без ознак латерального зсуву, що свідчить про незначно виражений набряк тканин мозку.
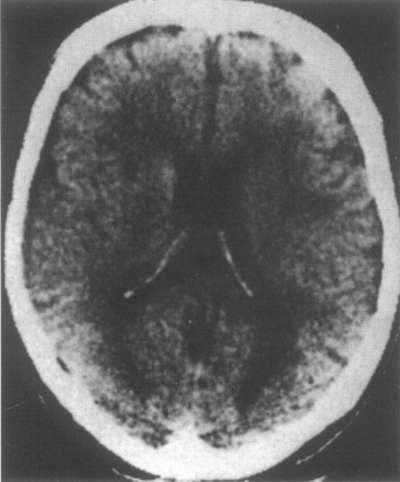
Мал.10 КТ головного мозку пацієнта з ДЕ.
Видно множинні мікроосередкові зміни, в основному в перивентрикулярних відділах, що супроводжуються атрофією кори та розширенням шлуночків головного мозку. Виявляється лейкоареоз, який проявляється гіподенсивнми зонами, вираженість цих змін, так само як і вираженість розширення шлуночкової системи, корелює з тяжкістю клінічних розладів.
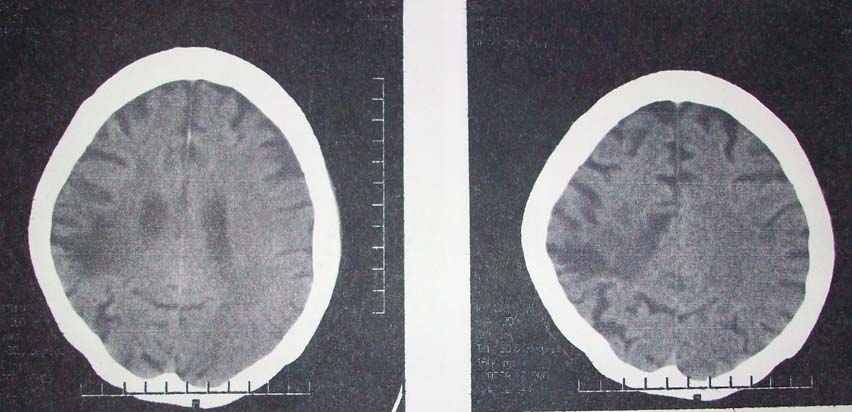
Для порівняння на мал. 11 показана КТ головного мозку пацієнта з хворобою Альцгеймера.

Мал. 11 КТ головного мозку пацієнта з хворобою Альцгеймера.
Видно значне розширення щілин та борозен, особливо у лобних долях. Погано візуалізуються межі між сірою та білою речовиною. Шлуночки розширені. Подібна КТ-картина не патогномонічна для хвороби Альцгеймера та може спостерігатися при інших деменціях (хвороба Піка та хвороба Гентінгтона).
Мал. 12 Комп’ютерна томограма головного мозку хворої Н. Ішемічний інсульт у басейні правої СМА. Зона зниженої щільності у правій тім’яній ділянці ( V=10,3 см3):
а) аксіальний зріз на рівні медіобазальних структур; б) аксіальний зріз на рівні коркових відділів тім’яних часток.
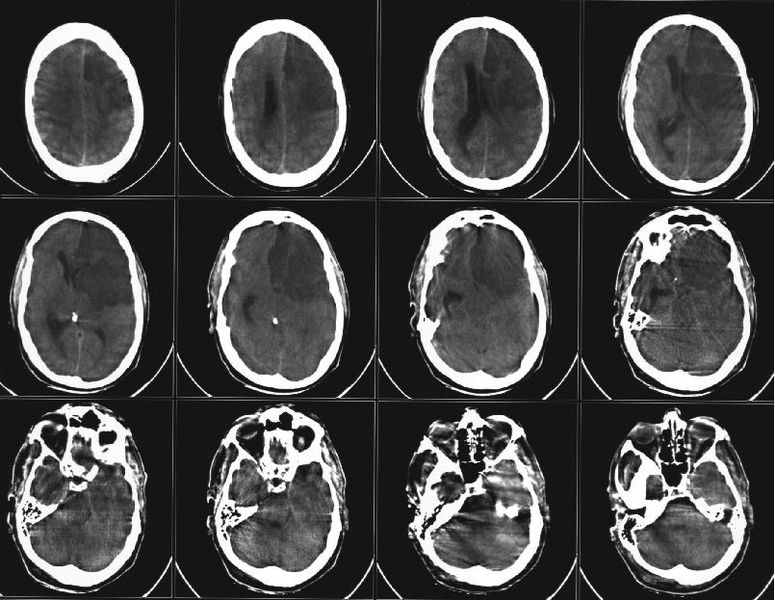
Мал. 13 Компютерна томограма головного мозку хворого В. Ішемічний інсульт в басейні лівої СМА. Зона зниженої щільності у лівій лобно-скроневій ділянці ( V=20,6 см3).
У хворих дані КТ відповідали клінічним проявам. Більший об`єм осередку ураження головного мозку супроводжувався більш вираженим набряком, що обумовлювало тяжкий загальний стан пацієнтів.
РОЗДІЛ ІV
Півкульні особливості Мозкового кровообігу у пацієнтів, що перенесли мозковий інсульт
Ішемічний інсульт є складним поліетіологічним судинним захворюванням головного мозку та є результатом багатьох різних за характером патологічних станів системи кровообігу [111,118]. Концепція гетерогенності ішемічного інсульту має на увазі не лише необхідність діагностики порушення мозкового кровообігу, але й пошук причин, що призвели до церебральної катастрофи [110].
Останніми роками, за висловом N. Futrell (1998), " маятник качнулся в сторону эмболии как главной причины ишемического инсульта " [99]. Серед головних причин емболічних інсультів значне місце відводиться, безумовно, кардіогенній емболії.
За даними широковідомих реєстрів інсульту, таких як Harvard Stroke Registry (HSR), Michael Reese Stroke Registry (MRSR), Stroke Data Bank (SDB), та сучасних світових досліджень [136, 143,144], кардіогенна емболія стає причиною розвитку 29-39 % ішемічних інсультів [108]. У свою чергу, неклапанна фібриляція передсердь (ФП), інфаркт міокарду та аневризми шлуночків викликають відповідно 45,15 та 10% кардіоемболічних інсультів[119,120].
Одну з важливих ролей серед інструментальних методик, що використовуються при діагностиці гострих порушень мозкового кровообігу (ГПМК) будь-якого генезу, відіграють ультразвукові методи обстеження [78,113,125]. Стан церебрального судинного резерву, який визначається здатністю системи мозкового кровообігу компенсувати гемодинамічні порушення, є основним чинником у розвитку ішемічного порушення мозкового кровообігу, зокрема кардіоемболічного інсульту (КЕІ) [3]. Для хворих з КЕІ, у яких відмічається поєднане ураження мозкових судин та кардіальні порушення, важливим є проведення комплексного аналізу показників мозкового кровообігу та функціонального стану серця[111,112,117]. Такий комплексний системний підхід інформативний, оскільки дає можливість розширити уявлення про патогенетичі механізми формування різних типів КЕІ та працювати шляхом поєднаної корекції гемодинамічних порушень церебральної та системної гемодинаміки у цієї категорії хворих. Проте, до сьогоднішнього часу такий методичний підхід до проблеми КЕІ недостатньо використовується. Усе вищесказане визначило доцільність вивчення стану мозкового кровотоку у хворих з ФП, що перенесли КЕІ. А оскільки функціональна міжпівкульна асиметрія є єдиною унікальною особливістю діяльності мозку людини [99,108,112], то оцінювати стан мозкового кровотоку доцільно з урахуванням півкульної локалізації ішемічного вогнища. Критерієм оцінки рівня та ступеню порушення мозкового кровообігу у хворих з КЕІ були показники розмірів комплексу інтима-медіа (КІМ), частота та ступінь вираженості стенозу, структура атеросклеротичних бляшок[3].
У дослідженні взяли участь 86 пацієнтів літнього та старечого віку, що перенесли КЕІ в каротидному басейні на тлі постійної форми ФП, які були розділені на 2 групи: 44 пацієнти з локалізацією ішемічного вогнища у лівій півкулі та 42 - у правій півкулі головного мозку. Групи були порівняні за основними параметрами - віком, статтю, індексу маси тіла, давності ФП, давності АГ та КЕІ.
Критеріями відбору хворих була верифікація кардіоемболічного МІ у каротидному басейні (за даними анамнезу, клінічного обстеження та результатами комп’ютерної томографії). Середній вік обстежених пацієнтів 72,7 ± 5,8 року.
У дослідженні не брали участь пацієнти, що перенесли геморагічний інсульт, з штучним водієм ритму, серцевою недостатністю III - IV ФК за NYHA, гострим інфарктом міокарду та тих, що перенесли інфаркт міокарду, з набутими вадами серця, онкологічними, ендокринними, інфекційними захворюваннями, хронічним захворюванням нирок 4-5-ої стадії, печінковою недостатністю, психічними розладами.
Усі хворі, що перенесли КЕІ, проходили комплексне клініко-інструментальне обстеження, яке включало загальноклінічне, клініко-неврологічне обстеження та дослідження мозкового кровообігу методом ультразвукового дуплексного сканування екстра- та інтракраніальних відділів магістральних артерій голови та шиї на приладі Philips EnVisor ( фірми Philips) при одночасному проведенні базисної медикаментозної терапії відповідно до рекомендацій Європейської асоціації кардіологів щодо ведення пацієнтів з АГ, ФП (інгібітори АПФ, блокатори бета-адренорецепторів, антикоагулянти (варфарин) за відсутності протипоказань)[128,129,135].
Статистичну обробку даних проводили за допомогою програмного забезпечення Statistica 6.O. Розраховували середнє значення, помилку середнього та статистичну значимість за допомогою параметричного методу
(t -критерій Ст’юдента) для незалежних груп з урахуванням того, що розподіл ознак відповідав закону нормального розподілу та дисперсії розподілу ознак у двох порівнюваних групах були рівні.
Основним ультразвуковим показником, що дозволяє відносно оцінити наявність структурної перебудови судинної стінки, являється стан комплексу інтима-медіа (товщина, ехогенність, ступінь диференціювання на шари).
У 80,6 % обстежених нами пацієнтів з локалізацією ІВ у правій півкулі та у
73,3 % з локалізацією у лівій відзначається відносно рівномірне підвищення ехогенності КІМ ЗСА з двох сторін з частковою втратою диференціювання його на шари (1,13 ± 0,03 та 1,12 ± 0,03 відповідно).
Зважаючи на значну роль стенозу у розвитку ішемічного інсульту та кореляцію ступеню стенозу та ризику розвитку ішемії мозку [107], нами була проаналізована частота різних ступенів стенозу судин каротидного басейну у хворих, що перенесли ішемічний інсульт.
Згідно з отриманими даними, частота стенозів екстракраніальних судин каротидного басейну до 50 % у хворих з локалізацією ішемічного вогнища у правій та лівій півкулі як у гомолатеральних так і в гетеролатеральних судинах не розрізнялася (38, 50, 57, 60 % відповідно). У той же час частота стенозів
50-75 % як у гомо-, так й у гетеролатеральних вогнищу экстракраніальних судинах каротидного басейну значно вище у хворих з локалізацією ішемічного вогнища у правій півкулі - більш ніж в 2 рази (33 і 14 % відповідно).
У механізмах формування мозкової ішемії значну роль відіграє не лише ступінь стенозу судини, але й морфологія атеросклеротичної бляшки, характеристика її поверхні. Ультразвукове дуплексне сканування дозволяє охарактеризувати бляшки сонної артерії за ехогенністю, що дає можливість ймовірно встановити їх морфологічний склад. Згідно з критеріями Европейской групи дослідників з ехощільності, розрізняють наступні бляшки сонних артерій: гіперехогенні, пропроміжні та гіпоехогенні. Морфологічним субстратом гіпоехогенних бляшок є молоді сполучнотканинні елементи, ліпіди та клітини крові. Такий тип атеросклеротичної бляшки здатний швидко рости, що призводить до значного звуження судини або її повної оклюзії та свідчить про агресивну форму атеросклерозу [109].
Враховуючи високу агресивність гіпоехогенних бляшек, слід звернути увагу на вищий відсоток виявлення при УЗДС гіпоехогенних бляшок у хворих з локалізацією ішемічного вогнища у правій півкулі (46% у порівнянні з 29% у пацієнтів з лівопівкульним інсультом). Частота гіперехогенних бляшок, які є меньш агресивними, проте в їх структурі є гіпоехогенний компонент, у судинах каротидного басейну у хворих з локалізацією ішемічного вогнища у правій та лівій півкулі статистично значимо не розрізняється (46 та 32 % відповідно).
На підставі представлених даних необхідно відмітити, що аналіз частоти та структури атеросклеротичних бляшок виявив виражені міжпівкульні відмінності: частіше агресивні атеросклеротичні бляшки зустрічаються у пацієнтів з локалізацією ІВ у правій півкулі.
Висновки:
1. Згідно з отриманими даними частота стенозів 50-75% як у гомолатеральних, так й у гетеролатеральних вогнищу екстракраніальних судинах каротидного басейну статистично значимо вище, більш ніж у 2 рази, у хворих з локалізацією ішемічного вогнища у правій півкулі головного мозку .
Тоді як частота стенозів до 50% істотно не відрізнялась в залежності від того, яка півкуля була уражена ішемічним інсультом.
2. Згідно з представленими до вашої уваги даними у хворих з локалізацією ішемічного вогнища у правій та лівій півкулі в уражених ЗСА величина комплексу інтима-медіа статистично значимо не відрізняється.
У той же час у пацієнтів усіх груп цей показник перевищує норму
(нормальне значення - 1,0 мм).
3. Проведене дослідження показує, що гіпоехогенні бляшки, які мають здатність до швидкого росту, частіше виявляються у хворих з локалізацією патологічного вогнища у правій півкулі, що у свою чергу призводить до значного звуження судини або, навіть, повної її оклюзії з вираженими геодинамічними розладами, які часто стають для хворого фатальними.
РОЗДІЛ V
Клінічна характеристика хворих у гострому періоді інфаркту головного мозку.
Мозковий інсульт- клінічний синдром гострого судинного ураження головного мозку. Він є результатом різних за характером патологічних процесів з боку серцево-судинної системи, системи крові та супроводжується морфологічними та структурними змінами тканини мозку з порушенням його функцій, стійкими органічними та неврологічними симптомами [41].
Проведене комплексне обстеження 140 хворих у гострому періоді інфаркту головного мозку, вивчені клінічні особливості перебігу госторого періоду ішемічного інсульту. Групи хворих були порівняні за такими основними параметрами, як вік, стать, локалізація інсульту та відмінності у неврологічному статусі в залежності від того, яка півкуля головного мозку була уражена.
У групи ввійшли 140 пацієнтів, з них 82 (58,6%) особи були з лівосторонньою локалізацією вогнища та 58 (41,4%) осіб - з правосторонньою локалізацією вогнища інфаркту в басейні середньої мозкової артерії. Обов’язковою була верифікація за допомогою комп’ютерної томографії. Розподіл хворих за локалізацією вогнища, статтю, віком наведений у таблиці 5.
Таблиця 5. Розподіл хворих з інфарктом головного мозку за локалізацією патологічного вогнища, статтю,віком.
| Вік роки | ЛСМА | ПСМА | ||||||||
| | ч | ж | Всього | ч | ж | Всього | ||||
| n | % | n | % | n | % | n | % | |||
| Всього | 46 | 56,1±0,55 | 36 | 43,9±0,55 | 82 | 42 | 72,4±0,59 | 16 | 27,6±0,59 | 58 |
| 46-50 | 3 | 6,5±0,36 | 1 | 2,8±0,27 | 4 | 1 | 2,4±0,24 | 0 | 0±0,63 | 1 |
| 51-55 | 8 | 17,4±0,56 | 3 | 8,3±0,46 | 11 | 5 | 11,9±0,5 | 3 | 18,8±0,98 | 8 |
| 56-60 | 16 | 34,8±0,7 | 10 | 27,8±0,75 | 26 | 8 | 19,0±0,61 | 4 | 25,0±1,1 | 12 |
| 61-65 | 19 | 41,3±0,73 | 22 | 61,1±0,81 | 41 | 28 | 66,7±0,73 | 9 | 56,2±1,2 | 37 |
Під час ретельного збору анамнезу було виявлено, що у 83,6% хворих інсульт розвивався під час сну чи відразу після пробудження, а у 16,4 % виникав у будь-який час доби.
Діаграма 1.Розподіл хворих в залежності від часу виникнення ішемічного інсульту.

Констатовані ще й такі особливості прояву патології: у 61,3% пацієнтів зареєстрований гострий початок захворювання, у 32,3% поступовий, «підгострий» розвиток мав місце у 6,4%, що вимагало більш ретельного диференціального діагнозу з неопластичними процесами.
У першу добу стан хворих за Скандинавською шкалою відповідав 56,8%- легкому інсульту, у 32,3%- середньої тяжкості, у 10,9%- тяжкому. Загальномозкові симптоми були варіабельні, а вогнищеві прогресували. Так у 8 ( 3 особи з правопівкульним та 5 осіб з лівопівкульним вогнищами) хворих спостерігався епілептичний синдром, у 5 пацієнтів діагностована пневмонія.
За оцінкою свідомості обох груп хворих за шкалою Глазго, у 56,8% пацієнтів з ішемічним інсультом порушення свідомості не виявлено (відповідає ясній свідомості за шкалою), у 38,7% констатовано заглушення ( від помірного до глибокого за шкалою), у 4,5%- сопор. Значних розладів у роботі життєво важливих органів та систем не було виявлено. У 17,3% спостерігалась температурна реакція.
Особливе значення мали прояви у неврологічному статусі в залежності від пошкодженої півкулі головного мозку ( тобто у басейні лівої чи правої СМА знаходилося вогнище ураження). У всіх хворих визначались геміпарези чи геміплегії ( в залежності від розміру вогнища та його локалізації), геміанестезія.
При лівобічному осередку відмічалось порушення мови (у вигляді сенсорної або моторної, чи ,навіть, тотальної афазії), функції письма ( аграфія ), можливості виконувати ціленаправлені рухи ( апраксія ), порушення різних видів ( зорового, тактильного, слухового) сприйняття навколишнього світу. Моторна афазія спостерігалась у 52,4% випадків, сенсорна афазія у 28,1%, на частку тотальної афазії припадає 6,9% хворих з локалізацією інфаркту в басейні лівої СМА, у 12,6% пацієнтів відмічалась кіркова дизартрія. Усі хворі з ішемічним інсультом лівопівкульної локалізації мали порушення людських функцій: моторну, сенсорну, амнестичну афазію, аграфію, алексію, акалькулію. Усі хворі оглянуті логопедом. У деяких хворих з масивним ішемічним вогнищем виявлена тотальна афазія. При наявності менших вогнищ переважали ті чи інші порушення мови - переважно моторна чи сенсорна афазія.
Серед обстежених 72,4 % чоловіків були з правобічною локалізацією патологічного вогнища, що відповідає даним літератури [23,79].
При наявності правобічного осередку ураження спостерігались такі відхилення, як анозогнозія ( хворий не усвідомлює дефект, ігнорує параліч), аутотопогнозія ( розлад схеми тіла- коли пацієнт втратив орієнтування у відношенні до свого тіла або його частин ).
У 73,6% хворих з правопівкульною локалізацією патологічного вогнища (інфаркту мозку) були виявлені порушення психіки та поведінкових реакцій: вони були малоініціативні, неконтактні з родичами та персоналом при одночасному збереженні мовних функцій. У 35,2% хворих жіночої статі відмічався депресивний стан, що викликало необхідність в консультації психотерапевта й призначення адекватного лікування.
Мова - вища людська функція. У хворих з лівопівкульною локалізацією патологічного вогнища (інфаркту мозку) чітко виявлені порушення мови, вираженість яких залежить від характеру ураження, його розміру та локалізації. Виявлені порушення інших вищих функцій, які зумовлені ураженням часток лівої півкулі головного мозку. При ураженні правої півкулі виявлені зміни психічної діяльності.
Недостатня кількість досліджень з даної проблеми викликає необхідність продовження подальшого вивчення функціональних асиметрій людини у нормі та при патології.
РОЗДІЛ VI
Когнітивні та афективні порушення у гострому періоді мозкового інсульту
Перенесений мозковий інсульт підвищує вірогідність розвитку когнітивного дефіциту в 4-12 разів. Виражена деменція розвивається у 25-30% пацієнтів, які перенесли інсульт, та призводить до значного зниження якості життя, а також підвищує смертність та розходи на догляд за хворими [86]. Когнітивні функції формуються в результаті інтегрованої діяльності різних відділів головного мозку. Згідно з концепцією А.Р.Лурія [84] кожний відділ головного мозку вносить свій специфічний вклад у формування когнітивних функцій. Гіпокамп, мамілярні тіла, медіальні ядра таламуса та пов’язані з ними структури (круг Пейпеца) відповідають за підтримку необхідного рівня уваги та запам’ятовування нової інформації. Задні відділи кори (тім’яні, скроневі та потиличні частки) забезпечують сприйняття, обробку, розпізнавання та збереження інформації. Роль лобної частки - вибір цілі діяльності, розробка програми для досягнення поставленої мети та контроль за виконанням програми (так звані “керівні функції”)[29,60] . До найбільш значущих чинників ризику розвитку післяінсультної деменції відносяться: літній та старечий вік; чоловіча стать (хоча зараз з’являються дані про більшу ураженість жіночої популяції); деякі расово-етнічні характеристики (наприклад, відомо, що люди жовтої раси найбільш вразливі до виникнення післяінсультної деменції); рівень освіти (чим він вище, тим менша вірогідність розвитку когнітивних порушень); наявність когнітивних порушень у хворих до інсульту[15,69,70,71].
Вірогідність розвитку післяінсультної деменції та її тяжкість напряму залежить від характеристики самого інсульту. Мають значення: кількість та об’єм вогнища ураження мозкової тканини, наявність церебральної атрофії, особливо в медіальних відділах скроневої частки; наявність дифузних змін білої речовини півкуль мозку (лейкоареоз) [29,63]. Всі вищеперераховані чинники призводять до порушення гемореологічних властивостей крові та церебральної гемодинаміки, які, у свою чергу, стають причинами ГПМК. Структурні зміни сірої та білої речовини нервової тканини є патоморфологічним субстратом феномена кірково-підкірково дисоціації та порушення нейротрансмісії в ЦНС[67]. Ішемічна загибель нейронів збільшується природними, асоційованими з віком, процесами нейродегенерації, які були до цереброваскулярної катастрофи, що й визначає рівень когнітивних розладів та тяжкість деменції після виникнення ГПМК[63,65]. Психоемоційні та порушення когнітивних функцій у хворих взагалі, а у хворих працездатного віку, особливо, є негативним фактором[101], що відбивається на якості реабілітаційних та лікувальних заходів[63]. Аналіз ступеня задоволення ходом лікування та оцінка функцій уваги, пам’яті та мислення дає можливість прийняти рішення про залучення до комплексу лікування відповідних спеціалістів (психологів, психотерапевтів, соціальних працівників) та якомога ранішого включення до медикаментозного комплексу препаратів, основним напрямком дії яких є ноотропна[87]. Тому запропонованого дослідження є вивчення особливостей КП у хворих у гострий період ІМ.
В роботі наведені дані, отримані нами шляхом проведеного комплексного обстеження 34 хворих (15 чоловіків та 19 жінок) віком 27–59 років (середній вік – 49,8±1,2 року), у яких ІМ розвинувся вперше. Всі хворі знаходились під час обстеження в стаціонарі та були у свідомості та без мовних порушень. У 21 пацієнта вогнище ураження локалізувалося в басейні правої, у 13 — лівої внутрішньої сонної артерії. Більшість хворих - 19 (55,8%) мали середню освіту, 9 (26,4%) — середню спеціальну, 6 (17,6%) — вищу.
Контрольну групу становили 20 осіб із хронічними порушеннями мозкового кровообігу у вигляді дисциркуляторной енцефалопатії (І–ІІ стадії) судинного генезу без ГПМК в анамнезі, які мали вікові розлади когнітивної функції, віком 30-59 років (середній вік - 50,0±1,14). Серед них було 7 (35%) чоловіків та 13 (65%) жінок. Вищу освіту в цій групі мали 20% осіб, середню спеціальну — 35%, середню - 45%. Основна клінічна група та група порівняння були однорідними за віком та статтю, рівнем освіти.
Не залучались до дослідження хворі в найгострішої фазі з порушенням свідомості, мовними розладами та ті, які не мали можливості виконувати тестові завдання. Додаткові дослідження проводитися згідно з протоколами надання медичної допомоги хворим з цереброваскулярною патологією (огляд невролога відділення інтенсивної терапії, консультації лікаря-терапевта, окуліста, за необхідністю – нейрохірурга та кардіолога, запис електрокардіограми, загальні аналізи крові та сечі, визначення ліпідного спектру та показників загортальної та протизгортальної систем, ниркові та печінкові проби, ультразвукове обстеження магістральних артерій голови, нейровізуалізаційне обстеження (комп’ютерна томографія або магнітно-резонансна томографія). Ступінь тяжкості хворих на ішемічний інсульт оцінювався з використання шкали NIHSS.
За даними неврологічного обстеження із вогнищевих симптомів найчастіше зустрічалися рухові – у 33 осіб (97,0%), чутливі- 25 хворих (73,5%) незначні мовні порушення у вигляді дизартрії - 2 хворих (5,8%).
Рухові порушення були представлені геміпарезом різного ступеня тяжкості: легкий геміпарез – у 16 осіб (48,4%), помірний – у 7 хворих (21,2%), тяжкий – у 5 хворих (15,1%). У 3 (9,0%) виявлені ознаки пірамідної недостатності.
Для об’єктивізації стану когнітивних функцій використовували шкалу Mini Mental State Examination (додаток А), яка дає змогу швидко й ефективно оцінити орієнтування в часі, місці, сприйняття, увагу, стан короткої та довготривалої пам’яті, мовну функцію, гнозис та праксис. Наявність та тяжкість депресії оцінювали за допомогою опитувальника Бека (додаток Б).
Тяжкість стану оцінювали за шкалою NIHSS – від 8 до 15 балів (Додаток Г). У всіх випадках діагноз підтверджений нейровізуалізаційними методиками.
Для оцінки вірогідності отриманих результатів проведено статистичну обробку отриманих даних з використанням пакета прикладних програм для статистичної обробки даних “Microsoft Excel”. Вірогідність різниці між групами оцінювали за критерієм Стьюдента.
Коротка шкала оцінювання психічного статусу (англ. Mini Mental State Examination, MMSE) – це опитувальник з 30 пунктів, який широко використовується для первинної оцінки стану когнітивних функцій та скринінга цих порушень у динамиці, а також деменції. Шкала MMSE була розроблена Фольгштейном у 1982 році.
MMSE також застосовують для оцінювання когнітивних порушень на тлі лікування. Нами використаний україно- та російськомовний варіанти опитувальника. Наведена інтерпретація тесту MMSE [79,84] має орієнтовний характер, діагностування деменції не може ґрунтуватися лише на його результатах. Разом з кількісної обробкою результатів необхідно проводити ще й якіcний аналіз. Крім того, потрібен індивідуальний підхід до кожного пацієнта та інтерпретації результатів дослідження у пацієнтів з вираженими мовними порушеннями, руховими розладами, порушеннями зору та слуху. Оцінка когнітивних функцій при депресіях різного ступеня важкості вимагає також особливого підходу, тому що у таких хворих має місце явище оборотного когнітивного дефіциту, яке зникає разом з афективною симптоматикою. З метою об’єктивізації істинного рівня когнітивних розладів у цих хворих слід проводити обстеження в динаміці. Отримані за допомогою MMSE результати мають бути зіставлені з даними клінічного та інших параклінічних досліджень. Але саме ця методика є найбільш безвитратною та часто використовується у світі завдяки простоті, швидкості проведення без залучення суміжних фахівців.
Депресії після інсульту відносяться до органічних депресій, що позначені в МКХ-10 рубрикою F 06.32. Для оцінки тяжкості депресії ми обрали добре відомий методи - опитувальник Бека. Шкала Бека раніше вже неодноразово використовувалася у хворих на інсульт та існують переконливі підтвердження її чутливості.
У гострому періоді (21 доба) ІМ, за даними шкали MMSE (27 балів та менше), виявлені когнітивні у 92,9 % із обстежених осіб. У пацієнтів зі зниженими показниками когнітивних функцій сума балів за шкалою MMSE коливалася від 18 до 27, у середньому 23,79±0,32.
Характерною особливістю когнітивних порушень у обстежених хворих була наявність уповільнення психічних процесів, втрата активності, ригідність, емоційна лабільність. Виявлено вірогідне (р<0,01) зниження когнітивних функцій в обстежених хворих порівняно з групою контролю. При проведенні дослідження когнітивної функції залежно від рівня освіти, нами виявлені такі дані. Хворі з вищою освітою мали вищий бал за шкалою MMSE по відношенню до хворих із середнім та середньоспеціальним рівнем освіти.
Таблиця 6. Основні показники когнітивної діяльності у обстежених хворих (за даними шкали MMSE).
| Показник (в балах) | Хворі на ІІ в гострому періоді n=34 | Група контролю n=20 |
| Орієнтування (макс. 10) | 7,8±0,4 | 8,8±0,6 |
| Пам’ять (макс. 6) | 2,8±0,2 | 4,0±0,2* |
| Увага та рахування (макс. 5) | 4,1±0,4 | 4,9±0,4* |
| Перцептивно-гно-стична сфера (макс.9) | 6,9±0,7 | 8,2±0,8 |
| Загальний показник (макс. 30) | 25,3±4,5 | 27,6±2,1* |
Примітка: * - статистично достовірні відмінності між групами (p ≤ 0,05).
Не виявлено достовірної різниці за тестом «орієнтування» між хворими двох груп. При дослідженні тесту «пам’ять» у хворих основної групи показники вірогідно відрізнялися від показників контрольної групи (2,8±0,2 та 4,0±0,2 бала відповідно), що характеризує короткотривалу пам’ять. Відзначена вірогідність відмінностей показників за тестом «увага та рахування» - 4,1±0,4 бала в основній та 4,9±0,4 бала — у контрольній групі. Вірогідно нижчі показники за тестом «перцептивно-гностична сфера» відмічені у хворих із ІМ порівняно з контрольною групою (р<0,05).
При проведенні порівняльної оцінки показників когнітивної функції у хворих в гострий період ІМ, залежно від локалізації вогнища ішемії, отримані такі дані. Середній сумарний бал за шкалою MMSE достовірно (р<0,05) перевищував у хворих із правопівкульною локалізацією вогнища (24,0±0,47 бала за шкалою MMSE) порівняно із хворими з лівопівкульною локалізацією вогнища ішемії (23,0±0,42 бала).
Установлено, що депресія є частим наслідком ішемічного інсульту і відмічається у 17,3% - 32,2% хворих (p<0,05). Характерною особливістю депресії була стійкість симптомів, легкий та помірний ступінь їх вираженості, перевага сомато-вегетативної симптоматики, збереження критики до свого стану та інші. Депресивні розлади включали ознаки як органічної депресії, так й особисту реакцію на розвиток мозкової катастрофи. Втрата контактів з колегами, друзями сприяли розвитку депресії. Через місяць після інсульту загальний бал за опитувальником Бека 15,1±1,3. Показано взаємозв’язок депресії з вираженістю неврологічного дефіциту, локалізацією вогнища (більш виражені симптоми депресії були у хворих з правопівкульною локалізацією вогнища), а також з такими психосоціальними факторами, як самотнє проживання, втрата роботи, високий соціальний та професійний статус в преморбіді.
Висновки:
1. Вираженість КП в осіб у гострому періоді інфаркту мозку залежить від віку, освіти, та не залежить від статі. Причому більший ступінь КП при атеротромботичному та лакунарному інфаркті мозку.
2. Ступень вираженості психоемоційних розладів визначається характером неврологічних проявів, соціальним статусом хворого.
3. В гострому періоді МІ спостерігається закономірна зміна типу реагування на хворобу, що, на наш погляд, викликано зростанням ступеня соціально-психологічної дезадаптації, ростом рівня невротизації та депресивних проявів, тривожності внаслідок ймовірних соціальних наслідків інсульту ( інвалідизація, необхідність стороннього догляду ).
4. Наведений комплекс нейропсихологічного дослідження може бути використаний для оцінки когнітивних функцій в осіб у гострому періоді інфаркту мозку.
5. Доведена висока інформативність шкали MMSE в гострому періоді інфаркту мозку. Тому є необхідним для застосування в гострому періоді при комплексному обстеженні ІМ з метою раннього виявлення вказаних порушень та негайного початку лікування.
6. Отримані результати мають стати підставою для проведення індивідуальних медичних та реабілітаційних програм (медикаментозних, психотерапевтичних та соціальних).
7. Оцінювання динаміки розвитку порушень когнітивної сфери необхідно проводити регулярно, особливо протягом першого року після інсульту для проведення корекції лікувальних заходів, що повинно стати предметом зацікавленості сімейних лікарів та неврологів поліклінічних відділень. Тобто це має бути прогностичним фактором відновлення не тільки розумових, а й рухових функцій.
РОЗДІЛ VІІ
Результати дослідження функціональних асиметрій у групі здорових людей
Група здорових людей складалася з 60 осіб віком 18-24 роки (студенти медичного інституту): 42 особи жіночої та 18 осіб чоловічої статі.
З анамнестичних даних виявлено, що з усіх досліджуваних лише 3 студента медичного інституту (група здорових) були лівші, всі інші досліджувані були правші. Нами не виявлено асиметрії рук, ніг, тулуба, обличчя, очей у здорових.
Дослідження смакової чутливості у здорових осіб виявило наступні дані, які наведені у таблиці 7.
