Полимеризуемые стоматологические адгезивы и композиты. Обзор
| Вид материала | Реферат |
| Циклические ацетали и аллилсульфиды Жидкокристаллические, разветвленные и дендриновые мономеры |
- Стоматологические материалы краткий обзор новых технологий, 44.32kb.
- Прайс-лист на стоматологические услуги Консультация врача, 360.92kb.
- Эпоксидные композиты, стойкие в растворах азотной кислоты, 207.8kb.
- Обязательного, 101.11kb.
- Лекция и контрольные вопросы для стоматологов (4 курс) стоматологические проявления, 222.86kb.
- Абдрахманова Л. А., Низамов, 75.63kb.
- Инвективы-композиты в системно-функциональном аспекте (на материале немецкого, русского, 845.47kb.
- Обзор выполнения программы за период с 1 января по 30 июня 2004 Г. Отчет Секретариата, 1186.73kb.
- Однодневные экскурсии в Москву и пригороды, 55.06kb.
- 1 отделение профилактической медицины, 432.97kb.
Циклические ацетали и аллилсульфиды
Циклические кетенацетали полимеризуются с раскрытием кольца по свободно-радикальному и катионному механизму с незначительной усадкой, что делает их перспективными мономерами для стоматологических материалов. Впервые различные 1,3-диоксаланы были исследованы в качестве стоматологических мономеров в 1972 г [38] (рис.14).
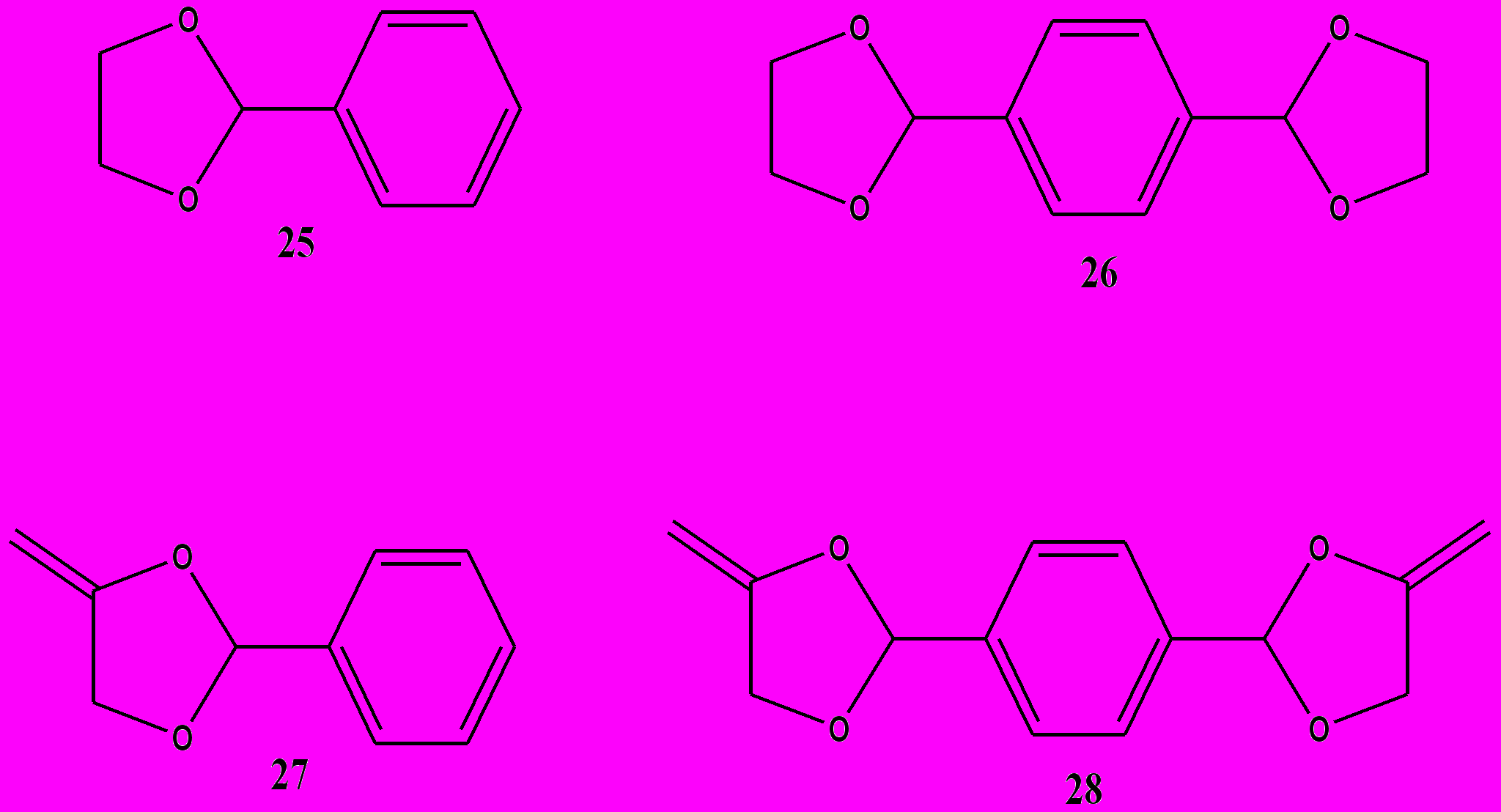
Рисунок 14. Не-винильные 25-26 и винильные 27-28 1,3-диоксаланы изученные в стоматологических композитах [38].
Более перспективным мономером является семичленный циклический винильный кетен ацеталь – 2-метилен-1,3-диоксепан (структура 29 на рис. 15). Он полимеризуется с раскрытием кольца до высоких степеней конверсии при фото- и термо- инициировании, давая особо чистый поли(-капролактон) (рис. 15).
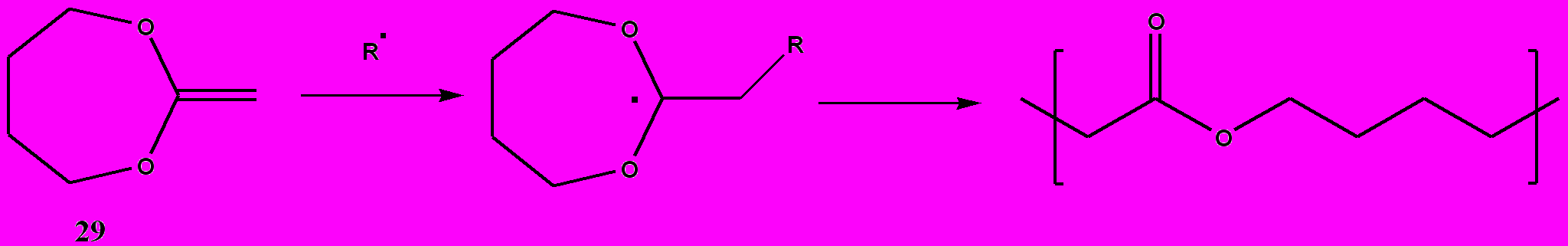
Рисунок 15. Механизм свбодно-радикальной полимеризации с раскрытием кольца 2-метилен-1,3-диоксепана 29 [38].
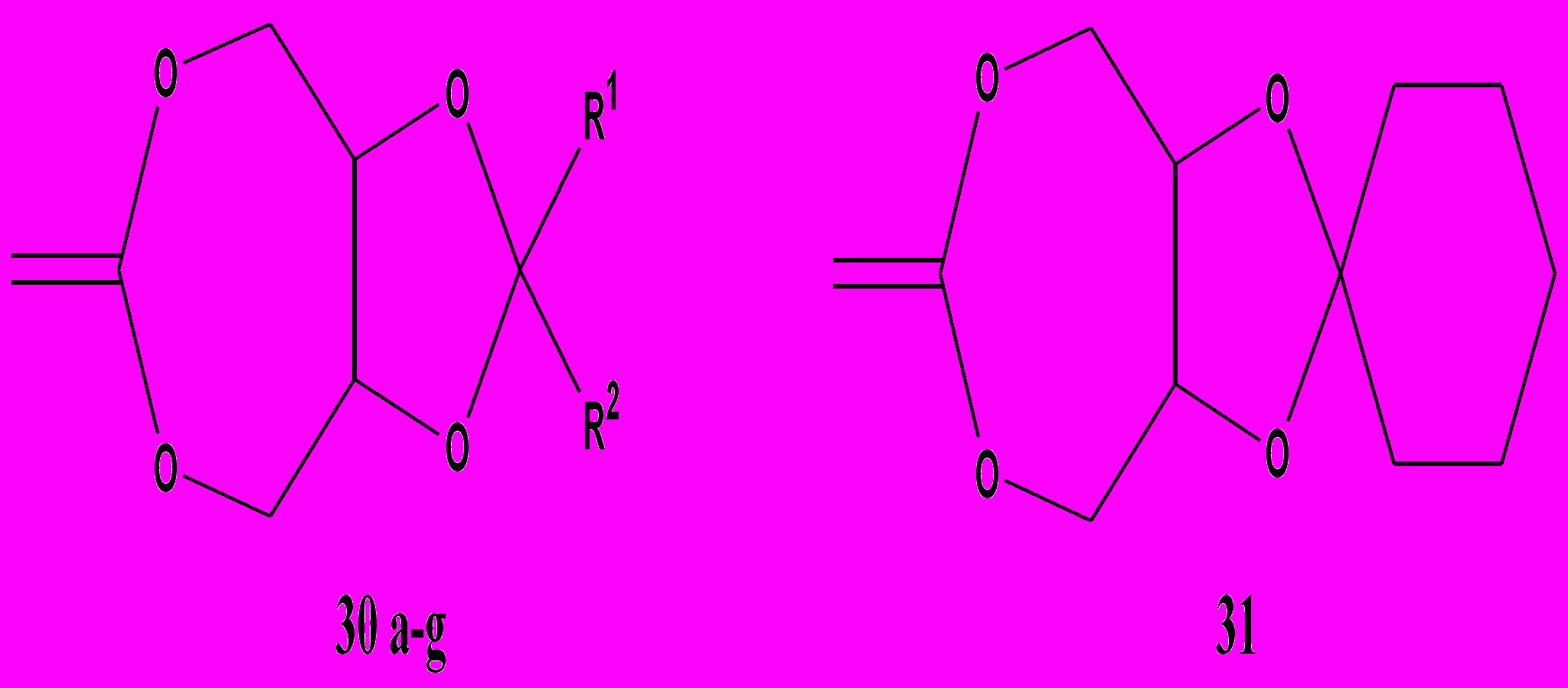
Далее были синтезированы бицикличные 2-метилен-1,3-диоксепаны (структура 30-31 на рис. 16) [47]. Мономер 30g показал при полимеризации объемное расширение 2,9% за счет превращения более плотной структуры кристаллического мономера в менее плотную структуру аморфного полиэфира. К сожалению полиэфиры на основе данных мономеров имели температуру стеклования от –8 до 350С, что было неприемлемо для стоматологического применения. Кроме того, 2-метилен-1,3-диоксепаны, как обогащенные электронами олефины, очень чувствительны к воде и нуклеофильным соединениям (аминам, спиртам и т.д.). Пасты композитов на их основе, особенно со стеклонаполнителем, оказались не стабильны при хранении и склонными к спонтанному отверждению в течение нескольких дней. Наконец, 2-метилен-1,3-диоксепаны были значительно менее реакционно-способны, чем метакрилаты.
| R1 | CH3 | C2H5 | C2H5 | Фенил | CH=CH2 | 3-CH3-фенил | 4-CH3-фенил |
| R2 | CH3 | CH3 | H | H | CH3 | H | H |
| 30 | a | b | c | d | e | f | g |
Рисунок 16. Бицикличные 2-метилен-1,3-диоксепаны [38].
Более стабильными в присутствии воды оказались циклические аллилсульфиды. Например, 6-метилен-1,4-дитиэпан или 3-метилен-1,5-дитиациклооктан (структуры 32 и 33 на рис. 17, соответственно) спокойно выдерживали воздействие воды и кислот. Циклические аллилсульфиды полимеризовались с раскрытием кольца по свободно-радикальному механизму, давая нерастворимые кристаллические высокомолекулярные гомополимеры. Жидкие 6-метилен-1,4-дитиэпаны (структуры 34-33 на рис. 18) приводят к сшитым полимерам.
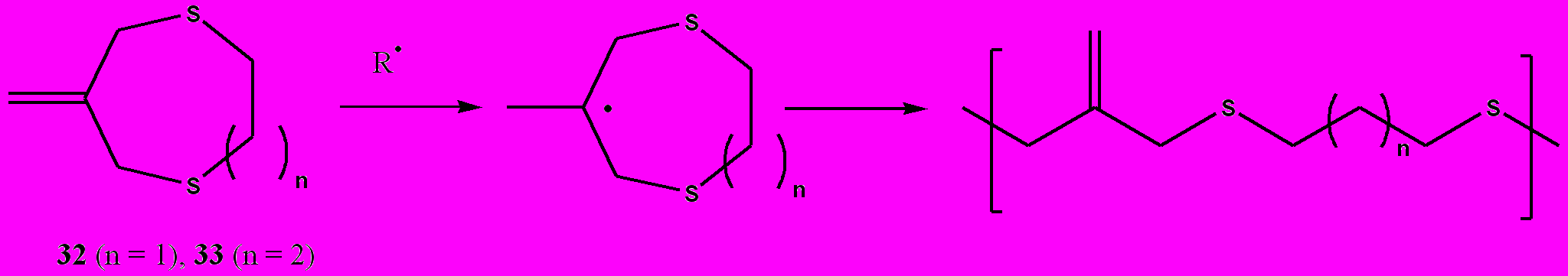
Рисунок 17. Свободно-радикальная полимеризация с раскрытием кольца циклических аллилсульфидов [38].
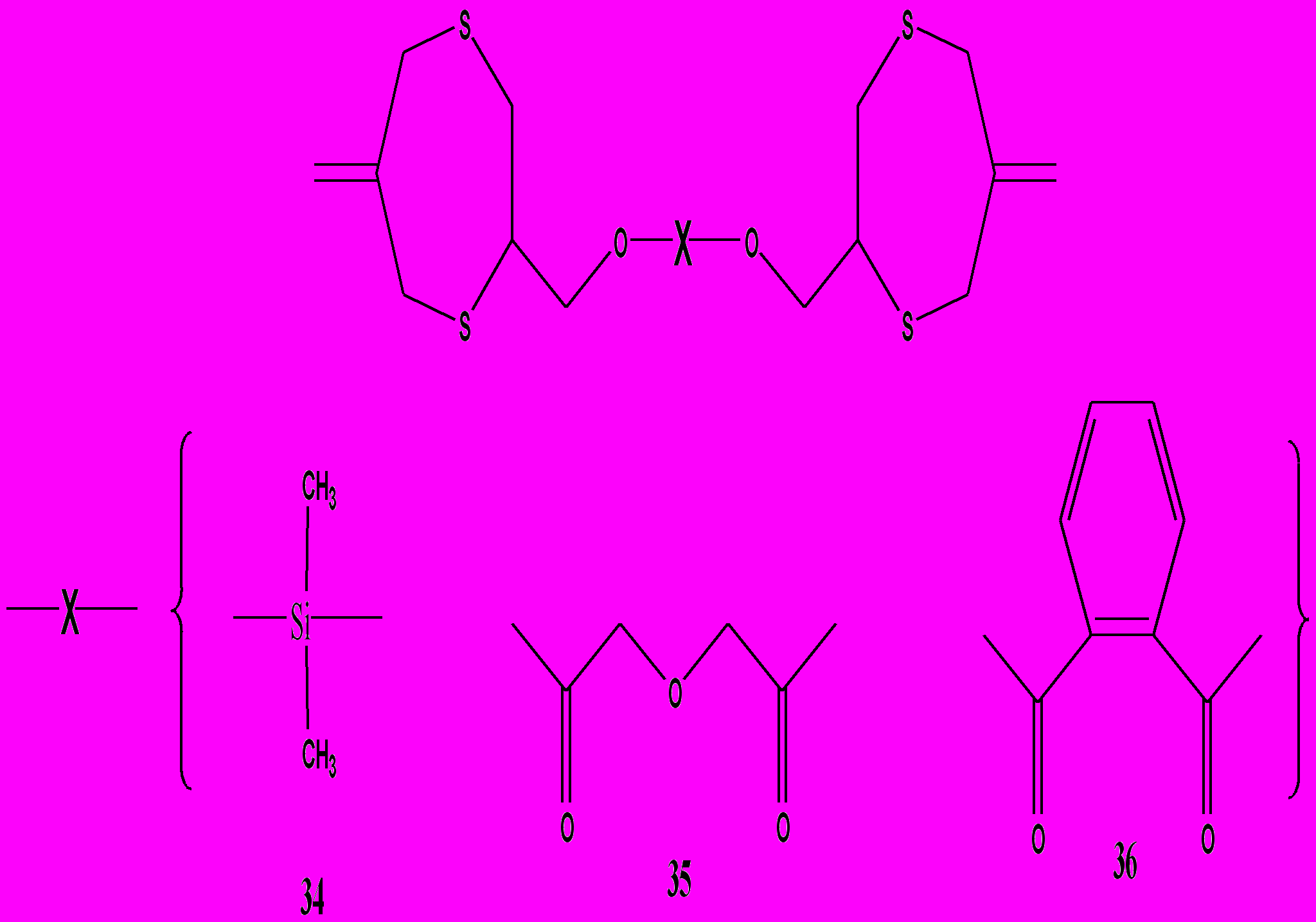
Рисунок 18. Структуры жидких 6-метилен-1,4-дитиэпанов 34-36 [38].
Главной проблемой применения циклических аллилсульфидов в стоматологических материалах является значительно меньшая реакционная способность этих мономеров по сравнению с метакрилатами и слишком гибкая аморфная структура, образующихся полимеров.
Винилциклопропаны
2-Винилциклопропаны (структуры 37-39 на рис. 19) также известны как свободно-радикально полимеризуемые мономеры с низкой усадкой [38]. Температура стеклования 1,1-дизамещенных 2-винилциклопропанов зависит от природы заместителей (рис. 19).
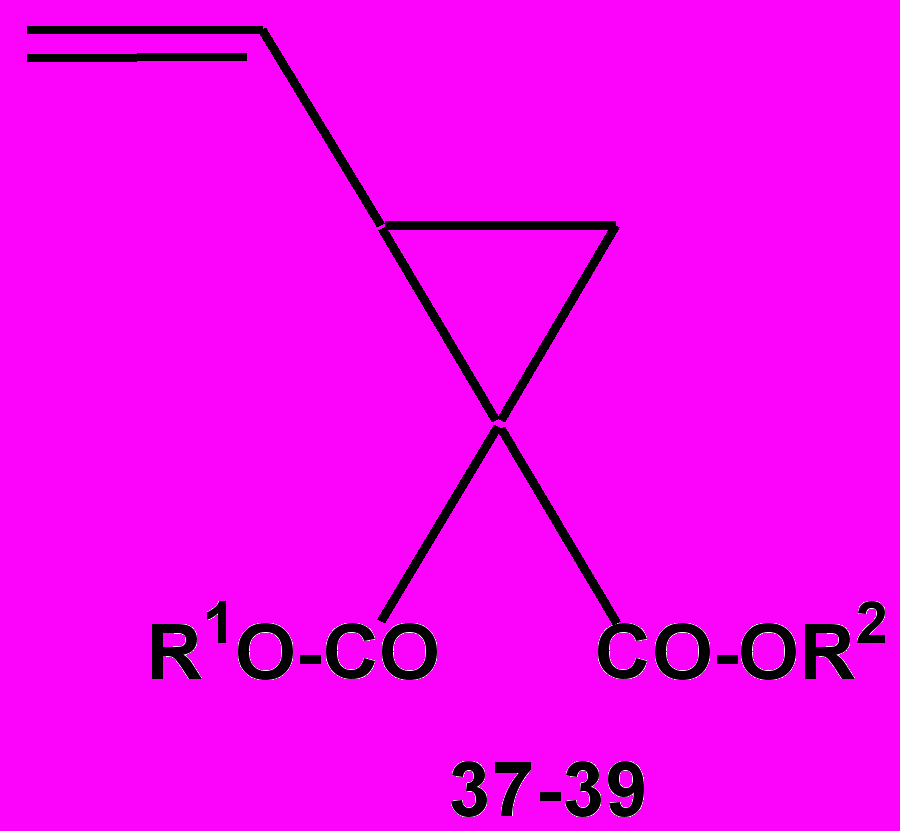
| Мономер | 37 | 38 | 39 |
| R1 | C2H5 | C2H5 | Фенил |
| R2 | C2H5 | Фенил | Фенил |
| Температура стеклования полимера (Tg, 0C) | 40 | 54 | 77 |
Рисунок 19. Структуры мономеров и температура стеклования полимеров 1,1-дизамещенных 2-винилциклопропанов [38].
Температура стеклования полимеров для стоматологического применения должна быть выше 600С. Однако, заместители, наряду с температурой стеклования, увеличивают и температуру плавления исходных мономеров. Менее вязкими мономерами, способными давать сшитые полимеры нерастворимые в органических растворителях, оказались структуры 40-44 (рис. 20). К тому же некоторые из них (41) показали расширение объема при полимеризации в массе, которое можно объяснить переходом плотной структуры кристаллического мономера в менее сжатую структуру аморфного полимера.
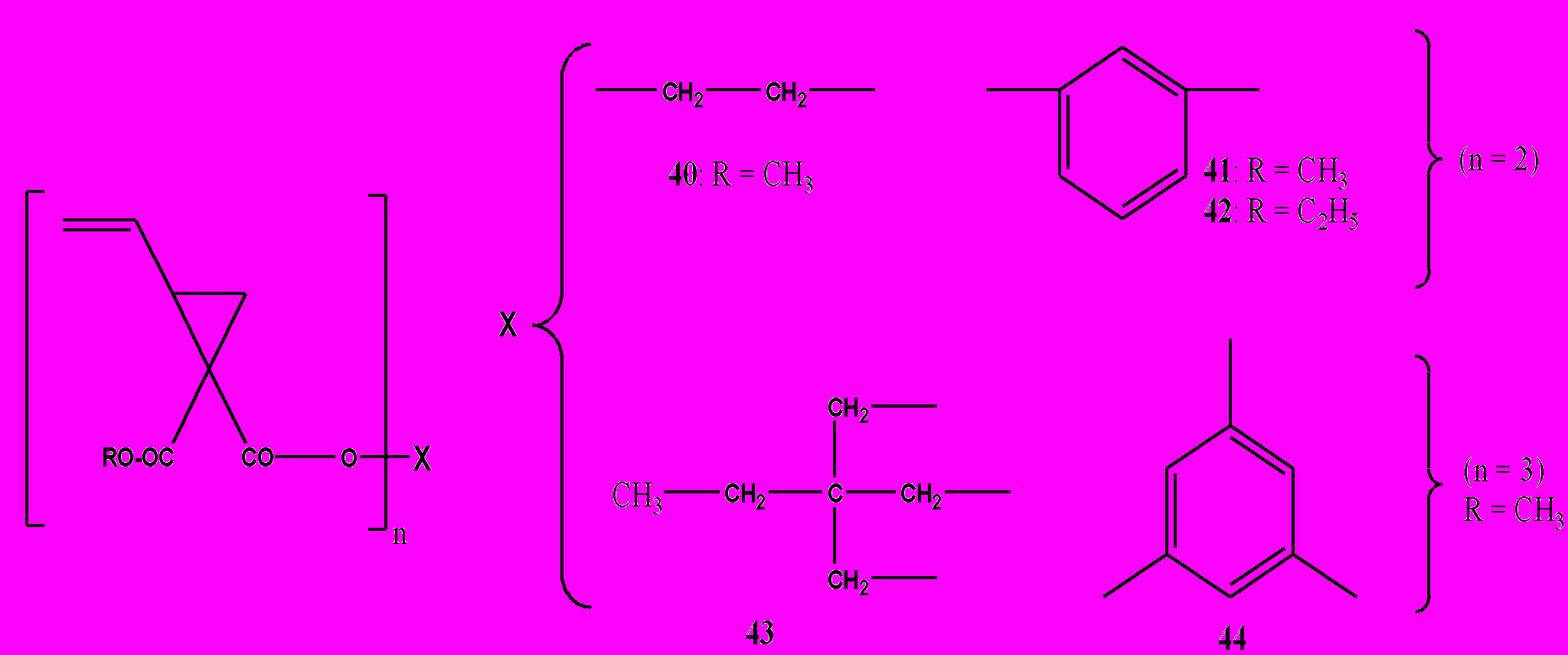
Рисунок 20. Сшиваемые 1,1-дизамещенные 2-винилциклопропаны 40-44 [38].
Сшиваемые винилциклопропаны оказались менее реакционноспособны, чем метакрилаты. Поэтому были синтезированы гибридные мономеры (структуры 45-47 на рис. 21), содержащие и винилциклопропильные и метакрилатные группы [48].
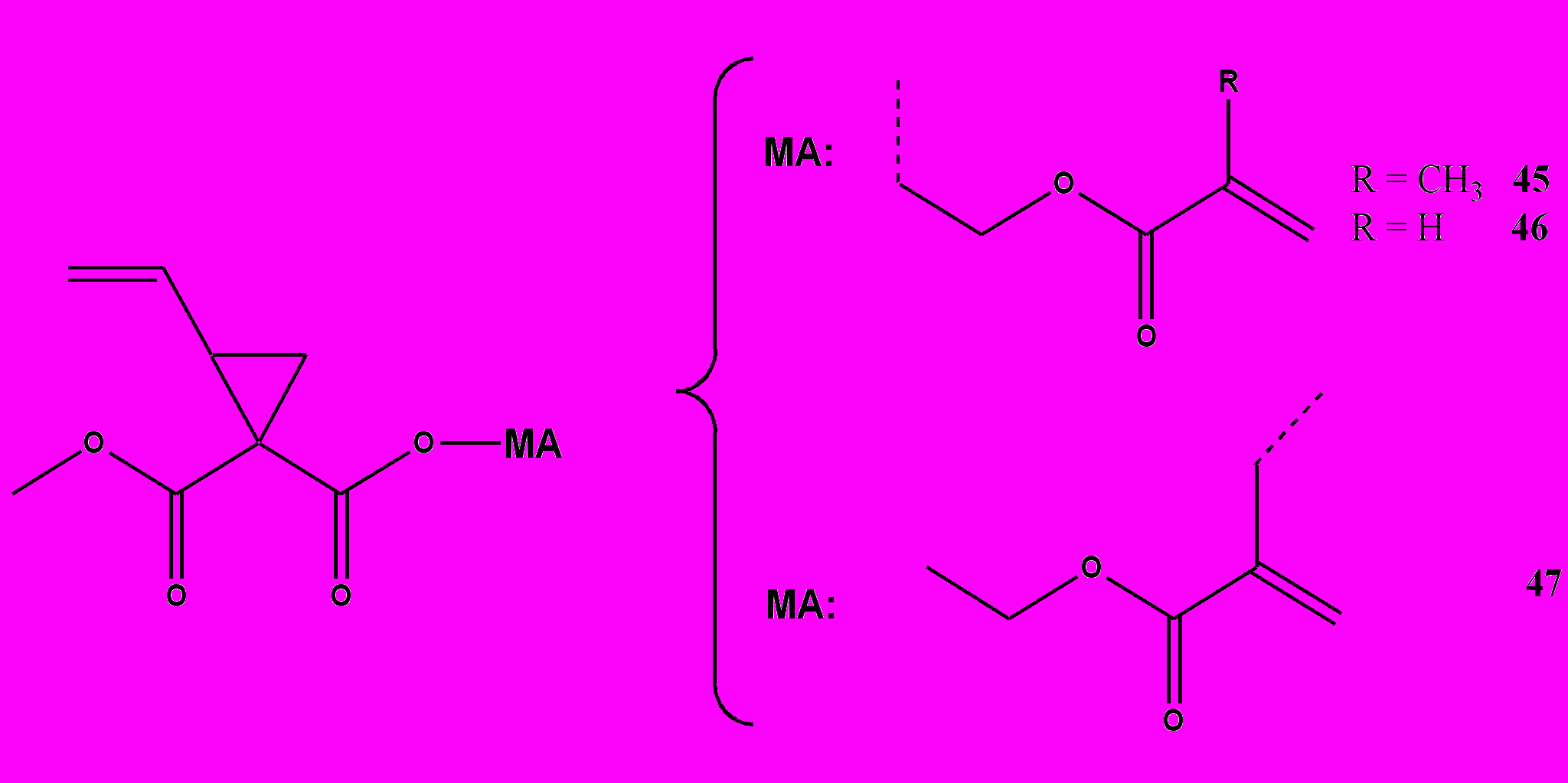
Рисунок 21. Сшиваемые гибридные 2-винилциклопропаны 45-47 [38].
Сшиваемые винилциклопропаны показали меньшую, чем метакрилаты, токсичность, были стабильны в присутствии влаги, наполнителей, кислотных и основных примесей. Однако их применение в стоматологических составах требует более тщательного изучения.
Резюмируя все вышесказанное можно сделать вывод, что циклические мономеры, полимеризующиеся с раскрытием кольца с низкой усадкой или расширением, до сих пор не получили практического применения в коммерческих пломбировочных материалах. Главная причина в том, что они не удовлетворяют основным требованиям, предъявляемым к композитным восстановительным материалам.
