Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот 14. 04. 02-фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат диссертации |
| Биологическая активность синтезированных соединений Острая токсичность Противомикробная активность Анальгетическая активность Противовоспалительная активность Местноанестезирующая активность |
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Программа курса «Аналитическая химия» специальность «Фармация», 92.69kb.
- Тематический план лекций по дисциплине «Фармацевтическая химия», 32.57kb.
Биологическая активность синтезированных соединений
Фармакологическому скринингу было подвергнуто 115 соединений на наличие различных видов активности, таких как противомикробная, анальгетическая, противовоспалительная и местноанестезирующая.
Острая токсичность
Острая токсичность исследована на кафедре физиологии и патологии ПГФА под руководством доцента, кандидата биологических наук Чащиной С.В., под руководством доктора медицинских наук, профессора, заведующего кафедрой Сыропятова Б.Я.
Токсичность при внутрибрюшинном введении определяли на белых мышах по Прозоровскому. Результаты обрабатывали с вычислением средней смертельной дозы (ЛД50) при р ≤ 0,05 (таблица 1).
Таблица 1
Острая токсичность соединений при внутрибрюшинном введении
| Соединение/Эталон | ЛД50 | Соединение/Эталон | ЛД50 |
| 1 | 2 | 3 | 4 |
| 3н | 564,0 (470,0÷670) p≤0,05 | 14а | 300.0 (240,0÷380,0) p≤0,05 |
| 11л | 2820,0 (2300,0÷3400,0) p≤0,05 | 14б | 325,0 (260,0÷400,0) p≤0,05 |
| 1 | 2 | 3 | 4 |
| 11м | 1410,0 (1100,0÷1700,0) p≤0,05 | 14г | 355,0 (260,0÷400,0) p≤0,05 |
| 13д | 178,0 (150,0÷210,0) p≤0,05 | 14ж | 708,0 (620,0÷800,0) p≤0,05 |
| 13ж | 708,0 (590,0÷840,0) p≤0,05 | лидокаин | 128,0 (132,0÷178,0) |
| тримек-аин* | 180,0 (132,0÷178,0) | анальгин* | 2900 (2160-3340) |
| левоми-цетин* | 1300* (1000,0÷1600,0) | ортофен* | 74(48,8-124) |
* - литературные данные
Из таблицы видно, что большинство испытанных соединений обладают низкой токсичностью и относятся по классификации Сидорова К.К. к малотоксичным и практически нетоксичным веществам
Противомикробная активность
Противомикробная активность 111 соединений, была изучена на кафедре микробиологии в Пермской государственной фармацевтической академии под руководством доктора фармацевтических наук, заведующей кафедрой микробиологии Одеговой Т.Ф.
Определение противомикробной активности синтезированных соединений проводили методом двукратных серийных разведений в жидкой питательной среде. Для всех исследуемых соединений определяли минимальные подавляющие концентрации (МПК) в мкг/мл. В качестве эталона сравнения использовали антибактериальные препараты – левомицетин и норфлоксацин (таблица 2).
Таблица 2
Противомикробная активность.
| Соединение/Эталон | МПК, мкг/мл S. aureus | МПК, мкг/мл E. coli | Соединение/Эталон | МПК, мкг/мл S. aureus | МПК, мкг/мл E. coli |
| 2е | 31 | 15,6 | 11н | 15,6 | 15,6 |
| 2з | 15,6 | 15,6 | 12г | 31 | 62 |
| 2и | 15,6 | 15,6 | 12д | 7,8 | 15,6 |
| 2л | 31 | 31 | 12з | 31 | 31 |
| 2м | 31 | 31 | 12и | 15,6 | 7,8 |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 3н | 7,8 | 7,8 | 12к | 125 | 125 |
| 8ю | 15,6 | 15,6 | 12л | 3,9 | 3,9 |
| 9р | 125 | 250 | 12м | 7,8 | 7,8 |
| 11а | 31 | 15,6 | 12н | 3,9 | 7,8 |
| 11в | 31 | 31 | 13б | 31 | 31 |
| 11г | 15,6 | 31 | 13в | 62 | 62 |
| 11з | 31 | 31 | 13е | 7,8 | 15,6 |
| 11и | 3,9 | 7,8 | 13ж | 3.9 | 3,9 |
| 11к | 7,8 | 15,6 | 14г | 31 | 31 |
| 11л | 0,25 | 2 | 14к | 15,6 | 15,6 |
| 11м | 0,06-3,9 | 1 | 14л | 7,8 | 3,9 |
| левоми-цетин | 0,5-100 | 0,5-200 | норфлоксацин | 0,06- >32 | 0,03-32,0 |
В ходе опытов высокую активность по отношению к штаммам S. aureus и E. coli показали 12 соединений (3н, 11и, 11к, 11л, 11м, 12д, 12л, 12м, 12н, 13е, 13ж, 14л) (их МПК меньше 15,6 мкг/мл), 19 соединений проявили среднюю активность (МПК 15,6-62,5 мкг/мл), остальные оказались либо малоактивными (МПК 125-1000 мкг/мл), либо неактивными (МПК больше 1000 мкг/мл).
Енаминокислоты 2,3 практически неактивны, за исключением соединений, в молекуле которых присутствует тимольный фрагмент. Введение электронодонорных заместителей в ароматическе кольцо соединений (2з, 2и) приводит к незначительному увеличению активности. В то же время введение электроноакцепторного заместителя практически не влияет на эффект (2л, 2м). При замене арильного фрагмента в 4-ом положении молекулы на трет-бутильный возрастает противомикробное действие (3м). Аммонийные соли АПК и енаминокислот, енаминоамиды АПК оказались неактивными, за исключением соединений 8ю, 9р, которые имеют МПК равную 15,6–250 мкг/мл.
Все амиды кислот, кроме соединения 11е, проявляют противомикробную активность. Наиболее активными оказались соединения 11л, 11м по отношению к штаммам золотистого стафилококка и кишечной палочки. Введение в положение 2 амидов (11) N,N-диэтиламиноэтиламинного фрагмента снижает противомикробную активность соединений 12. У солей оснований 13, 14 наблюдается некоторое снижение противомикробного действия, за исключением соединения 13ж.
Таким образом для углубленных фармакологических исследований рекомендованы N-замещенные амиды 2-гидрокси-4-оксо-4-(4-хлорфенил)-2-бутеновых кислот (11л, м), проявляющие противомикробную активность на уровне препаратов сравнения левомицетина и норфлоксацина.
Анальгетическая активность
Исследование анальгетической активности проведено доцентом, кандидатом фармацевтических наук Махмудовым Р.Р. в лаборатории БАВ Естественнонаучного института при Пермском Государственном Университете.
Скринингу на анальгетическую активность по методу «горячая пластинка» было подвергнуто 21 соединение. Исследуемые вещества вводили перорально в дозе 50 мг/кг в виде взвеси в 2% крахмальном растворе. Эффект сравнивали с активностью метамизола натрия и ортофена (таблица 3).
Таблица 3
Анальгетическая активность
| Соеди-нение /Эталон | Доза мг/кг | Время оборонительного рефлекса, сек (через120 минут) | Соеди-нение /Эталон | Доза мг/кг | Время оборонительного рефлекса, сек (через120 минут) |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 2г | 50 | 19,20±0,88 p≤0,05 | 9ж | 50 | 19,80±0,80 p≤0,05 |
| 2д | 50 | 19,40±5,05 p≤0,05 | 9м | 50 | 26,02±0,91 * p≤0,05 |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 2ж | 50 | 18,58±1,11 p≤0,05 | 9н | 50 | 19,17±5,20 p≤0,05 |
| 3к | 50 | 18,00±1,57 p≤0,05 | 9о | 50 | 19,35±2,40 p≤0,05 |
| 3м | 50 | 19,20±0,49 p≤0,05 | 9х | 50 | 23,88±4,65 p≤0,05 |
| 4з | 50 | 19,40±0,92 p≤0,05 | 9ц | 50 | 21,50±2,12 p≤0,05 |
| 4и | 50 | 24,90±3,26 * p≤0,05 | 2% крахмальный раствор | 50 | 12.62 ± 1.09 |
| метамизол натрия | 50 | 16,60±3,40 | ортофен | 10 | 26,20±0,96 |
* - отличие достоверно по сравнению с метамизолом натрия при p≤0,05
Почти все соединения проявляют анальгетическую активность, достоверно не отличаясь по действию от таковой метамизола натрия. Наиболее сильным анальгетическим действием обладают два соединения (4и, 9м), которые по активности достоверно не отличаются от аналогичного действия ортофена.
В группе енаминокислот – соединения (2г, 2д, 2ж, 3к, 3м) проявляют актив-ность, достоверно превышающую активность метамизола натрия, но уступающие по активности ортофену.
В группе аммонийных солей АПК при введении электронодонорных заместителей в ароматическое кольцо резко возрастает активность. Наиболее сильным анальгетическим действием обладает 2-гидрокси-4-оксо-4-(4-хлорфенил)-2-бутеноат 5-фенилоксадиазолиламмония (4и), показавший эффект на уровне ортофена.
В группе енаминоамидов АПК введение в амидную часть молекулы гетерильного заместителя приводит к увеличению активности, а при замене трет-бутильного заместителя на арильный наблюдается снижение эффекта (9м, 9х).
Противовоспалительная активность
Исследования противовоспалительной активности проведено доцентом, кандидатом фармацевтических наук Махмудовым Р.Р. в лаборатории БАВ Естественнонаучного института при Пермском государственном Университете и Марковой Л.Н., зав. виварием Пермской государственной фармацевтической академии.
На наличие противовоспалительной активности было проверено 9 соединений.
Противовоспалительную активность изучали на белых крысах обоего пола, на модели каррагенинового отека. Исследуемые вещества вводили внутрибрюшинно в дозе 50 мг/кг в виде взвеси в 2% крахмальном растворе. Расчет прироста отека воспаленной стопы проводили в сравнении с исходным объемом. Торможение отека вычисляли в сравнении с контролем - 2% крахмальным раствором.
Таблица 4
Противовоспалительная активность синтезированных соединений
| Соеди-нение/ Эталон | Формула | Торможение каррагениного отека в % | ||
| 1 час | 3 часа | 5 часов | ||
| 2ж |  | … | 50,92 p≤0,05 | … |
| 3б |  | 52,0* p≤0,05 | 32,1 p≤0,05 | 23,0 p≤0,05 |
| 9х |  | 66,3* p≤0,05 | 42,7 p≤0,05 | 14,0 p≤0,05 |
| | диклофенак натрия | 40,2 | 65,6 | 60,1 |
Относительно препарата сравнения * p≤0,05 – диклофенака натрия
Как видно из таблицы 4, соединения (3б, 3м, 9х) через час после введения каррагенина проявили активность на уровне диклофенака натрия. Далее в течение эксперимента активность веществ снижается, и они уступают по активности диклофенаку натрия.
Местноанестезирующая активность
Исследование местноанестезирующей активности синтезированных соединений проведено на кафедре физиологии и патологии Пермской государственной фармацевтической академии доцентом, кандидатом биологических наук Чащиной С.В. под руководством доктора медицинских наук, профессора, заведующего кафедрой Сыропятова Б.Я.
Впервые среди производных ацилпировиноградных кислот были обнаружены соединения с местноанестезирующе активностью.
Была изучена местноанестезирующая активность 21 соединения, относящихся к солям N-замещенных амидов 4-арил-2-(β-N,N-диэтил-аминоэтиламино)-4-оксо-2-бутеновых кислот. Соединения исследовали в виде 1% водных растворов в опытах на кроликах методом Ренье. В качестве препаратов сравнения были взяты наиболее известные препараты данной группы, широко применяемые в медицине – лидокаин и тримекаин.
Таблица 5
Местноанестезирующая активность
| Соеди-нение/ Эталон | R | R1 | Концен-трация % | Индекс Ренье | Время действия, мин |
| 1 | 2 | 3 | 4 | 5 | 6 |
| | 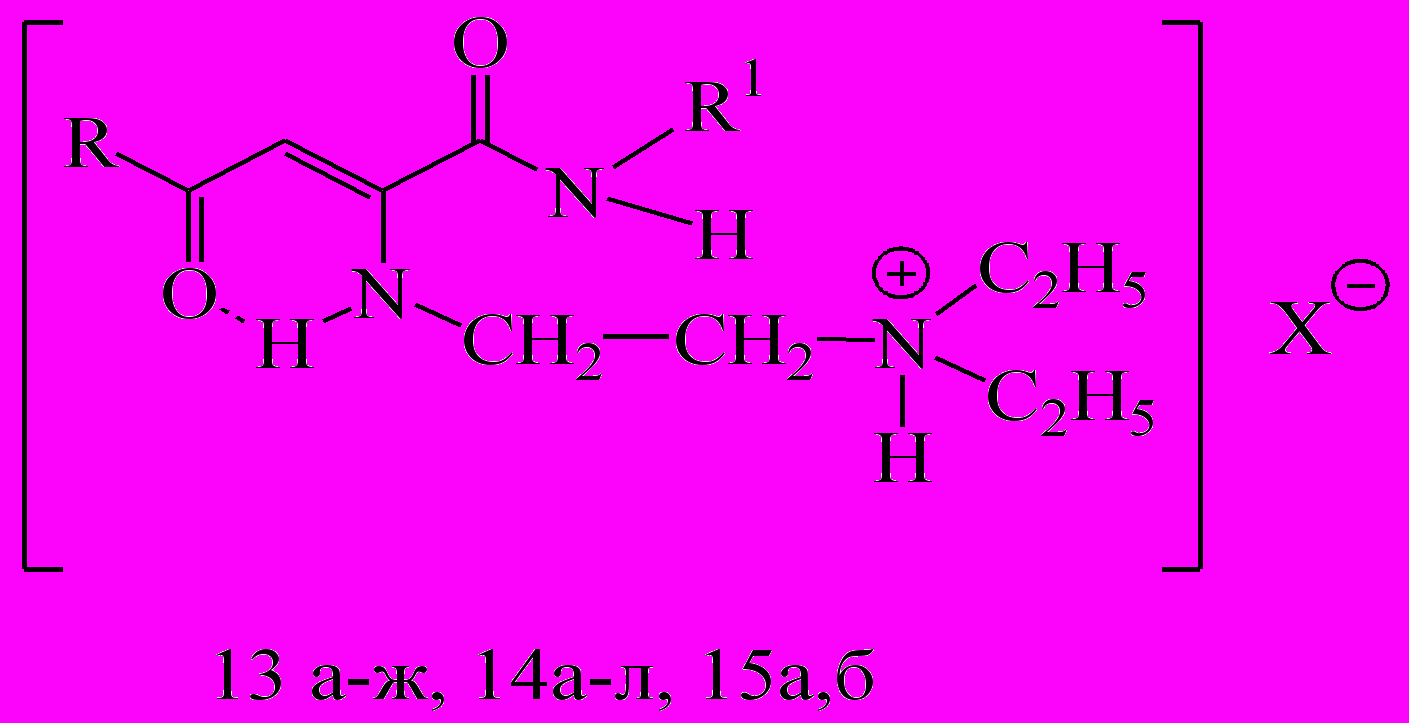 Х= Cl- (13а-ж), HOOC-CH2-CH2-COO- (14а-л), HOOC-CH(OH)-CH(OH)-COO-(15а, б) | ||||
| 13а | C6H5 | 2,6-(СН3)2C6H3 | 1 | 1132,8±69,7,* p≤0,05 | 60,0±0,0* |
| 13б | C6H5 | 2,4,6-(СН3)3C6H2 | 1 | 376,0±23,8, p≤0,05 | 35,0±1,8 |
| 13в | 4-СН3C6H4 | 2,6-(СН3)2C6H3 | 1 | 641,3±262,9, | 42,5±12,7 |
| 13г | 4-СН3C6H4 | 2,4,6-(СН3)3C6H2 | 1 | 1182,7±6,3,* p≤0,05 | 58,3±1,2* |
| 13д | 4-С2Н5OC6H4 | 2,6-(СН3)2C6H3 | 1 | 1300,0±0,0,* p≤0,05 | 71,3±4,5* |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 13е | 4-СlC6H4 | 2,6-(СН3)2C6H3 | 1 | 1202,5±21,5,* p≤0,05 | 47,5±9,0 |
| 13ж | 4-СlC6H4 | 2,4,6-(СН3)3C6H2 | 1 | 243,8±154,6, | 45,0±10,8 |
| 14а | C6H5 | 2,6-(СН3)2C6H3 | 1 | 1280,0±12,8,* p≤0,05 | 80,0±1,4* |
| 14б | C6H5 | 2,4,6-(СН3)3-C6H2 | 1 | 1272,8±12,8,* p≤0,05 | 68,8±1,4* |
| 14в | 4-СН3C6H4 | 2,6-(СН3)2C6H3 | 1 | 1265,3±36,6,* p≤0,05 | 71,3±2,7* |
| 14г | 4-СН3C6H4 | 2,4,6-(СН3)3C6H2 | 1 | 1257,5±42,6,* p≤0,05 | 73,8±2,7* |
| 14д | 4-СН3OC6H4 | 2,6-(СН3)2C6H3 | 1 | 517,2±65,4, | 30,0±5,6 |
| 14е | 4-СН3OC6H4 | 2,4,6-(СН3)3C6H2 | 1 | 807,5±115,6,* | 58,3±3,1* |
| 14ж | 4-С2Н5OC6H4 | 2,6-(СН3)2C6H3 | 1 | 381,5±16,1, p≤0,05 | 22,5±0,8 |
| 14з | 4-С2Н5OC6H4 | 2,4,6-(СН3)3C6H2 | 1 | 1283,3±15,5,* p≤0,05 | 69,8±12,8* |
| 14и | 4-FC6H4 | 2,6-(СН3)2C6H3 | 1 | 1002,0±161,7,* | 60,0±1,8* |
| 14к | 4-СlC6H4 | 2,6-(СН3)2C6H3 | 1 | 731,0±64,6,* p≤0,05 | 61,3±0,7* |
| 14л | 4-СlC6H4 | 2,4,6-(СН3)3C6H2 | 1 | 90,5±47,3* | 6,3±4,2 |
| 15а | C6H5 | 2,6-(СН3)2C6H3 | 1 | н/а | н/а |
| 15б | C6H5 | 2,4,6-(СН3)2C6H3 | 1 | н/а | н/а |
| лидокаин** | 1 | 552,0±57,9, p≤0,05 | 35,0±3,7 | ||
| тримекаин*** | 1 | 559,0±26,1, p≤0,05 | 31,8±4,4 | ||
* - Отличия достоверны по сравнению с контролем при p≤0,05
** - собственные исследования ***- литературные данные
Как видно из таблицы 5, все изученные соединения, кроме соединений 15а,б, проявили активность при поверхностной анестезии. Активность двенадцати апробированных соединений (13а, 13г-13е, 14а-14г, 14з, 14и, 14к) превосходят препараты сравнения по показателю глубины при поверхностной анестезии и по продолжительности действия, два соединения (13в, 14е) достоверно не отличаются по действию от препаратов сравнения – лидокаина и тримекаина. Три соединения (13б,ж, 14ж) уступают препаратам сравнения по показателю глубины при поверхностной анестезии, достоверно не отличаясь по продолжительности действия. Соединение 14л уступает по всем показателям препаратам сравнения – лидокаину и тримекаину.
В группе гидрохлоридов N-(2,6-диметилфенил)амидов 4-арил-2-(β-N,N-диэтиламиноэтиламино)-4-оксо-2-бутеновых кислот введение в арильную часть молекулы этоксигруппы приводит к достижению максимального показателя глубины при поверхностной анестезии и увеличению продолжительности действия.
В группе гидрохлоридов N-(2,4,6-триметилфенил)амидов 4-арил-2-(β-N,N-диэтиламиноэтиламино)-4-оксо-2-бутеновых кислот введение в арильную часть молекулы электронодонорного заместителя (13г) приводит к увеличению показателя глубины при поверхностной анестезии и продолжительности действия, а электроноакцепторного заместителя (13ж) - только к увеличению продолжительности действия
В группе сукцинатов N-(2,6-диметилфенил)амидов 4-арил-2-(β-N,N-диэтил-аминоэтиламино)-4-оксо-2-бутеновых кислот обнаружен ряд соединений, обладающих выраженной местноанестезирующей активностью, превосходящих препараты сравнения (14а, 14в, 14и, 14к), причем наличие в арильной части молекулы электронодонорных и электроноакцепторных заместителей приводит к снижению обоих показателей. Исключение составляет соединение 14в, у которого снижается только продолжительность действия.
В группе сукцинатов N-(2,4,6-триметилфенил)амидов 4-арил-2-(β-N,N-ди-этиламиноэтиламино)-4-оксо-2-бутеновой кислоты обнаружены соединения с выраженной местноанестезирующей активностью, превосходящие по глубине и продолжительности действия препараты сравнения. Наличие в арильной части молекулы электронодонорых заместителей не приводит к достоверным изменениям показателя глубины при поверхностной анестезии и продолжительности действия. Исключением является соединение 14е. Введение электроноакцепторных заместителей приводит к снижению обоих показателей.
В группе тартратов активных соединений не обнаружено.
В группе гидрохлоридов замена в амидной части 2,6-диметилфенильного фрагмента на 2,4,6-триметилфенильнай приводит к снижению обоих показателей, исключением является соединение 13г, у которого увеличивается показатель глубины при поверхностной анестезии и соединение 13ж – у которого показатель продолжительности остается на том же уровне, не имея достоверных отличий.
В группе сукцинатов замена в амидной части 2,6-диметилфенильного фрагмента на 2,4,6-триметилфенильный либо не приводит к изменению обоих показателей, либо снижает их. Исключения составляют соединения в арильной части, которых есть метокси- или этоксигруппы – у этих соединений происходит обратная взаимосвязь.
Замена хлорид–иона на сукцинат–ион в группе N-(2,6-диметилфенил)амидов 4-арил-2-(β-N,N-диэтиламиноэтиламино)-4-оксо-2-бутеновых кислот может изменять глубину и продолжительность действия как в сторону увеличения, так и в сторону уменьшения.
Замена хлорид-иона на сукцинат-иона группе N-(2,4,6-триметилфенил) амидов 4-арил-2-(β-N,N-диэтиламиноэтиламино)-4-оксо-2-бутеновоых кислот приводит к увеличению показателя глубины при поверхностной анестезии и продолжительности действия, исключение составляет соединение 13л у которого оба показателя падают.
Введение в молекулу тартрат-ионов вместо гидрохлорид- и сукцинат-ионов в группе N-замещенных амидов 4-арил-2-(β-N,N-диэтиламиноэтиламино)-4-оксо-2-бутеновых кислот делает соединения неактивными.
Соединения 13д, 13е были проверены на наличие проводниковой и инфильтрационной анестезии. Исследования проведены в опытах на крысах с использованием методов Bülbring и Waida (1945) при электрическом раздражении кожи животного и Truant, 1958 раздражение нервов крыс производили выше места блокады. Определен порог электрического раздражения. Результаты испытаний представлены в таблице 6.
Таблица 6
Проводниковая и инфильтрационная анестезии
| Соединение/ Эталон | Проводниковая анестезия | Инфильтрационная анестезия | ||
| Глубина анест.,% | Продолж. анест., мин | Глубина анест.,% | Продолж. анест., мин | |
| 13д | 100 | 153,2±12,4 | 94,5±6,0 | 117,5±16,3 |
| 13е | 90±10,8 | 173,4±28,2 | 100 | 60,0±10 |
| лидокаин * | 80 | 150 | 80 | 150 |
| тримекаин* | 100 | 176±28,4 | 100 | 196,3±3,8 |
*- литературные данные
Как видно из таблицы 6, при проводниковой анестезии соединения 13д, 13е достоверно превосходят по глубине анестезии препарат сравнения лидокаин и не отличается по глубине анестезии от препарата сравнения тримекаина. По продолжительности действия соединения достоверно не отличаются от препаратов сравнения .
При инфильтрационной анестезии соединения 13д, 13е превосходят препарат сравнения лидокаин, достоверно не отличаясь по действию от тримекаина, но уступают им по продолжительности действия.
Таким образом, в результате исследования осуществлен синтез ранее неизвестных соединений, среди которых выявлены вещества, обладающие противомикробной, анальгетической, противовоспалительной и местноанестезирующей активностью. Выявлены некоторые закономерности зависимости биологической активности от структуры соединений, которые могут быть учтены в дальнейшем целенаправленном поиске новых БАВ в ряду енаминоамидов АПК.
ВЫВОДЫ
- При взаимодействии АПК с первичными ароматическими аминами образуются енаминокислоты, а с азотосодержащими гетериламинами – аммонийные соли АПК.
- 2-Ариламино-5,5-диметил-4-оксогекс-2-еновые кислоты, сушествующие в растворах в трех таутомерных формах, вступают во взаимодействие с уксусным ангидридом в циклической форме с образованием продуктов О-ацилирования.
- Дециклизация 3-замещенных фуранонов под действием первичных аминов является удобным методом для синтеза енаминоамидов АПК с различными заместителями в структуре.
- Впервые осуществлен целенаправленный синтез N-замещенных амидов 4-арил-2-(β,β-диэтиламиноэтиламино)-4-оксо-2-бутеновых кислот, обладаю-щих местноанестезирующей активностью.
- Проведен фармакологический скрининг 115 синтезированных соединений, среди которых обнаружена противомикробная анальгетическая, противовоспалительная и местноанестезирующая активность.
- Для углубленных фармакологических исследований предлагаются:
а) N-(2,4,6-триметилфенил)амид 2-гидрокси-4-оксо-4-(4-хлорфенил)-2-буте-новой кислоты (11м), проявляющий высокую противомикробную активность по сравнению с левомицетином и норфлоксацином.
б) Гидрохлорид N-(2,6-диметилфенил)амида 2-(2-N,N-диэтиламиноэтилами-но)-4-оксо-4-(4-этоксифенил)-2-бутеновой кислоты (13д), сукцинат N-(2,4,6-триметилфенил)амида 2-(2-N,N-диэтиламиноэтиламино)-4-оксо-4-(4-метил-фенил)-2-бутеновой кислоты, (14г) проявляющие выраженную местно-анестезирующую активность, превосходя препараты сравнения – лидокаин и тримекаин.
