Гульмурадова Наргис Ташпулатовна применение лазерных технологий в лечении острого деструктивного панкреатита
| Вид материала | Автореферат |
| Результаты собственных исследований. Прямые признаки Косвенные признаки |
- К вопросу о раннем энтеральном питании у больных с деструктивным панкреатитом, 115.83kb.
- Рименение лазерных технологий в лечении заболеваний лор органов в Окружном кардиологическом, 31.97kb.
- Острого деструктивного панкреатита, 300.67kb.
- Место ронколейкина в лечении тяжелого острого панкреатита, 125.81kb.
- «Фиброэндоскопические санации при лечении гнойно-некротических осложнений деструктивного, 387.89kb.
- Методическая разработка по хирургии для студентов IV курса медицинского факультета, 49.72kb.
- «Концерн апф» офіційне представництво зат «Фарм Синтез» в Україні, 230.4kb.
- Применение алгоритма диагностики и лечения тяжелого острого панкреатита 14. 01., 517.82kb.
- Применение споробактерина в комплексном лечении острого холецистита у пациентов пожилого, 606.3kb.
- Березницкий александр павлович пути оптимизации применения малоинвазивных технологий, 263.1kb.
Наряду с традиционными исследованиями, с целью определения тяжести эндогенной интоксикации у пациентов в плазме крови определяли уровень средних молекул (СМ). Содержание СМ проводили по методике Рябова Г.А. и соавт. (1985) в лаборатории ФГУ «ГНЦ ЛМ ФМБА, России». Нормальный показатель содержания СМ в плазме крови составлял 0.4±0,04 ед. опт. плотности.
Для прогнозирования течения заболевания и оценки эффективности комплексного лечения определяли степень активности процессов перекисного окисления липидов (ПОЛ) и антиоксидантной активности SH групп и СМ на 1,3,7 и 14 сутки лечения. Исследования проводили в лаборатории ФГУ «ГНЦ ЛМ ФМБА, России». Определение содержания малонового диальдегида проводили по методике Mihara М., Unhiyama. M (1978). Нормативный показатель составил 1,45±0,24 нмоль/мг. Определение белковых сульфгидрильных групп (SH-групп) проводили по методике Эллмана с использованием дитионитробензойной кислоты. Нормативный показатель соответствовал – 0,37±0,08мµ. Содержание белковых карбонильных групп определяли спекторофотометрически с использованием 2,4- динитрофенилгидразина по методике Levine R.L., Garland D. (1990). Нормативный показатель составил 0,70±0,1 нмоль/мг.
Оценку иммунного статуса проводили в лабораториях «XXI век» г.Москвы и отделении иммунологии и регуляторных механизмов в хирургии им. академика Б.В. Петровского РАМН. При оценке клеточного иммунитета для определения количества лейкоцитов и лимфоцитов у всех пациентов проводили общий клинический анализ крови на гематологическом анализаторе Sysmex 2000 (Sysmex, Япония). Иммунофенотипирование лимфоцитов выполняли на лазерном проточном цитофлоуметре CYTOMICS FC 500 (Beckman Coulter, США). Определение субпопуляций лимфоцитов проводили с помощью многоцветного окрашивания мечеными моноклональными антителами (Beckman Coulter, США).
С помощью иммунотурбидиметрического метода на биохимическом анализаторе “OLYMPUS AU 640”(наборы реактивов этой же фирмы) проводили следующие исследования: содержание СРБ; определение компонентов комплемента С3 и С4; определение иммуноглобулинов IgА, IgM и IgG (у 1/3 больных уровень иммуноглобулинов в сыворотке крови определяли методом радиальной иммунодиффузии).
Фагоцитарную активность нейтрофилов (неспецифический клеточный иммунитет) исследовали с использованием проточной лазерной цитометрии с применением двухцветного реагента Simultest, Phagotest.
Нами были использованы следующие инструментальные методы: УЗИ, ФГДС, рентгенологическое исследование брюшной полости и грудной клетки, ЭРХПГ, видеолапароскопия, компьютерная томография, глубинная микроволновая радиотермометрия, фистулография.
УЗИ проводили на аппаратах фирмы «Алока» (Япония) и ««Voluson Expert E8» компании «General Electrics (США), оснащенных пункционным датчиком. УЗИ начинали с оценки размеров головки, тела и хвоста поджелудочной железы, ее контуров, эхогенности, эхоструктуры, диаметра Вирсунгова протока, состояния парапанкреатической клетчатки, наличия свободной жидкости в брюшной и плевральной полостях. Оценивали также размеры и эхогенность паренхимы печени, состояние и размеры внутрипеченочных протоков, общего желчного протока и желчного пузыря.
В целях точной верификации объема панкреонекроза, оценки его органной и внеорганной распространенности, а также для дальнейшего прогнозирования течения заболевания проводили КТ на спиральном томографе «General Electrics» (США). Исследования выполняли после предварительного перорального контрастирования пищеварительного тракта раствором урографина по стандартной методике, с внутривенным контрастным усилением, путем в/в введения 40-50 мл рентгеноконтрастных препаратов «Омнипак» 350 (Визипак-300). Морфологическую степень тяжести острого панкреатита определяли с использованием томографического индекса степени тяжести (СТ Severity INDEX = CTSI), разработанного группой Balthazar E. et.аl. (1985) со счетом баллов от 1 до 10. По данным КТ с контрастным усилением выделяют пять степеней тяжести поражения поджелудочной железы, которые могут быть суммированы в виде шкалы интегральной оценки распространенности и характера поражения при ОДП. Для расчета СТSI к баллам степени поражения поджелудочной железы прибавляли баллы степени некроза: 2 балла – при поражении менее 1/3 объема паренхимы, 4 балла – при некрозе более 1/3, но менее 1/2 объема; 6 баллов – при поражении более 1/2 объема железы (табл.4). Рентгенологическое исследование проводили на аппарате «Siemens» (Германия). ФГДС выполняли фиброгастродуоденоскопом фирмы «Olympus TJF 30» (Япония) с обязательным осмотром БДС с боковой оптикой.
Видеолапароскопию выполняли по стандартной методике, в условиях общей анестезии, с применением аппаратуры фирмы «Karl-Storz» (Германия).
Глубинную микроволновую радиотермометрию производили аппаратом РТМ-01-РЭМ (Россия), позволяющим проводить измерения интенсивности собственного электромагнитного излучения тканей больного в диапазоне сверхвысоких частот, прямо пропорционально отражающей температуру тканей.
Данные по температуре обрабатывали и отображали на мониторе в виде термограмм или полей температур. Для выявления инфильтрата или скоплений жидкости у больных с ОДП использовали инфракрасный датчик, который фиксировал температуру кожи по тепловому излучению в инфракрасном диапазоне, согласно специально заданной программе «поджелудочная железа». Температуру измеряли транскутанно в проекции головки, тела и хвоста поджелудочной железы и поясничных областей. РТМ диагностику проводили пациентам на 3-5 сутки госпитализации.
Таблица 4
Определение тяжести острого деструктивного панкреатита
с помощью КТ (Balthazar E. et.аl., 1985)
| Состояние ПЖ и перипанкреатической клетчатки | КТ индекс | Баллы | Площадь некроза | Баллы |
| Нормальное состояние ПЖ | А | 0 | 0 | 0 |
| Локальное или диффузное увеличение ПЖ+гиподенсивные включения, с нечеткими контурами, расширение панкреатического протока | В | 1 | <30% | 2 |
| Значительные изменения ткани ПЖ (В)+ воспалительные изменения в перипанкреатической клетчатке | С | 2 | 50% | 4 |
| Вышеуказанные изменения С+ единичные жидкостные образования вне ПЖ | Д | 3 | >50% | 6 |
| Д+ два или более жидкостных образований или газ в панкреатической/перипанкреатической области | Е | 4 | - | - |
Статистическую обработку результатов исследований осуществляли на ПЭВМ IBM PC DX-2-80 методом вариационной статистики (Л.С.Каминский 1964, А.П. Боровиков и соавт. //Statistica). Статистический анализ и обработка данных проведен “Windows”.– 2003 с использованием пакета программ “Excell-5”. Результаты рассматривали как достоверные, если вероятность случайного их происхождения по t-критерию Стьюдента была менее 5% (р<0,05).
Результаты собственных исследований. Острый отечный панкреатит (ООП), как правило, на фоне проводимой комплексной консервативной терапии имел абортивное течение. Появление метеоризма (83,2%), на фоне напряжения брюшной стенки (86,1%), формирование инфильтрации в парапанкреатической клетчатке (76,9%), токсической энцефалопатии (41,6%) или реактивного плеврита (12,1%) указывали на развитие панкреонекроза и распространение процесса на забрюшинную клетчатку (табл.2). При этом развитие дыхательной (56,6%) и почечной (39,9%) недостаточности были следствием тяжелой эндотоксемии. Для 54 (21,4%) больных инфицированным панкреонекрозом (ИПН) было характерно двухфазное течение заболевания: после относительной стабилизации состояния больного, через 2-3 недели отмечалось развитие гнойных осложнений.
Переход стерильного панкреонекроза в инфицированный, как правило, сопровождался ухудшением состояния пациента, нарастанием интоксикации, появлением симптомов полиорганной недостаточности (ПОН), формированием пальпируемого инфильтрата в верхней половине живота, появлением перитонеальных симптомов, лихорадки, озноба, желтухи и смешанной энцефалопатии.
Однако диагностическая значимость вышеуказанных клинических симптомов, по нашим наблюдениям, была невысокой, поскольку были неспецифичны. Для улучшения диагностики мы применяли ряд инструментальных (УЗИ и лапароскопию, ФГДС, КТ) и лабораторных исследований.
Результаты лабораторных исследований у больных с различными клинико-морфологическими формами ОП не выявили достоверных отличий в уровне общего белка, мочевины и глюкозы крови (табл.5).
Таблица 5
Исходные биохимические показатели крови в зависимости от формы заболевания
| Показатели | Норма | Группа больных | Отечный панкреатит (n=79) | ОДП (n=173) |
| Общий белок | 64-83 г/л | Контрольная | 72.1±3.7 | 68.7±1.9 |
| Основная | 73.6±3.6 | 69.8±2.4 | ||
| Общий билирубин | 3.4-17.1 ммоль/л | Контрольная | 36.1±1.9* | 41.1±2.8** |
| Основная | 35.1±1.8* | 39.4±2.4** | ||
| АсАТ | 0-35 Ед/л | Контрольная | 38.4±2.0* | 96±2.8** |
| Основная | 41.9±2.3* | 116±5.8** | ||
| АлАТ | 0-31 Ед/л | Контрольная | 48.1±0.4* | 108±4.3** |
| Основная | 39.5±0.5* | 92.1±6.3** | ||
| Креатинин | 70-110 ммоль/л | Контрольная | 106.2±2.1 | 146±4.6** |
| Основная | 101.8±2.3 | 148±6.1** | ||
| Мочевина | 2.5-6.5 ммоль/л | Контрольная | 6.9±0.9 | 7.2±2.6 |
| Основная | 6.2±0.8 | 7.5±3.1 | ||
| Амилаза крови | 10-100 ЕД/л | Контрольная | 264±4.1* | 389±4,7* |
| Основная | 263±4.8* | 371±4.4* | ||
| Глюкоза | 3.8-5.8 ммоль/л | Контрольная | 5.9±2.1 | 6.8±1.2 |
| Основная | 5.8±1.9 | 7.2±1.3 |
Примечание: *-p<0,05 , **p <0,001 по сравнению с нормой.
Однако отечный панкреатит сопровождался существенным повышением общего билирубина, увеличением уровня АсАт и АлАт, при этом сдвиги были более выраженными у больных с панкреонекрозом (ОДП). Таким образом, приведенные лабораторные тесты свидетельствовали о наличии функциональной недостаточности печени на фоне токсического гепатита. У всех больных с отечной формой и большинства пациентов с панкреонекрозами было также установлено повышение уровня амилазы крови от 130 до 2710 ЕД/л. Лишь в 9 (5,2%) наблюдениях у лиц с тотальным панкреонекрозом показатели амилазы крови были в пределах нормы. Проявлением функциональной недостаточности почек было обнаружение повышение уровня креатинина крови до 148±6,1 ммоль/л (р < 0,05) у больных с панкреонекрозом.
У больных с отечным панкреатитом (контрольная и основная группы) в первые сутки наблюдения мы выявляли изменения факторов ПОЛ, проявляющихся в снижении уровня SH-групп (0,32±0,09 и 0,35±0,06) и в достоверном повышении уровня СМ (0,68±0,02 и 0,65±0,02), МДА (2,120±,09 и 2,18±0,17) и КБ (0,86±0,05 и 0,81±0,06). Эти сдвиги указывали на интенсификацию процесса ПОЛ, играющего важную роль о патогенезе ОП. У больных ОДП отмечали достоверно высокие цифры продуктов ПОЛ и маркера эндотоксемии (СМ) в сравнении с данными у больных ОП (контрольная и основная группы), а именно снижение уровня SН-группы (0,28±0,04 и 0,27±0,05), резкое повышение (в 2 раза и более) уровня СМ (0,8±60,03 и 0,82±0,04), МДА (3,91±0,13 и 4,06±0,18) и на 45-50% повышение уровня КБ (0,93±0,05 и 0,94±0,06) (табл.6).
Таблица 6
Исходные параметры эндогенной интоксикации и ПОЛ у больных основной и контрольной групп.
| Показатели | Группы больных | Отечный панкреатит | ОДП |
| Средние молекулы (норма 0,4±0,04 ед/л) | Контрольная | 0,68±0,02* | 0,86±0,03** |
| Основная | 0,65±0,02* | 0,82±0,04** | |
| Малоновый диальдегид (норма 1,45±0,24 ммоль/л) | Контрольная | 2,12±0,09* | 3,91±0,13** |
| Основная | 2,18±0,17* | 4,06±0,18** | |
| SH- группы (норма 0,37±0,08мµ) | Контрольная | 0,32±0,09 | 0,28±0,04** |
| Основная | 0,35±0,06 | 0,27±0,05** | |
| Карбонилы (норма 0,70±0,1 нмоль/л) | Контрольная | 0,86±0,04* | 0,93±0,05** |
| Основная | 0,81±0,06* | 0,94±0,06** |
Примечание: достоверность различия *р<0,05 по сравнению с нормой;
**р<0,05 по сравнению с отечной формой заболевания.
Следовательно, уже на стадии острого отечного панкреатита мы наблюдали определенные изменения, а на стадии панкреонекроза – более существенное усиление процессов липопероксидации. Накопление и поддерживание в сыворотке крови на довольно высоком уровне МДА и КБ совпадает с высоким уровнем СМ. Такой параллелизм изменений свидетельствует о несомненном участии продуктов ПОЛ в общей совокупности токсических соединений, циркулирующих в крови больных с панкреонекрозом и поддерживающих высокую степень эндотоксемии.
В патогенезе прогрессирования острого панкреатита ведущую роль отводят иммунным нарушениям. У больных с панкреонекрозом развиваются выраженные изменения со стороны клеточного и гуморальных звеньев иммунитета, а также ФАН, которые существенно отягощают течение заболевания.
Нами были проведены исследования иммунного статуса у 57 пациентов с ОП из числа, которых 32 больным проводили сеансы НИЛИ (основная группа). Среди обследованных отечной формой ОП (I группа) было 13 больных; стерильным панкреонекрозом и ферментативным перитонитом (II группа) – 25 пациентов; инфицированным панкреонекрозом (III группа) – 19 больных. У пациентов I гр. проводили только комплексное консервативное лечение, у больных II гр. – комплексное консервативное лечение и лапароскопическое дренирование брюшной полости, у III гр. – традиционное хирургическое лечение. Мониторинг исследований иммунного статуса проводили до и после проведения курса сеансов НИЛИ.
Результаты наших исследований свидетельствуют, что при отечной форме ОП наблюдается достоверное повышение количества лейкоцитов (11,3±0.67), лимфопения, снижение содержания Т-лимфоцитов и их субпопуляций. (рис.1). О развитии иммунодефицита уже на 2-3 сутки заболевания указывало повышение показателя лейкоцитарно-Т-лимфоцитарного индекса до 13.61±4.8 (при норме 5,8±4,6) и содержания В–лимфоцитов (р<0,05). Упомянутые сдвиги клеточного иммунитета, характерные для панкреатогенной токсемии, мы наблюдали при всех формах ОП. Фагоцитарная активность нейтрофилов (ФАН) и концентрация иммуноглобулинов классов A, M и G в сыворотке крови при отечной форме заболевания были в пределах нормы.
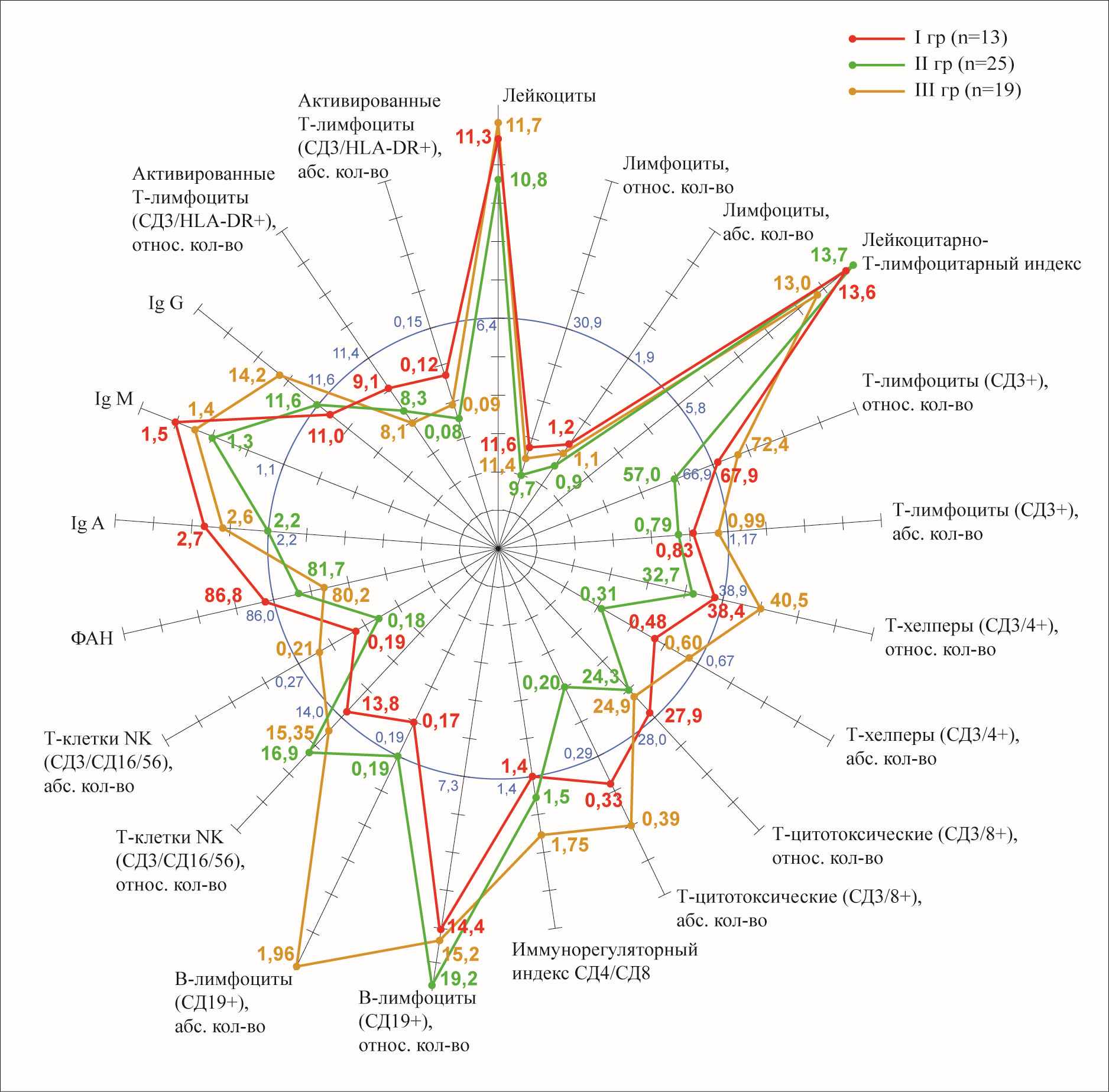
Рис.1. Исходные иммунограммы у больных отечным панкреатитом (I группа), стерильным (II группа) инфицированным (III группа) панкреонекрозом.
У пациентов со стерильным панкреонекрозом и ферментативным перитонитом (n=25) также был обнаружен высокий лейкоцитарно-Т- лимфоцитарный индекс (13,7±5,2) на фоне снижения показателей Т-лимфоцитов (СД3+) как в относительном, так и в абсолютном значениях в сравнении с показателями здоровых доноров: 57,0±2,01%, 0,79±0,031х109/л и 66,9±2,4%, 1,168±0,073х109/л соответственно. Было отмечено также снижение Т-хелперов и Т-цитотоксических клеток: СД4+ – 32,73±1,89%, 0,31±0,042х109/л и СД8+ – 24,32±1,51% и 0,203±0,014x109/л. Маркеры активации Т-лимфоцитов во II группе были низкими и составили СД3/HLA-DR+8,31±0,97%, 0,08±0,01x109/л (р<0,05). Достоверное увеличение относительных показателей В-лимфоцитов (СД19+) – 19,16±1.2%, содержания естественных киллеров СД3/СД16/56 до 16,9±1,2% на фоне снижения абсолютного значения лимфоцитов (0,94±0,09x109/л) и ФАН (81,67±1,3%) (р<0,05) указывали на развитие выраженного иммунодефицита, обусловленного тяжелой токсемией.
При инфицированном панкреонекрозе (n=19) исходные иммунологические сдвиги были сопоставимы с показателями иммунного статуса при отечной форме, хотя клинически данная группа была наиболее тяжелой. Для III группы была характерна пан Т-лимфоцитемия, СД3+ (72,35±2,3% и 0,989±0,242x109 г/л), наиболее низкие показатели маркеров активации Т-лимфоцитов (СД3/HLA-DR+ - 8,09±1.2% и 0,09±0,03x109/л), ФАН (80,2±1,2%), повышение содержания иммуноглобулина G-(14,21±1,3 г/л) (р<0,05), которые явились неблагоприятными прогностическими признаками инфицирования очагов деструкции.
Таким образом, панкреонекроз сопровождается активацией ПОЛ, угнетением системы антиоксидантной защиты, тяжелой эндотоксемией и развитием выраженного вторичного иммунодефицита.
УЗИ при остром панкреатите в качестве скринингового метода оценки состояния поджелудочной железы, билиарной системы, брюшной и плевральных полостей проводили всем поступившим больным.
У большинства больных с отечной формой ОП (74,7%) было установлено тотальное увеличение размеров железы, реже наблюдалось сегментарное увеличение железы за счет одного из отделов, при этом сегментарное увеличение головки ПЖ было выявлено у 9 (11,4%) больных, тела – у 5 (6,3%), хвоста – у 6 (7,6%) пациентов (табл.7).
При отечной форме ОП были обнаружены изменения эхогенности паренхимы железы. Пониженная эхогенность у данной категории пациентов была выявлена у 68 (86,1%), повышенная – у 7 (8,9%) больных. Неровные и нечеткие контуры железы обнаружены у 21(26,6%), инфильтрат в проекции ПЖ у 17 (24,5%) пациентов. Неоднородность эхоструктуры железы было также установлена у 22 (27,8%) пациентов.
Для панкреонекроза (173 больных) было характерным тотальное увеличение размеров железы. Контуры железы в большинстве случаев (94.8%) были нечеткими и неровными. У всех пациентов с ОДП было выявлено изменение эхогенности паренхимы железы, которая была пониженной у 129 (74,6%), а повышенной – 44 (25,4%) больных.
Таблица 7
Частота встречаемости ультрасонографических признаков острого панкреатита
| Признаки | ООП (n=79) | ОДП (n=173) | ||
| Абс | % | Абс | % | |
| Увеличение размеров ПЖ: тотальное сегментарное: головка тело хвост | 59 9 5 6 | 74,7 11,4 6,3 7,6 | 173 | 100 |
| Неровные и нечеткие контуры ПЖ | 21 | 26,6 | 164 | 94,8 |
| Эхогенность: пониженная Повышенная | 68 7 | 86,1 8,9 | 129 44 | 74,6 25,4 |
| Неоднородность эхоструктуры железы | 22 | 27,8 | 166 | 95,9 |
| Формирование жидкостных образований в проекции ПЖ | 3 | 3,8 | 143 | 82,7 |
| Инфильтрат в проекции ПЖ | 17 | 21,5 | 141 | 81,5 |
| Свободная жидкость в брюшной полости | - | - | 130 | 75,1 |
| Инфильтрация и неоднородность забрюшинной клетчатки | 25 | 31,6 | 73 | 42,2 |
| Выпот в плевральных полостях | - | - | 47 | 27,2 |
| Парез ЖКТ | 46 | 58,2 | 162 | 93,6 |
| Расширение Вирсунгова протока | 3 | 3,8 | 9 | 5,2 |
Неоднородность эхоструктуры ПЖ была определена у 166 (95,9%) больных. Воспалительный инфильтрат в проекции ПЖ обнаружен у 141 (81,5%).
У больных с ОДП жидкостные скопления в сальниковой сумке (рис.2) (оментобурсит) и в забрюшинной клетчатке были обнаружены у 143 (82,7%) пациентов, выпот в брюшной полости – у 130 (75,1%), в плевральных полостях – у 47 (27,2%) пациентов. Инфильтрация и неоднородность забрюшинной клетчатки установлены у 73 (42,2%) больных. Расширение Вирсунгова протока имело место у 9 (5,2%) пациентов.
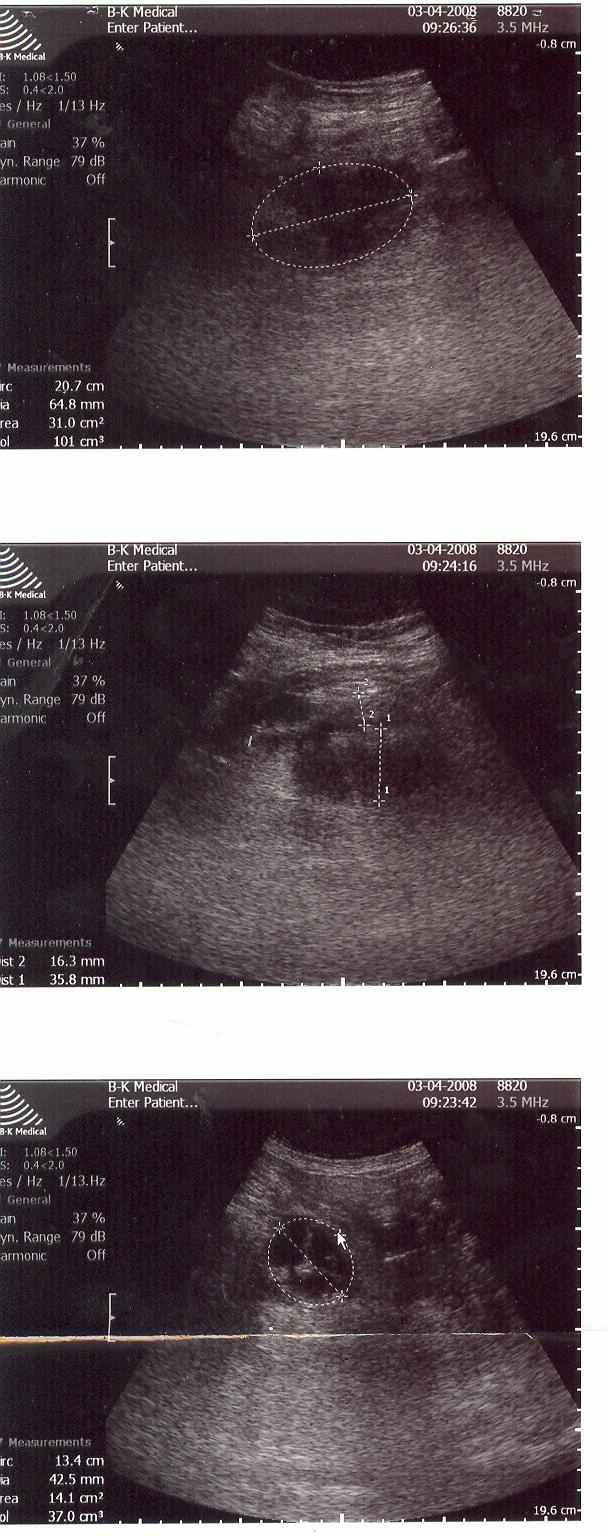
Рис.2 УЗИ картина оментобурсита,
у б-го М. с субтотальным геморрагическим панкреонекрозом.
В процессе лечения больных важное значение мы придавали динамическому УЗИ, которое позволяло оценить течение заболевания, эффективность проводимой терапии, а также проводить, что крайне важно, раннюю диагностику осложнений панкреонекроза. При анализе информативности динамического УЗИ в диагностике ОП чувствительность метода составила 91,7%, специфичность – 97,2%, точность – 93,2%.
Таким образом, полученные результаты свидетельствуют о том, что метод УЗИ является высоко информативным, доступным и безопасным методом диагностики острого панкреатита.
Однако УЗИ обладает меньшей разрешающей способностью в плане топической диагностики при инфицированных формах панкреонекроза, что обусловливает необходимость проведения КТ у данной категории пациентов.
При анализе КТ-семиотики ОДП у 98 больных (в т. ч. среди 50 пациентов основной и у 48-контрольной группы) у всех пациентов были обнаружены прямые признаки панкреонекроза – диффузное увеличение ПЖ, нечеткость контуров и негомогенность паренхимы железы, наличие очагов некроза и снижение денситометрической плотности. Расширение Вирсунгова протока имело место лишь у 21 (21,4%) пациента (табл.8).
Таблица 8
КТ - семиотика острого деструктивного панкреатита (n=98)
| КТ – признаки | Кол-во наблюдений | |
| Абс. | % | |
| 1 Прямые признаки: | | |
| диффузное увеличение ПЖ | 98 | 100 |
| нечеткость контуров ПЖ | 98 | 100 |
| негомогенность паренхимы ПЖ | 98 | 100 |
| очаги некроза ПЖ | 98 | 100 |
| снижение денситометрической плотности ПЖ | 98 | 100 |
| расширение Вирунгова протока | 21 | 21,4 |
| 2. Косвенные признаки: выпот в брюшной полости | 91 | 92,8 |
| нечеткая визуализация и деформация крупных близлежащих сосудов | 59 | 60,2 |
| ЖКБ, холедохолитиаз Реактивный плеврит | 9 25 | 9,2 25,5 |
Из косвенных признаков панкреонекроза наличие свободной жидкости в брюшной полости мы наблюдали у 91 (92,8%), нечеткость визуализации и деформацию крупных близлежащих сосудов - у 59 (60,2%), появление свободной жидкости в плевральной полости - у 25 (25,5%) больных. ЖКБ и холедохолитиаз были обнаружены у 9 (9,2%) пациентов. Внутривенное контрастное усиление позволяло четко верифицировать объем некроза поджелудочной железы.
Среди обследованных 98 больных, объем некроза более 50% (субтотально-тотальный панкреонекроз) был обнаружен у 34 (34,7%), в т.ч. в основной группе у 16 (32,0%), а контрольной группе у 18 (37,5%) пациентов (рис.3).
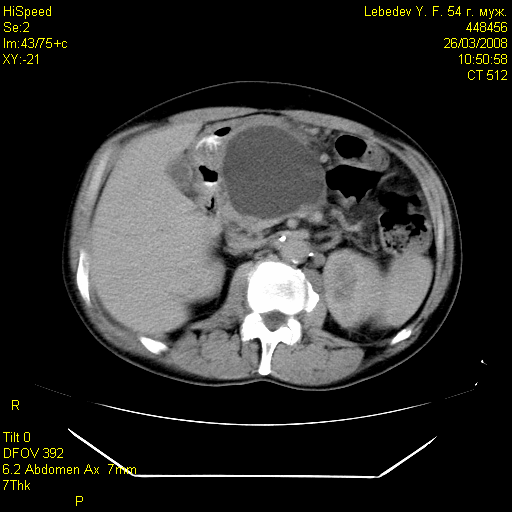
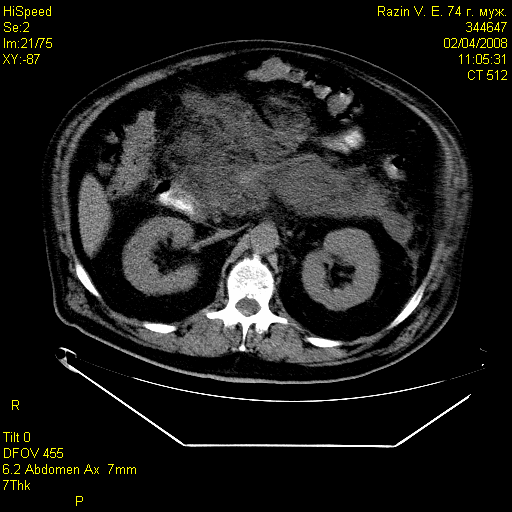
Рис. 3 Рис. 4.
Больной Р. Больной Л.
КТ картина тотального геморрагического КТ картина постнекротической кисты
панкреонекроза, парапанкреатита, параколита. головки поджелудочной железы.
Объем некроза в пределах 30-50% выявлен у 42 (42,9%), а объем некроза менее 30% был отмечен у 22 (22,4%) пациентов. С помощью КТ нам удавалось установить локализацию, размеры и толщину стенок постнекротических кист поджелудочной железы (рис.4)
Среди 98 обследованных, легкая степень тяжести (индекс CTSI-0-3) была определена у 10 (10,2%), средняя степень (индекс CTSI-4-6) у 16 (16,3%), тяжелая степень тяжести (индекс CTSI -7-10) у 72 (73,5%) пациентов, при этом у больных панкреонекрозом при значении индекса 0-3 и 4-6 случаев летального исхода не было. А в группе больных (72), имевших индекс CTSI 7-10, умерло 11 больных (15,3%). Следует отметить, что скончались пациенты, имевшие объем зоны некроза поджелудочной железы более 50%.
Таким образом, КТ с внутривенным контрастным усилением является наиболее чувствительным методом топической диагностики панкреонекроза и его осложнений. КТ позволяет не только достоверно определить размеры деструкции ПЖ и окружающей клетчатки, но и прогнозировать летальность в зависимости от объёма зоны некроза.
Среди 173 больных панкреонекрозом у 105 (60,7%) мы провели лечебно-диагностическую лапароскопию по стандартной методике. Показаниями к этой процедуре служили доказанное УЗИ наличие свободной жидкости в брюшной полости и симптомов разлитого перитонита. При обнаружении панкреатогенного ферментативного перитонита проводили ургентную видеолапароскопию, эвакуацию выпота электроотсосом, ревизию органов брюшной полости и малого таза с обязательным посевом выпота на стерильность и определением уровня амилазы. В большинстве случаев уровень амилазы в перитонеальной жидкости колебался в пределах от 785 до 2700 Ед/л, а в посевах на стерильность роста микрофлоры не обнаружено.
В ходе диагностической лапароскопии нами были выявлены следующие прямые признаки панкреонекроза: геморрагический выпот в брюшной полости у 75 (71,4%) больных, при этом у 26 (24,8%) количество жидкости составило более 1 литра. Серозный выпот (до 500 мл) в брюшной полости обнаружен у 30 (28,6%), бляшки стеатонекроза на брюшине, большом и в малом сальнике были выявлены у 25 (23,8%), а геморрагическая имбибиция забрюшинной клетчатки у 22 (20,9%) пациентов (табл.9).
Таблица 9
Лапароскопическая семиотика панкреонекроза (n=105)
| Признаки панкреонекроза | Количество больных | |
| Абс. | % | |
| 1 Прямые симптомы: -бляшки стеатонекроза на брюшине | 25 | 23,8 |
| - геморрагический выпот в объеме - до 500 мл | 75 21 | 71,4 20,0 |
| - 500 мл – 1л | 28 | 26,6 |
| -более 1 л | 26 | 24,8 |
| -серозный выпот (до 500 мл) | 30 | 28,6 |
| -геморрагическая имбибиция забрюшинной клетчатки | 22 | 20,9 |
| -стекловидный отек забрюшинной клетчатки | 33 | 31,4 |
| 2 .Косвенные признаки: -отек и гиперемия малого сальника и брюшины верхнего этажа | 69 | 65,7 |
| - парез желудка и поперечной ободочной кишки | 86 | 81,9 |
| -увеличенный (застойный) желчный пузырь | 14 | 13,3 |
Косвенные признаки панкреонекроза: отек и гиперемия малого сальника и брюшины верхнего этажа имели место у 69 (65,7%) больных, парез желудка и поперечной ободочной кишки у 86 (81,9%), увеличенный и застойный желчный пузырь у 14 (13,3%) пациентов. Процедуру завершали дренированием брюшной полости с установлением силиконовых трубок в малый таз, в подпеченочное пространство к Винслову отверстию и по ходу латеральных каналов. При благоприятном течении заболевания дренажи из брюшной полости удаляли в среднем на 3-5 сутки.
ФГДС была проведена 54 больным с отечным панкреатитом и 137 больным с ОДП в качестве дополнительного метода исследования, для визуальной оценки состояния слизистой пищевода, желудка, ДПК и БДС. Важное значение при ОП ФГДС приобретает как метод точной диагностики сопутствующей патологии БДС. Так, среди 191 обследованного больного, папилит был обнаружен у 21 (10,9%), ущемленный камень в БДС у 4 (2,1%). В последних 4 случаях исследование было завершено ЭПСТ с экстракцией ущемленного камня.
После выполнения ФГДС, пациентам с выявленной сопутствующей язвенной болезнью ДПК (n=2) и острыми эрозивно-язвенными поражениями желудка и ДПК (n=46), на фоне противоязвенной терапии применяли меры профилактики желудочно-кишечного кровотечения.
Глубинная радиоволновая радиотермометрия была проведена 30 пациентам с панкреонекрозом на 3-5 сутки после видеолапароскопического дренирования брюшной полости. К сожалению, из-за различий в выраженности подкожно-жировой клетчатки передней брюшной стенки и поясничных областей у пациентов, термограммы часто имели расхождение с данными УЗИ и КТ. Информативность данного исследования была низкой. Лишь у 6 (20%) из 30 обследованных больных с крупноочаговым панкреонекрозом и парапанкреатическим инфильтратом была установлена термоассиметрия и очаг низкой температуры (рис.5)
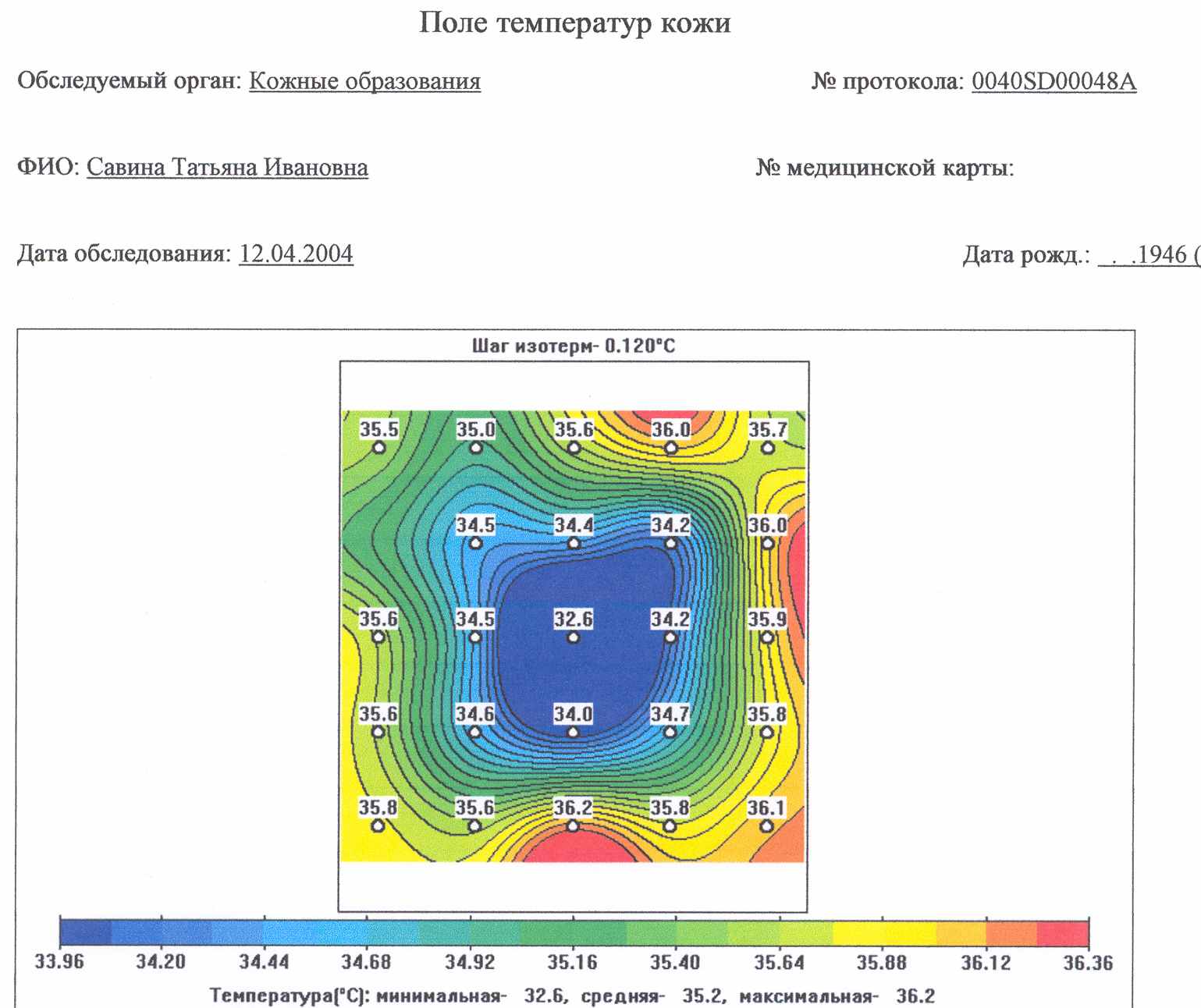
Рис. 5. Глубинная термограмма проекции головки поджелудочной железы больного с субтотальным геморрагическим панкреонекрозом, оментобурситом, 5 сутки после видеолапароскопического дренирования брюшной полости. Средняя температура в проекции поджелудочной железы составила – 35,2°С, минимальная -32.6°С, максимальная – 36.2°С
