Исследование регуляции экспрессии генов цитохрома Р450 подсемейства 1А в печени инбредных линий мышей
| Вид материала | Исследование |
| CYP1A2 (от -4675 до -4204), содержащая энхансерные модули, необходимые для конститутивной экспрессии гена Cyp Список работ, опубликованных по теме диссертации |
- Синтез пуриновых нуклеотидов, 49.64kb.
- Пахарукова Мария Юрьевна Изучение роли транскрипционных факторов hnf3 и рецепторов, 208.86kb.
- Влияние экспрессии гетерологичных генов хитинсвязывающих белков и гевеин-подобных антимикробных, 1284.68kb.
- Автореферат диссертации на соискание ученой степени, 365kb.
- На прошлой лекции было дано краткое введения в биоинформатику днк-биочип-экспериментов, 172.51kb.
- Вопросы к экзамену по курсу «Молекулярная биология» (вечернее отделение), 36.64kb.
- Рабочая программа дисциплины «биология клетки» (молекулярная биология) Код дисциплины, 225.32kb.
- «Генетика» Общая трудоемкость изучения дисциплины составляет, 13.01kb.
- Рак печени и органов билиопанкреатодуоденальной зоны: современная диагностика и лечение, 411.75kb.
- Изменение уровней экспрессии генов из критичных районов хромосомы 3 человека в эпителиальных, 390.19kb.
Рисунок 8. Электрофореграмма разделения продуктов мультиплексной ОТ-ПЦР в 2%-агарозном геле.
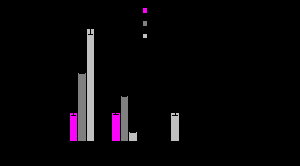
Рисунок 9. Относительное количество мРНК в печени мышей. Данные представлены как среднее ± стандартное отклонение для группы из семи животных. ***P<0,001 в сравнении с молодыми контрольными животными; ###P<0,001, #P<0,05 в сравнении со старыми контрольными животными.
В печени интактных взрослых мышей мРНК Cyp1A1 практически не регистрировалась, в то время как содержание мРНК Cyp1A2 было достаточно высоким, что подтверждает результаты наших исследований и вполне согласуется с полученными ранее данными (Kimura et al., 1986; Tukey, Nebert, 1984). По нашим оценкам содержание мРНК CYP1A1 у интактных животных было приблизительно на два порядка ниже содержания мРНК CYP1A2 (данные не представлены). Не обнаружено влияния стресса и старения на содержание мРНК CYP1A1. Напротив, содержание мРНК CYP1A2 было выше у старых интактных животных по сравнению с молодыми и увеличивалось под воздействием стресса у молодых особей. У старых животных содержание мРНК Cyp1A2 было почти в 4 раза выше по сравнению с молодыми и практически не изменялось при стрессе.
Ранее было показано, что ЭРОД и ацетанилид-4-гидроксилазная активности, отражающие ферментативную активность CYP1A1 и CYP1A2 соответственно, были одинаковы как у молодых (10-недельного возраста), так и у старых (28-месячного возраста) мышей линии C57BL/6N (Pegram et al., 1995). У мышей линии B10.RIII (H-2r) 28-месячного возраста содержание мРНК CYP1A1 и CYP1A2 существенно уменьшалось на 65 и 95% соответственно, по сравнению с мышами 4-месячного возраста. Однако у мышей линии C57BL/10 (H-2b) не было обнаружено существенных изменений в конститутивном содержании мРНК CYP1A1 и CYP1A2 (Mote et al., 1990). У женских особей мышиной линии C3B10RF1 было показано уменьшение экспрессии генов N-сульфотрансферазы и трех генов цитохрома P450, включая CYP1A2, а также гена S-трансферазы omega 1 (фермента II фазы) при старении (Cao et al., 2001). Эти данные противоречат результатам нашего исследования, где у старых интактных мышей-самцов линии C3H/a содержание мРНК Cyp1A2 было почти в 4 раза выше по сравнению с молодыми. Повышенное содержание мРНК CYP1A2 у старых животных могло бы быть объяснен гипотезой, что хронические индукции этого фермента ПАУ и многими другими ксенобиотиками на протяжении всей жизни приводят к высокому уровню конститутивной экспрессии гена CYP1A2. Однако это может зависеть и от используемой линии мышей или, что наиболее вероятно, являться сложной функцией от изменений в генной экспрессии, включая несколько ядерных факторов, и гормонального статуса.
В большинстве известных случаев, индукция CYP1A1 и CYP1A2 осуществляется через так называемый Ah-зависимый рецепторный механизм, в котором непосредственное участие принимают транскрипционные факторы Ah рецептор и ARNT. В связи с этим, возникает определенный интерес изучить особенности экспрессии AhR и ARNT при стрессе и старении.
В настоящей работе показано, что содержание мРНК AhR у старых интактных животных почти в три раза ниже по сравнению с молодыми. Эти результаты согласуются с данными по онтогенезу AhR у крыс Sprague-Dawley: концентрация печеночного и легочного Ah рецепторов быстро увеличивалась после рождения и оставалась на максимальном уровне со 2-ого по 21-ый день. После этого концентрация AhR в этих тканях медленно снижалась с возрастом (Gasiewicz et al., 1984). Интересно, что мы не смогли оценить уровень экспрессии ARNT у молодых животных вследствие весьма низкого содержания его мРНК, хотя линия C3H/a традиционно считается ПАУ-индуцибельной. Кроме того, в других экспериментах мы обнаружили достаточно высокую экспрессию ARNT у молодых мышей других линий, как ПАУ-индуцибельных, так и ПАУ-неиндуцибельных.
У старых животных, однако, содержание мРНК ARNT было достаточно высоким. Можно предположить, что подобное увеличение экспрессии ARNT при старении могло бы способствовать транслокации Ah рецептора и его аккумуляции в ядре, приводя к транскрипционно активному комплексу AhR-ARNT, способному индуцировать экспрессию генов-мишеней, включая CYP1A2, содержание мРНК которого было значительно увеличенным у старых мышей по сравнению с молодыми.
В некоторых исследований было показано, что как психологический, так и физиологический стресс могут модулировать экспрессию генов ферментов ММС (Konstandi et al., 1998; Konstandi et al., 2004). У грызунов под воздействием различных стрессов было показано уменьшение скорости оксидативного метаболизма ксенобиотиков (Pollack et al., 1991), что могло модифицировать токсичность этих соединений. Различные модели стресса, как было установлено, различаются по своим эффектам на ферменты биотрансформации. Например, при стрессе ограничения пространства (restraint stress) увеличиваются некоторые ферментативные активности в печени мышей и уменьшаются другие, в то время как умеренный непредсказуемый стресс (unpredictable mild stress) действует по другому, иногда даже противоположному пути (Konstandi et al., 1998; Konstandi et al., 2004; Matamoros, Levine, 1996).
До сих пор при изучении животных используются многие стрессовые воздействия, такие как касание или ношение в руках, иммобилизационный стресс, ожидание болевых стимулов и гипотензивное кровотечение. Ханс Селье был первым исследователем, применившим иммобилизационный стресс в экспериментах на крысах (Selye, 1936). Впоследствии данный тип стресса был хорошо изучен в отношении различных аспектов эндокринной и нервной системы. В нашем эксперименте мы использовали в качестве модели модель иммобилизационного стресса, описанную ранее (Kvetnansky, Mikulaj, 1970). Было показано, что воздействие иммобилизационного стресса в течение 30-180 мин приводит к изменениям мРНК уровня ряда генов в тканях различных органов (Pacak, Palkovits, 2001; Kvetnansky et al., 1995). Однако до сих пор немного известно о системе ферментов метаболизма в период поздних стадий развития организма и в условиях стресса.
Можно предположить, что благодаря индукции Cyp1A2 у мышей, подвергнутых иммобилизационному стрессу, и повышенному уровню экспрессии гена Cyp1A2 у старых животных, в печени может происходить ускоренное разложение какого-либо эндогенного субстрата, и, соответственно, падение его уровня в крови. В этом случае нарушается сигнальная система, функционирующая по принципу обратной связи, что может способствовать усиленной гормональной секреции, и, как следствие, развитию опухолей. Так, например, гипофиз, в который не поступает тироксин, постоянно выделяет ТТГ (тиреотропный гормон), что вызывает пролиферацию клеток щитовидной железы с последующим развитием опухоли (Fagin, 1994).
Полученные нами результаты определенным образом согласуются с данными по исследованию активности НАДН: и НАД(Ф)Н: 2,6-дихлорфенолиндофенол редуктаз в микросомах печени взрослых и старых крыс, подвергнутых иммобилизационному стрессу. Было показано, что активность обеих редуктаз резко снижена у старых животных по сравнению со взрослыми. При стрессе у взрослых крыс происходило выраженное уменьшение активности НАДН-редуктазы (Рудько, Давыдов, 2001).
Таким образом, нами показано, что содержание мРНК исследуемых генов, за исключением Cyp1A1, различается между контрольными группами взрослых и старых животных. Содержание мРНК CYP1A2 и ARNT в печени старых мышей заметно выше, чем в печени взрослых особей, в то время как содержание мРНК AhR у старых животных понижено по сравнению со взрослыми.
Кроме того, под влиянием стресса увеличивается экспрессия генов CYP1А2, AhR и ARNT, что в большей мере проявляется у взрослых особей. Полученные результаты указывают на существенное ослабление реакции адаптации на стресс у старых животных. Дальнейшее изучение данного вопроса помогло бы объяснить причины изменений функции печени при старении и установить роль стресса в формировании возрастной патологии этого органа.
Заключение
Инбредные линии мышей, различающиеся по чувствительности к индуцирующему действию ПАУ, являются общепризнанной удобной моделью не только для изучения индуцирующего действия многих химических соединений на живые организмы, но и для изучения механизмов химически индуцированного канцерогенеза. Поэтому исследование различных этапов индукции, начиная от активации генов и заканчивая «созреванием» ферментативной активности, является актуальной проблемой современной биохимии и токсикологии. В настоящей работе было проведено исследование индукции цитохромов Р450 1А1 и 1А2 в печени инбредных линий мышей с различным генотипом Ah рецептора с одновременным измерением таких параметров, как активность ферментов и экспрессия соответствующих генов, а также уровень экспрессии транскрипционных факторов, вовлеченных в индукцию.
В ходе выполнения работы было показано, что индукция цитохромов Р450 подсемейства 1А зависит не только от генотипа Ah-рецептора, но и от таких физиологических факторов, как возраст и стресс. Количество мРНК генов CYP1А1, CYP1А2, AhR и ARNT различается у молодых и старых мышей в норме и под воздействием стресса. Влияние стресса в большей мере проявляется у молодых особей, что, по-видимому, демонстрирует отсутствие или существенное ослабление у старых животных реакции адаптации на стресс.
В печени взрослых мышей, как чувствительных к индуцирующему действию ПАУ (Ah+ генотип), так и нечувствительных линиях (Ah- генотип), регистрировалась существенная конститутивная экспрессии генов СYP1A2, AhR, ARNT при отсутствии экспрессии гена СYP1A1. Последний, будучи конститутивно неактивным, высоко чувствителен к индукции многими планарными ПАУ, как это показано и в нашем случае, когда в эксперимент были взяты линии C57BL, A/Sn и CBA (Ah+ генотипом). Для этих мышей увеличение содержания мРНК СYP1A1 сопровождалось многократным усилением ферментативной активности, специфичной для этой формы цитохрома Р450. Этот факт свидетельствует о классическом варианте индукции, когда увеличению ферментативной активности предшествует усиление транскрипции гена.
Однако для мышей линий SWR, AKR и DBA (Ah- генотип), являющихся нечувствительными к ПАУ-индукции, характерен другой механизм, когда при наличии транскрипта гена CYP1А1 не регистрируется увеличение активности фермента. Этот факт свидетельствует о посттранскрипционной супрессии синтеза белка, о чем также говорят и результаты Вестерн-блот анализа. И если до сих пор отсутствие индуцирующего эффекта ПАУ на монооксигеназы данных линий мышей объясняли дефектом Ah-рецептора, то полученные результаты опровергают это предположение. В таком случае целесообразно говорить о дефекте белкового синтеза у мышей линий SWR, AKR и DBA. Чтобы окончательно выяснить механизм этого явления, необходимо провести детальное исследование синтеза белковой молекулы CYP1A, начиная от полисом и заканчивая фолдингом белка в микросомах.
Проведенные эксперименты показали, что уровень экспрессии генов транскрипционных факторов AhR и ARNT существенно не зависит от генотипа Ah рецептора и индукции ПАУ. Таким образом, полученные результаты свидетельствуют о различных механизмах индукции CYP1A у мышей, генетически различающихся по чувствительности к ПАУ, причем эти различия выявляются для каждой индивидуальной линии. Тогда при исследовании механизмов канцерогенного действия химических соединений, в том числе и ПАУ, целесообразно применять индивидуальный подход для каждой исследуемой линии инбредных мышей.
Выводы
1. Уровень ферментативной активности Cyp1A1 и Cyp1A2 в печени не различается в норме между мышами всех исследуемых линий. При введении как МХ, так и ОАТ, активность Cyp1A1 и Cyp1A2 в 8-27 раз увеличивается у мышей C57BL, CBA и A/Sn, обладающих Ah+ генотипом, и не изменяется у мышей SWR, AKR, DBA, обладающих генотипом Ah-, что подтверждает наличие генетических различий в индуцибельности цитохрома Р450 1А у мышей.
2. В печени мышей всех исследуемых линий (с Ah+ или Ah- генотипом) в норме определяется мРНК СYP1А2, но не СYP1А1. Под действием МХ и ОАТ содержание мРНК СYP1А2 увеличивается в 2-4 раза у мышей всех линий, за исключением мышей SWR. Содержание мРНК CYP1А1 также увеличивается в 10-200 раз у всех линий мышей, независимо от генотипа Ah рецептора, в том числе у мышей SWR, AKR и DBA, традиционно считающихся нечувствительными к индукции ПАУ.
3. В печени мышей всех исследуемых линий, различающихся по чувствительности к индукции ПАУ, определяется мРНК транскрипционных факторов AhR и ARNT, причем введение МХ существенно не влияет на уровень их экспрессии. Вместе с результатами по экспрессии генов СYP1А1 и СYP1А2 это свидетельствует о том, что межлинейные различия у мышей в чувствительности к индукции ПАУ обусловлены не только дефектом Ah-рецептора.
4. Последовательность регуляторной области гена CYP1A2 (от -4675 до -4204), содержащая энхансерные модули, необходимые для конститутивной экспрессии гена Cyp1A2, у различных инбредных линий мышей является консервативной и не связана с межлинейными различиями в экспрессии CYP1A2 и чувствительностью к гепатоканцерогенному действию ОАТ.
5. Уровень экспрессии исследуемых генов, за исключением CYP1А1, различается у молодых и старых мышей в норме и под воздействием стресса. Содержание мРНК CYP1A2 и ARNT в печени старых мышей заметно выше, чем в печени молодых особей, в то время как содержание мРНК AhR у старых животных понижено по сравнению с молодыми. Под влиянием стресса увеличивается экспрессия генов CYP1А2, AhR и ARNT, что в большей мере проявляется у молодых особей и может свидетельствовать об отсутствии или существенном ослаблении у старых животных реакции адаптации на стресс.
Список работ, опубликованных по теме диссертации:
- Mikhailova O.N., Filipenko M.L., Timofeeva O.A., Kaledin V.I., Gulyaeva L.F., Lyakhovich V.V. Induction of CYP1A1 and CYP1A2 gene expression by different xenobiotics in liver of C57BL mice. // 13th International Symposium on Microsomes and Drug Oxidations “MDO2000”. – 2000. – Stresa, Italy. – P. 140.
- Mikhailova O.N., Filipenko M.L., Timofeeva O.A., Kaledin V.I., Gulyaeva L.F., Lyakhovich V.V. CYP1A1 and CYP1A2 gene expression during induction with different xenobiotics in liver of C57BL mice. // Analytical Cellular Pathology. – 2001. – V. 22. – P. 24-25.
- Mikhailova O.N., Gulyaeva L.F., Filipenko M.L. Differences in gene expression and regulation of biotransformation enzymes in liver of adult and aged mice during stress. // 18th European Workshop on Drug Metabolism “DMW2002”. – 2002. – Valencia, Spain. – P.46.
- Михайлова О.Н., Гуляева Л.Ф., Филипенко М.Л. Возрастные изменения экспрессии ферментов метаболизма гормонов и других эндогенных субстратов в печени и влияние стресса. // "Эндокринная регуляция физиологических функций в норме и патологии". – Сб. докладов. – 2002. – Новосибирск, Россия. – С. 93.
- Mikhailova O.N., Gulyaeva L.F., Filipenko M.L. Effect of immobilization stress on drug metabolizing enzymes in liver of adult and aged mice. // Drug Metabolism Reviews. – V. 34 – 2002. – P. 114.
- Mikhailova O.N., Gulyaeva L.F., Filipenko M.L. Age-dependent alterations in expression of metabolizing enzymes in mouse liver during stress. // 3rd European Congress of Biogerontology. – 2002. – Florence, Italy. – P. 119
- Zacharova L.Yu., Gulyaeva L.F., Lyakhovich V.V., Mikhailova O.N., Timofeeva O.A., Filipenko M.L., Kaledin V.I. Comparison of cytochrome P450 1a gene expression in the liver of aromatic hydrocarbon - responsive and – nonresponsive mice treated with 3-methylcholanthrene or o-aminoazotoluene. // Drug Metabolism Reviews. – 2003. – V. 35. – P. 81.
- Mikhailova O.N., Gulyaeva L.F., Filipenko M.L. Age-dependent alterations in expression of metabolizing enzymes in the mouse liver during stress. // Endocrine Reguluation. – 2003. – V. 37. – P. 98
- Zacharova L.Yu., Gulyaeva L.F., Lyakhovich V.V., Mikhailova O.N., Timofeeva O.A., Filipenko M.L., Kaledin V.I. Cytochrome P4501A1 and 1A2 gene expression in the liver of 3-methylcholanthrene- and o-aminoazotoluene treated mice: A comparison between PAH-responsive and PAH-nonresponsive strains. // Toxicological Sciences. – 2003. – V. 73. – P. 108-113.
- Михайлова О.Н., Филипенко М.Л., Тимофеева О.А., Каледин В.И.,. Гуляева Л.Ф, Ляхович В.В. Уровень мРНК и активность цитохромов Р450 1А в печени мышей линии C57BL при индукции различными ксенобиотиками. // Биомедицинская химия. – 2003. – Т. 49. – С. 388-393.
- Mikhailova O.N., Gulyaeva L.F., Filipenko M.L., Kaledin V.I. A comparative sequencing of enhancer elements in the mouse CYP1A2 gene among mouse strains. // Drug Metabolism Reviews. – 2004. – V. 36. - P. 72.
- Mikhailova O.N., Gulyaeva L.F., Filipenko M.L. Gene expression of drug metabolizing enzymes in adult and aged mouse liver: a modulation by immobilization stress. // Toxicology. – 2005. – V. 210. – P. 189-196.
- Mikhailova O.N., Vasyunina E.A., Ovchinnikova L.P., Gulyaeva L.F., Timofeeva O.A., Filipenko M.L., Kaledin V.I.. O-Aminoazotoluene does induce the enzymes of its own mutagenic activation in mouse liver. // Toxicology. – 2005. – V. 211. – P. 132-138.
Список используемых сокращений:
AhR арилгидрокарбоновый рецептор
АRNT переносчик AhR в ядро
CYP цитохром Р450
CYP1A1, CYP1A2 цитохром Р450 1А1, цитохром Р450 1А2
GAPDH глицеральдегид-3-фосфат дегидрогеназа
МХ 3-метилхолантрен
МРОД метоксирезоруфин-О-деметилаза
ОАТ о-аминоазотолуол
ПАУ полициклические ароматические углеводороды
RPL30 рибосомный белок L30
ЭРОД этоксирезоруфин-О-деэтилаза
XRE ксенобиотик-чувствительный элемент
Соискатель О.Н. Михайлова
