Исследование регуляции экспрессии генов цитохрома Р450 подсемейства 1А в печени инбредных линий мышей
| Вид материала | Исследование |
- Синтез пуриновых нуклеотидов, 49.64kb.
- Пахарукова Мария Юрьевна Изучение роли транскрипционных факторов hnf3 и рецепторов, 208.86kb.
- Влияние экспрессии гетерологичных генов хитинсвязывающих белков и гевеин-подобных антимикробных, 1284.68kb.
- Автореферат диссертации на соискание ученой степени, 365kb.
- На прошлой лекции было дано краткое введения в биоинформатику днк-биочип-экспериментов, 172.51kb.
- Вопросы к экзамену по курсу «Молекулярная биология» (вечернее отделение), 36.64kb.
- Рабочая программа дисциплины «биология клетки» (молекулярная биология) Код дисциплины, 225.32kb.
- «Генетика» Общая трудоемкость изучения дисциплины составляет, 13.01kb.
- Рак печени и органов билиопанкреатодуоденальной зоны: современная диагностика и лечение, 411.75kb.
- Изменение уровней экспрессии генов из критичных районов хромосомы 3 человека в эпителиальных, 390.19kb.
Исследование экспрессии генов CYP1A1, CYP1A2, AhR и ARNT в зависимости от времени после введения МХ в качестве индуктора
Общепринятым на сегодняшний день, является представление о дефекте Ah рецептора, как о причине различий в индуцибельности цитохрома 1А у мышей. Однако до сих пор не исследовали, существует ли корреляция между увеличением ферментативной активности и транскрипцией соответствующего гена, а также существует ли прямая взаимосвязь с изменением экспрессии соответствующих транскрипционных факторов. Поэтому следующим шагом в нашей работе было определение методом мультиплексной ОТ-ПЦР уровня мРНК CYP1A1 и CYP1A2, а также AhR и ARNT в норме и при индукции МХ и ОАТ.
На первом этапе необходимо было определить максимум накопления мРНК в зависимости от времени после введения индуктора. Для ответа на вопрос, существует ли корреляция между увеличением ферментативной активности и транскрипцией соответствующего гена были проведены эксперименты по определению уровня мРНК CYP1A1 и CYP1A2, а также транскрипционных факторов AhR и ARNT в норме и при индукции МХ и ОАТ.

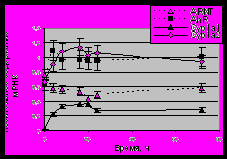
Рисунок 2. Изменение экспрессии исследуемых генов в зависимости от времени после введения МХ в качестве индуктора у мышей линии DBA (Ah-нечувствительная). А). Электрофореграмма разделения продуктов мультиплексной ОТ-ПЦР в 2%-агарозном геле. К – контрольная группа животных. Б). Данные представлены как средние значения для групп животных из шести особей стандартное отклонение.


А)
Б)
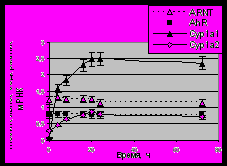
Рисунок 3. Изменение экспрессии исследуемых генов в зависимости от времени после введения МХ в качестве индуктора у мышей линии CBA (Ah-чувствительная). А). Электрофореграмма разделения продуктов мультиплексной ОТ-ПЦР в 2%-агарозном геле. К – контрольная группа животных. Б). Данные представлены как средние значения для групп животных из шести особей стандартное отклонение.
Для определения экспрессии генов транскрипционных факторов AhR, ARNT и цитохромов Р4501А в печени мышей был использован метод мультиплексной ОТ-ПЦР, ранее используемый в нашей лаборатории и адаптированный для наших условий. Для определения максимального уровня экспрессии исследуемых генов после введения мышам индуктора 3-метилхолантрена (МХ), было взято несколько временных точек: 4, 8, 16, 20, 24 и 72 часа после действия индуктора. В эксперимент были взяты две линии мышей – DBA (Ah-нечувствительная) и CBA (Ah-чувствительная) (Nebert, 1989; Nebert et al., 2004). Результаты этого эксперимента приведены на рисунках 2 и 3.
Как видно, максимальный уровень экспрессии исследуемых генов приходится на 16 – 20-ти часовой интервал после введения индуктора. В дальнейших экспериментах содержание мРНК определяли через 20 часов после введения мышам индуктора.
Содержание мРНК цитохромов Р450 1А1 и 1А2 в печени мышей в норме и при индукции МХ и ОАТ
Методом мультиплексной ОТ-ПЦР были определены уровни мРНК цитохромов Р450 1А1 и 1А2 в печени 6-ти инбредных линий мышей, различающихся по генотипу Ah-рецептора, т.е. по чувствительности к индуцирующему действию полициклических ароматических углеводородов (ПАУ), в норме и при индукции МХ.

Рисунок 4. Уровень экспрессии генов CYP1A1 и CYP1A2 в печени мышей инбредных линий в норме и при индукции МХ и ОАТ. А) Электрофореграмма разделения продуктов мультиплексной ОТ-ПЦР в 2%-агарозном геле: к, группа контрольных мышей; м, при индукции МХ; o, при индукции ОАТ (у мышей линии CBA индукцию ОАТ не исследовали). Б) Данные представлены как средние значения для групп животных из восьми особей, стандартное отклонение. *P<0.05; **P<0.01; ***P<0.001. (Статистически значимые различия между индуцированными и интактными животными по критерию Стьюдента).
Среди выбранных мышей три линии обладали AhR+ генотипом (CBA, C57BL, A/Sn) и три линии были нечувствительны к индукции ПАУ (DBA, AKR и SWR – AhR—генотип) (Nebert, 1989; Nebert et al., 2004). Полученные данные представлены на рисунке 4.
В печени интактных мышей исследуемых линий мРНК СYр1а1 практически не регистрировался, в то время как конститутивный уровень экспрессии гена СYр1а2 был достаточно высок, что вполне согласуется с результатами Вестерн-иммуноблота, а также с ранее полученными результатами (Kimura et al., 1986).
Обнаружено, что в печени всех исследуемых линий мышей регистрируется значительное увеличение количества мРНК цитохрома Р450 1А1 (рис. 4) при индукции 3-метилхолантреном. Этот факт оказался неожиданным, поскольку мыши линий SWR, AKR и DBA традиционно считаются ПАУ-неиндуцибельными (Nebert, 1989), т.е. обладают генотипом Ahd Ahd. Увеличение содержания уровня мРНК CYP1A1 достаточно трудно оценить вследствие её низкого содержания в контроле. Тем не менее, видна разница в уровне мРНК CYP1A1 среди исследуемых линий. Особенно это заметно для линий Ah+ генотипа. У линий, дефектных по Ah-рецептору, также наблюдалось увеличение содержания мРНК CYP1А1, хотя оно было не столь ярко выраженным: в 2 - 3 раза ниже по сравнению с Ah+ линиями.
При исследовании экспрессии гена CYP1А2 обнаружено, что, в отличие от CYP1А1, в печени необработанных индуктором мышей регистрируется заметное количество мРНК (рис. 4). Количество мРНК CYP1А2 различается среди исследуемых линий не значительно. Исключение составляют мыши линии SWR, у которых количество мРНК CYP1А2 в контроле в 3-4 раза выше, по сравнению с мышами линий C57BL, A/Sn, CBA, AKR и DBA и сравним с индуцированным МХ.
Введение животным 3-метилхолантрена сопровождалось усилением экспрессии CYP1А2 в печени мышей A/Sn, C57BL, CBA и AKR в 3-4 раза. Содержание мРНК CYP1A2 не изменялось у SWR мышей, но статистически значимо (p < 0.05), увеличивалось у DBA мышей при индукции МХ.
Аналогичные эксперименты были проведены с использованием ОАТ в качестве индуктора. Методом мультиплексной ОТ-ПЦР были определены уровни мРНК цитохромов Р450 1А1 и 1А2 в печени 5-ти инбредных линий мышей, различающихся по генотипу Ah-рецептора. Полученные данные представлены на рисунке 4.
Как видно, индукция ОАТ проходит схожим с МХ образом. Можно лишь отметить, что уровень индукции в случае ОАТ выше, чем в случае с МХ.
Таким образом, вне зависимости от генотипа индуцибельности (генотипа Ah-рецептора) все исследуемые линии мышей реагировали на введение химических канцерогенов (МХ или ОАТ) усилением экспрессии генов Cyp1A1 и Cyp1A2. Этот факт оказался неожиданным, поскольку мыши линий SWR, AKR и DBA традиционно считаются ПАУ-неиндуцибельными. Полученные результаты выявили несоответствие между усилением транскрипции генов CYP1A1 и CYP1A2 и индуцибельностью соответствующих ферментов в печени мышей, что не согласуется с общепринятыми представлениями о механизмах индукции CYP1A1 и CYP1A2. Наличие при индукции МХ и ОАТ увеличения мРНК CYP1A1 у всех линий, независимо от генотипа Ah рецептора указывает на то, что межлинейные различия не связаны с дефектом Ah рецептора, и позволяет предположить существование посттранскрипционных механизмов регуляции CYP1A. Однако невозможно все объяснить с точки зрения только посттранскрипционных механизмов регуляции. Так у Ah+ линий обнаружено увеличение как уровня мРНК для генов CYP1A, так и уровня ферментативных активностей соответствующих ферментов. Также линия SWR ведет себя, как классическая неиндуцибельная линия в отношении CYP1A2. Скорее всего, существует вклад в межлинейные различия индуцибельности CYP1A и на транскрипционном уровне.
Содержание мРНК генов AhR и ARNT в печени мышей в норме и при индукции МХ
До настоящего времени тестируемые линии не были охарактеризованы по уровню экспрессии генов AhR и ARNT. Поэтому следующим шагом в нашей работе было определение уровня мРНК этих транскрипционных факторов в норме и при индукции. Поскольку предварительно не было обнаружено существенных отличий при индукции CYP1A ОАТ и МХ, то дальнейшие эксперименты проводили только с использованием МХ в качестве индуктора.
Методом мультиплексной ОТ-ПЦР были определены уровни мРНК транскрипционных факторов AhR и ARNT в печени 6-ти инбредных линий мышей, различающихся по генотипу Ah-рецептора, т.е. по чувствительности к индуцирующему действию полициклических ароматических углеводородов (ПАУ). Результаты представлены на рисунке 5.
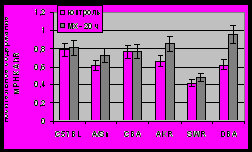
На рисунке 5а приведены значения относительного содержания мРНК Ah-рецептора в печени мышей исследуемых линий. Видно, что вне зависимости от генотипа AhR, его экспрессия практически одинакова у всех мышей. И лишь для линии SWR можно отметить почти двукратное снижение его экспрессии по сравнению с другими линиями. Видно также, что экспрессия этого фактора практически не изменяется при введении мышам индуктора. При индукции МХ содержание мРНК AhR статистически значимо (p < 0.05) увеличивалось только у мышей линий AKR и DBA, тогда как у C57BL, A/Sn, CBA и SWR мышей – не изменялось.
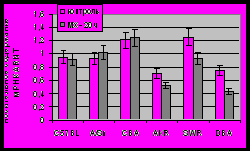
Аналогичные эксперименты были проведены для ARNT (рис. 5б). И в этом случае нами не было выявлено существенных межлинейных различий и зависимости от введения индуктора. Конститутивный уровень мРНК ARNT различался статистически значимо (p < 0.05), но лишь незначительно среди исследуемых линий мышей: немного повышен у мышей линий CBA и SWR и слегка понижен у AKR и DBA по сравнению с C57BL и A/Sn. После индукции МХ содержание мРНК ARNT не изменялось у мышей с Ah+-генотипом и слегка уменьшалось у мышей с Ah--генотипом.
Таким образом, проведенные эксперименты показали, что уровень экспрессии генов AhR и ARNT существенно не зависит от генотипа Ah рецептора и индукции 3-метилхолантреном.

А
Б
Рисунок 5. Эффект МХ на относительное содержание мРНК AhR (А) и ARNT (Б) в печени мышей разных линий. Данные представлены как средние значения для групп животных из шести особей стандартное отклонение. *P<0,05; **P<0,01; ***P<0,001 (Статистически значимые различия между МХ-индуцированными и интактными животными по Критерию Стьюдента).
Анализ полученных данных позволяет сделать ряд важных заключений. Во-первых, стабильная экспрессия AhR и ARNT, регулирующих транскрипцию генов CYP1A, обнаруживается у всех исследуемых линий мышей, различающихся по чувствительности к ПАУ-индукции, причем введение МХ не влияет существенно на их экспрессию. Во-вторых, изменение экспрессии генов CYP1A в ответ на индукцию МХ обнаруживается у всех исследуемых линий мышей независимо от генотипа Ah рецептора. Можно допустить, что у мышей с Ah+ генотипом (C57BL, CBA и A/Sn) индукция CYP1A осуществляется через традиционный транскрипционный механизм, как это было предложено ранее другими исследователями (Nebert, 1989; Gonzalez et al., 1984). В то же время у мышей с Ah- генотипом (SWR, AKR и DBA) включается другой механизм индукции CYP1A, который, возможно, не связан напрямую с AhR-опосредованным механизмом регуляции. Эти результаты свидетельствуют в пользу AhR-независимого механизма индукции CYP1A1 и CYP1A2, что подтверждается случаями, известными для CYP1A2 (Chaloupka et al., 1994; Nerurkar et al., 1993; Adams et al., 1993). Механизм феномена AhR-независимого пути остается неизвестным. Предполагается, что он реализуется благодаря активации посттранскрипционных механизмов стабилизации мРНК и/или посттрансляционной стабилизации комплекса фермент-индуктор. По-видимому, также в отсутствие Ah рецептора, другие транскрипционные факторы способны связываться со специфической последовательностью ДНК (DRE) с последующей инициацией транскрипции гена CYP1A2 (Corcos et al., 1998), хотя для CYP1A1 такой механизм до сих пор не показан. Другая гипотеза может быть связана с существованием у мышей с Ah- генотипом посттранскрипционного механизма регуляции CYP1A, который ингибирует синтез белков CYP1A. Отсутствие накопления белков во время стабильной транскрипции соответствующих генов может указывать на дефекты в трансляции CYP1A1 и CYP1A2. Для определения точного механизма данного явления требуется более глубокое исследование молекулярной генетики Ah рецептора, а также дальнейшее исследование посттранскрипционных механизмов регуляции генов CYP1A1 и CYP1A2 в печени мышей различных инбредных линий.
В результате нашего исследования показаны индивидуальные различия в конститутивном и индуцированном уровне экспрессии генов CYP1A1, CYP1A2, AhR и ARNT для каждой исследуемой линии мышей, даже если некоторая корреляция была обнаружена в отношении генотипа Ah рецептора. Таким образом, инбредные линии мышей представляют уникальную модель для изучения индивидуальных различий в механизме экспрессии генов цитохрома P450 1A, что, возможно, является основной причиной различной индивидуальной чувствительности к канцерогенам.
Сравнительный анализ регуляторной последовательности гена CYP1A2 (от -4675 до -4204) у мышей инбредных линий
В настоящей работе было показано, что в случае мышей линии SWR содержание мРНК в норме существенно повышено по сравнению с мышами других исследуемых линий. К тому же, не было обнаружено увеличения количества мРНК CYP1A2 при индукции МХ и ОАТ, как в случае мышей остальных тестируемых линий мышей (рис. 4). Мы предположили, что такая неодинаковая картина экспрессии гена CYP1A2 под действием индукторов у инбредных линий при стабильной экспрессии транскрипционных факторов может быть связана с мутациями/заменами в ДНК-связывающей области промотора гена CYP1A2. Ранее в промоторе гена Cyp1A2 мыши была идентифицирована область, содержащая два энхансерных элемента, которая, как было показано, необходима для конститутивной экспрессии гена Cyp1A2 (Uchida et al., 2002) (рис. 7). В нашем эксперименте мы проверили гипотезу, что возможные полиморфизмы в этой регуляторной области гена CYP1A2 могут вносить вклад в генетические различия экспресии и/или индукции CYP1A2 среди различных инбредных линий мышей.
Для этого в микросомах печени мышей была определена МРОД активность, которая, как считается, отражает ферментативную активность CYP1A2. Для анализа использовали 11 линий мышей, различающихся по генотипу Ah рецептора и чувствительности к гепатоканцерогенному действию ОАТ (табл. 2).
Таблица 2. Используемые в эксперименте линии мышей
| | Чувствительные к индукции ПАУ** | Нечувствительные к индукции ПАУ** |
| Чувствительные к ОАТ-индуцированному канцерогенезу * | C57BL, A/Sn, A/He, CBA, C3H/а | DBA, SWR, DD |
| Устойчивые к ОАТ-индуцированному канцерогенезу * | BALB/c, CC57BR | AKR |
*Каледин, Захарова, 1984; Каледин и др., 1990; ** Nebert, 1989
Результаты эксперимента представлены на рисунке 6. Можно заметить различия среди исследуемых линий: некоторые из них имеют сравнимый конститутивный уровень ферментативной активности CYP1A2, в то время как у других он повышен (CC57BR) или понижен (C3H/a, A/Sn, AKR, SWR).
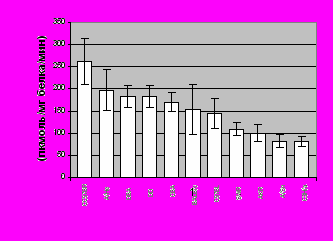
Рисунок 6. Конститутивная активность МРОД в печени мышей различных линий.Статистический анализ проведен с использованием Критерия Стьюдента. Данные представлены как среднее ± стандартное отклонение для группы из восьми животных.
Для проверки, не является ли причиной обнаруженных различий возможный полиморфизм в регуляторном районе гена CYP1A2, была секвенирована последовательность ДНК гена CYP1A2 от -4675 до -4204, содержащая необходимые для конститутивной экспрессии элементы E1 и E2, у всех исследуемых линий мышей (рис. 7).

Рисунок 7. Нуклеотидная последовательность исследуемого района. Энхансерный район и 5- и 3-фланкирующие последовательности представлены заглавными и прописными буквами соответственно. Энхансерные элементы E1 и E2 подчеркнуты.
В результате анализа не было обнаружено полиморфизмов в исследуемом фрагменте ДНК, который, по-видимому, является консервативным и не связан с межлинейными различиями в экспрессии CYP1A2 и чувствительности к гепатоканцерогенному действию ОАТ.
С другой стороны, подобная стабильность в регуляторном районе гена может отражать ключевую роль, которую этот район играет в конститутивной экспрессии гена CYP1A2. В этом случае фенотипические различия могли бы быть связаны с регуляцией экспрессии этого гена или, возможно, с полиморфизмами других районов гена CYP1A2.
Идентификация возможных полиморфных вариантов гена имеет значение для фармакогенетических исследований, включая экспрессию гена CYP1A2, так же как и поиск новых детерминант метаболизма ксенобиотиков в токсикологии. Действительно, недавно несколько полиморфизмов были обнаружены в гене CYP1A2 в экспериментах с APN и C3H/HeJ мышами, различающимися по скорости метаболизма кофеина (Casley et al., 1999; Casley et al., 2000). Таким образом, представляют интерес дальнейшие исследования других районов гена CYP1A2 среди различных линий мышей.
Влияние стресса на индукцию цитохрома Р4501А, AhR и ARNT
В возрастных изменениях особое значение имеют сдвиги на двух уровнях: изменения в регуляции работы генов и изменения в нервной и гормональной регуляции. Известно, что и при стрессе в основе многих изменений клеточного метаболизма лежат гормональные сдвиги (Frolkis, 1993). У человека активность ферментов метаболизма ксенобиотиков в печени существенно снижается при старении (Anantharaju et al., 2002). Данные по экспрессии цитохромов Р450 у экспериментальных животных при старении на сегодняшний день не систематизированы. Из многочисленных исследований следует, что возрастная зависимость экспрессии этих ферментов различается у различных видов и линий животных, у мужских и женских особей (Pegram et al., 1995; Mote et al., 1990; Cao et al., 2001).
Показано, что продолжительность жизни животных, находящихся в обычных условиях, в условиях умеренных стрессов, больше, чем тех, которые жили при резком ограничении стрессовых воздействий или, наоборот, в условиях частых “сильных” стрессов. Многие проявления старения сходны с теми изменениями, которые наступают у взрослых животных, у людей при стрессе. Например, общими для старения и стресса являются повышение концентрации адреналина, вазопрессина, АКТГ и кортизола в крови, снижение концентрации тестостерона, тироксина, трийодглобулина, падение инсулиновой активности крови.
Недавние исследования обнаружили непосредственное влияние как психологического, так и физиологического стресса на экспрессию генов CYP1A1 и CYP1A2 в печени мышей и крыс (Konstandi et al., 2004; Konstandi et al., 1998). Очевидно, реакция системы фементов метаболизма ксенобиотиков на внешние регуляторные факторы может модифицироваться в условиях с измененной физиологической регуляцией. Широко известно, что рак чаще всего развивается при старении, что, в свою очередь, связано с динамикой возрастных генорегуляторных изменений. Таким образом, существует очевидная связь между стрессом, старением и системой ферментов цитохрома Р450.
Поскольку CYP1A участвуют в метаболизме не только экзогенных, но также и эндогенных соединений, то определенный интерес представляют исследования воздействия физиологических и психологических факторов на систему ферментов метаболизма ксенобиотиков. В связи с этим, следующим этапом нашей работы было изучение влияния стресса и старения на регуляцию генов CYP1A1 и CYP1A2.
В работе проведено исследование экспрессии генов Cyp1A1, Cyp1A2, AhR и ARNT в печени взрослых (3-месячных) и старых (26 месячных) мышей-самцов линии C3H/a, подвергнутых иммобилизационному стрессу.
На рисунке 8 показана типичная электрофореграмма разделения продуктов амплификации мультиплексной ПЦР. Результаты эксперимента представлены на рисунке 9. В печени мышей исследуемых линий мРНК CYP1A1 не регистрировался, как у интактных животных, так и у подверженных иммобилизационному стрессу (данные не представлены). Содержание мРНК ARNT было чрезвычайно низким у молодых животных и достаточно высоким у старых.
Статистическая обработка данных с использованием многофакторного анализа вариации (MANOVA) показала эффекты старения (FA) и стресса (FS) на экспрессию гена CYP1A2 (FA(1,22) = 173,02, P<0,00001; FS(1,22) = 11,70, P<0,003) и AhR (FA(1,22) = 721,34, P<0,00001; FS(1,22) = 113,47, P<0,00001), а также взаимодействие двух факторов Старение×Стресс (F(1,22) = 31,50, P<0,00002 для CYP1A2; F(1,22) = 62,90, P<0,00001 для AhR).
Методом Tukey для итогового многофакторного сравнения средних величин были обнаружены различия между экспериментальными группами. В печени старых интактных мышей по сравнению с молодыми интактными значительно увеличивалось содержание мРНК CYP1A2 (в 3,9 раза, P<0,001) и уменьшалось содержание мРНК AhR (в 2,9 раза, P<0,001). В печени молодых животных, подверженных стрессу, по сравнению с молодыми контрольными увеличивалось содержание мРНК CYP1A2 и AhR (в 2,4 раза, P<0,001 и в 1,6 раза, P<0,001 соответственно). В печени старых, подверженных стрессу мышей по сравнению со старыми контрольными животными содержание мРНК статистически значимо увеличивалось в случае AhR (в 1,3 раза, P<0,05) и ARNT (в 1,6 раза, P<0,001) и не изменялось в случае CYP1A2.
Из результатов нашего эксперимента видно, что имеет место ощутимое влияние стресса на экспрессию исследуемых генов, которое в большей мере проявляется у молодых особей (рис. 9). Обнаружены статистически значимые различия между молодыми и старыми животными внутри контрольной группы для всех исследуемых генов, за исключением Cyp1A1. Так содержание мРНК Cyp1A2 и ARNT в печени старых мышей выше, чем в печени молодых особей, в то время как содержание мРНК AhR у старых животных понижено по сравнению с молодыми.

