Новые подходы к фармакокоррекции неспецифических составляющих патогенеза токсических поражений 14. 00. 25 фармакология, клиническая фармакология 14. 00. 16 патологическая физиология
| Вид материала | Автореферат диссертации |
- Клиническая эффективность и фармакоэпидемиология лекарственных средств у детей с аллергическим, 462.25kb.
- «Клиническая фармакология» Специальность: 111201 Ветеринария Пояснительная записка, 94.74kb.
- Календарно-тематический план лекций элективного курса «Клиническая фармакология в акушерстве», 28.46kb.
- «Экспериментальная и клиническая фармакология» журнал к сведению, 84.61kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 10 Фармакология,, 197.39kb.
- Антиметастатическая активность препаратов природного происхождения 14. 00. 25 фармакология,, 1023.15kb.
- Оптимизация фармакотерапии плоского лишая 14. 00. 25. фармакология, клиническая фармакология, 214.56kb.
- Оптимизация противотромботической терапии острого инфаркта миокарда 14. 00. 06 кардиология, 862.58kb.
- Лекарственные растительные средства в профилактике респираторных заболеваний у детей, 439.68kb.
- Типовые учебный план и программа для клинических ординаторов по специальности «клиническая, 656.73kb.
Примечание: kp1 – коэффициент распределения ткань/цельная кровь,
kp2 – коэффициент распределения ткань/плазма.
Анализ экспериментальных данных, полученных в результате изучения распределения бемитила в органах и тканях крыс при однократном и курсовом применении препарата, позволяет сделать вывод об интенсивном переходе препарата в органы и ткани из крови. Исследование распределения бемитила при курсовом введении показало, что кровь обладает способностью кумулировать препарат, преимущественно за счет накопления бемитила в эритроцитах.
Для обеспечения эффективной фармакологической поддержки работоспособности в экстремальных условиях перспективным является создание системы фармакологических комплексов, состоящих из базисного средства, чье позитивное влияние на работоспособность наблюдается при максимально широком спектре неблагоприятных для профессиональной деятельности условий, и дополнительных препаратов, избирательно повышающих работоспособность в конкретной экстремальной ситуации.
Анализ фармакокинетики бромитила позволил выявить модифицирующее влияние интерференции на всех этапах прохождения комплексного препарата в организме: всасывание, распределение, биотрансформация и выведение.
Фаза абсорбции бромантана, в случае применения бромитила, в 3,1 раза продолжительнее (t1/2абс бромитил = 0,286 ч) фазы всасывания бромантана из раствора в ПЭГ-400 (t1/2абс бромантан = 0,091 ч), что обусловлено меньшей скоростью всасывания (табл. 22). Соответственно время достижения максимальной концентрации бромантана из бромитила продолжительнее, чем tmax бромантана, в случае применения раствора препарата в ПЭГ-400.
Максимальная концентрация бромантана в крови, в случае применения бромитила (Сmax бромитил = 0,311 мкг/мл; Д бромантан = 100 мг/кг), сравнима с максимальной концентрацией бромантана в крови при введении раствора бромантана в ПЭГ-400 (Д бромантан = 100 мг/кг).
Скорость всасывания бемитила, в случае применения бромитила, увеличивается по сравнению с kабс водного раствора препарата, время достижения максимальной концентрации не изменяется, однако максимальная концентрация бемитила в крови, в случае перорального введения водного раствора бемитила (100 мг/кг), в 2,4 раза выше максимальной концентрации бемитила, достигаемой при введении бромитила.
Модифицирующее влияние интерференции на фармакокинетические параметры бемитила с аналогичной тенденцией описано Г.Г.Незнамовым с сотрудниками (Незнамов Г.Г. и соавт., 1993). Отмечено снижение равновесной концентрации бемитила в крови пациентов при применении бемитила в комбинации с феназепамом (Css, при применении бемитила 2,46±0,58 мкг/мл, при комбинированной терапии – 1,75±0,40 мкг/мл), соответственно изменяется степень выраженности фармакологических эффектов бемитила; происходит уменьшение выраженности психостимулирующего и связанного с ним астенического действия препарата.
При применении бромитила интенсивность распределения бромантана и бемитила изменяется по сравнению с раздельным применением препаратов.
Объем распределения бемитила, в случае применения бромитила, увеличивается по сравнению с V1 водного раствора препарата в 3,2 раза. Объем распределения бромантана, в случае применения бромитила, в 1,4 раза ниже объема распределения бромантана при применении раствора препарата в ПЭГ-400.
В метаболизме ксенобиотиков непосредственное участие принимают в основном монооксигеназы микросом печени с участием цитохрома Р450 в качестве терминальной оксидазы. Этот гидроксилирующий комплекс занимает одно из центральных мест в общем процессе детоксикации. Скорость метаболизма лекарственных препаратов является наиболее важным фактором, влияющим на интенсивность и длительность их действия. Изучение процессов стимулирования и ингибирования гидроксилирующей системы ксенобиотиками необходимо в клинической практике при длительном лечении пациентов комплексом лекарственных средств.
Бромантан является выраженным индуктором цитохром-Р450-зависимой монооксигеназной системы печени (Хлопушина Т.Г. и соавт., 1991, 1992; Сергеева С.А., 1993). Влияние производных бензимидазола на цитохром-Р450-зависимый метаболизм ксенобиотиков зависит от дозы, лекарственной формы и времени, прошедшего с момента введения, а также способа введения (Ковалев И.Е. и соавт., 1994; Лазарева Д.Н, Алехин Е.К., 1985).
Таблица 22
Фармакокинетические параметры бромантана, бемитила и бромитила
в плазме крови крыс после перорального введения
| Пара-метры | Размер-ность | Бемитил (водный раствор) Д = 100 мг/кг | Бромантан (раствор в ПЭГ-400) Д = 100 мг/кг | Бромитил | |
| Бромантан Д = 100 мг/кг | Бемитил Д = 125 мг/кг | ||||
| kабс | ч-1 | 1,755 | 7,562 | 2,42 | 1,99 |
| t1/2абс | ч | 0,395 | 0,091 | 0,286 | 0,347 |
| Сmax | мкг/мл | 1,88 | 0,311 | 0,311 | 0,78 |
| tmax | ч | 1,0 | 0,33 | 1,0 | 1,0 |
| t1/2 | ч | 0,96 | 0,819 | 2,55 | 1,394 |
| t1/2 | ч | 6,023 | 46,2 | 44,1 | 8,592 |
| k12 | ч-1 | 0,251 | 0,248 | 0,107 | 0,143 |
| k21 | ч-1 | 0,241 | 0,591 | 0,15 | 0,133 |
| kel | ч-1 | 0,345 | 0,021 | 0,028 | 0,302 |
| AUC | мг•ч/л | 8,656 | 16,763 | 12,579 | 3,834 |
| V1 | л/кг | 33,459 | 397,68 | 283,9 | 107,99 |
| F | % | 4,4 | 27,6 | 20,71 | 3,1 |
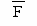 | % | 24,95 | 42,2 | 32,6 | 10,5 |
Сочетанное применение лекарственных препаратов, оказывающих выраженное влияние на цитохром-Р450-зависимую монооксигеназную систему печени, безусловно вносит свой вклад в модификацию фармако- и токсикокинетики, а также, соответственно, динамики развития фармакологических и токсикологических эффектов бромитила по сравнению с раздельным применением препаратов. При изучении острой токсичности у крыс при пероральном введении установлено: LD50 для бромантана – 5640 (4900–6400) мг/кг; LD50 для бемитила – 581,48 (350,17–965,57) мг/кг; LD50 для бромитила – 1750,30 (1463,07 –2093,92) мг/кг.
Константа элиминации бемитила уменьшается в случае применения бромитила, по сравнению с раздельным его применением, в 1,14 раза. Константа элиминации бромантана увеличивается в случае применения бромитила в 1,33 раза по сравнению с раздельным его применением.
Анализ влияния феномена фармакокинетической интерференции на фармакокинетические параметры бромантана и бемитила при их совместном применении в единой таблетированной лекарственной форме (бромитил) позволил выявить модифицирующее влияние интерференции на всех этапах прохождения исследуемых лекарственных препаратов в организме экспериментальных животных: всасывания, распределения по органам и тканям, биотрансформации и выведения.
При пероральном применении бемитил быстро всасывается из желудочно-кишечного тракта (ka6c = 1,655 ч-1; t1/2a6c = 0,419 ч), достигая максимальной концентрации через 1 час после введения; характер элиминации из крови биэкспоненциальный. Высокое значение объема распределения (табл. 23) подтверждает интенсивность распределения бемитила по органам и тканям.
Пирацетам после перорального введения всасывается из желудочно-кишечного тракта с высокой скоростью (ka6c = 3,589 ч-1; t1/2a6c = 0,193 ч), время достижения максимальной концентрации – 1 час; характер элиминации из крови биэкспоненциальный. Высокое значение объема распределения (V1 = 43,832 л) свидетельствует об интенсивном распределении пирацетама в органы и ткани из крови.
Анализ фармакокинетики пирабела позволил выявить модифицирующее влияние интерференции на всех этапах прохождения комплексного препарата в организме: всасывания, распределения, биотрансформации и выведения. Фаза абсорбции пирацетама в случае применения пирабела продолжительнее (t1/2абс пирабел = 0,271 ч) фазы всасывания пирацетама при раздельном его применении (t1/2абс пирацетам = 0,193 ч), что обусловлено меньшей скоростью всасывания (табл. 23). Время достижения максимальной концентрации не изменилось, однако Сmax при раздельном применении пирацетама выше. Площадь под фармакокинетической кривой пирацетама в случае применения пирабела в 1,5 раза меньше, чем AUC пирацетама при раздельном его применении в той же дозе.
Скорость всасывания бемитила в случае применения пирабела уменьшается (табл. 23), время достижения максимальной концентрации увеличивается по сравнению с аналогичными фармакокинетическими параметрами бемитила при раздельном применении. Однако Сmax бемитила в крови в случае введения пирабела выше максимальной концентрации бемитила при раздельном его применении в той же дозе. AUC бемитила при применении пирабела (а соответственно, и биодоступность) в 2 раза ниже, чем AUC бемитила при раздельном его применении в той же дозе.
Объем распределения бемитила в случае применения пирабела уменьшается по сравнению с V1 таблеток бемитила в 1,8 раза. При применении пирабела интенсивность распределения пирацетама практически не отличается от аналогичных параметров таблеток пирацетама.
Таблица 23
Фармакокинетические параметры пирацетама, бемитила и пирабела
после перорального введения у человека
-
Параметры
Размерность
Пирацетам
0,6 г
Бемитил
0,25 г
Пирабел
Пирацетам
0,6 г
Бемитил
0,25 г
kабс
ч-1
3,589
1,655
2,559
1,433
t1/2абс
ч
0,193
0,419
0,271
0,484
tα1/2
ч
2,537
2,109
2,601
0,914
tβ1/2
ч
21,769
8,626
11,833
13,227
V1
л
43,832
103,29
45,348
58,576
kel
ч-1
0,062
0,146
0,091
0,532
k21
ч-1
0,140
0,181
0,170
0,075
k12
ч-1
0,103
0,082
0,063
0,203
CL
л/ч
2,715
15,07
4,152
31,172
AUC
мкг•ч/мл
221,025
16,592
144,498
8,02
MRT
ч
28,230
10,569
15,351
7,701
tmax
ч
1,0
1,0
1,0
2,0
Сmax
мкг/мл
12,22±0,41
1,87±0,21
11,86±0,39
2,16±0,33
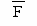
%
97,1
85,7
95,6
74,3
Рассмотренные в настоящем исследовании некоторые аспекты фармакокинетической интерференции могут наряду с теоретическим, в ряде случаев представлять и практический интерес, поскольку для обеспечения эффективной фармакотерапии экстремальных состояний перспективной является комбинированная фармакотерапия.
Влияние включения бемитила в комплексную терапию нарушений функций печени исследовали у 81 ликвидатора последствий аварии на Чернобыльской АЭС (ЧАЭС) с хроническими заболеваниями гепатобилиарной системы.
В отдаленный период после повреждающего радиационного воздействия (через 20 лет после катастрофы) у ликвидаторов был обнаружен дисбаланс процессов свободнорадикального окисления, выражающийся в гиперпродукции свободных радикалов кислорода, дефиците ферментативных и низкомолекулярных звеньев антиоксидантной защиты и накоплении продуктов ПОЛ.
Применение бемитила позволило достичь уменьшения проявлений тканевой гипоксии, оптимизировать функционирование антиоксидантной системы и предотвратить активацию процессов липопероксидации, что положительно отразилось на печеночной функции.
Таблица 24
Данные лабораторных исследований печеночной функции
и проявлений тканевой гипоксии до и после лечения
| Показатель | Бемитил | Контроль | ||||
| Исходно | 14-й день | Δ% | Исходно | 14-й день | Δ% | |
| Билирубин общ. (мкмоль/л) | 12,7±0,84 | 10,2±0,71 | -19,7 | 12,9±0,51 | 11,9±0,85 | -7,8 |
| Трансаминазы | ||||||
| АлАТ (мккат/л) | 0,25±0,06 | 0,20±0,05 | -20,0 | 0,28±0,06 | 0,24±0,08 | -14,3 |
| АсАТ (мккат/л) | 0,19±0,02 | 0,12±0,02 | -36,8 | 0,21±0,02 | 0,17±0,05 | -19,1 |
| Органоспецифические ферменты | ||||||
| Уроканиназа (ед.) | 0,14±0,03 | 0,10±0,02 | -28,6 | 0,15±0,02 | 0,12±0,02 | -20,0 |
| Гистидаза (ед.) | 0,19±0,03 | 0,13±0,05 | -31,6 | 0,22±0,02 | 0,19±0,02 | -13,6 |
| СДГ (мкмоль/л/ч) | 71,7±5,92 | 61,8±5,24 | -13,9 | 78,4±5,92 | 61,8±5,24 | -21,2 |
| ТДГ (мкмоль/л/ч) | 71,5±6,06 | 66,3±3,24 | -7,3 | 74,6±6,04 | 67,3±4,04 | -9,8 |
| Перекисное окисление липидов | ||||||
| МДА (мкмоль/л) | 8,7±0,69 | 6,9±0,44* | -20,6 | 9,0±0,69 | 8,7±0,49 | -3,1 |
| Ферменты антиоксидантной защиты | ||||||
| Каталаза (мкмоль/мл/мин) | 16,5±1,47 | 21,6±0,53* | +23,6 | 17,0±1,57 | 18,6±0,64 | +8,8 |
| СОД (у.е./мл ) | 3,4±0,31 | 3,9±0,19 | +13,6 | 3,4±0,29 | 3,5±0,19 | +3,1 |
| ГП (мкмоль/мл/мин) | 2,6±0,13 | 3,5±0,15* | +26,6 | 2,4±0,18 | 2,8±0,27 | +14,1 |
Примечание: * – статистически достоверное различие (р<0,05) по сравнению с исходными значениями.
На 14-й день лечения отмечено снижение уровня билирубина плазмы, активности аланиновой и аспарагиновой трансаминаз, гистидазы и уроканиназы, α-сериндегидратазы и α-треониндегидротазы. Значимое улучшение функции печени (снижение 25% от исходных значений) в процессе лечения достигнуто у 79,6% пациентов, принимающих бемитил (табл. 24). Улучшения сократительной функции желчного пузыря (по данным УЗИ-контроля) выявлено не было ни в одной из групп.
В результате лечения отмечено уменьшение общей слабости и утомляемости пациентов, а также тяжести в правом подреберье (табл. 25). Клиническое улучшение было более выражено в группе пациентов, получавших бемитил, по сравнению со стандартной гепатопротекторной терапией.
Следует отметить, что добавление бемитила в комплексную терапию нарушений функций печени не приводило к достоверным изменениям печеночного кровотока, что объясняет положительную динамику клинических и лабораторных показателей главным образом его метаболическим действием.
Таблица 25
Динамика клинической симптоматики в изучаемых группах пациентов,
кол-во человек с симптомом (% пациентов с симптомом)
| | Бемитил (n=54) | Контроль (n=27) | ||
| исходно | 14-й день | исходно | 14-й день | |
| Гепатомегалия | 30 (55,5%) | 26 (48,2%) | 17 (62,9%) | 14 (51,9%) |
| Спленомегалия | 5 (9,3%) | 4 (7,4%) | 2 (7,4%) | 2 (7,4%) |
| Тяжесть в правом подреберье | 18 (33,3%) | 6* (11,1%) | 10 (37,0%) | 5 (18,5%) |
| Болезненность печени при пальпации | 31 (57,4%) | 22 (40,7%) | 14 (51,8%) | 8 (29,6%) |
| Астеновегетативные проявления | 52 (96,3%) | 16* (29,6%) | 24 (88,9%) | 10 (37,0%) |
| Диспепсические явления | 12(22,2%) | 4 (7,4%) | 5 (18,5%) | 2 (7,4%) |
Примечание: * – статистически достоверное различие (р<0,05) по сравнению с исходными значениями.
Таким образом, включение бемитила в комплекс реабилитационных мероприятий ликвидаторов аварии на Чернобыльской АЭС в дозе 750 мг в сутки приводило к оптимизации функционирования антиоксидантной системы и предотвращению активации процессов липопероксидации. У пациентов улучшалось функциональное состояние печени и снижались проявления цитолитического синдрома. Препарат бемитил в суточной дозе 750 мг может быть рекомендован для использования пациентами, страдающими хроническими заболеваниями гепатобилиарной системы, с целью дополнительной коррекции антиоксидантной и антигипоксической защитной систем организма.
