Новые подходы к фармакокоррекции неспецифических составляющих патогенеза токсических поражений 14. 00. 25 фармакология, клиническая фармакология 14. 00. 16 патологическая физиология
| Вид материала | Автореферат диссертации |
- Клиническая эффективность и фармакоэпидемиология лекарственных средств у детей с аллергическим, 462.25kb.
- «Клиническая фармакология» Специальность: 111201 Ветеринария Пояснительная записка, 94.74kb.
- Календарно-тематический план лекций элективного курса «Клиническая фармакология в акушерстве», 28.46kb.
- «Экспериментальная и клиническая фармакология» журнал к сведению, 84.61kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 10 Фармакология,, 197.39kb.
- Антиметастатическая активность препаратов природного происхождения 14. 00. 25 фармакология,, 1023.15kb.
- Оптимизация фармакотерапии плоского лишая 14. 00. 25. фармакология, клиническая фармакология, 214.56kb.
- Оптимизация противотромботической терапии острого инфаркта миокарда 14. 00. 06 кардиология, 862.58kb.
- Лекарственные растительные средства в профилактике респираторных заболеваний у детей, 439.68kb.
- Типовые учебный план и программа для клинических ординаторов по специальности «клиническая, 656.73kb.
Таблица 12
Содержание Шиффовых оснований в органах крыс, отравленных карбофосом
(отн. ед/мг липидов, n = 8)
| Группы крыс, препараты | Статистический показатель | Время после отравления | ||
| 6 сутки | 14 сутки | |||
| Головной мозг | Интактные крысы | М±m | 0,16 ±0,02 | 0,16 ±0,02 |
| % | 100 | 100 | ||
| Карбофос | М±m | 0,40 ±0,01* | 0,34 ± 0,02* | |
| % | 250 | 213 | ||
| Карбофос + бемитил | М±m | 0,28 ± 0,02** | 0,30 ±0,03** | |
| % | 175 | 188 | ||
| Карбофос + этомерзол | М±m | 0,20 ±0,02** | 0,20 ± 0,02** | |
| % | 125 | 125 | ||
| Карбофос + соединение Б-16 | М±m | 0,18 ±0,01** | 0,19 ±0,01** | |
| % | 113 | 119 | ||
| Миокард | Интактные крысы | М±m | 0,38 ± 0,04 | 0,38 ± 0,04 |
| % | 100 | 100 | ||
| Карбофос | М±m | 1,22 ±0,22* | 1,04 ± 0,06* | |
| % | 321 | 274 | ||
| Карбофос + бемитил | М±m | 0,50 ±0,05** | 0,58 ±0,05** | |
| % | 132 | 153 | ||
| Карбофос + этомерзол | М±m | 0,46 ± 0,06** | 0,60 ±0,04** | |
| % | 121 | 158 | ||
| Карбофос + соединение Б-16 | М±m | 0,48 ± 0,05** | 0,48 ± 0,08** | |
| % | 126 | 126 | ||
Примечания: * – статистически достоверное различие (р<0,05) с группой «интактные крысы»; ** – статистически достоверное различие (р<0,05) с группой «карбофос».
В настоящее время UNEP (United Nations Environmental Project) особо выделяет группу из 12 соединений и групп соединений, на которые следует обращать первоочередное внимание. Эта так называемая «грязная дюжина» включает в себя следующие вещества: полихлорированные бифенилы (ПХБ), полихлорированные дибензо-п-дикосины, полихлорированные дибензофураны, алдрин, диэлдрин, дихлор-дифенил-трихлорэтан, эндрин, хлордан, гексахлорбензол, мирекс, токсафен и гептахлор (Юфит С.С., 2001). 23 мая 2002 г. в Стокгольме принята Глобальная международная конвенция о запрещении стойких органических загрязнителей (СОЗ), к которой присоединилась и Россия. Среди СОЗов ПХБ являются одним из самых распространенных, в процессе биотрансформации ПХБ образуются более токсичные метаболиты.
В условиях длительной сочетанной интоксикации ПХБ и эталоном на 30-е сутки морфогистохимический анализ печени крыс показал развитие хронического гепатологического процесса, основными проявлениями которого являются фиброз и цирроз печени.
Биохимическими показателями, отражающими метаболизм и функцию печени в нормальных и патологических условиях, является уровень печеночных ферментов в сыворотке крови. Одним из наиболее специфичных ферментов является уроканиназа. Появление в крови уроканиназы является следствием нарушения гистогематического барьера печени в результате массированного некроза под влиянием повреждающего фактора. У здоровых крыс активность уроканиназы в крови находится на очень низком уровне или практически не определяется (табл. 13).
Таблица 13
Влияние бемитила и силимарина на биохимические показатели сыворотки крови крыс в условиях сочетанной интоксикации ПХБ и этанолом
| Показатели | Статистический показатель | Группы животных | |||
| Интактные крысы | ПХБ + этанол | ПХБ + этанол + бемитил | ПХБ + этанол + силимарин | ||
| Уроканиназа, нмоль/с•л | M±m | - | 54,9±3,5* | 44,8±3,6** | 52,5±4,4* |
| АлАТ, ммоль/ч•л | M±m % | 3,3±0,18 100,00 | 9,4±0,45* 2865,30 | 4,2±0,76** 152,00 | 8,8±0,77* 267,20 |
| АсАТ, ммоль/ч•л | M±m % | 10,7±0,14 100,00 | 25,7±0,43* 240,10 | 12,4±1,1** 115,80 | 10,0±2,5** 93,40 |
| ЛДГ, ммоль/ч•л | M±m % | 29,9±1,0 100,00 | 122,0±1,8* 408,00 | 92,6±3,3** 309,60 | 149,7±1,5* 500,60 |
| ЩФ, ммоль/ч•л | M±m % | 15,1±1,4 100,00 | 28,5±1,9* 188,70 | 23,2±1,3* 153,60 | 36,0±7,7* 238,40 |
| КФ, ммоль/ч•л | M±m % | 15,2±2,6 100,00 | 26,8±8,8* 176,30 | 16,8±1,8** 110,50 | 24,0±7,0* 157,80 |
Примечания: * – статистически достоверное различие (р<0,05) с группой «интактные крысы»; ** – статистически достоверное различие (р<0,05) с группой «ПХБ + этанол».
Судя по существенному снижению повышенного в результате интоксикации уровня активности уроканиназы (на 18,4%; р < 0,05), активности трансминаз – АлАТ (в 2,2 раза; р<0,05), АсАТ (в 2,1 раза; р<0,05), ЛДГ (в 1,3 раза; р<0,05), КФ (в 1,6 раза; р < 0,05), бемитил в отличие от силимарина препятствует развитию цитолитического синдрома. Однако, так же как и силимарин, бемитил не изменяет активности ЩФ, что свидетельствует об отсутствии его влияния на холестатический эффект токсикантов.
Результаты сравнительного изучения влияния бемитила и силимарина на ПОЛ и функционирование в гепатоцитах ключевых ферментов антиокислительной системы цикла трикарбоновых кислот, пентозофосфатного цикла и ферментов синтеза мочевины в условиях сочетанной интоксикации ПХБ и этанола представлены в таблицах 14, 15 и 16. Продукты ПОЛ определяли в липидных экстрактах печени. Продукты, реагирующие с тиобарбитуровой кислотой (ТБК-реагирующие продукты), определяли в гомогенатах печени крыс.
Таблица 14
Влияние бемитила и силимарина на процессы ПОЛ, активность каталазы и Гл-6-ФДГ
в печени крыс в условиях сочетанной интоксикации ПХБ и этанолом
| Показатели | Статистиче- ский показатель | Группы животных | |||
| Интактные крысы | ПХБ + этанол | ПХБ + этанол + бемитил | ПХБ + этанол + силимарин | ||
| ДК, Д232 | M±m % | 0,454±0,022 100,0 | 0,632±0,026* 139,2 | 0,464±0,032** 102,2 | 0,516±0,023** 113,6 |
| ТБК-РП, нмоль/г ткани | M±m % | 90,4±4,1 100,0 | 123,1±3,4* 136,1 | 98,3±2,8** 108,7 | 100,8±1,4** 111,5 |
| Каталаза, ммоль/мин/г белка | M±m % | 328,0±24,0 100,0 | 236,0±17,0* 71,9 | 308,0±19,0** 93,9 | 264,0±16,5* 80,4 |
| Гл-6-ФДГ, нкат/г белка | M±m % | 528,6±36,9 100,0 | 806,5±63,4* 152,5 | 578,2±66,5** 109,3 | 708,4±42,7* 134,0 |
Примечания: * – статистически достоверное различие (р<0,05) с группой «интактные крысы»; ** – статистически достоверное различие (р<0,05) с группой «ПХБ + этанол».
Лечебное введение бемитила отравленным животным сопровождалось выраженным восстановительным эффектом, превосходящим влияние гепатопротектора силимарина на все исследуемые показатели: ДК, ТБК-РП, каталазу, Гл-6-ФДГ (табл. 14).
Длительная сочетанная интоксикация ПХБ и этанолом сопровождалась существенным подавлением каталитической активности ферментов цикла трикарбоновых кислот (табл. 14). МДГ является наиболее активным ферментом цикла трикарбоновых кислот (ЦТК), что обусловлено органными особенностями метаболизма печени – преобладанием тканевого дыхания над гликолизом. Данный факт позволяет предположить, что одним из важных патогенетических механизмов поражений печени в условиях сочетанной интоксикации ПХБ и этанолом является биоэнергетическая (тканевая) гипоксия. Вышеизложенное подтверждается результатами исследования: гепатопротектор силимарин не изменял активность СДГ и МДГ в гепатоцитах, а антигипоксант бемитил статистически значимо увеличивал активность исследованных ферментов ЦТК у отравленных животных. Бемитил предупреждает снижение уровня митохондриального белка в митохондриях, а силимарин таким действием не обладает.
Таблица 15
Влияние бемитила и силимарина на активность ферментов цикла трикарбоновых кислот и количество белка в митохондриальной фракции гепатоцитов крыс в условиях сочетанной интоксикации ПХБ и этанолом
| Показатели | Статистиче-ский показатель | Группы животных | |||
| Интактные крысы | ПХБ + этанол | ПХБ + этанол + бемитил | ПХБ + этанол + силимарин | ||
| СДГ, нкат/г белка | M±m % | 146,0±12,8 100 | 93,2±8,9* 63,8 | 130,7*±9,0** 89,5 | 106,5±9,2* 72,9 |
| МДГ, мккат/г белка | M±m % | 7,2±0,2 100 | 3,9±0,7* 52,6 | 5,9*±0,2** 81,6 | 4,4±0,9* 61,3 |
| Митохондри-альный белок, мг/г | M±m % | 9,8±0,6 100 | 6,8±0,7* 69,7 | 9,7±0,3** 98,3 | 6,6±0,7* 67,5 |
Примечания: * – статистически достоверное различие (р<0,05) с группой «интактные крысы»; ** – статистически достоверное различие (р<0,05) с группой «ПХБ + этанол».
При длительной сочетанной интоксикации ПХБ и этанолом, наряду с нарушением процессов ПОЛ, снижением функциональной активности каталазы, Гл-6-ФДГ и ферментов ЦТК, в гепатоцитах обнаружено снижение активности ключевых ферментов мочевинообразования – карбомоилфосфатсинтетазы и аргиназы (табл. 16). Применение бемитила оказывало выраженный корригирующий эффект.
Таблица 16
Влияние бемитила на активность аргиназы и КФС в гепатоцитах крыс
в условиях сочетанной интоксикации ПХБ и этанолом
| Показатели | Статистический показатель | Группы животных | ||
| Интактные крысы | ПХБ + этанол | ПХБ + этанол + бемитил | ||
| Аргиназа, мккат/г белка | M±m % | 160,5±18,52 100,0 | 96,3±8,94* 60,0 | 131,5±8,22** 81,9 |
| КФС, нкат/г белка | M±m % | 258,4±32,1 100,0 | 122,3±13,8* 47,3 | 179,6±13,2** 69,5 |
Примечания: * – статистически достоверное различие (р<0,05) с группой «интактные крысы»; ** – статистически достоверное различие (р<0,05) с группой «ПХБ + этанол».
Анализ результатов проведенного исследования позволяет констатировать, что ПОЛ является общим механизмом нарушения метаболических процессов и состояния биологических мембран при экспериментальной интоксикации нитритами, ФОС, ПХБ и этанолом. Полученные результаты, доказывающие и уточняющие участие процессов ПОЛ в патогенезе интоксикаций изученными химическими веществами, открывают перспективное направление в фармакотерапии отравлений с помощью ингибиторов ПОЛ – производных бензимидазола.
Основным путем метаболизма производных бензимидазола является их биотрансформация цитохромом P450-зависимыми монооксигеназами печени и других тканей (Zimmermann K. et al., 2008; Asteinza J. et al., 2000). При этом одно и то же соединение, в биотрансформации которого нередко принимают участие различные изоформы цитохрома Р450, в зависимости от режима введения и дозы, способно как ингибировать, так и индуцировать цитохром Р450. Детальный анализ влияния бемитила на монооксигенирование различных модельных субстратов представляет несомненный интерес, поскольку позволяет не только косвенно определить спектр участвующих в биотрансформации препарата изоформ, но и прогнозировать характер его фармакокинетической интерференции с другими, метаболизирующимися цитохром-Р450-зависимыми монооксигеназами препаратами.
В настоящем исследовании проведен анализ влияния бемитила на характер изменения суммарного уровня цитохрома Р450 и его воздействия на некоторые изоформо-специфические и изоформо-неспецифические монооксигеназные активности в печени крыс и in vitro – в лимфоцитах человека.
Результаты анализа уровней цитохромов Р450 и b5 и монооксигеназных активностей в печени крыс иллюстрирует таблица 17. При однократном введении бемитил статистически значимо увеличивал содержание цитохрома Р450 в печени крыс – уровень белка цитохрома Р450 составил 116% от такового в контрольной группе животных; уровень цитохрома b5 также незначительно увеличивался, однако статистически значимых отличий от контроля не наблюдалось. При курсовом введении бемитила отмечалась лишь тенденция к увеличению содержания цитохрома Р450, а уровень цитохрома b5 при этом режиме введения практически не изменялся.
Бемитил при однократном введении вызывал отчетливую индукцию аминопирин-N-деметилазной активности, которая возрастала в 1,7 раза по сравнению с контрольной группой. При курсовом введении индуцирующий эффект был выражен в меньшей степени – аминопирин-N-деметилазная активность возрастала в 1,5 раза и различия с контрольной группой были статистически несущественны. Изменения аминопирин-N-деметилазной активности соответствовали таковым для CYP2B1/2-изоформо-специфической БРОД-активности, поскольку именно эта изоформа является основной изоформой, обеспечивающей биотрансформацию аминопирина у грызунов (Ryan D., Levin W., 1990). Бемитил не вызывал статистически значимого изменения скорости монооксигенирования анилина, биотрансформация которого у грызунов осуществляется в основном изоформой CYP2E1 (Ryan D., Levin W., 1990), показатели анилин–p-гидроксилазной активности в группе животных, получавших как однократное, так и курсовое введение препарата, статистически значимо от контроля не отличались.
При однократном введении препарата 4-нитроанизол-О-деметилазная активность, в реализации которой основном принимают участие CYP1A1/2 изоформы, возрастала в 2,3 раза, а при 5-кратном введении – в 1,8 раза. Скорость гидроксилирования 2,5-дифенилоксазола, метаболизирующегося в основном CYP1A2, спустя сутки после однократного введения бемитила возрастала в 4,4 раза, а после курсового введения – в 2,3 раза. Максимальная индукция выявлена при оценке CYP1A1-изоформо-специфической ЭРОД-активности. При однократном введении бемитила скорость О-деэтилирования 7-этоксирезоруфина возрастала в 5 раз, а при курсовом - в 2,1 раза.
Таблица 17
Влияние бемитила на уровни цитохромов Р450 и b 5 в микросомах
и монооксигеназные активности в 12000g-гомогенатах печени крыс
| Показатели | Группа животных | ||
| Контроль n = 8 | Бемитил, однократное введение n = 8 | Бемитил, курсовое введение n = 8 | |
| Уровни цитохромов (M±m) | |||
| Цитохром Р450, нмоль/мг белка микросом | 0,70±0,023 | 0,81±0,048 * | 0,79±0,027 |
| Цитохром b5, нмоль/мг белка микросом | 0,69±0,040 | 0,74±0,020 | 0,71±0,042 |
| Монооксигеназные активности (M±m) | |||
| Аминопирин-N-деметилазная, нмоль/мин/мг | 0,100±0,006 | 0,170±0,022 * | 0,146±0,018 |
| Анилин-р-гидроксилазная, нмоль/мин/мг | 0,017±0,004 | 0,020±0,004 | 0,018±0,002 |
| 4-нитроанизол-О-деметилазная, нмоль/мин/мг | 0,054±0,009 | 0,122±0,014 ** | 0,098±0,017 * |
| 2,5-дифенилоуксазол-р-гидроксилазная, RFU/мин/мг | 75,6±3,9 | 336,8±62,3** # | 172,0±21,4 ** |
| ЭРОД-активность, пкмоль/мин/мг | 1,56±0,17 | 7,87±0,32 ** ## | 3,26±0,62 * |
| БРОД-активность, пкмоль/мин/мг | 1,47±0,11 | 2,42±0,41* | 2,29±0,31 |
Примечания: * – статистически достоверное различие (р<0,05) с группой «контроль»;
** – статистически достоверное различие (р<0,01) с группой «контроль»;
# – статистически достоверное различие (р<0,05) с группой «бемитил, курсовое введение»; ## – статистически достоверное различие (р<0,01)
с группой «бемитил, курсовое введение».
Ценным методическим подходом к оценке влияния различных ксенобиотиков на активность цитохром-Р450-зависимых монооксигеназ является проведение исследований лимфоцитов миеломоноцитарных или лимфобластоидных линий клеток in vitro. Исследования in vitro могут служить ценной моделью для прогнозирования биотрансформации ксенобиотика у человека (Balls M., Sabbioni E., 1999). Как правило, изменения активности в гепатоцитах и лимфоцитах при воздействии индукторов и ингибиторов цитохрома Р450 идут параллельно. При анализе влияния бемитила на ЭРОД-активности в лимфоцитах человека (табл. 18) выявлен “волнообразный”, зависимый от концентрации эффект препарата. В концентрации 100 µM бемитил вызывал отчетливую, статистически значимую индукцию деэтилазной активности; при концентрации бемитила в культуре 10 µM этот эффект снижался; в концентрации 1 µM – практически отсутствовал, но при дальнейшем снижении концентрации вновь наблюдалась тенденция к индукции ЭРОД- активности. Влияние бемитила на БРОД-активность является “зеркальным отражением” его влияния на ЭРОД-активность. Максимальный индуцирующий эффект на дебензилирование 7-бензилоксирезоруфина, осуществляющийся у человека изоформами, ортологичными CYP2B1/2 грызунов, наблюдался в диапазоне доз от 1 до 10 µM, а при увеличении или снижении концентрации препарата индукции монооксигеназной активности не отмечалось.
Таблица 18
Влияние бемитила на ЭРОД-активность и БРОД-активность
в митоген-стимулированных лимфоцитах человека
| № | Условия культивирования | Ферментативная активность, пмолей/мин/106 лимфоцитов M±m | |
| ЭРОД-активность (n = 8) | БРОД-активность (n = 7) | ||
| 1 | Контроль | 0,119±0,016 | 0,048±0,010 |
| 2 | Бемитил 100 µМ | 0,172±0,035 * | 0,040±0,012 |
| 3 | Бемитил 10 µМ | 0,166±0,040 | 0,058±0,014 |
| 4 | Бемитил 1 µМ | 0,124±0,023 | 0,059±0,013 * |
| 5 | Бемитил 0,1 µМ | 0,162±0,027 | 0,043±0,015 |
Примечание: * – статистически достоверное различие (р<0,05) с группой «контроль».
Таким образом, бемитил, при введении крысам внутрь в эффективной дозе 50 мг/кг, как при однократном, так и при курсовом введении, проявил свойства индуктора смешаного типа. Максимальный индуцирующий эффект для большинства изученных монооксигеназных активностей прослеживается при однократном введении препарата. Судя по характеру изменения монооксигеназных активностей, бемитил преимущественно индуцирует Ah-рецептор-зависимые изоформы цитохрома Р450 – СYP1A1/2 (т.н. “метилхолантрен-индуцируемые”), в меньшей степени влияя на т.н. “фенобарбиталовые изоформы“ подсемейства CYP2B и практически не оказывает влияния на “короткоживущую” изоформу CYP2E1. Эти данные согласуются с многочисленными исследованиями, свидетельствующими об CYP1A1/2-индуцирующем влиянии производных бензимидазола (омепразола, тиабендазола, пимозида, оксфендазола, астемизола, фенбендазола) и участии этих изоформ, наряду с CYP2C и СYP3A, в метаболизме самих бензимидазолов. In vitro, при использовании митоген-стимулированных лимфоцитов человека, бемитил, в зависимости от концентрации, также вызывал индукцию ЭРОД- и БРОД-активностей, что косвенно свидетельствует о сходных путях биотрансформации самого бемитила у грызунов и человека.
Анализ результатов, полученных в ходе настоящего исследования, позволяет утверждать, что бемитил проявляет свойства индуктора цитохрома Р450 смешанного типа, увеличивая уровень цитохрома Р450 в микросомах и монооксигеназные активности, сопряженные как с Ah-рецептор-зависимыми, так и с Ah-рецептор-независимыми изоформами, за исключением анилин-р-гидроксилазной активности, которая оставалась неизменной. Индуцирующий эффект в отношении монооксигеназных активностей, реализуемых Ah-рецептор-зависимыми изоформами (4-нитроанизол-О-деметилазная, 2,5-дифенилоксазол-р-гидроксилазная, ЭРОД-активность), более выражен и максимален при однократном введении препарата. In vitro бемитил в высоких концентрациях увеличивает экспрессию ЭРОД-активности в лимфоцитах, а в низких – БРОД-активности.
Для обеспечения эффективной фармакотерапии экстремальных состояний перспективным является создание системы фармакологических комплексов, состоящих из базисного средства, чье позитивное влияние на работоспособность наблюдается при максимально широком спектре неблагоприятных для профессиональной деятельности условий, и дополнительных препаратов, избирательно увеличивающих работоспособность в конкретной экстремальной ситуации. Подобный комплекс должен обладать психостимулирующим действием без развития истощения, анаболическим и иммуностимулирующим действием на фоне достаточного антиоксидантного, витаминного и минерального обеспечения.
В качестве базовых препаратов наиболее перспективными являются актопротекторы – производные бензимидазола. При использовании актопротекторов – производных бензимидазола в комплексной терапии необходимо учитывать их способность модифицировать активность цитохром-Р450-зависимых монооксигеназ, изменять фармакокинетику и, соответственно, динамику развития фармакологических эффектов совместно применяемых лекарственных препаратов.
Сравнивая фармакокинетические параметры в плазме крови крыс при различных путях введения бемитила, следует отметить, что значение константы элиминации при пероральном введении препарата превышает kel при его внутривенном введении (табл. 19). При пероральном введении бемитила крысам (100 мг/кг) он всасывается из желудочно-кишечного тракта с высокой скоростью (kабс плазма = 1,75 ч-1), период полуабсорбции – 0,395 ч, время достижения максимальной концентрации – 1 ч, максимальная концентрация в плазме крови – 1,9±0,15 мкг/мл.
Анализируя полученные экспериментальные данные, можно сделать вывод, что увеличение kel бемитила при пероральном введении может быть обусловлено двумя причинами:
- Выраженной биотрансформацией в кишечной стенке. Большинство лекарственных средств, характеризующихся эффектом первого прохождения через печень, подвергается значительному метаболизму в ней, но это не значит, что t1/2 в крови препаратов с высоким печеночным клиренсом непродолжителен (Лоуренс Д.Р., Беннит П.Н., 1991).
- Более интенсивным распределением препарата в органы и ткани. Объем распределения бемитила при пероральном введении в 17,4 раза выше, чем при внутривенном введении (табл. 16).
При курсовом пероральном введении бемитила крысам концентрация неизмененного препарата в плазме крови практически не меняется.
Таблица 19
Фармакокинетические параметры бемитила в плазме крови и цельной крови крыс после однократного введения
| Параметры | Размерность | Внутривенное введение (10 мг/кг) | Пероральное введение (100 мг/кг) | |
| Плазма крови | Плазма крови | Цельная кровь | ||
| | ч-1 | 2,575 | 0,721 | 0,67 |
| | ч-1 | 0,106 | 0,115 | 0,099 |
| kабс | ч-1 | - | 1,755 | 1,814 |
| t1/2абс | ч | - | 0,395 | 0,382 |
| tmax | ч | - | 1,0 | 1,0 |
| Сmax | нг/мл | - | 1888,0 | 2684,0 |
| t1/2 | ч | 0,269 | 0,96 | 1,035 |
| t1/2 | ч | 6,523 | 6,023 | 6,932 |
| kel | ч-1 | 0,264 | 0,345 | 0,326 |
| k12 | ч-1 | 1,381 | 0,251 | 0,238 |
| k21 | ч-1 | 1,036 | 0,241 | 0,206 |
| Cl | л/кг•ч | 0,509 | 11,552 | 7,709 |
| V1 | л/кг | 1,927 | 33,459 | 23,668 |
| MRT | ч | 8,834 | 6,489 | 7,183 |
| AUC | нг•ч/мл | 19646,104 | 8656,545 | 12970,93 |
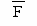 | % | - | 24,95 | - |
