Методические указания к лабораторно- практическим занятиям по курсу «Средства и методы мониторинга окружающей среды»
| Вид материала | Методические указания |
- Методические указания к лабораторно-практическим занятиям для студентов очного и заочного, 620.25kb.
- Методические указания по практическим занятиям По дисциплине Математические методы, 129.27kb.
- Методические указания к изучению курса и практическим занятиям для студентов спец., 914.85kb.
- Методические указания к лабораторно-практическим занятиям для студентов агрономического, 453.89kb.
- Методические указания по практическим работам По дисциплине, 193.22kb.
- Методические указания к практическим занятиям для студентов очной формы обучения специальности, 183.25kb.
- Методические указания для доаудиторной подготовки к практическим занятиям по эпидемиологии, 1893.8kb.
- Методические указания и задания к лабораторно-практическим занятиям Для студентов агробиологического, 833.58kb.
- Методические указания к практическим занятиям и индивидуальные домашние задачи по физике, 635.57kb.
- Методические указания к практическим занятиям для студентов экономических специальностей, 560.21kb.
Приближенный метод определения нитритов
В пробирку наливают 10 мл воды и добавляют 0,5 мл реактива Грисса, содержимое пробирки 5 мин нагревают до 70-80оС (без нагревания, при комнатной температуре, исследуют через 20 мин после добавления реактива Грисса) (табл.8).
Таблица 8. Шкала оценки содержание нитритов в воде
| Окрашивание воды в пробирке при просмотре | Содержание нитритов, мг/л | |
| Сбоку | Сверху | |
| Нет Едва заметное розовое Очень слабо розовое Слабо розовое Розовое Сильно розовое Красное | Нет Чрезвычайно слабо розовое Слабо розовое Светло розовое Сильно розовое Красное Ярко красное | Менее 0,001 0,002 0,004 0,02 0,07 0,2 0,4 |
Колориметрический метод определения азота нитратов
Принцип исследования заключается в том, что азотнокислые соли переводятся раствором фенола в серной кислоте в пикриновую кислоту, последняя после добавления аммиака образует пикрат аммония желтого цвета.
Реактивы:
- Сульфофеноловый раствор;
- стандартный раствор нитрата калия, содержащий в1 мл 0,001 мг азота нитратов;
- 25% -ный раствор нашатырного спирта.
Методика исследован6ия: 10 мл приготовленного рабочего стандартного раствора наливают в фарфоровую чашку, выпаривают на водяной бане досуха и остужают. Параллельно в другую фарфоровую чашку наливают 10 мл исследуемой воды и выпаривают таким же образом.
В чашки с сухим остатком исследуемой воды и стандарта добавляют по 2 мл исследуемой воды и сульфофенолового раствора и размешивают стеклянной палочкой до полного растворения. Посоле этого чашки со стеклянными палочками оставляют на 5-10 минут, а затем добавляют в каждую чашку 20 мл дистиллированной воды, и приливают при помешивании 20 мл 25%-нго раствора нашатырного спирта . В присутствии нитратов раствор окрашивается в желтый цвет, последний переносят в колбу на 100 мл. Чашки, стеклянные палочки несколько раз смывают водой и смывные воды переливают к основному раствору. После этого объем дистиллированной водой доводят до метки 100 мл и содержимое колбы перемешивают.
Колориметрия. Пробы воды, окрашенные в желтый цвет и стандартный раствор заведомо известным количеством азота нитратов подвергают колориметрированию Оптическую плотность окрашенных растворов определяют на ФЭК, с синим светофильтром в кюветах толщиной 1-5 см.
Содержание нитратов определяют по формулу
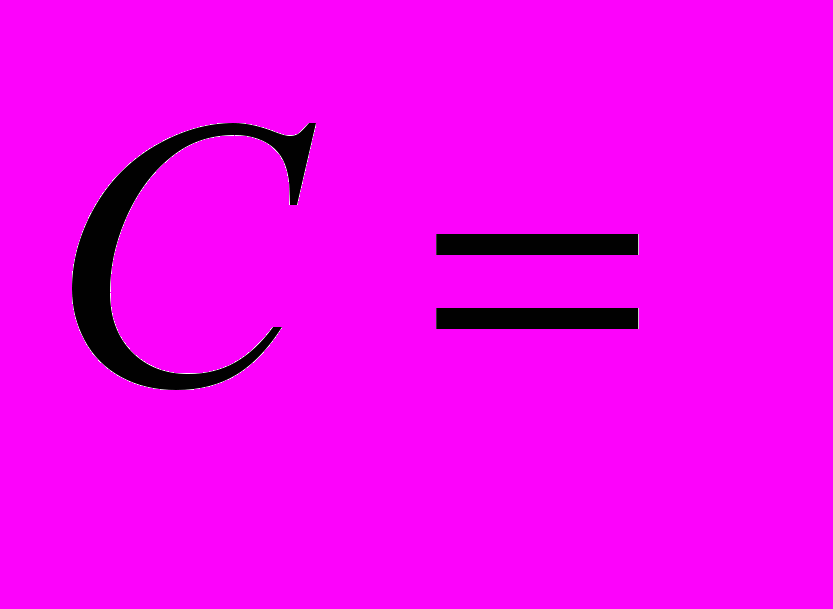
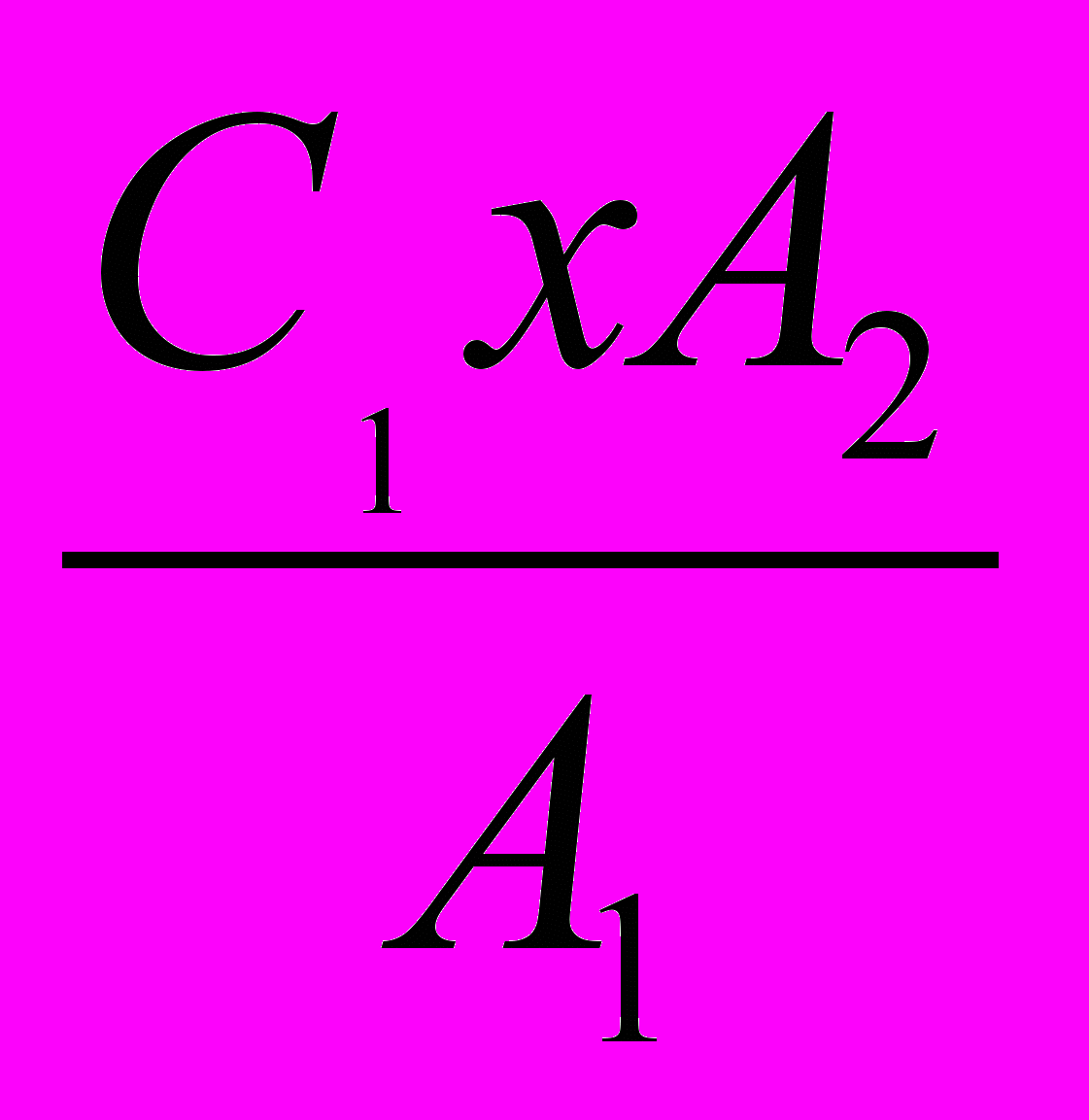 ,
, где С - содержание азота нитрата в воде мг \л;
С - то же в стандартном растворе мг\л;
А2 - оптическая плотность испытуемой воды;
А1 - оптическая плотность стандартного раствора.
Приближенный метод определения азота нитратов.
В пробирку наливают 1 мл исследуемой воды, добавляют 1 мл сульфофенолового раствора так, чтобы его капли падали на поверхность воды. Параллельно ставят пробу с дистиллированной водой (контроль). Смесь в пробирках взбалтывают, оставляют в покое на 20 мин и определяют содержание нитратов по таблице 9.
Таблица 9. Шкала оценки содержания нитратов в воде
| Окрашивание сбоку | Содержание азота нитратов, мг/л |
| Улавливается при сравнении с контролем Едва заметное, желтое Чрезвычайно слабо-желтое Очень слабо желтое Слабо желтоватое Слабо желтое Светло-желтое Желтое Сильно желтое | 0,5 1 2 3 5 10 25 50 100 |
Работа 11. ПОЛИФОСФАТЫ
Принцип метода: Метод определения основан на гидролизе полифосфатов в кислой среде, при котором они переходят в растворенные ортофосфаты, определяемые колориметрическим способом в виде фосфорномолибденового комплекса, окрашенного в синий цвет. В отдельной пробе выявляют ортофосфаты, первоначально содержащиеся в воде, количество которых вычитают из результата, полученного при определении фосфатов (ГОСТ 18309-72). Пробы воды отбирают в хорошо выщелоченные склянки с притертыми пробками.
Реактивы:
- Основной стандартный раствор однозамещенного химически чистого фосфорнокислого калия. (0,7165 г препарата, предварительно высушенного в термостате в течение 2 ч при 1050, растворяют в мерной колбе на 1000 мл дистиллированной водой и доводят объем раствора до метки, добавляют 2 мл хлороформа. 1 мл раствора содержит 0,5 мг иона фосфата);
- Первый рабочий стандартный раствор однозамещенного фосфорнокислого калия. (10 мл основного раствора доводят до 1 л дистиллированной водой. 1 мл раствора содержит 0,005 мг иона фосфата). Используют свежеполученный раствор;
- Второй рабочий стандартный раствор однозамещенного фосфорнокислого калия. (50 мл первого рабочего раствора доводят до 250 мл дистиллированной водой. 1 мл раствора содержит 0.001 мг иона фосфата);
- Молибденовокислый аммоний - реактив I. (25 г препарата растворяют в 600 мл дистиллированной воды. К этому раствору осторожно, охлаждая, добавляют 337 мл концентрированной 98% -ной серной кислоты. После охлаждения раствор доводят дистиллированной водой до 1 л. Раствор хранят в бутыли из темного стекла с притертой пробкой. Используют его через 48 ч после приготовления);
- Молибденовокислый амоний - реактив II. (10 г препарата растворяют в 400 мл дистиллированной воды и добавляют 7 мл концентрированной 98 % серной кислоты. Раствор хранят в полиэтиленовой бутыли в темном месте. Устойчив около 3 мес. Применять реактив можно через 48 ч после приготовления);
- 37%-ный раствор серной кислоты;
- Раствор двухлористого олова. (1,95 г кристалического невыветренного препарата растворяют в 50 мл 13,6%-ной соляной кислоты (18,4 мл 37%-ной кислоты, не содержащей мышьяка, доводят до 50 мл дистиллированной водой)). Суспензию тщательно перемешивают, хранят в склянке, покрытой внутри слоем парафина. Перед применением суспензию хорошо перемешивают. Можно ее использовать сразу после получения;
- Раствор двухлористого олова. (2,5 мл основного раствора (суспензия) доводят дистиллированной водой до10 мл. Необходимо применять свежеприготовленный раствор. Устойчив он около 4 ч).
Определению полифосфатов мешают железо при концентрации, превышающей 1 мг/л, растворимые силикаты более 25 мг/л, нитраты. Влияние железа и силикатов устраняется соответствующим разбавлением исследуемой водой. Влияние нитратов при концентрации до 25 мг/л устраняется добавлением к пробе 0,1 г сульфаминовой кислоты, которую вносят до добавления к пробе молибденовокислого аммония.
Методика определения ортофосфатов. В 50 мл исследуемой воды ( без разбавления можно определить не более 0,4 мг/л иона фосфата), пропущенной через плотный бумажный фильтр (синяя лента), вносят те же реактивы и в той же последовательности, что и в образцовые растворы. Оптическую плотность раствора определяют при помощи ФЭК. Концентрацию ортофосфатов устанавливают по калибровочному графику.
Методика определения полифосфатов. К 100 мл исследуемой воды профильтрованной через плотный бумажный фильтр, или к меньшему объему, доведенному до 10 мл дистиллированной водой, добавляют 2 мл 37%-ного раствора серной кислоты и кипятят 30 мин. Объем исследуемой воды поддерживают добавлением дистиллированной воды в приделах 50-90 мл. После охлаждения раствор переносят в мерную колбу на 100 мл и доводят объем дистиллированной водой до метки. Добавляют 1 мл слабокислого раствора, молибденовокислого раствора (реактив II), перемешивают и через 5 мин приливают 0,1 мл рабочего раствора двухлористого олова, затем снова перемешивают. Через 10-15 мин измеряют интенсивность окраски на ФЭК.
Построение калибровочного графика. В мерные колбы на 50 мл вносят пипеткой 0,0; 0,5; 1,0; 2,0; 5,0; 10,0; 20,0 мл рабочего стандартного раствора фосфорнокислого калия (1 мл - 0,001 мг иона фосфата) и доводят объем его до метки дистиллированной водой.
Содержание полифосфатов в образцовых растворах будет соответственно равно 0,0; 0,01; 0,02; 0,04; 0,10; 0,20; 0,40 мг иона фосфата в 1л воды. В каждую колбу добавляют точно 1 мл молибденовокислого аммония (реактив I, кислый раствор),перемешивают через 5 мин микропипеткой вносят 0,1 мл рабочего раствора двухлористого олова и снова перемешивают. Интенсивность окраски измеряют через 10-15 мин на ФЭК, пользуясь красным светофильтром и кюветами толщиной слоя 2-3 см. Из полученных величин оптических плотностей вычитают оптическую плотность контрольной пробы и результаты наносят на график.
Обработка результатов. Содержание неорганических растворенных ортофосфатов (Х), мг/л, определяют по формуле:
Х=
 ,
,где: С - содержание ортофосфатов, найденное по колибровочному графику, мг/л;
50 - показатель приведения объема исследуемой воды к 50 мл;
V- объем исследуемой воды, взятый для определения, мл.
Содержание гидролизирующих полифосфатов (Х1), мг/л, определяют по формуле:
Х1=
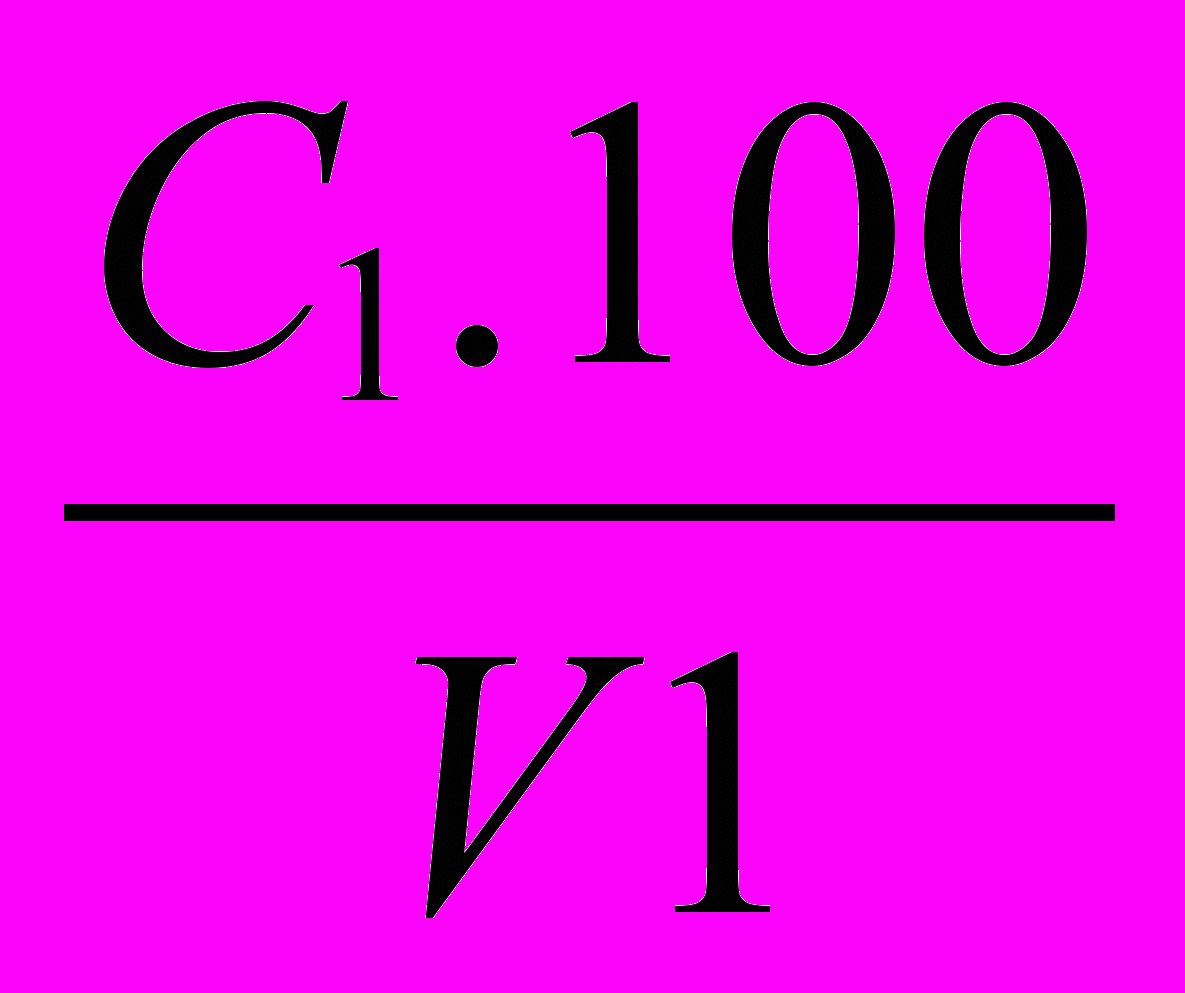 ,
,где: С1 - содержание полифосфатов, найденное по калибровочному графику, мг/л;
- - показатель приведения объема исследуемой воды к 100 мл;
V1 - объем исследуемой воды, взятый для определения, мл.
Работа 12. ЩЕЛОЧНОСТЬ.
Щелочность обуславливается суммой содержания в воде бикарбонатов, карбонатов и гидратов, а также и других солей слабых кислот, вступающих в реакцию с кислотой. Щелочность выражается в мг-экв/л.
Практически щелочность соответствует концентрации гидрокарбанатных ионов (HCO3), если в воде отсутствуют карбонаты (CO3). Концентрация гидрокарбонатных ионов в мг определяется умножением величины щелочности на эквивалентную массу HCO3 = 61.
Ход определения. К 100 мл испытуемой воды прибавляют 3-4 капли метилоранжа и титруют 0,1 н. раствором соляной кислоты до перехода окраски из желтой в слабо-розовую. Для контроля, чтобы уловить переход окраски, рядом ставят коническую колбу с той же пробой воды с добавлением в нее 3-4 капли метилоранжа.
Расчет делают по уравнению:
 ,
,где:
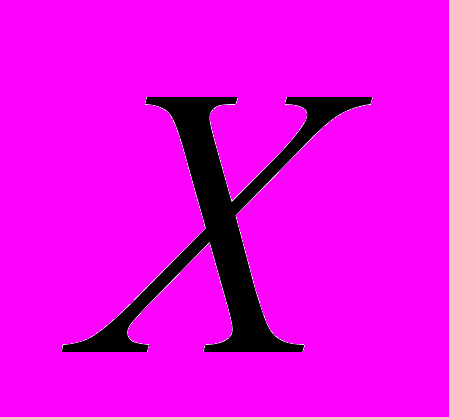 - величина щелочности воды, мг/эк.л
- величина щелочности воды, мг/эк.л - объем 0,1 Н кислоты, пошедшей на титрование
- объем 0,1 Н кислоты, пошедшей на титрование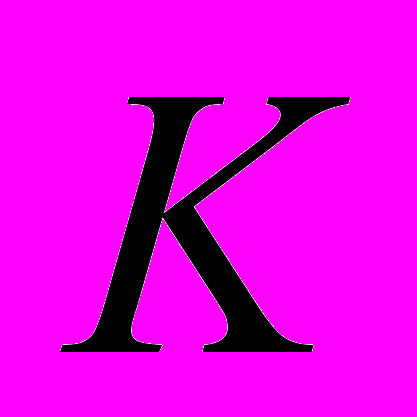 - поправочный коэффициент титра кислоты
- поправочный коэффициент титра кислоты1,04 - поправочный коэффициент на влияние углекислоты
В колбу наливают 10 мл фиксанала кислоты добавляют 2-3 капли метилоранжа и титруют 0,1 Н раствором кислоты
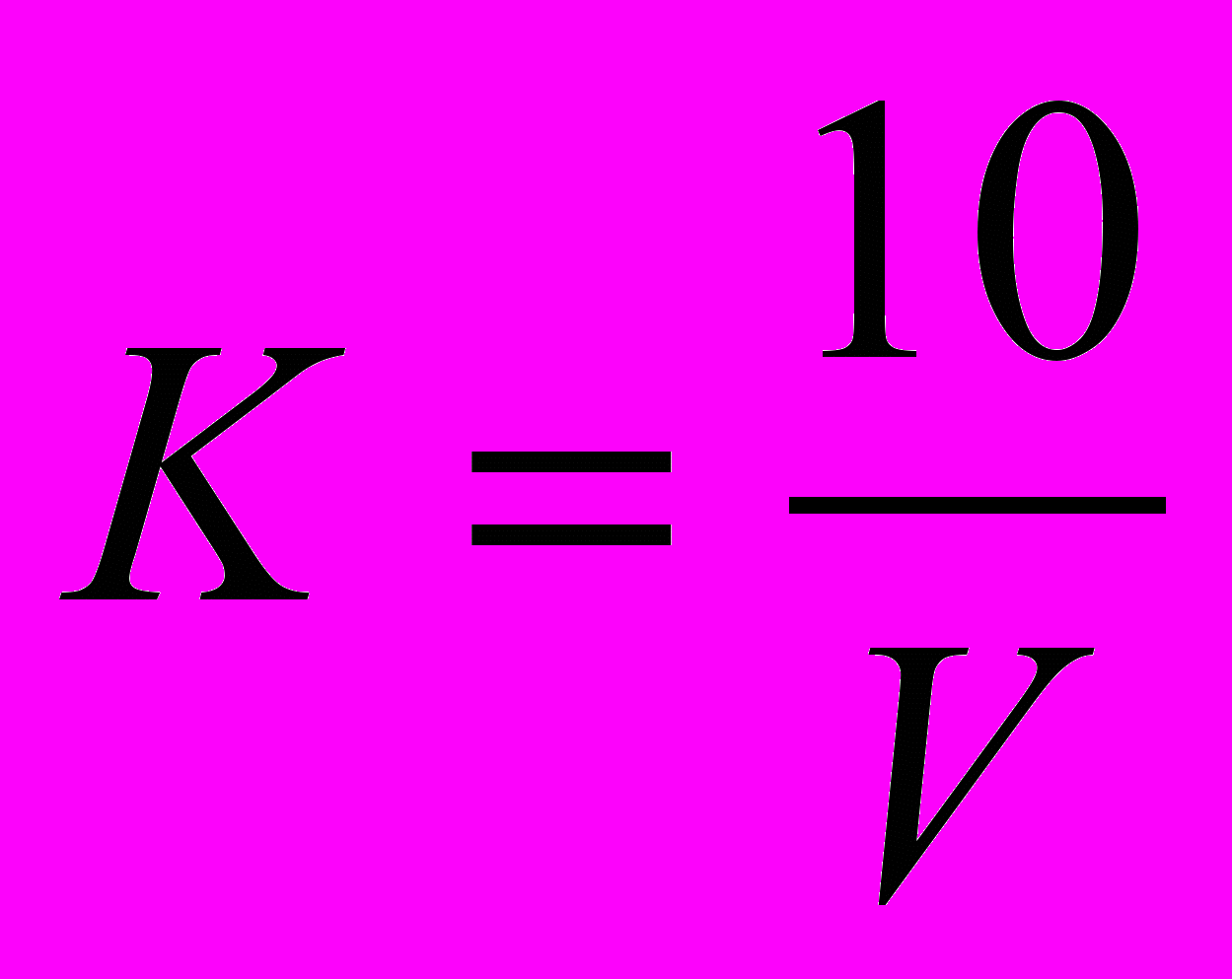 ,
,где: 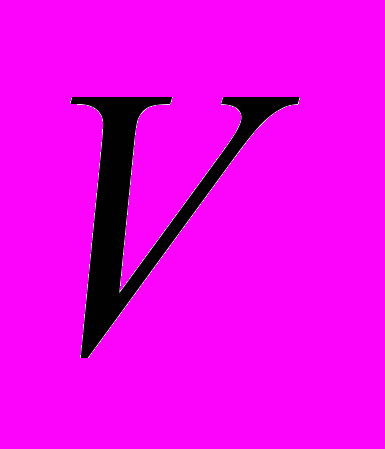 - объем 0,1 Н кислоты
- объем 0,1 Н кислоты
Реактивы:
0,1 Н солянная кислота.
- Смешанный индикатор.
Материалы и оборудование:
- Колбы емкостью 150-200 мл.
- Мерный цилиндр.
- Титратор.
- Пипетки.
Работа 13.ОПРЕДЕЛЕНИЕ рН
Принцип метода. Основан на измерении разности потенциалов, возникающих на границах между внешней поверхностью стеклянной мембраны электрода, например хлорсеребряного, называемого электродом сравнения, потенциал которого практически не зависит от ионов водорода рН в исследуемом растворе.
Нормы. По результатом метрологического исследования, при определении рН в пробах воды в диапазоне 2-10 суммарная погрешность не превышает 10%.
Материалы и оборудование:
- рН-метр миллвольтметр РНК-673, рН-673М
- Термометр лабораторный.
- Электрод стеклянный ЭСЛ-43-07.
- Электрод вспомогательный ЭВЛ-1МЗ.
- Колбы мерные 500 мл.
- Мешалка магнитная
Реактивы.
- Вода дистиллированная
- Калия хлорид, х. ч.
- Соляная кислота, раствор 0,1 моль/дмЗ, стандарт-титр
- Стандарт-титр "для рН-метрии" для приготовления образцовых буферных растворов.
Методика определения. Промывают электроды и перемешивающий стержень от электромагнитной мешалки дважды небольшим количеством исследуемой пробы воды, наливают в стакан исследуемую пробу, опускает электроды и включают электромагнитную мешалку. Через 5 минут снимают показания прибора.
Вычисление результатов измерений. Концентрацию ионов водорода с (моль/дмЗ) определяют по формуле:
с=10(-рН),
где с - концентрация иона водорода, моль/дмЗ;
рН - измеренное значение рН.
Концентрацию ионов водорода можно также найти из таблицы.
Таблица 10. Данные для пересчета значений рН в концентрацию ионов водорода
| рН | 0,00 | 0,01 | 0,02 | 0,03 | 0,04 | 0,05 | 0,06 | 0,07 | 0,08 | 0,09 |
| 0,0 | 1.00 | 0.98 | 0.96 | 0.93 | 0.91 | 0.89 | 0.87 | 0.85 | 0.83 | 0.81 |
| 0.1 | 0.79 | 0.77 | 0.76 | 0.74 | 0.73 | 0.71 | 0.69 | 0.68 | 0.66 | 0.65 |
| 0.2 | 0.63 | 0.62 | 0.60 | 0.58 | 0.58 | 0.56 | 0.55 | 0.54 | 0.53 | 0.51 |
| 0.3 | 0.50 | 0.49 | 0.48 | 0.47 | 0.46 | 0.45 | 0.44 | 0.43 | 0.42 | 0.41 |
| 0.4 | 0.40 | 0.39 | 0.38 | 0.37 | 0.36 | 0.36 | 0.35 | 0.34 | 0.33 | 0.32 |
| 0.5 | 0.31 | 0.31 | 0.30 | 0.30 | 0.29 | 0.28 | 0.28 | 0.27 | 0.26 | 0.26 |
| 0.6 | 0.25 | 0.25 | 0.24 | 0.23 | 0.23 | 0.22 | 0.22 | 0.21 | 0.21 | 0.20 |
| 0.7 | 0.20 | 0.20 | 0.19 | 0.19 | 0.18 | 0.18 | 0.17 | 0.17 | 0.17 | 0.16 |
| 0.8 | 0.16 | 0.16 | 0.15 | 0.15 | 0.15 | 0.14 | 0.14 | 0.14 | 0.13 | 0.13 |
| 0.9 | 0.13 | 0.12 | 0.12 | 0.12 | 0.12 | 0.11 | 0.11 | 0.11 | 0.11 | 0.10 |
ЛИТЕРАТУРА
Лурье Ю.Ю., Рыбников А.И. Химический анализ производственных сточных вод. М., "Химия", 1979.
Резников А.А., Муликовская Е.П. Методы анализа природных вод. М., "Недра", 1970.
Унифицированные методы исследования качества вод. Ч. 1. Методы химического анализа вод. Изд 2-е. М., СЭВ, 1974.
