Методические указания к лабораторно- практическим занятиям по курсу «Средства и методы мониторинга окружающей среды»
| Вид материала | Методические указания |
- Методические указания к лабораторно-практическим занятиям для студентов очного и заочного, 620.25kb.
- Методические указания по практическим занятиям По дисциплине Математические методы, 129.27kb.
- Методические указания к изучению курса и практическим занятиям для студентов спец., 914.85kb.
- Методические указания к лабораторно-практическим занятиям для студентов агрономического, 453.89kb.
- Методические указания по практическим работам По дисциплине, 193.22kb.
- Методические указания к практическим занятиям для студентов очной формы обучения специальности, 183.25kb.
- Методические указания для доаудиторной подготовки к практическим занятиям по эпидемиологии, 1893.8kb.
- Методические указания и задания к лабораторно-практическим занятиям Для студентов агробиологического, 833.58kb.
- Методические указания к практическим занятиям и индивидуальные домашние задачи по физике, 635.57kb.
- Методические указания к практическим занятиям для студентов экономических специальностей, 560.21kb.
Работа 3. ОПРЕДЕЛЕНИЕ ЦВЕТНОСТИ И ЗАПАХА ВОДЫ
Цветность воды.
Цветность, привкус и запах воды обуславливают некоторые ее химические и биологические особенности. Существенное влияние на эту группу показателей качества воды оказывают присутствие в ней гуминовых и дубильных веществ, белков, жиров, органических кислот и других соединений, входящих в состав животных и растительных организмов и являющихся их продуктами жизнедеятельности или распада.
Окраска воды, ее вкус и запах вызываются также присутствием соединений железа, марганца и др. минеральных солей.
Определение цветности питьевой воды. Принцип метода основан на визуальной оценке окраски 10-12 см столбика воды.
Материалы и оборудование :
- пробирки диаметрои 12-14 см
- измерительная линейка
- лист белой бумаги
Последовательность выполнения работы.
Чистую пробирку наполняют водой до 10-12 см и смотрят сверху на белом фоне.
Шкала оценки:
- бесцветная
- слабо-желтая;
- интенсивно-желтая;
- голубая;
- зеленовато-голубая.
Запах воды.
Принцип метода. запах оценивается по органолептическим впечатлениям без предварительной или с предварительной обработкой пробы. Интенсивность определяется разбавлением испытываемой воды до органолептического исчезновения. При наличии интенсивного запаха пробу воды разбавляют водой без запаха до различных концентраций (в 2 раза, в 5, в 10 и т.д.). В серии разбавленных проб устанавливают запах, описывают разведение, при котором он исчезает. Характер запаха оценивается по 5 бальной системе.
Материалы, оборудование и реактивы.
1.Сосуды для отбора пробы воды емкостью 2 л;
2. Колбы емкостью 200 – 300 мл;
3. Мерный цилиндр;
- Электроплита.
Ход выполнения работы.
Запах определяется при температуре 20о и 60о С. В колбу емкостью 250-300 мл наливают 100 мл воды отобранной пробы, закрывают пробкой и тщательно перемешивают вращательным движением в течение 1 минуты. Затем определяют вид запаха (табл. 1) и его интенсивность (табл. 2). Результаты записываются в рабочую тетрадь.
Если интенсивность запаха трудно установить, то пробу нагревают на водяной бане при температуре 60оС и определяют вид и его интенсивность (таблица 1 и 2).
Таблица 2. Классификация запаха воды
Вид запаха | Источники происхождения |
| камфора, гвоздика, лимон, лаванда |
| 2. Огуречный | |
| 3. Цветочный | |
| 4. Углеводородный | нефтепродукты |
| 5. Лекарственный | фенол и иодоформ |
| 6. Сернистый | сероводород |
| 7. Навозный | |
| 8. Травянистый | лежалая трава |
| 9. Затхлый | преющая солома |
| 10. Овощной | корни овощей |
| 11. Гнилостный | застоявшие сточные воды |
| 12. Болотный | |
| 13. Рыбный | |
| 14. Хлорный | свободный хлор |
| 15. Землистый | сырая земля |
| 16.Неопределенный | |
| 17. Химический | промышленные сточные воды |
| 18. Плесневой | сырой подвал |
| 19. Торфяной | торф |
Таблица 3. Шкала оценки интенсивности запаха воды
| Интенсивность запаха, балл | Характеристика | Проявление запаха |
| 0 | никакого запаха | отсутствие ощутимого запаха |
| 1 | очень слабый | запах не замечаемый потребителем, но обнаруживается специалистом |
| 2 | слабый запах | обнаруживается потребителем |
| 3 | заметный | вода неприятна для питья |
| 4 | отчетливый | |
Работа 4. ХИМИЧЕСКОЕ ПОТРЕБЛЕНИЕ КИСЛОРОДА (ОКИСЛЯЕМОСТЬ)
Окисляемостью называется величина, характеризующая общее содержание в воде примесей органической и неорганической природы реагирующих с сильными окислителями.
Величину окисляемости выражают количеством кислорода (мл), необходимого для окисления веществ, содержащихся в 1 л воды.
Источником атомарного кислорода служит перманганат или бихромат калия.
Перманганатную окисляемость определяют для оценки загрязненности воды органическими веществами, которые оказывают отрицательное воздействие на кислородный режим водных обьектов в течение длительного времени.
Принцип метода основан на количественном учете кислорода, расходуемого на окисление органических веществ. Источником атмосферного кислорода служит перманганат калия.
Материалы, оборудование и реактивы.
- Емкости для отбора пробы воды на 2 л.
- Колбы емкостью 200-250 мл.
- Мерный цилиндр 10 мл
- Электроплита
- Титрометр.
- Щавелевая кислота 0.01Н р-р
- Перманганат калия 0.01Н р-р
- Серная кислота разбавленная 1:3.
Ход выполнения работы.
В колбу на 200-250 мл берется 100 мл пробы воды и добавляется 5 мл H2SO4 (разб. 1:3). раствор помещают на электроплиту и нагревают до первых признаков кипения, затем колбу снимают, добавляют 10 мл р-ра KMnO4 и продолжают кипятить 10 минут. После этого колбу снимают и добавляют 10 мл раствора щавелевой кислоты. Жидкость обесцвечивается и титруется по каплям KMnO4 до слаборозового оттенка.
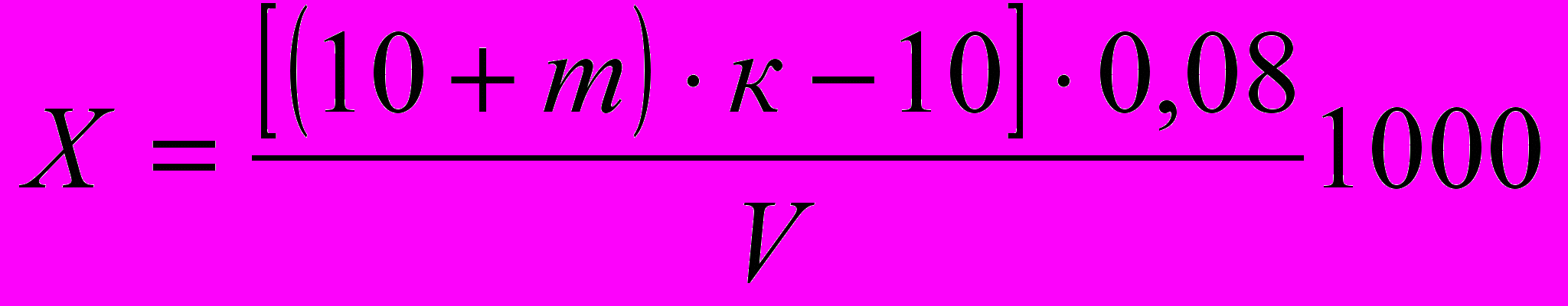 ,
,где: Х - окисляемость, мг/л
10 - количество раствора KMnO4 прилитого до кипячения, мл
m - количество раствора KMnO4 пошедшего на титрование, мл
к - коэффициент поправки. Его определяют добавлением в рабочий раствор 10 мл, 0,01H раствора щавелевой кислоты и титрованием KMnO4 до слаборозовой окраски. Снимаем показатель и делим его на 10.
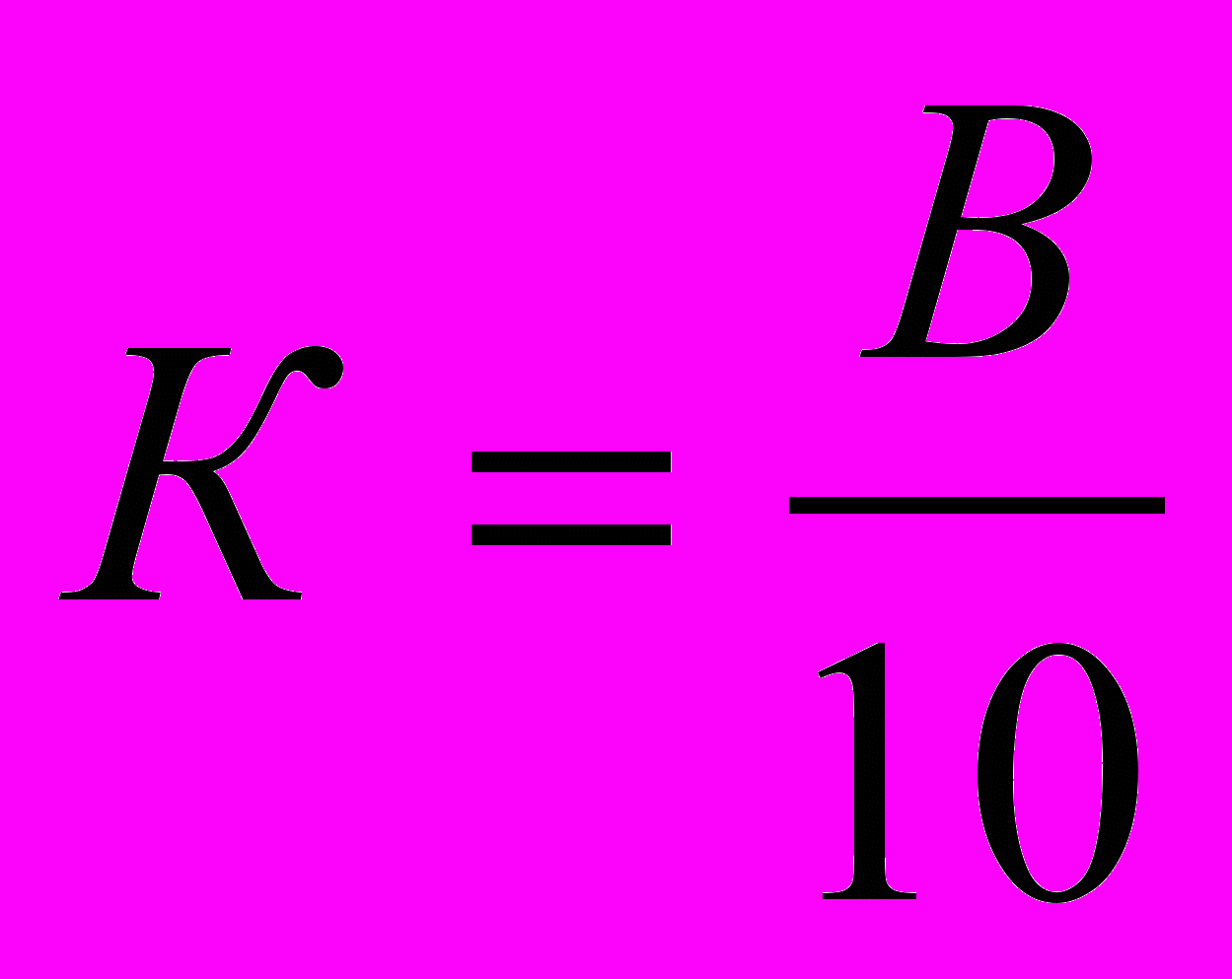
где: в- количество раствора KMnO4 пошедшего на титрование, мл.
10 - количество щавелевой кислоты, мл
0,08 – количество О2 выделяемого из 1 мл KMnO4, мл .
Полученные результаты сопоставляют со шкалой.
Шкала оценки расхода кислорода на окисление примесей.
Очень чистая до 1 мг/ л
Чистая 2 мг/ л
Умеренно грязная 3 мг/ л
Загрязнённая 4 мг/л
Грязная 5-15 мг/л
Очень грязная более 15 мг/л
Работа 5. ОПРЕДЕЛЕНИЕ РАСТВОРЕННОГО КИСЛОРОДА В ВОДЕ МЕТОДОМ ВИНКЛЕРА
Растворенный в воде кислород является одним из основных показателей оценки качества воды, по которому можно судить о главном режиме и санитарном состоянии водоема и водотока.
Принцип метода основан на окислении гидрата закиси марганца, образованного при реакции солей марганца со щелочью, растворенным в воде кислородом с образованием гидрата окиси марганца.
