Автореферат диссертации на соискание ученой степени кандидата
| Вид материала | Автореферат диссертации |
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание ученой степени кандидата, 1242.08kb.
- Автореферат диссертации на соискание ученой степени кандидата искусствоведения, 484.62kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- «Тобольская государственная социально-педагогическая академия им. Д. И. Менделеева», 345.4kb.
- Эволюция лирического героя в поэзии м. Турсун -заде, 1088.86kb.
- Автореферат диссертации на соискание ученой степени кандидата политических наук, 643.82kb.
На правах рукописи
СОЛОВЬЁВ Павел Валерьевич
ВЗАИМОСВЯЗЬ «СТРУКТУРА-СВОЙСТВО» НАНОКЛАСТЕРОВ d-МЕТАЛЛОВ И НЕКОТОРЫХ ВИДОВ ПОЛИМЕРОВ
Специальность
02.00.04. – физическая химия
АВТОРЕФЕРАТ
Диссертации на соискание ученой степени кандидата
химических наук
2009
Работа выполнена на кафедре физики Московского государственного университета печати.
| Научный руководитель: | доктор физико-математических наук, профессор ВАСИЛЬЕВА Людмила Юрьевна |
| Официальные оппоненты: | доктор химических наук, профессор ВИНОГРАДОВА Марина Геннадьевна |
| | кандидат физико-математических наук, доцент КРИВЕНКО Ирина Валерьевна |
| Ведущая организация: | МГТУ «СТАНКИН» - Московский государственный технологический университет «СТАНКИН» |
Защита состоится 12 ноября 2009 года в 15:30 часов на заседании диссертационного совета Д 212.263.02 по защите диссертации на соискание ученой степени кандидата химических наук в Тверском государственном университете по адресу: 170002 г. Тверь, Садовый пер. д. 35, ауд. 226.
С диссертацией можно ознакомиться в библиотеке Тверского государственного университета.
Автореферат разослан 12 октября 2009г.
Ученый секретарь
Диссертационного совета,
Кандидат химических наук, доцент Феофанова М.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность. Настоящая работа посвящена новому направлению современной науки – мезоскопической физике, которая изучает специфические свойства, закономерности поведения и применения мезоскопических объектов, к которым относятся нанокластеры (нанокомплексы), ансамбли наночастиц, наносистемы. Мезообъекты занимают промежуточную область между микроскопическими и макроскопическими масштабами, т.е. относятся к размерному диапазону от десятков до сотен нм. Область от одного нм до десятков нм занимают отдельные наночастицы и нанокластеры, в некоторых работах весь диапазон от одного нм до нескольких сотен нм относят к мезообъектам. Интересно, что некоторые вирусы имеют размеры порядка 10 нм, а многие молекулы белков, некоторых полимеров – несколько нм. Использование мезо- и нанообъектов привело к развитию новых технологий, открывающих фантастические возможности для человечества.
Мезо- и нанообъекты представляют собой практический и научно-исследовательский интерес. В настоящее время, например, широким фронтом проводятся работы по получению новых материалов со специфическими заданными свойствами путем внедрения наночастиц в структуру вещества. Эксперименты в этой области показывают зависимость физических свойств от размеров наночастиц и нанокластеров (нанокомплексов), но причины этой зависимости не выявлены, и не решен вопрос об универсальности этой зависимости. В последние годы широкое распространение в научной литературе получил термин «кластер» (комплекс), который подразумевает особое состояние вещества, промежуточное между отдельными молекулами и конденсированным состоянием.
Предполагается, что изучение нанокластерных систем может обнаружить новые фундаментальные свойства веществ. Кластеры (комплексы) рассматривают как стабильные системы, содержащие конечное число частиц, определяемые внутренними координатами, вдоль которых энергия диссоциации меньше, а равновесные расстояния больше, чем у молекул. Экспериментальные исследования показали, что свойства кластеров зависят от межмолекулярных взаимодействий и взаимодействия кластера с матрицей, от состояния поверхности. Особый интерес представляют бионанокластеры переходных металлов (d – металлов), которые участвуют во всех процессах жизнедеятельности. Специфические особенности структуры, свойств всех видов кластеров и функционирование бионаноклатеров привлекают внимание исследователей самых разных направлений и определяются, с одной стороны, квантовыми эффектами, а с другой стороны, волновыми свойствами перемещающихся электронов.
Необходимо также отметить, что за последние десять лет получили развитие новые нанонаправления: молекулярные нанотехнологии и биоинформатика, которые занимаются конструированием наномашин из белковых и полимерных фрагментов, решением молекулярно-биологических задач. Исследование функционирования биологически-активных нанокластеров дает возможность предполагать, что подобные системы в будущем могут использоваться как естественные наномашины.
Анализ исследований в этой области мезоскопической физики показал, что изучение нано- и мезообъектов требует комплексного подхода: применение методов математического и компьютерного моделирования, современных экспериментальных методов, например, методов СЗМ – сканирующей зондовой микроскопии. Подобный подход демонстрируется в настоящей работе.
Целью работы являлось исследование взаимосвязи структуры и функциональных свойств для бионанокластеров и некоторых видов полимеров с использованием двух подходов: квантово-химического и молекулярно графового для полимеров, экспериментальное исследование поверхности ансамблей бионанокластеров.
Для достижения поставленной цели были решены следующие задачи:
- моделирование электронной структуры активных центров на основе квантово-химических методов;
- анализ взаимосвязи структура-функциональные свойства на основе полученных моделей;
- отработка методик визуализации нанообъектов для экспериментального исследования;
- проведение экспериментального исследования поверхности ансамбля нанокомплексов на примере пероксидазы методом зондовой микроскопии;
- анализ современного состояния теоретико-графовых исследований взаимосвязи структура-свойство;
- проведение вычислительного эксперимента по расчету топологических индексов связанности ряда виниловых полимеров, используемых в качестве модельных объектов, и биополимеров;
- построение корреляционных зависимостей между топологическими индексами связанности и свойствами рассматриваемых соединений.
Методы исследования. Для моделирования электронной структуры активных центров используется комплекс теоретических подходов: квантово-химическая теория поля лигандов, теория симметрии и теория групп; для вычислительного эксперимента по изучению взаимосвязи «структура-свойство» полимеров – теоретико-графовый подход. Экспериментальные исследования поверхности бионанокластеров проводились методом СЗМ на примере пероксидазы.
Научная новизна работы заключается в следующем:
- впервые разработаны модели электронной структуры активных центров медь- и цинк содержащих бионанокластеров на основе теории поля лигандов, теории симметрии и теории групп;
- проведен анализ взаимосвязи «структура-функциональные свойства» на основе полученных моделей;
- проведена отработка методики визуализации исследуемых нанообъектов для использования метода СЗМ (сканирующей зондовой микроскопии);
- разработана модификация топологического метода Бицерано; топологических индексов для рассматриваемых видов полимеров;
- в результате вычислительного эксперимента показано, что полученные корреляционные зависимости являются четко выраженными корреляциями между топологическими индексами связанности;
- работу можно отнести к новому направлению конвергенции технологий, т.е. синергизму нанонауки, биотехнологии, информационных технологий.
Практическая значимость работы заключается в том, что полученные модели электронной структуры активных центров дают возможность выяснить взаимосвязь «структура-функциональные свойства», которая позволяет объяснить и выделить универсальность наномеханизма функционирования. Полученная информация может быть использована в наномедицине, в молекулярных нанотехнологиях при создании наномашин. Результаты исследования взаимосвязи «структура – свойство» для виниловых полимеров и биополимеров можно использовать для составления базы данных по аналогичным соединениям, для корреляции конкретных физико-химических свойств с топологическими индексами связанности.
Полученные в работе корреляционные зависимости позволяют с достаточной точностью предсказывать свойства полимеров, что очень важно для практического использования виниловых полимеров, являющихся основой для синтеза большого количества веществ с заранее заданными свойствами, различных пластмасс, клеев, строительных материалов. Кроме того, по своим конформационным особенностям виниловые полимеры напоминают строение белков и поэтому они были выбраны как модельные системы, что дало возможность провести вычислительный эксперимент для биополимеров.
Апробация работы. Результаты работы докладывались и обсуждались на следующих научных конференциях:
1-4. Междисциплинарных научных конференциях «Идеи синергетики в естественных науках» - вторые, третьи, четвертые и пятые юбилейные Курдюмовские чтения. Тверь, 2006, 2007, 2008 и 2009 г.
5. Третья Международная конференция ИНТЕРНАС’07 «Актуальные проблемы современного естествознания», Калуга, 2007 г.
6. 14-я Международная научная конференция «Математика. Компьютер. Образование.», Пущино, 2007.
7. Международная научная конференция «Моделирование нелинейных процессов и систем», Москва, 2008.
8. 15-я Международная научная конференция «Математика. Компьютер. Образование.» Пущино, 2009.
Публикации по теме диссертации. Опубликовано 7 работ, в том числе четыре публикации – материалы международной, междисциплинарной конференции «Идеи синергетики в естественных науках», одно учебное пособие, две работы в центральной печати.
Структура и объем работы. Диссертация состоит из 5 глав, заключения, списка литературы. Содержание диссертации изложено на 115 листах машинописного текста и включает 40 рисунок и 10 таблиц.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность темы диссертации, сформулированы основные цели и задачи, методы исследования, а также показана научная новизна, практическая значимость и перспективное применение результатов исследования. Приведена структура диссертационной работы.
В первой главе «Анализ методов моделирования электронной структуры активных центров нанокластеров и исследования взаимосвязи «структура-свойство» полимеров проводится анализ теоретических методов, используемых при моделировании электронной структуры активных центров бионанокластеров. Метод валентных связей (ВС) дает возможность выяснить механизм образования координационных связей нанокластеров, содержащих ионы d – металла: центральный ион d-металла предоставляет на связь вакантные орбитали – гибридизированные орбитали (ГО, например, d2sp3 гибридизация для исследуемых в работе объектов), а лиганды – неподеленные пары электронов. Метод ВС не дает количественных оценок, но с его помощью можно прогнозировать возможное строение комплекса, при моделировании оценить варианты возможных структур.
Теория кристаллического поля (ТКП) основана на электростатическом подходе к комплексным соединениям. Рассматривается электростатическое взаимодействие между центральным ионом и лигандами, но при этом учитываются только атомные орбитали (АО) центрального иона, их расщепление в пространстве, структура лигандов не учитывается, они являются только источниками внешнего электрического поля, вызывающего расщепление d – уровня. Применение метода молекулярных орбиталей (МО) к многоатомным комплексным соединениям и обобщенных представлений ТКП в квантовой химии получило название теории поля лигандов (ТПЛ). Комплекс рассматривается как единое целое, т.е. учитывается электронная структура всех входящих в комплекс составляющих частиц. В методе МО молекулярная орбиталь комплекса выражается в приближении ЛКАО (линейная комбинация атомных орбиталей). Полученная таким образом волновая функция вводится в стационарное уравнение Шредингера, точное решение которого крайне сложно в вычислительном отношении. Применение полуэмпирических методов не дает точного решения. В теории электронного строения и свойств координационных соединений большое значение имеют представления о симметрии, наиболее полное описание которой достигается с помощью математической теории групп. В квантово-химических исследованиях применение теории групп оказалось возможным в связи со свойствами симметрии атомных и молекулярных систем, состояние которых описывается волновыми функциями, удовлетворяющими стационарному уравнению Шредингера. Теория симметрии позволяет все атомные функции системы группировать по симметрии, соответствующим определенным типам симметрии неприводимым представлениям (НП), что значительно упрощает секулярное уравнение
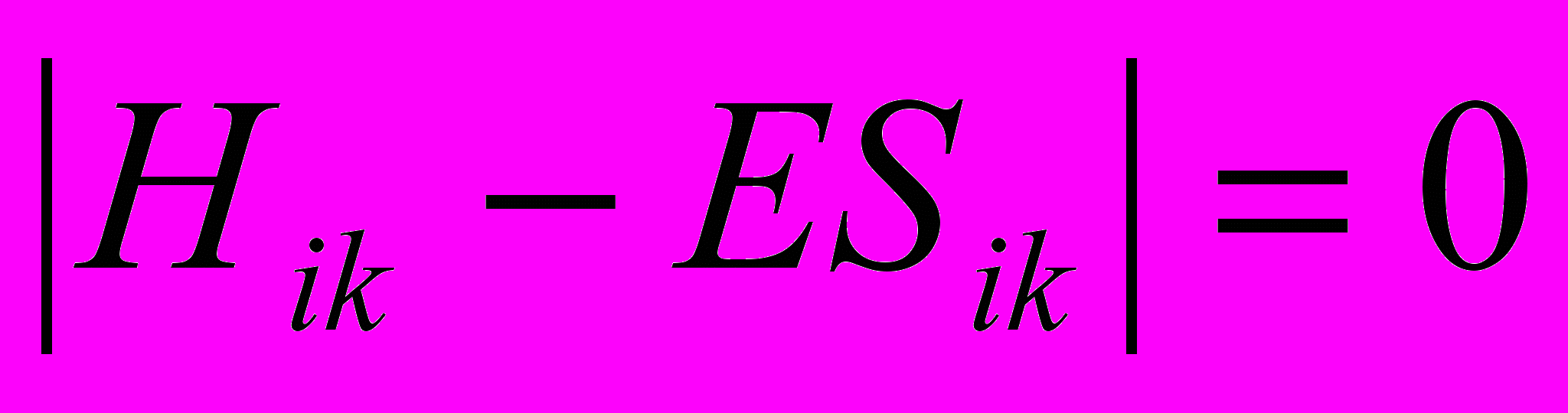 . Применение теории групп в квантовой химии основано на том, что каждому энергетическому терму комплекса (МО комплекса) соответствует одно из неприводимых представлений (НП) ее группы симметрии. Например, для комплекса, обладающего симметрией группы Oh (октаэдрическая группа симметрии, характерная для многих d – металлосодержащих ферментов), реализуются следующие типы энергетических термов: невырожденные A1g, A1u, A2g, A2u, двукратно вырожденные Eg, Eu, трехкратно вырожденные – T1g, T2g, T1u, T2u. Индексы g и u у символа НП указывают на то, меняет ли волновая функция знак (u) или нет (g) при операции инверсии, а индексы 1 и 2 указывают на то, меняет ли знак волновая функция (1) или нет (2) при других операциях симметрии. При моделировании электронной структуры активных центров биологически-активных нанокластеров использовался алгоритм моделирования, разработанный Васильевой Л.Ю. и используемый в работах Романовой Е.Ю.
. Применение теории групп в квантовой химии основано на том, что каждому энергетическому терму комплекса (МО комплекса) соответствует одно из неприводимых представлений (НП) ее группы симметрии. Например, для комплекса, обладающего симметрией группы Oh (октаэдрическая группа симметрии, характерная для многих d – металлосодержащих ферментов), реализуются следующие типы энергетических термов: невырожденные A1g, A1u, A2g, A2u, двукратно вырожденные Eg, Eu, трехкратно вырожденные – T1g, T2g, T1u, T2u. Индексы g и u у символа НП указывают на то, меняет ли волновая функция знак (u) или нет (g) при операции инверсии, а индексы 1 и 2 указывают на то, меняет ли знак волновая функция (1) или нет (2) при других операциях симметрии. При моделировании электронной структуры активных центров биологически-активных нанокластеров использовался алгоритм моделирования, разработанный Васильевой Л.Ю. и используемый в работах Романовой Е.Ю. Исследования взаимосвязи «структура-свойство» дает информацию о строении молекул, о механизме возникновения и проявления различных свойств, может быть использована для прогнозирования свойств при синтезировании новых соединений. Для мезообъектов, состоящих из тысяч атомов, в настоящее время используются формальные методы, основанные на анализе структурной формулы вещества. Большое распространение получил топологический метод, основанный на теории графов, в котором структурная формула молекулы эквивалентна соответствующему ей молекулярному графу. Количественные корреляции структура-свойство строятся с помощью инвариантов графа, названных топологическими индексами (ТИ). Методы установления количественных соотношений между структурой и свойствами соединений выделились в самостоятельное научное направление, обозначаемое в литературе QSPR/QSAR (Quantitative Structure – Property Relationship/Quantitative Structure Activity Relationships). Особое место в этих методах занимают способы описания структуры молекулы. Структурная формула содержит информацию о том, каким образом атомы связаны между собой. Задание координат ядер атомов в пространстве позволяет строить трехмерные модели молекул. Независимые переменные, характеризующие структурные особенности соединений, называются межмолекулярными дескрипторами (МД). В настоящее время в литературе применяются дескрипторы различных типов, которые рассматриваются в главе.
Топологические индексы рассчитываются непосредственно из структурной формулы соединений, в случае дескрипторов электронной структуры, молекулярной формы и межмолекулярных взаимодействий требуются компьютерные программы. Источниками топологических индексов являются матрицы молекулярного графа. Используются различные алгоритмы вычисления топологических индексов по заданной матрице. Процедура построения корреляционных зависимостей «структура-свойство» включает в себя выбор топологических индексов и выбор вида функциональной зависимости между свойством и ТИ.
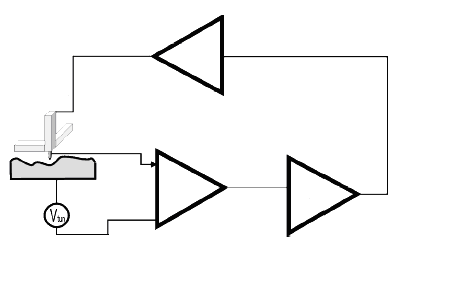
Во второй главе «Экспериментальное исследование поверхности ансамблей бионанокластеров» рассматривается применение метода СЗМ. Приводится обзор по различным типам зондовых микроскопов, режимам их работы, схемы и устройство 2-х основных типов микроскопов – СТМ (Сканирующий туннельный микроскоп), АСМ (Атомно-силовой микроскоп).
УВВ
УТТ
интегратор
Itun
X
Z
Y
Рис.1. Упрощенная схема туннельного микроскопа. УТТ – усилитель туннельного тока, УВВ – высоковольтный усилитель.
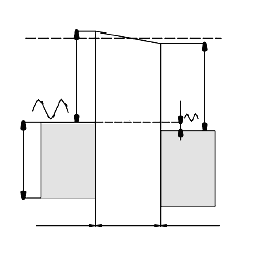
Принцип действия любого туннельного микроскопа основан на квантово-химическом принципе туннелирования через энергетический барьер системы «зонд-поверхность исследуемого образца». Наглядно этот эффект легко представить, используя представления статистической физики (распределение Ферми-Дирака). Если все квантовые состояния с энергией Е полностью заполнены электронами, система состоит из нескольких подсистем, то уровни Ферми совпадают для каждой из подсистем. Если к системе приложить разность потенциалов, то уровень Ферми одной подсистемы повышается, а второй понижается, рис. 2.
φ1
Положение
уровня
Ферми
Уровень
вакуума
eV
φ2
металл
диэлектрик
металл
μ
Рис. 2. Положение уровней Ферми для системы металл-диэлектрик-металл.
Таким образом, в качестве одного из электродов выступает исследуемый образец, который должен быть проводящим (металл, полупроводник, тонкая туннельно – прозрачная пленка диэлектрика на поверхности проводника, материал с большой поверхностной плотностью заряда и т.п.). В качестве другого электрода используется – игла туннельного микроскопа (зонд), заточенный в идеале до 1-го атома на кончике, обычно изготавливаемый из вольфрама, платины и ее сплавов. Зонд за счет манипуляторов подходит к поверхности исследуемого образца на такое расстояние, что между поверхностью образца и зондом возникает туннельный ток, обусловленный просачиванием электронов с зонда на поверхность образца через воздушный зазор.
Сканирование образцов проводится двумя методами: режим сканирования при постоянном токе (I=const) и изменении расстояния зонда от поверхности сканирования, при фиксированной высоте зонда над поверхностью и, соответственно, изменении туннельного тока. В режиме постоянного тока поддерживается постоянным туннельный барьер. В режиме постоянной высоты меняется расстояние зонда от поверхности, что вызывает изменение туннельного тока.
Как уже отмечалось, при исследованиях на туннельном микроскопе поверхность образца должна быть проводящей. В случае, если исследуемое вещество является диэлектриком, для его изучения используется атомно-силовой микроскоп (АСМ). Принцип действия АСМ основан на фиксации сил, возникающих между зондом и поверхностью образца (силы отталкивания электронных оболочек атомов зонда и поверхности, силы Ван-дер-Ваальса).
Приводится обзор по результатам применения АСМ и СТМ для визуального и электрохимического исследования поверхности различных образцов. В обзоре акцент делается на использование СТМ и АСМ для получения поверхностных физико-химических свойств бионанокластеров. Были найдены экспериментальные методики исследования поверхности белков, молекул ДНК, реализованные на базе компании НТМДТ. Анализ показал, что для исследования поверхностей биообъектов не выявлено универсального механизма визуализации и получения физико-химических характеристик поверхностей бионанокластеров.
Использование методов АСМ и СТМ открывают перед экспериментатором широкие возможности для углубления в структуру исследуемого соединения. Получаемый массив данных, как правило, обрабатывается с помощью компьютерной программы, поставляемой в комплекте с оборудованием. Принцип обработки основан на фильтрации данных, устранении внешних «шумов», комбинации режимов сканирования.
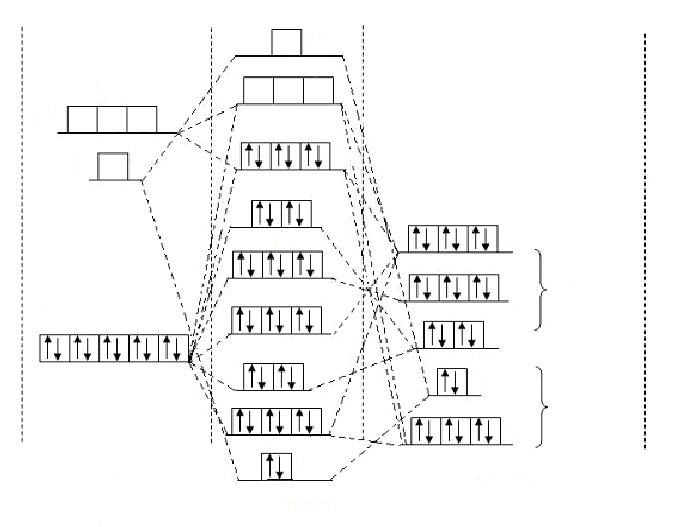
В третьей главе «Обсуждение моделей структуры активных центров некоторых бионанокластеров и экспериментального исследования поверхности их ансамблей» приводятся квантово - химические модели электронной структуры активных центров ферментов с центральными ионами Zn(II), Cu(II), Cu(I). Модели электронной структуры активных центров дают возможность выявить взаимосвязь «структура-функциональные свойства» и наномеханизм функционирования активных центров.
Специфической особенностью подобных соединений является то, что они проявляют как каталитические, так и чисто ферментативные функциональные свойства. Примерами медьсодержащих соединений являются гемоцианин, церулоплазмин, тирозиназа, лактазы, оксидазы. Церулоплазмин обнаружен в плазме человека и животных, его функции разнообразны: фермент служит регулятором баланса меди в организме, катализирует окисление ионов двухвалентного железа в трехвалентное (ферроксидазная активность), участвует в синтезе гемоглобина, образовании трансферрина. Оксидазная активность церулоплазмина обусловлена способностью ионов Cu(II) обратимо восстанавливать и окислять. Ионы Сu(II) определяют интенсивную синюю окраску церулоплазмина, который полностью обесцвечивается под действием восстановителей. Церулоплазмин – это единственный фермент, который катализирует окисление полиаминов в плазме. Гемоцианины обнаружены в крови членистоногих, моллюсков. В гемоцианине два иона меди связываются с одной молекулой кислорода, белок окрашен в голубой цвет. Гемоцианины обратимо взаимодействуют с окисью углерода, образуя бесцветные соединения, физиологические функции гемоцианина связаны с транспортом кислорода (аналогия с гемоглобином). Гемоцианины при связывании с кислородом демонстрируют кооперативный эффект, конформация белка в целом стабилизирует активные центры. Тирозиназа – необходимый для организма фермент, катализирующий окисление аминокислоты тирозина, которое сопровождается образованием пигмента – меланина. Лактазы – медьсодержащие ферменты, эффективно окисляющие кислород воды в биомолекулярный кислород.
Для медьсодержащих соединений характерно разнообразие структуры активных центров: тетраэдр, октаэдр, плоский квадрат, причем наблюдается три типа октаэдров: [MX6], [MX5Y], [MX4Y2].
На рис.3 представлена модель электронной структуры функциональных молекулярных орбиталей (МО) для активных центров различной симметрии, содержащих ион Cu(II). Необходимо отметить, что тетраэдр не имеет центра инверсии и его термы не обладают симметрией (g) или антисимметрией (u), поэтому опускаются индексы g и uу символов (НП).
3d9
t*2
dxy
dxz dyz
e*
dz2 dx2-y2
e*
dz2 dx2-y2
t*2g
dxy dxz dyz
b1
dx2-y2
dx2-y2
dx2-y2
dz2
dz2
dz2
b2
dxy
dxy
dxy
dxz dyz
dxz dyz
dxz dyz
e
eg
eg
a1g
a1
b2g
b2g
a1g
b1g
b1g
АО
ц.и. Cu(II)
d9
MX4
T4
тетраэдр
MX5
Oh
MX5Y
MX4Y2
(транс)
октаэдр
MX4
D4h
плоский квадрат
z
x
y
1
3
4
2
z
x
y
1
4
3
5
2
6
x
y
z
Рис. 3. Квантово-химическая модель функциональных МО активного центра, содержащего ион Cu(II).
По симметрийным и энергетическим соображениям можно предположить, что неспаренные электроны при различной симметрии медьсодержащего активного центра определяют его функциональные ферментативные свойства. Электроны взаимодействующих веществ (субстратов) могут поступать на
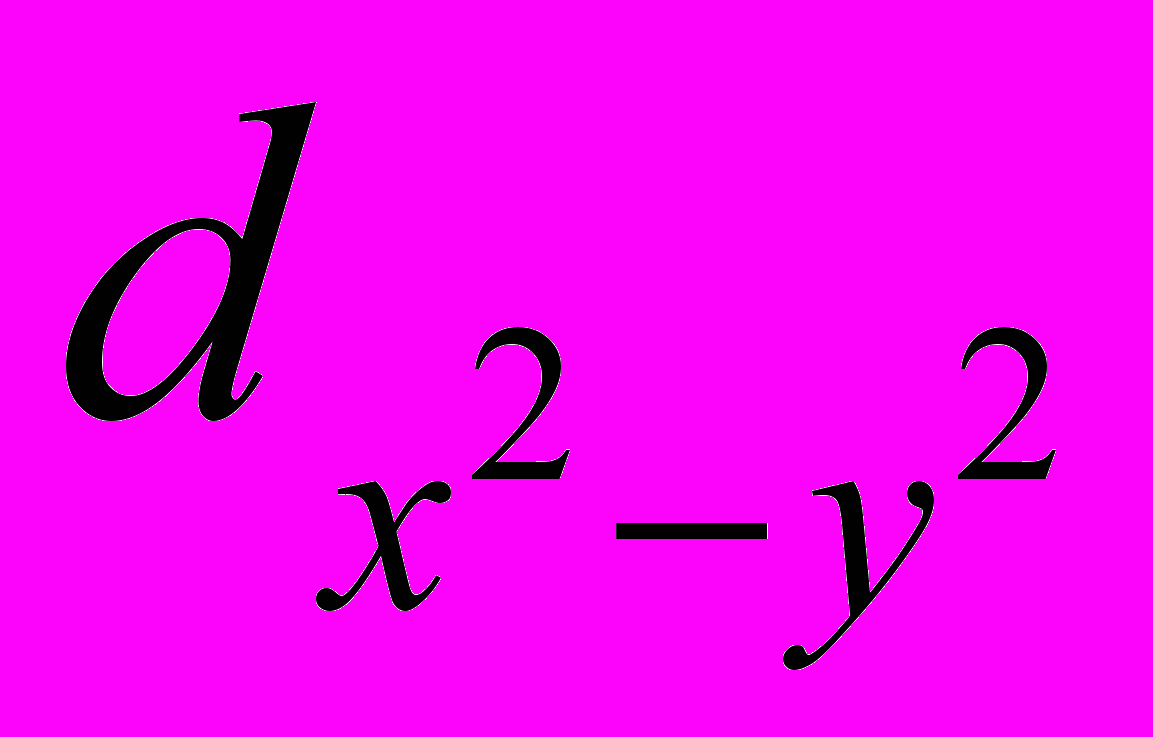 - орбиталь для структуры октаэдра и плоского квадрата или t*2 в случае тетраэдра. Таким образом, Cu(II) – содержащие соединения функционируют, в основном, как ферменты (лактазы, церулоплазмин). Модель показывает, что для функционирования необходима соответствующая стереохимия активного центра, ион металла определяет специфическую ориентацию фермента и субстрата. Белковый матрикс обеспечивает разнообразие симметрий активного центра, необходимые конформации, предотвращая его разрушение.
- орбиталь для структуры октаэдра и плоского квадрата или t*2 в случае тетраэдра. Таким образом, Cu(II) – содержащие соединения функционируют, в основном, как ферменты (лактазы, церулоплазмин). Модель показывает, что для функционирования необходима соответствующая стереохимия активного центра, ион металла определяет специфическую ориентацию фермента и субстрата. Белковый матрикс обеспечивает разнообразие симметрий активного центра, необходимые конформации, предотвращая его разрушение. Каталитические свойства Cu(II) – содержащих соединений (так же как и Zn(II) – содержащих) определяются тем, что центральный ион оттягивает электрон от углеродного атома карбоксильной группы.
Особый интерес представляет гемоцианин, содержащий два иона Cu(I) (d10), обеспечивающих его каталитическую активность. Модель активного центра гемоцианинов аналогична модели Zn(II)-содержащего активного центра, представленной на рис. 4. Аналогия определяется однотипной электронной конфигурацией центрального иона – (d10) и, соответственно, тетраэдрической структурой, второй ион Cu(I) можно рассматривать как лиганд первого иона Cu(I).
Из цинксодержащих биологически-активных соединений наиболее известными являются карбоксипептидазы и карбоангидразы. Карбоксипептидазы А и В (КПА, КПВ) образуются при гидролизе трипсином соответствующих прокарбоксипептидазных предшественников, синтезируемых в поджелудочной железе. Методом рентгеноструктурного анализа было определено, что активный центр КПА содержит следующие лиганды: His-69, His-196, Glu-72, донорные атомы – два имидазных атома азота, один карбоксильный атом кислорода из карбоксильной группы глютаминовой боковой цепи и один атом кислорода молекулы Н2О. В комплексах с аминокислотами и пептидами центральный ион Zn(II) имеет координационное число равное четырем, что соответствует тетраэдрическому комплексу. Активный центр занимает четверть молекулы фермента, погружен в белковый карман, имеется также канал связывания с субстратом и прилегающие области. Было выяснено, что связь Zn(II) – пептидный кислород не стабилизирована хелатообразованием (как в случае с медьсодержащими комплексами), следовательно, эта связь должна стабилизироваться другим образом. Можно предположить, что роль стабилизатора структуры активного центра могут выполнять связанные молекулы H2O, обнаруженные вблизи активного центра. Было, также, обнаружено, что координация иона металла в КПА с атомом кислорода карбоксильной группы субстрата определяет поляризацию связи С=О, эффект поляризации усиливается карбоксильной группой Glu-270. КПВ является аналогом КПА или, точнее ее структурным гомологом. Предполагается, что отличие КПВ от КПА заключается в неодинаковости третичной структуры. Карбоксипептидазы взаимодействуют с большим количеством субстратов: пептидами, ациламинокислотами, сложными эфирами, ингибиторами.
Карбоангидраза широко распространена в растениях, животных, бактериях. Физиологическая роль – быстрая гидратация метаболического СО2, образующегося в тканях, дегидратация НСО-3 в органах секреции. Различают две формы: карбоангидраза В (КАВ) и карбоангидраза С (КАС), различающиеся по аминокислотному составу и активности. Рентгеноструктурный анализ показал интересную картину: фермент включает обширную структуру полипептидной цепи β – спиральных участков в конформации типа «плиссированной простыни», делящий молекулу на две половины. Активный центр с центральным ионом Zn(II) находится в большой гидрофобной полости, расположенной между β – спиралями и шестью полипептидными последовательностями.
Центральный ион Zn(II) активного центра имеет три лиганда – атомы азота от имидазольных колец гистидина – 93, - 95, - 117. Четвертый лиганд – молекула Н2О. Лиганды предоставляют на связь неподеленные пары электронов. В процессах гидратации – дегидратации ион Zn(II) взаимодействует с субстратом через молекулу Н2О.
t2
4p
4s
a1
3d
АО ц.и.
Zn(II) d10
МО комплекса
тетраэдр
АО лигандов
a*
t*2
t*2
e*
t1
t'2
e
t2
a1
t2
t1
e
a1
t2
π
σ
Рис. 4. Квантово-химическая модель активного центра с центральным ионом Zn(II).
На рис. 4 представлена модель Zn(II) – содержащих соединений, функционирование которых также проявляется в двух планах: ферментативном и каталитическом, что объясняется специфичностью электронной конфигурации иона Zn(II) – d10. Кроме того, особенность Zn(II) – содержащих активных центров определяется: 1) включением молекулы воды в координационную сферу центрального иона; 2) наличием второй молекулы Н2О вблизи активного центра; 3) присутствием 8-9 молекул Н2О вблизи молекулы фермента, которые, скорее всего, выполняют роль матрикса, обеспечивающего кооперативность, сохранение структуры активного центра на различных этапах его функционирования. Ион Zn(II) оказывает поляризующее влияние на атом кислорода в молекуле воды, в результате чего уменьшается прочность связи О-Н координированной молекулы Н2О, т.е. при физиологических значениях рН возможно образование гидроксильного иона. Молекула субстрата СО2 не связывается непосредственно с ионом Zn(II) в активном центре, располагается вблизи него и атакуется координированным гидроксильным ионом. Ион Zn(II) определяет необходимую ориентацию фермента и субстрата. Специфичность Zn(II) – содержащих соединений объясняется тем, что все функциональные орбитали МО комплекса t*2 и e* заняты неподеленными парами электронов.
В заключение можно отметить, что модели электронной структуры функциональных орбиталей в Cu(II) и Zn(II) – содержащих комплексах демонстрируют корреляцию функциональных свойств металлосодержащих соединений и электронной структуры центральных ионов, т.е., другими словами, наноструктура определяет функциональные свойства мезоструктуры.
Размеры активных центров металлоферментов составляют десятки нм. Метод СЗМ позволяет экспериментально обнаружить и измерить некоторые характеристики ансамблей активных центров металлоферментов на поверхности подложки.
Экспериментальное исследование поверхности ансамблей бионанокластеров проводилось методом СЗМ. Одной из наиболее сложных задач в СЗМ является визуализация макромолекул. Размеры макромолекул находятся в пределах от 1 нм до 100 мкм. Кроме того, нельзя, как в случае микробиологических объектов, выделить какое-то одно, общее для всех объектов этого класса свойство, позволяющее обеспечить их уверенную визуализацию. При визуализации макромолекулярных комплексов и агрегатов, как правило, требуется получение данных об их макроскопическом поведении и ориентации комплекса, а также о его структуре. К тому же, подобные объекты требуют высокого разрешения. Даже в том случае, когда макромолекулы прочно фиксированы на подложке, их большие размеры, тепловая и индуцируемая зондом подвижность приводят к потере разрешения.
Можно использовать несколько методов нанесения исследуемого образца на подложку для биосистем. Все предлагаемые методики делятся на две группы: методики, связанные с предварительной обработкой поверхности подложки и методики простого нанесения вещества на подложку.
- Нанесение вещества на поверхность свежесколотой слюды из буфера, содержащего двухвалентные ионы, при этом необходимо присутствие ионов Mg2+, которые упрочняют взаимосвязь объекта со слюдой. Однако, хорошее качество таких изображений получается при низкой влажности.
- Увеличение позиционной стабильности молекулы достигается нанесением тонкого слоя платины с углеродом на поверхности скола слюды с адсорбированной на ней макромолекулой. Напыление слоя платины и углерода толщиной 5 нм достаточно для получения стабильных изображений.
- Усиление связи с подложкой достигается изменением свойств, за счет предварительного напыления 0,5 нм слоя углерода. Такая предварительная обработка дает возможность наносить исследуемое вещество на подложку даже в отсутствии ионов магния.
- При нанесении фермента на «чистую» подложку в первую очередь надо обратить внимание на то, что она должна быть гидрофильной (например, слюда), тогда фермент связывается с ней за счет сил электростатического притяжения. Затем подложку с ферментом высушивают.
Экспериментальное исследование ансамблей бионанокластеров металлоферментов проводили на микроскопах СММ-2000 и СТМ, сканирование осуществлялось в режиме Z (h)-const, значении тока I~10 нА, при нормальных условиях.
Раствор пероксидазы льна наносили капельным методом на слюду, затем высушивали в струе воздуха.
Типичный результат сканирования ансамблей бионанокластеров пероксидазы, полученный на периферии и в центре подложки представлен на рисунках 5 и 6.

Рис. 5. Трехмерное изображение поверхности ансамблей бионанокомплексов пероксидазы в водном растворе, полученное с помощью СТМ (на периферии).
Размер кадра области сканирования на краю подложки составляет 1,02х1,02 мкм. Наблюдаемая максимальная высота выступов над поверхностью подложки составляет 0,25 мкм.
Изображение пероксидазы получено после медианного сглаживания с боковой подсветкой. На изображении четко видно, что бионанокластеры пероксидазы образуют нитевидную структуру на поверхности подложки.

Рис.6. Трехмерное изображение поверхности ансамблей пероксидазы в водном растворе, полученное с помощью СТМ (в центре).
Область сканирования в центре подложки составляет, как и на первом изображении, 0,13х0,13 мкм. Наблюдаемая максимальная высота выступов над поверхностью составляет 0,25 мкм. Изображение получено при сканировании пероксидазы в центре подложки.
Сравнивая поверхностные характеристики ансамблей пероксидазы льна в разных местах нанесения (центр и край образца) можно сделать вывод о расположении наночастиц на поверхности, а также о влиянии подложки на образец.
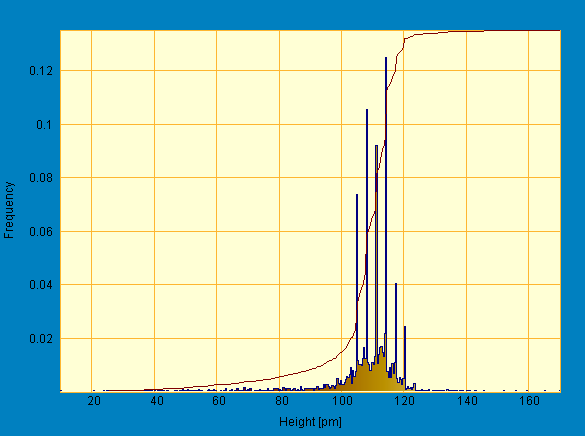
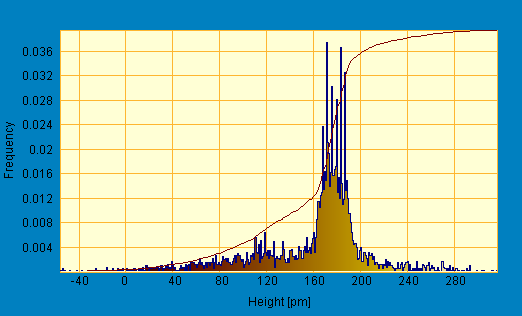
Одной из качественных характеристик поверхности является зависимость линейных размеров частиц от их высоты (профиль) и распределение частиц по размерам (гистограмма). Данные получены с помощью обработки результатов сканирования на СТМ образцов пероксидазы программой SPIP (The Scanning Probe Image Processor). Полученные гистограммы представлены на рис. 7:
а
б
Рис. 7. Гистограмма ансамблей пероксидазы. а - центр исследуемого образца; б - край исследуемого образца
Из представленных графических зависимостей видно, что длина большинства частиц (кластеров) составляет 160-200 пм (а) и 100-120 пм (б)
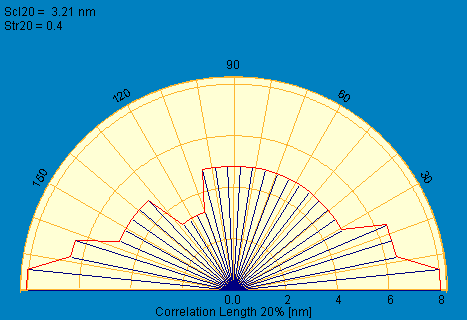
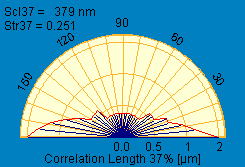
(а) (б)
Рис. 8. Зависимость длины от высоты (а – в центре образца; б – на периферии образца). Зависимость – положительна. Коэффициент зависимости Scl (шероховатость поверхности) а- 379 нм, б – 321 нм.
На основании полученных данных видно компактное расположение нитей фермента, однако, их высота в центре на 0,2 мкм меньше чем на периферии. Фермент при нанесении на подложку как бы «стекал» из центра на периферию.
Для качественного выяснения распределения ансамблей пероксидазы снимались вольт-амперные характеристики (ВАХ). Снятие характеристик (получение туннельного спектра) проводилось по всей поверхности образца с разрывом петли обратной связи. Игла при этом касалась поверхности и высота иглы не фиксировалась.
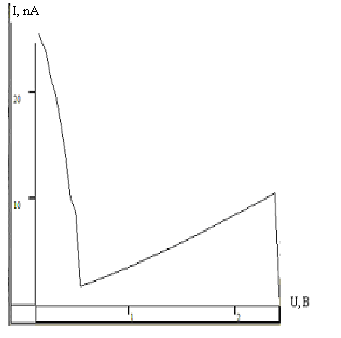
Рис.9. ВАХ полученная на туннельном микроскопе СТМ, в центре подложки.
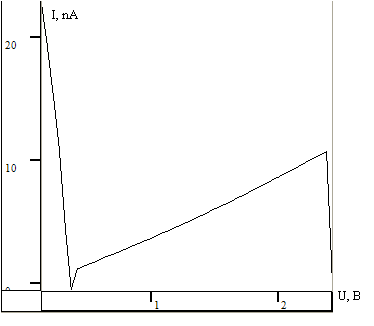
Рис.10. ВАХ полученная на туннельном микроскопе СТМ на периферии подложки.
Полученные вольт-амперные характеристики имеют нелинейный характер I=f(U), изменялось напряжение. Вследствие изменения расстояния зонда над поверхностью менялся туннельный ток. На графиках четко прослеживается, что уровень падения тока разный: в центре уровень падения выше, на краю ток падает до нуля. Результаты подтверждают картину распределения ансамблей пероксидазы на гистограммах (рис. 7 и 8). Поскольку, как отмечалось выше, поверхность образца в методе СТМ должна быть проводящей, по характеру полученных зависимостей можно предположить, что ансамбли пероксидазы обладают полупроводниковыми свойствами.
В заключении можно сделать следующие выводы: 1) ВАХ ансамблей пероксидазы имеет полупроводниковый характер; 2) распределение частиц пероксидазы на подложке по размерам происходит самоорганизованно.
