Автореферат диссертации на соискание ученой степени кандидата
| Вид материала | Автореферат диссертации |
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание ученой степени кандидата, 1242.08kb.
- Автореферат диссертации на соискание ученой степени кандидата искусствоведения, 484.62kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- «Тобольская государственная социально-педагогическая академия им. Д. И. Менделеева», 345.4kb.
- Эволюция лирического героя в поэзии м. Турсун -заде, 1088.86kb.
- Автореферат диссертации на соискание ученой степени кандидата политических наук, 643.82kb.
Взаимосвязь структура-свойство для аминокислот с полярными и неполярными радикалами.
Строение белков сходно со строением виниловых полимеров. Не смотря на то, что природа этих веществ различна (виниловые полимеры – синтетические вещества, белки – природные), цепи белков и виниловых полимеров имеют одинаковую (спиралевидную) конфигурацию цепей.
В третьей главе было установлено, что между структурой виниловых полимеров и индексами связанности первого и второго порядков существует некая закономерность. Причем, точность такой закономерности определяется порядком индекса связанности. На основании такой взаимосвязи можно рассчитать некоторые физико-химические свойства полимеров, предсказать поведение рассматриваемых систем в различных средах, не прибегая к сложным экспериментальным исследованиям. Хотя, стоит отметить, что полностью вычеркнуть эксперимент из исследований невозможно. Именно поэтому виниловые полимеры выступают в качестве модельных систем для исследования аминокислот.
Интерес представляет поведение белков в водном растворе, в частности, растворимость. Гидратация белков - это один из основных факторов, влияющих на свёртку белков в нативную третичную конформацию. Общая топология белковой глобулы определяется гидрофобными взаимодействиями. Неполярные углеводороды разрушают структуры воды. Однако разрушение структуры воды нарушает систему водородных связей между молекулами воды. Вместо водородных связей углеводороды способны образовывать только более слабые Ван-дер-Ваальсовы связи с водой, природа этих связей электростатическая и обусловлена электростатическим полем у соответствующего радикала аминокислоты и диполями воды. Это приводит к выталкиванию углеводородов из водной фазы. Гидрофобные взаимодействия в целом стабилизируют макромолекулы, хотя детальная картина взаимодействия с водой в пределах макромолекулы значительно сложнее. Сами молекулы воды распределены в глобуле неравномерно. Вода может оказывать сильное влияние на внутримолекулярную подвижность белка. Следует рассматривать систему белок – вода как единую кооперативную систему. Такая картина особенно характерна для ферментов, где молекулы воды концентрируются около активного центра и непосредственно участвуют в его функционировании.
Анализ результатов экспериментальных исследований роли воды в биосистемах приводится в работе Аксенова С.И., который показал, что распределение полярных и неполярных аминокислотных остатков в белковой макромолекуле довольно сложное. Предполагается, что гидрофобные эффекты играют определяющую роль в образовании и стабилизации конформации биополимеров и компактной структуры белковой глобулы с полярными группами на поверхности и неполярными внутри. Экспериментальные исследования дают возможность сделать вывод с том, что молекулы воды в биокомплексах, с одной стороны, стабилизирует структуру комплекса, а, с другой стороны, разрыхляют ее, конкурируя за водородные связи между пептидными группами белка внутри глобулярной структуры. Как было показано в третьей главе в медь- и цинксодержащих комплексах молекулы воды за счет гидрофобного взаимодействия стабилизируют структуру комплекса в целом, а в активных центрах выполняют как структурную, так и функциональную роль. Таким образом, прослеживается следующая закономерность: аминокислотный состав определяет биологическую активность, взаимодействие с молекулами воды определяется распределением аминокислотных полярных и неполярных групп и таким параметром как растворимость.
При описании структуры белка, а именно аминокислот, с помощью индексов связанности учитывается их электронная конфигурация, а, следовательно, и электростатические взаимодействия внутри и снаружи молекулы. Исходя из этих представлений, можно предположить, что индексы связанности будут взаимосвязаны с растворимостью аминокислот.
Все аминокислоты, встречающиеся в природе, отличаются природой радикала – R.
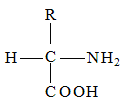
Рис.15 общая формула аминокислот.
Особенности свойств аминокислот связаны с природой радикала, именно благодаря радикалу белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов. Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой. Исходя из этого, различают пять классов аминокислот. Интерес представляют неполярные и полярные аминокислоты. Их процентное содержание в белках наибольшее.
Таблица.5 Свойства полярных и неполярных аминокислот.
| Название аминокислот | Формула | tразл 0C | Растворимость при 250С | рК1 |
| Неполярные аминокислоты | ||||
| Глицин | С2О2Н5N | 292 | 24,99 | 2,34 |
| Аланин | С3О2Н7N | 297 | 16,65 | 2,34 |
| Валин | С5О2Н11N | 315 | 8,85 | 2,32 |
| Лейцин | С6О2Н13N | 337 | 2,43 | 2,36 |
| Изолейцин | С6О2Н13N | 253 | 4,12 | 2,36 |
| Пролин | С5О2Н9N | 222 | 16,23 | 1,99 |
| Полярные аминокислоты | ||||
| Серин | С3О3Н7N | 228 | 5,0 | 2,21 |
| Треонин | С4О3Н8N | 253 | 3,52 | 2,71 |
| Цистеин | С3О2Н7NS | 260 | 0,01 | 2,05 |
| Метеонин | С5О2Н11NS | 283 | 3,5 | 2,28 |
| Аспаргин | С4О3Н8N2 | 236 | 2,98 | 2,02 |
| Глутамин | С5О3Н10N2 | 185 | 3,6 | 2,17 |
При топологическом описании аминокислот по методу Бицерано с использованием индексов связанности следует придерживаться такой классификации. Рассматривается зависимость индекса связанности и растворимости аминокислот от числа вершин графа, т.е. строения радикала.
Таблица. 6 Индексы связанности аминокислот первого и второго порядков 1χv, 2χv.
| Название аминокислот | 1χv | 2χv | n |
| Неполярные аминокислоты | |||
| Глицин | 1,1894 | 1,0762 | 5 |
| Аланин | 1,6270 | 2,0425 | 6 |
| Валин | 2,5376 | 2,7418 | 8 |
| Лейцин | 3,0207 | 3,4744 | 9 |
| Изолейцин | 2,7423 | 3,5238 | 9 |
| Пролин | 2,0064 | 3,3034 | 8 |
| Полярные аминокислоты | |||
| Серин | 2,1357 | 1,9200 | 7 |
| Треонин | 2,2185 | 2,8699 | 8 |
| Цистеин | 1,9051 | 2,0272 | 7 |
| Метеонин | 2,9434 | 3,2504 | 9 |
| Аспаргин | 2,3142 | 2,9482 | 9 |
| Глутамин | 2,8004 | 3,4212 | 10 |
n – число вершин графа
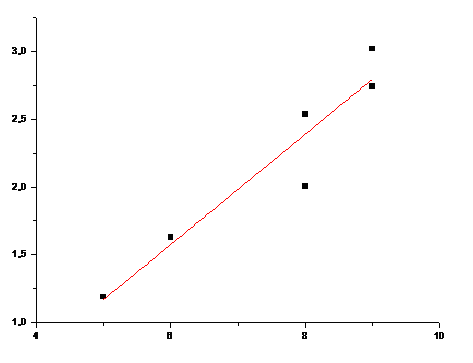
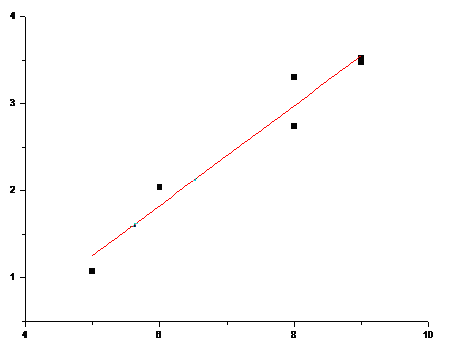
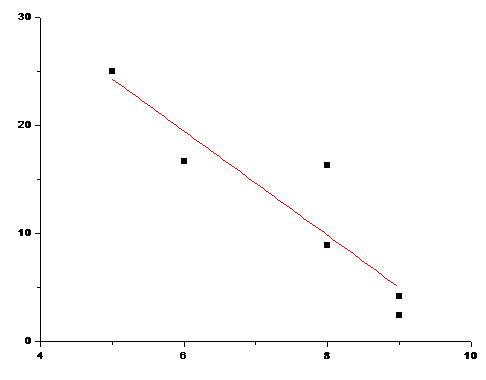
Зависимости индексов связанности и растворимости аминокислот с неполярным R.
1χv
n
Рис.16. Зависимость 1χv от n для аминокислот с неполярными R (Коэффициент корреляции - 0,8860)
2χv
n
Рис. 17. Зависимость 2χv от n для аминокислот с неполярными R. (Коэффициент корреляции - 0,9348)
n
Растворимость
Рис. 18 Зависимость растворимости при 250С от n для аминокислот с неполярным R. (Коэффициент корреляции -0,8055)
Зависимости индексов связанности и растворимости аминокислот с полярными R.
1χv
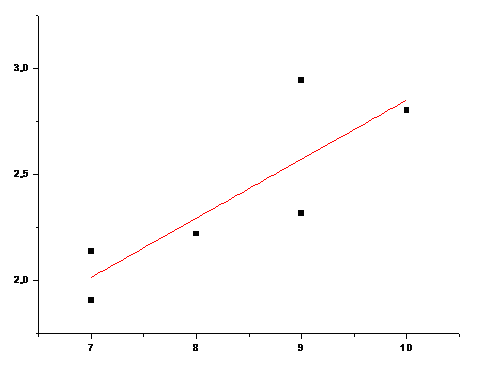
n
Рис. 19 Зависимость 1χv от n для аминокислот с полярными R (Коэффициент корреляции 0,6307)
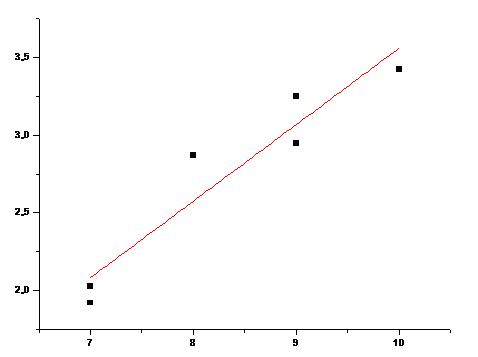
n
2χv
Рис. 20. 2χv от n для аминокислот с полярными R (Коэффициент корреляции 0,8836)
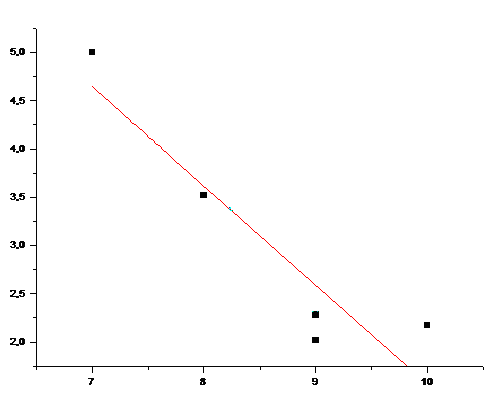
n
Растворимость
Рис. 21 Зависимость растворимости при 250С от n для аминокислот с полярным R. (Коэффициент корреляции 0,8083)
Полученные зависимости показывают, что: 1) точность индекса связанности второго порядка превышает точность индекса связанности первого порядка для полярных и неполярных аминокислот; 2) существует зависимость между индексами связанности и растворимостью аминокислот от строения радикала, вид такой зависимости обратный, т.е. с одной стороны, с увеличением n возрастает число атомов в радикале у аминокислоты, а, с другой стороны – растворимость уменьшается. Таким образом, от того, какой аминокислотный состав будет иметь белковое окружение, будет регулироваться взаимодействие фермента с водой, а это в свою очередь, влияет на функционирование активного центра.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ РАБОТЫ
- Построены квантово-химические модели электронной структуры функциональных молекулярных орбиталей (МО) Cu(II) - и Zn(II) - содержащих комплексов – активных центров биологически-активных соединений, показывающих взаимосвязь структуры и функциональных свойств.
- Полученные модели показывают, что для функционирования активных центров необходима определенная стереохимия, электронная структура функциональных МО определяет специфическую ориентацию фермента и субстрата, белковый матрикс и молекула воды обеспечивают разнообразие симметрий активных центров, необходимые конфигурации ближайшего окружения, предотвращая разрушение структуры активного центра, т.е. другими словами, наноструктура определяет функциональные свойства мезоструктуры.
- Разработана методика подготовки исследуемых образцов.
- Экспериментальные исследования поверхности ансамблей пероксидазы методом зондовой микроскопии (СММ-2000) показали, что распределение частиц пероксидазы на подложке (по размерам) происходит самоорганизованно, и что вольт-амперные характеристики (ВАХ) пероксидазы имеют полупроводниковый характер.
- Проведен анализ теоретико-графового подхода при исследовании взаимосвязи «структура-свойство».
- В результате вычислительного эксперимента проведены расчеты топологических индексов связанности (индексов Рандича) различных порядков для модельной системы типа «виниловый олигомер».
- Построены зависимости N (число вершин графа) и топологических индексов, показывающие, что чем больше параметров входит в описание топологических индексов, тем лучше их дискриминирующая способность и тем больше стандартное отклонение.
- Рассчитаны индексы связанности различных порядков для биоолигомеров аминокислот, входящих в состав биологически-активных соединений.
- Показано, что точность индекса связанности второго порядка превышает точность индекса связанности первого порядка для полярных и неполярных аминокислот.
- Показано, что существует зависимость между индексами связанности и растворимостью аминокислот от строения радикала, вид такой зависимости обратный, т.е. с одной стороны, с увеличением n возрастает число атомов в радикале у аминокислоты, а, с другой стороны – растворимость уменьшается.
СПИСОК ОСНОВНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ.
- Васильева Л.Ю., Соловьев П.В., Романова Е.Ю. Синергетика биологически-активных нанокластеров.//Материалы Международной междисциплинарной научной конференции «Идеи синергетики в естественных науках» (Вторые Курдюмовские чтения) – Тверь: ТвГУ, 2006 г., с. 166.
- Васильева Л.Ю., Соловьев П.В., Романова Е.Ю. Синергетический подход к исследованию мезообъектов и эволюция экспериментальных методов.// Материалы Международной междисциплинарной научной конференции «Синергетика в естественных науках» (Третьи Курдюмовские чтения) Тверь: ТвГУ, 2007, с.156-157.
- Васильева Л.Ю., Соловьев П.В., Романова Е.Ю. Роль многоуровневого подхода в установлении корреляции между структурой и функциями биологически-активных кластеров.//Тезисы 14-ой Международной конференции «Математика. Компьютер. Образование»- Москва-Ижевск: РХД, 2007, с.139.
- Васильева Л.Ю., Соловьев П.В., Романова Е.Ю. Фрактальные кластеры.// Вестник МГУП, №10, 2007, с. 39-44.
- Vasil’eva L.Yu., Romanova E.Yu., Solovev P.V. Some aspects of microscopic physics-new tendency of modern natural science.// Материалы третьей Международной конференции ИНТЕРНАС’07 «Актуальные проблемы современного естествознания» - Калуга: КГПУ, 2007, с.211-214.
- Васильева Л.Ю., Соловьев П.В., Романова Е.Ю. Анализ теоретических методов, используемых для моделирования электронной структуры активных центров металлосодержащих нанокомплексов.//Вестник МГУП, №8, 2006, с.58-63.
- Соловьев П.В. Анализ экспериментальных методов зондовой микроскопии для исследования биосистем.// Вестник МГУП, №10, 2007. 65-67.
- Соловьев П.В. Алгоритмы расчета топологических индексов связанности при исследовании корреляции «структура-свойство».//Тезисы докладов 16-ой Международной конференции «Математика. Компьютер. Образование»- Москва-Ижевск: РХД, Вып.16, ч.1, 2009, с.183.
- Васильева Л.Ю., Соловьев П.В., Романова Е.Ю. Анализ структуры и свойств биологически-активных нанокластеров: модели, экспериментальное исследование поверхности.// Тезисы докладов 12-ой Международной конференции «Математика. Компьютер. Образование»- Москва-Ижевск: РХД, ч.1., 2009, с.237.
- Васильева Л.Ю., Соловьев П.В., Романова Е.Ю. Бионанокомплексы – наномашины: моделирование структуры их активных центров, экспериментальное исследование их поверхности.// Тезисы Международной научной конференции «Моделирование нелинейных процессов и систем» -М.: МГУП, 2008, с.118.
- Соловьев П.В. Методика построения зависимостей «структура-свойство» в теоретико-графовом подходе.// Вестник МГУП, №1, 2009, с.115-121.
- Васильева Л.Ю., Соловьев П.В., Романова Е.Ю. Обсуждение квантово-химической модели электронной структуры активных центров медьсодержащих комплексов.//Материалы Международной междисциплинарной научной конференции «Идеи синергетики в естественных науках» (Пятые Курдюмовские чтения) -Тверь: ТвГУ, 2009.
- Васильева Л.Ю., Соловьев П.В. Моделирование электронной структуры активных центров бионанокомплексов и экспериментальное исследование поверхностей.//Биомедицинская радиоэлектроника, №8, 2009.
- Васильева Л.Ю., Романова Е.Ю., Соловьев П.В. Новое направление современного естествознания – мезоскопическая физика.//Материалы IV всероссийской научно-практической конференции преподавателей и студентов учебных заведений профессионального образования. Москва-Тверь.-М.:Библиотека журнала «СПО», 2009, 169с.
- Васильева Л.Ю., Романова Е.Ю., Соловьев П.В. Бионанокомплексы – наномашины.//Материалы IV всероссийской научно-практической конференции преподавателей и студентов учебных заведений профессионального образования. Москва-Тверь.-М.:Библиотека журнала «СПО», 2009, 170с.
