Исследования по разработке и стандартизации лекарственных растительных средств для профилактики и комплексного лечения заболеваний органов пищеварения 15. 00. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат |
- Разработка и стандартизация комплексного растительного средства, рекомендуемого для, 484.67kb.
- Исследование по стандартизации и разработке лекарственных средств на основе листьев, 475.51kb.
- Исследования по разработке и стандартизации комбинированного антимикробного и регенерирующего, 405.42kb.
- Кафедра фармацевтической и токсикологической химии медицинского факультета Фармацевтическая, 361.13kb.
- «Фармацевтическая химия» специальность – 111201 Ветеринарный врач специализация Ветеринарная, 77.44kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Предназначено для лечения и профилактики заболеваний в лечебных и лечебно-профилактических, 82.16kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
Разработка подходов к составлению рецептур сборов для
профилактики и комплексного лечения некоторых заболеваний органов пищеварения и обеспеченность сырьевой базы
Сложность этиологии и патогенеза заболеваний пищеварительной системы, тяжесть их течения, возможные осложнения объясняют необходимость комплексной терапии с применением эффективных и безопасных растительных средств с достаточной сырьевой базой для их производства. Руководствуясь запросами практикующих врачей, работающих в стационарных и амбулаторных учреждениях, нами проведены исследования по разработке новых сборов и лекарственных форм на их основе для профилактики и комплексного лечения некоторых заболеваний органов пищеварения.
Маркетинговые исследования потребителей рынка лекарственных препаратов, применяемых для лечения заболеваний органов пищеварения, показали, что фармацевтический рынок Республики Башкортостан (РБ) не обеспечен должным ассортиментом препаратов растительного происхождения и врачебные предпочтения в большей мере склоняются к назначению синтетических препаратов. Это связано с недостаточной информированностью врачей о возможности применения лекарственных препаратов растительного происхождения и их преимуществах перед синтетическими средствами. Однако, изучение спроса населения о препаратах растительного происхождения показало, что потребность в них является достаточно высокой и предпочтение отдается индивидуальным видам лекарственного растительного сырья и сборам. Это объясняет целесообразность разработки новых лекарственных растительных средств с высоким показателем их эффективности и качества.
Основной задачей на данном этапе явилось теоретическое научно-методологическое обоснование и создание алгоритма действий по разработке составов сборов для профилактики и комплексного лечения некоторых заболеваний органов пищеварения с учетом многофакторного механизма их развития (рис.1). При этом использовали репрезентативную выборку патологических состояний с учетом дифференциации признаков различных форм заболеваний в пределах нозологической группы. Главными составляющими при подборе лекарственного растительного сырья для формирования сборов при желудочно-кишечной патологии, являлись следующие: сведения об этиологии и патогенезе заболевания, составе биологически активных веществ растений, опыте их использования в научной и народной медицине. Немаловажным также было знание противопоказаний и предостережений при применении лекарственных растений.
При составлении сборов для лечения хронического панкреатита учитывали особенности его течения в различные фазы заболевания, развитие экзокринной, а затем эндокринной недостаточности поджелудочной железы, поражения печени, наличие возможных осложнений. Это определяло направленность действия сборов и, следовательно, необходимые виды фармакологической активности растительных компонентов. В подострой стадии заболевания недопустимо введение в сбор растений, обладающих желчегоным действием, поскольку усиление желчеобразования в условиях спазма сфинктера Одди может привести к холепанкреатическому рефлюксу, внутрипротоковой гипертензии и спровоцировать обострение заболевания.
При составлении сбора для профилактики и комплексного лечения хронического панкреатита в стадии ремиссии учитывали, что в этой фазе воспалительный процесс в поджелудочной железе еще не завершен, а в условиях нарушенной микроциркуляции репарация ацинарной ткани происходит медленно. Поэтому на месте воспаления формируется фиброзная



Р
















 ис. 1. Алгоритм действий по разработке рецептур сборов
ис. 1. Алгоритм действий по разработке рецептур сборов























ткань, что приводит к недостаточности функции поджелудочной железы. В фазе ремиссии показаны растения со слабым желчегонным действием (календула, девясил). При этом отдается предпочтение холекинетическому действию, особенно при дискинезиях желчевыводящих путей, так как желчь способствует перевариванию жиров за счет активации липазы, что улучшает внешнесекреторную функцию поджелудочной железы.
Эффективно в состав сборов, кроме растений специфического действия вводить компоненты антитоксического действия (горец птичий, пустырник, крапива), антигипоксического (сушеница, календула, шиповник, крапива и др.) и корректирующие метаболические нарушения.
Течение и обострение хронического панкреатита (ХП) характеризуется сложными функциональными нарушениями в печени, изменениями биохимических показателей, что подтвердилось в результате экспериментального моделирования хронического панкреатита на животных. Поэтому область применения сборов не ограничивается терапией и профилактикой хронического панкреатита в стадии обострения и ремиссии, их можно применять и при лечении заболеваний печени, а именно хронического гепатита в разных фазах заболевания.
При составлении композиции сбора для лечения язвенной болезни желудка выбор растительных компонентов осуществляли с учетом основных направлений патогенетической терапии и способности растений активно усиливать продукцию защитной слизи, восстанавливать структуру слизистой оболочки желудка, активизировать регенерацию клеток эпителия слизистой и соответственно стимулировать защитные факторы. В состав сбора при лечении язвенной болезни желудка вводили компоненты улучшающие обмен веществ: тканевой, жировой, углеводный, белковый, водно-солевой (девясил, крапива, пустырник, подорожник большой, солодка), антитоксические (пустырник, горец птичий, крапива), антигипоксические (рябина обыкновенная, сушеница, ромашка).
При составлении сбора для лечения дисбактериоза кишечника учитывали, что фитотерапия может быть эффективно использована для санации от условно патогенной микрофлоры, так как лекарственные растения в большинстве своем являются кишечными эубиотиками, уничтожающими патогенную, сохраняющими и стимулирующими сапрофитную микрофлору. Биологически активные вещества растений взаимодействуют с воспаленной слизистой кишечника, способствуют восстановлению и регенерации слизистого слоя, вызывают уплотнение протоплазмы, за счет денатурации белков, находящихся в слизи и тканевом экссудате и образование плотной пленки, защищающей нормальную и поврежденную слизистую оболочку от раздражения и внедрения патогенных бактерий. При дисбактериозах кишечника страдают процессы кишечного переваривания, поэтому оправдано включение в сбор растений, корректирующих эти процессы и растений противоположного действия: вяжущего (зверобой, лапчатка, шалфей) или слабительного (крушина), что дает возможность регулировать деятельность кишечника в зависимости от склонности к диарее или запорам. Учитывая патогенетические подходы к составлению сбора для комплексного лечения дисбактериоза кишечника, мы предположили, что он может оказаться эффективным и в комплексном лечении острых кишечных инфекций.
В состав разрабатываемых композиций вводили и дублирующие по действию растительные компоненты, исходя из того, что усложнение комплекса биологически активных веществ, приводит к потенцированию фармакологических эффектов за счет того, что компоненты одноименного действия имеют различные точки воздействия и повышают надежность ожидаемого лечебного эффекта. При этом обеспечивается поливалентность действия и снижается возможность побочных эффектов. Введение же компонентов с антитоксическим, седативным и тонизирующим эффектами приводит к созданию «круговой обороны» организма в целом. Таким образом, для дальнейших исследований нами было отобрано 28 видов лекарственного растительного сырья. Из отобранных отдельных видов растительного сырья составляли различные комбинации сборов (сбор №1 (125 вариантов), №2 (113 вариантов), сбор №3 (132 варианта), сбор №4 (123 варианта)), включающие от 2 до 15 компонентов, из них готовили водные извлечения (1:10) в разных режимах и проверяли активность.
Обоснование оптимальных составов сборов подтверждали экспериментально путем скрининга биологической и фармакологической активности. Поскольку в патогенезе хронического панкреатита и гепатита ведущая роль принадлежит развитию воспалительного процесса в поджелудочной железе (ПЖ) и печени, а также снижению ферментативной активности ПЖ, для скрининговых исследований было выбрано определение противовоспалительной и амилолитической активности. При разработке сбора для комплексного лечения язвенной болезни желудка изучали антиоксидантную и противоязвенную активность. При разработке сбора для комплексного лечения дисбактериоза была изучена антимикробная и антигрибковая активность.
Процентное соотношение компонентов в сборах обосновывали теоретически с учетом вклада каждого компонента в оказание конечного лечебного эффекта и экспериментально, оценивая активность растительных компонентов. При этом учитывалось явление взаимодействия растительных компонентов между собой (интерференции), так как наблюдалось, что некоторые виды растительного сырья, проявляющие более выраженную активность в отдельности, в смеси изменяли ее, или потенцируя или снижая действие совместно присутствующих компонентов.
Проведенный анализ литературных данных о химическом составе выбранных лекарственных растений, их активности, позволил обосновать рациональность отбора растительных компонентов для составления сборов. Таким образом, по результатам исследований были разработаны оптимальные прописи четырех сборов для профилактики и комплексного лечения хронического панкреатита и гепатита в стадии обострения - сбор №1 «Гепапанкреафит – О»: кора дуба, трава донника, корни лопуха, корни солодки, трава горца птичьего по 14%, листья мать-и-мачехи, трава пустырника, трава сушеницы топяной, трава эхинацеи пурпурной по 7,5%; хронического панкреатита и гепатита в стадии ремиссии – сбор №2 «Гепапанкреафит – Р»: корневища и корни девясила, цветки календулы, листья крапивы, листья подорожника большого, плоды шиповника по 15,5%, трава полыни обыкновенной, створки плодов фасоли, трава эхинацеи пурпурной по 7,5%; язвенной болезни желудка - сбор №3 «Ульцерофит»: цветки ромашки, трава сушеницы топяной, корни солодки, трава горца птичьего, корневища и корни девясила, листья подорожника большого по 12,5%, трава пустырника, плоды рябины, листья крапивы, плоды фенхеля по 6,25%; дисбактериоза кишечника - сбор №4 «Дисбакфит»: корневище лапчатки, листья шалфея, листья мяты перечной, корневища с корнями девясила, трава зверобоя, трава тысячелистника, трава череды, плоды фенхеля по 11,75%, кора крушины 6%. Кроме новых сборов, объектом исследования служил также разработанный и изученный ранее сбор «Экзофит», включающий траву зверобоя, цветки календулы, траву полыни горькой, соплодия хмеля, взятых поровну, и используемый для получения масляного растительного экстракта и приготовления на его основе лекарственных форм с противовоспалительной и ранозаживляющей активностью.
При подборе компонентов сборов, мы ставили перед собой задачу возможной их заготовки на территории Республики Башкортостан и промышленного производства. В состав разрабатываемых и изучаемых сборов вошли преимущественно виды местной флоры: из 28 видов лекарственных растений произрастают или культивируются на территории Республики Башкортостан - 25, остальные (мята перечная, фенхель обыкновенный, шалфей лекарственный) культивируются на территории Российской Федерации. Нами была проведена оценка запасов в некоторых районах Республики Башкортостан дикорастущих лекарственных растений, входящих в состав сборов, на основе которых были составлены практические рекомендации по их заготовке и рациональному использованию.
Для решения вопроса расширения сырьевой базы составных компонентов сборов, которые не произрастают в диком виде на территории Республики Башкортостан, были проведены исследования по введению в культуру таких растений как мята перечная, фенхель обыкновенный, шалфей лекарственный и других пряно-ароматических и эфиромасличных растений, применение которых имеет большое значение для профилактики заболеваний пищеварительной системы.
Исследования по интродукции пряно-ароматических и эфиромасличных растений в Республике Башкортостан проводились в г. Бирске в рамках совместных исследований с биологами на базе агробиостанции БГПИ. Проводя отбор различных видов пряно-ароматических и эфиромасличных растений из других географических пунктов для их интродукции в лесостепную зону Республики Башкортостан, учитывались продолжительность жизненного цикла растений и климатические условия произрастания, сравнивая их с таковыми в Южном Предуралье, обращалось внимание на количество атмосферных осадков, температуру воздуха, продолжительность безморозного периода. Выделялись факторы, ограничивающие интродукцию новых видов в республику: поздние весенние и ранние осенние заморозки, недостаток влаги в определенные сроки летнего периода, относительно низкая температура при отсутствии достаточного снежного покрова. Анализируя эти данные предполагалось, что в условиях Южного Предуралья хорошо будут расти и развиваться виды растений из лесной и лесостепной зон умеренных широт, из Средиземноморья – виды, произрастающие в горах; из тропических и субтропических районов - виды, проходящие весь жизненный цикл за один вегетационный период.
Таким образом, в условиях Башкортостана была изучена интродукция 50 видов пряно-ароматических и эфиромасличных растений, из которых хорошо адаптировались в условиях лесостепной зоны Южного Предуралья только 20 видов и форм растений. В результате оценки успешности интродукции пряно-ароматических, эфиромасличных растений, основанной на способности растений сохранять в культуре присущие им в природе габитус и размеры, было установлено, что интродукция 13-ти из 20-ти изученных видов растений перспективна в условиях лесостепной зоны Южного Предуралья. Поэтому в дальнейшем автором было проведено более глубокое изучение химического состава исследуемых образцов растений на содержание основных групп биологически активных веществ, что позволило бы расширить сферу их применения с профилактическими целями.
Таким образом, производство сборов может осуществляться как в результате заготовки дикорастущих лекарственных растений местной флоры, так и путем закупки в других регионах страны или введения в культуру отдельных видов растений в Республике Башкортостан, что способствует сохранению природных растительных сообществ и биоразнообразия ценных местных видов.
Фармакогностические исследования, стандартизация разработанных растительных сборов и фитохимическое изучение
интродуцированных растений
Для внедрения в медицинскую практику новых лекарственных средств, в том числе сборов, необходимо проведение исследований по разработке критериев подлинности сборов, гарантирующих эффективность, безопасность, воспроизводимость действия, и на основе полученных результатов, проектов ФС.
Макроскопический анализ проводили при осмотре составных компонентов аналитической пробы сборов визуально и с помощью лупы (10х), обращая внимание на структуру растительной смеси, цвет, запах, и вкус водного извлечения. В результате были выделены характерные внешние признаки сборов. В связи с тем, что разработанные сборы являются многокомпонентными, мы дифференцировали компоненты сборов по принадлежности к определенной морфологической группе. Затем из каждой морфологической группы выделяли отдельные растительные компоненты и их характерные диагностические признаки, необходимые для установления подлинности, на основе которых были разработаны «Определители» для морфологических групп: плоды, коры, подземные органы, листья и травы, цветки, входящие в состав сборов, и цветки, составляющие элементы трав.
При проведении микроскопического анализа изучали диагностически значимые признаки отдельных растительных компонентов и сборов. Микроскопия всех изученных сборов проиллюстрирована фотографиями. Исследуемые сборы включают сырье различных морфологических групп и при их описании важно определение диагностичности компонентов при совместном присутствии. Это связано с тем, что сборы могут выпускаться не только в измельченном виде, фасованные в пачки, но и в порошкованном в фильтр-пакетах, что изменяет характер микродиагностических признаков. Поэтому следующим этапом работы являлась количественная оценка проявления диагностически значимых признаков для определения стандартности лекарственного растительного сырья и сборов. Результаты определения проявляемости диагностически значимых частиц отдельных растительных компонентов и сборов №№ 1 - 4 представлены в таблице 1.
Таблица 1
Проявляемость микродиагностически значимых признаков
отдельных растительных компонентов и сборов
| № | Наименование сырья | Проявляемость диагностически значимых признаков, % | |
| отдельных растительных компонентов | в сборах | ||
| | СБОР №1 | ||
| 1 | Кора дуба | 40,0±0,8 | 33,1±1,5 |
| 2 | Трава донника | 35,3±0,5 | 23,7±0,7 |
| 3 | Корень солодки | 39,2±0,8 | 24,4±1,1 |
| 4 | Трава горца птичьего | 41,5±1,1 | 28,0±1,4 |
| 5 | Корни лопуха | 36,4±0,7 | 25,7±0,8 |
| 6 | Листья мать-и-мачехи | 37,5±0,4 | 28,1±1,5 |
| 7 | Трава пустырника | 46,4±0,9 | 26,2±1,2 |
| 8 | Трава сушеницы | 26,2±0,8 | 22,6±0,9 |
| 9 | Трава эхинацеи | 38,3±0,6 | 21,7±0,6 |
| | СБОР №2 | ||
| 1 | Корневища и корни девясила | 40,5±0,6 | 31,0±1,6 |
| 2 | Цветки календулы | 42,6±1,1 | 35,3±1,2 |
| 3 | Листья крапивы | 60,0±1,5 | 38,5±1,7 |
| 4 | Листья подорожника | 53,4±1,2 | 36,7±1,2 |
| 5 | Плоды шиповника | 46,3±1,2 | 38,5±0,8 |
| 6 | Трава полыни обыкновенной | 40,8±1,3 | 36,7±1,1 |
| 7 | Створки фасоли | 33,8±0,4 | 31,5±1,0 |
| 8 | Трава эхинацеи | 38,3±0,6 | 24,4±0,5 |
| | СБОР №3 | ||
| 1 | Трава сушеницы | 26,2±0,8 | 20,4±0,8 |
| 2 | Трава горца птичьего | 41,5±1,1 | 30,6±1,7 |
| 3 | Плоды фенхеля | 38,1±1,0 | 23,4±0,9 |
| 4 | Цветки ромашки | 35,3±0,6 | 26,9±1,6 |
| 5 | Корни солодки | 39,2±0,8 | 34,7±1,2 |
| 6 | Плоды рябины обыкнов. | 36,7±0,5 | 25,5±1,3 |
| 7 | Листья подорожника | 53,4±1,2 | 42,5±2,8 |
| 8 | Трава пустырника | 46,4±0,9 | 28,5±1,5 |
| 9 | Корневища и корни девясила | 40,5±0,6 | 31,8±1,4 |
| 10 | Листья крапивы | 60,0±1,5 | 36,5±2,5 |
| | СБОР №4 | ||
| 1 | Корневища лапчатки | 36,6±0,6 | 29,4±1,6 |
| 2 | Листья шалфея | 46,3±1,0 | 34,8±1,5 |
| 3 | Листья мяты перечной | 47,2±1,3 | 36,4±1,4 |
| 4 | Корневища и корни девясила | 40,5±0,6 | 30,7±1,3 |
| 5 | Трава зверобоя | 39,7±0,7 | 27,8±1,0 |
| 6 | Трава тысячелистника | 35,3±0,6 | 21,6±1,2 |
| 7 | Трава череды | 39,3±0,5 | 32,4±1,7 |
| 8 | Плоды фенхеля | 38,1±1,0 | 24,7±1,1 |
| 9 | Кора крушины | 36,2±0,8 | 21,6±0,5 |
Таким образом, из результатов исследования видно, что процент проявления диагностически значимых частиц компонентов в сборах снижается, по сравнению с проявлением этих признаков для отдельных компонентов сборов, что объясняется снижением частоты встречаемости значимых частиц при анализе многокомпонентных смесей.
Определение характеристик подлинности проводили в аналитических пробах образцов пяти серий сборов, изготовленных в лабораторных условиях. В сборах определяли показатели влажности, золы общей, золы, нерастворимой в 10% растворе хлористоводородной кислоты, измельченность сырья, содержание примесей (органических и минеральных). При определении примесей одновременно обращали внимание на наличие амбарных вредителей, которых в лекарственном растительном сырье обнаружено не было. Также в сборах было определено содержание экстрактивных веществ и установлено, что максимальное извлечение экстрактивных веществ из сборов наблюдается при использовании в качестве экстрагента: в сборах №1 и №4 - спирта 40%, в сборе №2 - спирта 50%, сборе №3 – спирта 70%. Извлечение водой, также показало достаточно высокие результаты, что имеет значение при использовании сборов в качестве водных извлечений для приема внутрь.
Качественный анализ сборов
По данным литературы БАВ в изучаемых сборах представлены веществами разнообразной природы, которые обеспечивают совокупное профилактическое и лечебное действие. Этим обоснована необходимость их фитохимических исследований в целях установления параметров доброкачественности. Для обнаружения отдельных групп БАВ были проведены качественные реакции с 10% водным извлечением из сборов. В результате в сборах были обнаружены следующие группы веществ: во всех 4 сборах - полисахариды, дубильные вещества, флавоноиды, сапонины, аминокислоты, кумарины; в сборе №4 - антраценпроизводные.
Обнаружение и идентификацию БАВ осуществляли с использованием хроматографических и спектральных методов исследований в сравнении со стандартными образцами.
Аскорбиновую кислоту в сборах обнаруживали в водном извлечении методом ТСХ, подвижная фаза (система «этилацетат - уксусная кислота (80:20)»), хроматографирование (~20 минут), детектирование осуществляли в УФ-свете до и после обработки 0,04% водным раствором 2,6-дихлорфенолиндофенолята натрия. Присутствие аскорбиновой кислоты в сборах №№ 1 - 4 устанавливали по появлению белого пятна на розовом фоне со значением Rf~0,89 – зона аскорбиновой кислоты и неидентифицированная зона со значением Rf~0,95.
Разделение каротиноидов проводили методом ТСХ, подвижная фаза (система «гексан - диэтиловый эфир (80:20)»), детектирование вели в УФ-свет до и после обработки 10% спиртовым раствором фосфорномолибденовой кислоты. Обнаружение каротиноидов в сборах №№ 1 - 4 устанавливали по появлению пятен синего цвета на желто-зеленом фоне со следующими значениями Rf~0,16; Rf~0,25; Rf~0,61; Rf~0,82, два из которых предположительно отнесены к каротиноидам, а два – не идентифицированы. Для подтверждения полученных данных, пятна элюировали с хроматограммы и снимали спектральные характеристики в интервале длин волн 350 – 500 нм и 470 – 700 нм. Результаты значений Rf и спектральные характеристики сопоставляли друг с другом и установили присутствие в сборах α и β – каротина.
Для обнаружения витамина К1 также использовали ТСХ при температуре 40-70ºС, подвижная фаза (система «бензол - петролейный эфир (1:1)»). Хроматограмму высушивали и выдерживали в УФ-свете при длине волны 360 нм (2 минуты). В сборах №2, №3, №4 наблюдали появление пятна с желто-зеленой флюоресценцией со значением Rf~0,68 – зона витамина К1 и не идентифицированная зона со значением Rf~0,34.
С целью разделения фенольных соединений проводили избирательную экстракцию последовательно хлороформом, этилацетатом и бутанолом. Извлечения подвергали анализу на присутствие веществ гидрофильной природы: флавоноидов, оксикоричных и фенолкарбоновых кислот и кумаринов. Для анализа агликонов флавоноидов спиртовые извлечения сборов подвергали гидролизу и экстрагировали диэтиловым эфиром.
Флавоноиды обнаруживали в этилацетатной фракции сборов. Наилучшее их разделение методом одномерной БХ наблюдалось в системах I - н-бутанол - уксусная кислота – вода (4:1:2), II-15% уксусная кислота, III - муравьиная кислота - уксусная кислота - вода (4:1:3), методом двумерной – в системах I и II. Детектирование зон флавоноидов проводили как по собственной флюоресценции веществ в УФ-свете (при λ = 254 и 366 нм), так и с помощью следующих проявителей: пары аммиака, 5% водный раствор натрия карбоната, 5% спиртовый раствор алюминия хлорида. Для сравнения использовали достоверные образцы свидетелей флавоноидов. Результаты хроматографического анализа флавоноидов сборов №1 - №4 свидетельствовали, что зоны адсорбции соединений данной группы в видимом свете имели бледно-желтую окраску, в УФ-свете обладали собственной флюоресценцией - от желтой, желто-зеленой до коричневой, которая усиливалась после проявления хромогенными реактивами. В системах растворителей I и II обнаружено 12 зон адсорбции в сборе №1; 9 зон адсорбции в сборе №2; 14 зон адсорбции в сборе №3 и 11 зон адсорбции в сборе №4, из которых к веществам флавоноидной природы можно отнести 9 зон в сборе №1, 6 зон в сборе №2, 11 зон в сборе №3 и 9 зон в сборе №4.
Обнаружение флавоноидов с помощью ТСХ проводили в системах «н-бутанол - уксусная кислота - вода (4:1:5)» и «этилацетат - уксусная кислота - вода (5:1:1)», при этом наилучшее разделение наблюдалось в системе «этилацетат - уксусная кислота - вода». В этилацетатной фракции установлено присутствие рутина в сборах №1 - №4 (Rf~0,28), гиперозида в сборах №1 и №3 (Rf~0,42), лютеолин-7-глюкозида в сборах №1 - №4 (Rf~0,57), авикулярина в сборах №1 и №3 (Rf~0,70), ликуразида в сборах №1 и №3 (Rf~0,43). Обнаружение агликонов флавоноидов проводили после кислотного гидролиза. В эфирной фракции обнаружили кверцетин в сборах №1 - №4 (Rf~0,98), мирицетин в сборе №4 (Rf~0,87), апигенин в сборах №1 - №4 (Rf~0,46), кемпферол в сборе №1 (Rf~0,88).
Обнаружение оксикоричных и фенолкарбоновых кислот проводили методом БХ в этилацетатной фракции. При этом наилучшее разделение наблюдалось в системе I и IV- 2% раствор уксусной кислоты. Методом ТСХ хорошее разделение наблюдалось в системе «хлороформ – метанол - вода (62:32:7)». Детектирование зон оксикоричных и фенолкарбоновых кислот проводили также по собственной флюоресценции в УФ-свете и после обработки хромогенными реактивами (пары аммиака, 3% спиртовый раствор треххлористого железа, раствор диазотированной сульфаниловой кислоты), сравнивая с аутентичными образцами свидетелей. Оксикоричные и фенолкарбоновые кислоты обнаруживали по ярко-голубой, зеленовато-голубой, фиолетовой флюоресценции, которая становилась интенсивнее после обработки проявляющими реактивами. В системе I обнаружено 4 зоны в сборе №1 и сборе №2, 5 зон в сборе №3 и 3 зоны в сборе №4 и установлено присутствие кофейной (Rf~0,73) и хлорогеновой кислот (Rf~0,36) в сборах №1 - №4; галловой кислоты (Rf~0,64) в сборе №1 и №4.
Обнаружение кумаринов проводили в хлороформной фракции методом ТСХ в системах «этилацетат - бензол (1:2)» и «хлороформ - петролейный эфир (1:2)». Наилучшее разделение наблюдалось в системе «этилацетат - бензол». Детектирование осуществляли в УФ-свете до и после обработки обрабатывали 10% спиртовым раствором калия гидроксида, хроматограммы высушивали и прогревали при температуре 110-1200С (2-3 мин), после чего опрыскивали свежеприготовленным диазореактивом. Кумарины обнаруживали по ярко-голубой флюоресценции в УФ-свете до обработки хромогенными реактивами, а после обработки пятна приобретали флюоресценцию от кирпично-красного до сине-фиолетового цвета. Наблюдали появление 7 зон адсорбции в сборе №1, 6 зон адсорбции в сборе №2, 8 зон адсорбции в сборе №3 и 5 зон адсорбции в сборе №4, из которых 5 зон в сборе №1 идентифицированы с умбеллифероном, дигидрокумарином, скополетином, герниарином, кумарином; 4 зоны в сборе №2 и №3 идентифицированы с эскулетином, умбеллифероном, скополетином, кумарином; 3 зоны в сборе №4 идентифицированы с эскулетином, умбеллифероном и скополетином.
Для получения более объективной информации наиболее интенсивные зоны флавоноидов и оксикоричных кислот счищали с пластинки и элюировали 96% этиловым спиртом при нагревании на водяной бане с обратным холодильником. Контроль за составом элюированных фракций осуществляли хроматографически. Операцию повторяли до получения достаточного количества исследуемых веществ. Для идентификации выделенных веществ использовали спектральные методы: УФ- и ИК-спектроскопию, которые в комплексе позволяют установить наличие, положение и характер заместителей. Спиртовые растворы выделенных веществ анализировали при аналитически значимых интервалах оптической плотности и вещества идентифицировали по спектрам их поглощения в ультрафиолетовой области, характерным сдвигам максимумов поглощения при использовании соответствующих диагностических добавок (этилата или метилата натрия, алюминия хлорида). Данные ТСХ анализа (значения Rf) и спектральных исследований сопоставляли друг с другом. Дифференциальные спектры выделенных веществ характеризовались наличием двух максимумов поглощения: для флавоноидов - рутин (при 361 и 258 нм), кверцетин (при 374 и 258 нм), кемпферол (при 368 и 258 нм), лютеолин-7-глюкозид (при 352 и 266 нм), апигенин (при 338 и 270 нм), гиперозид (при 359 и 254 нм); для оксикоричных кислот - галловой (при 276 и 222 нм), хлорогеновой (при 324 и 300 нм) и кофейной (при 324 и 292 нм). Для идентификации выделенных препаративно индивидуальных веществ в инфракрасной области готовили гомогенизированные суспензии в вазелиновом масле. Отмечали наличие интенсивной широкой полосы с максимумом при 3370 см-1 для рутина, который обусловлен валентными колебаниями спиртовых и фенольных групп; полоса 1654 см-1 принадлежит карбонильной группе -пирона; ароматические С=С связи дают ряд полос 1610, 1584, 1510, 1456 см-1. У кверцетина в ИК-спектре были обнаружены полосы валентных колебаний при 3300-3500 см-1, соответствующие гидроксильным группам; 1660 см-1 (С=О); 1612, 1558, 1522, 1462 см-1 (С=С). ИК-спектр кемпферола характеризуется полосами валентных колебаний при 3274-3520 см-1 (гидроксильные группы); 1654-1665 см-1 (карбонильная группа - пирона); 1610, 1510, 1462 см-1 (С=С). В ИК-спектре апигенина наблюдались полосы при 3286-3410 см-1 (фенольные ОН-группы); 1648-1660 см-1 (карбонильная группа - пирона); 1580, 1492 и 1450 см-1 (С=С). Для ИК-спектров изолированных оксикоричных кислот характерны валентные колебания при 1252-1300 см-1 (С=С); 1640-1705 см-1 (коричный фрагмент); 3280-3430 см-1 (наличие гидроксильных групп).
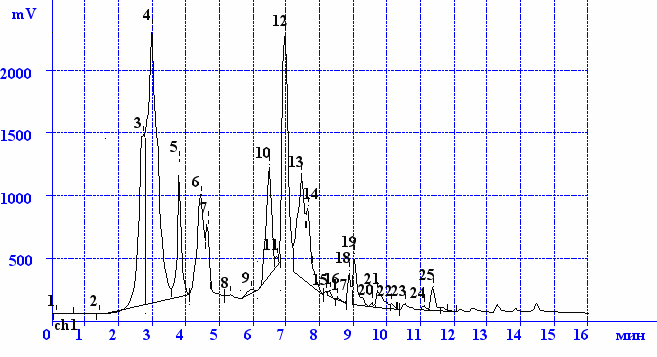
Для достоверного подтверждения качественного и количественного анализа фенольного комплекса сборов применяли метод ВЭЖХ. Анализ проводили на хроматографе с УФ-детектором при длине волны 360 нм. Для анализа получали спиртовое извлечение с экспериментально подобранными условиями. Параллельно готовили серию 0,05% растворов сравнения флавоноидных соединений и оксикоричных кислот в метиловом спирте. Идентификацию проводили путем сопоставления времен удерживания компонентов смеси и растворов сравнения. Результаты исследований представлены на рис. 2 - 5.
В сборе №1 (рис.2) установлено присутствие 34 веществ фенольной природы, из которых 9 идентифицированы как флавоноиды (рутин (10), авикулярин (14), лютеолин-7-глюкозид (11), кверцетин (18), изокверцетин (12), гиперозид (21), геспередин (16), ликуразид (24), апигенин (25)) и 3, как оксикоричные кислоты (галловая (5), хлорогеновая (8) и кофейная (9)).