Методические указания к электронным лабораторным работам по курсу физической химии для студентов дневной формы обучения химико-технологического факультета и факультета строительного материаловедения
| Вид материала | Методические указания |
- Методические указания к лабораторным работам по курсу "Математическое моделирование, 921.14kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 803.64kb.
- Методические указания к выполнению курсовой работы по дисциплине "Технология программирования", 278.46kb.
- Методические указания к лабораторным работам по биологической химии для студентов, 948.06kb.
- Методические указания к лабораторной работе по курсу «Информатика» Основы алгоритмизации, 441.82kb.
- Методические указания к лабораторным работам по курсу, 438.32kb.
- Методические указания для студентов заочной формы обучения факультета Коммерции и маркетинга, 405.26kb.
- Методические указания для студентов заочной формы обучения факультета Национальной, 287.81kb.
- Методические указания и вопросы самостоятельной работы по курсу «свиноводство и технология, 590.32kb.
- Рабочая программа и методические указания к контрольным работам для студентов специальности, 482.62kb.
Федеральное агентство по образованию
ГОУ ВПО «Уральский государственный технический университет − УПИ»
ОПРЕДЕЛЕНИЕ ПАРАМЕТРОВ КИНЕТИЧЕСКИХ УРАВНЕНИЙ
Методические указания к электронным лабораторным работам
по курсу физической химии для студентов дневной формы обучения
химико-технологического факультета
и факультета строительного материаловедения
Екатеринбург
2008
УДК 544(076)С79
ББК 24.5я73
Составитель Е. И. Степановских
Научный редактор доц., канд. хим. наук Л. А. Брусницына
ОПРЕДЕЛЕНИЕ ПАРАМЕТРОВ КИНЕТИЧЕСКИХ УРАВНЕНИЙ /Методические указания к электронным лабораторным работам по курсу физической химии / сост. Е. И. Степановских − Екатеринбург: ГОУ ВПО УГТУ−УПИ, 2008. − с.
В методических указаниях к лабораторным работам рассмотрен ход подготовки студента к проведению работы, а также даны необходимые пояснения для работы на программе и приведен необходимый экспериментальный материал.
Библиогр.: 6 назв. Табл. 5
Подготовлено кафедрой «Физическая и коллоидная химия».
ОБЩИЕ ЗАМЕЧАНИЯ ПО ВСЕМ РАБОТАМ
Каждая лабораторная работа посвящена небольшому фрагменту общего расчета параметров кинетического уравнения. Как показывает опыт, такое разбиение полного расчета на более мелкие части довольно удобно, как преподавателю, так и студенту.
Преподаватель, варьируя как число, так и типы сочетаемых в одном задании фрагментов расчета, может создать большое количество индивидуальных вариантов заданий для каждого студента.
Студенту такое разбиение удобно для выполнения однотипных операций расчета ведь обычное задание содержит анализ 36 кинетических кривых.
Каждая лабораторная работа состоит из следующих разделов:
1. Теоретическая часть.
2. Расчетная часть
3. Задание на лабораторную работу.
В теоретической части кратко рассмотрены необходимые теоретические сведения по теме работы. Наличие ее в лабораторной работе необходимо для того, чтобы при возникших вопросах можно было тут же, не обращаясь к каким-либо печатным изданиям, уточнить материал.
Расчетная часть это, по сути, алгоритм расчета, составленный таким образом, что, введя данные изучаемых опытов и следуя указаниям программы, студент в конце получает все необходимые результаты.
Задание на лабораторную работу приведено в нескольких вариантах.
Необходимо отметить, что автор программы намеренно отказался от возможностей автоматического определения такой величины как наклон прямых. Как показывает преподавательский опыт, гораздо продуктивнее для процесса изучения этого учебного материала является использование приема нахождения тангенса угла наклона прямой, что и предложено практически во всех электронных лабораторных работах. Конечно же, продвинутые студенты легко ускорят свою работу, нахождением уравнения линии тренда, из которого будут видны и наклон линии и отрезок, отсекаемый на оси ординат.
При работе с программой нужно следовать ее указаниям, причем нужно помнить, что вводить результаты опытов следует в ячейки, окрашенные в программе в желтый цвет. Результаты расчетов будут расположены в ячейках голубого цвета. Все лабораторные работы основаны на кинетических кривых, и в каждой работе сначала программа строит кинетическую кривую по данным, которые вводит студент. Типичный вид таблицы, которую нужно заполнить, приведен далее.
| Время, мин | Концентрация, моль/м3 |
| 0 | 30 |
| 2 | 28,49 |
| 4 | 27,01 |
| 6 | 25,58 |
| 8 | 24,18 |
| 10 | 22,82 |
| 13 | 20,86 |
| 17 | 18,38 |
| 20 | 16,62 |
| 30 | 11,41 |
| 40 | 7,17 |
| 60 | 1,63 |
| 80 | 0 |
В зависимости от темы лабораторной работы, далее следуют различные способы обработки этой кинетической кривой. Не имеет смысла повторять тут текст программ, нужно при работе просто внимательно выполнять требуемые действия. Если в работе планируется произвести несколько однотипных расчетов, то, используя соответствующую клавишу возврата (она бардового цвета), можно легко перейти к началу расчета и провести его уже для другого опыта.
Для удобства выполнения лабораторных работ в данном учебном пособии приводятся цели работы, задания на работу и рекомендации по составлению отчета. Отчет может быть выполнен от руки, или отпечатан на принтере. Если студент выполняет в течение одного занятия две лабораторные работы, то возможно написание одного общего отчета.
Любая лабораторная работа начинается с проработки теоретического материала соответствующего раздела данного учебного пособия или теоретическую часть лабораторной работы. Обязательным является решение одной из задач, приведенных в конце каждой лабораторной работы (каждый студент решает индивидуальную задачу по выполняемой лабораторной работе). После собеседования с преподавателем, можно приступить к работе.
Данные для построения кинетических кривых заданных в варианте лабораторной работы опытов, берутся из табл. 4.
ЛАБОРАТОРНАЯ РАБОТА К7
ПОСТРОЕНИЕ И АНАЛИЗ КИНЕТИЧЕСКОЙ КРИВОЙ
Цели работы
- Познакомиться с методами получения и видами кинетических кривых.
- Научиться определять начальную скорость реакции по кинетической кривой.
- Научиться определять скорость реакции в любой момент ее протекания.
Задание на лабораторную работу
- Построить и проанализировать кинетические кривые исследуемой реакции при различных начальных концентрациях реагента (для опытов, номера которых указаны преподавателем).
- Построить и проанализировать кинетические кривые этой же реакции при другой температуре (для опытов, номера которых указаны преподавателем).
Рекомендации по работе
В этой работе на графике с кинетической кривой автоматически появляется касательная (в программе она черного цвета) к начальному участку кривой. Она нужна для определения продолжительности линейного участка кинетической кривой. Очевидно, что те экспериментальные точки, которые укладываются вдоль этой касательной, находятся на линейном участке, а те, которые не укладываются, уже не находятся на линейном участке. Примерный вид рисунка в программе следующий:
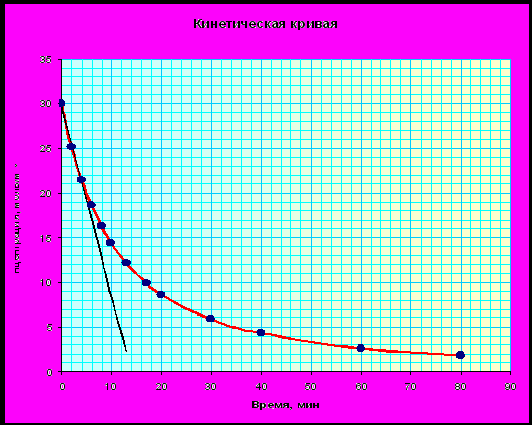
Каждому студенту будут предложено проанализировать шесть опытов. Результаты по определению начальной скорости реакции следует обязательно где-либо фиксировать: или в рабочем журнале, или в заготовке отчета в соответствующей таблице. Эти результаты будут нужны для дальнейшего расчета. Примерная форма таблицы приведена ниже.
| Начальная концентрация реагента, моль/м3 | | | | | | |
| Начальная скорость реакции, моль/(м3мин) | | | | | | |
Отчет по лабораторной работе
В отчете должны быть:
1) краткая теоретическая часть по видам кинетических кривых и способам их получения;
2) графическое изображение одной кинетической кривой для одной из реакций;
3) таблица с данными о скоростях реакций;
4) выводы.
В выводах по работе нужно отразить:
1) влияние концентрации реагента на начальную скорость реакции;
2) зависимость скорости реакции от концентрации реагента; от времени протекания реакции.
Задачи по лабораторной работе
1. Для реакции типа 2А+ В = 2С получены следующие опытные данные:
| | Опыт 1 | Опыт 2 | Опыт 3 |
| Начальная концентрация А, моль/л | 0,10 | 0,30 | 0,30 |
| Начальная концентрация В, моль/л | 0,20 | 0,40 | 0,80 |
| Начальная скорость реакции, мольлс1 | 300 | 3600 | 14400 |
Получите кинетическое уравнение этой реакции и определите, совпадает ли оно со стехиометрическим; определите порядок реакции по веществам и в целом; вычислите значение константы скорости реакции и укажите ее размерность.
2. Для элементарной газофазной реакции H2 + Ar = 2H + Ar значение константы скорости при 3000 К равно 2,2104 лмоль1с1. Определите скорость этой реакции, если известны концентрации
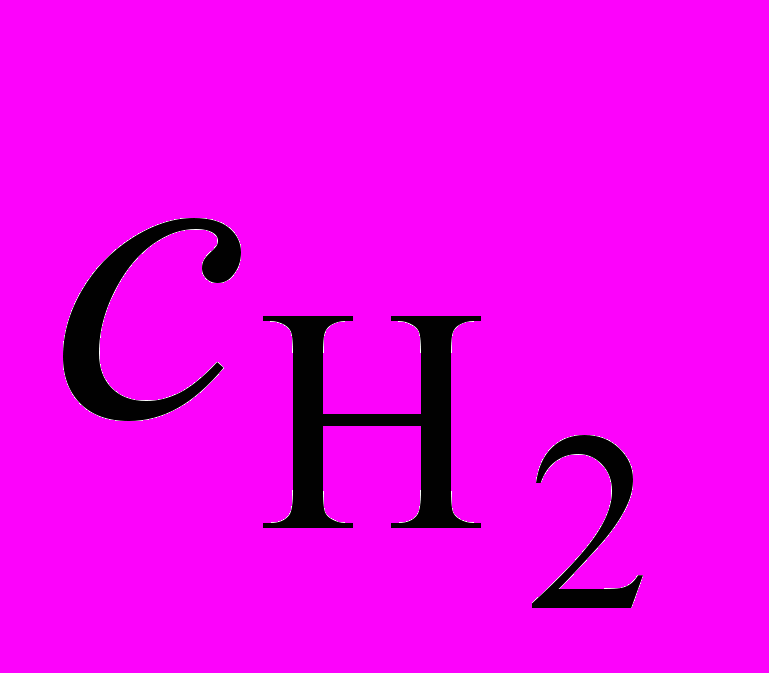 = 4,1103 моль/л и
= 4,1103 моль/л и  =4,1 104 моль/л. При каком значении концентрации аргона скорость реакции увеличивается вдвое?
=4,1 104 моль/л. При каком значении концентрации аргона скорость реакции увеличивается вдвое?3. Химическая реакция в жидкой фазе H2O +
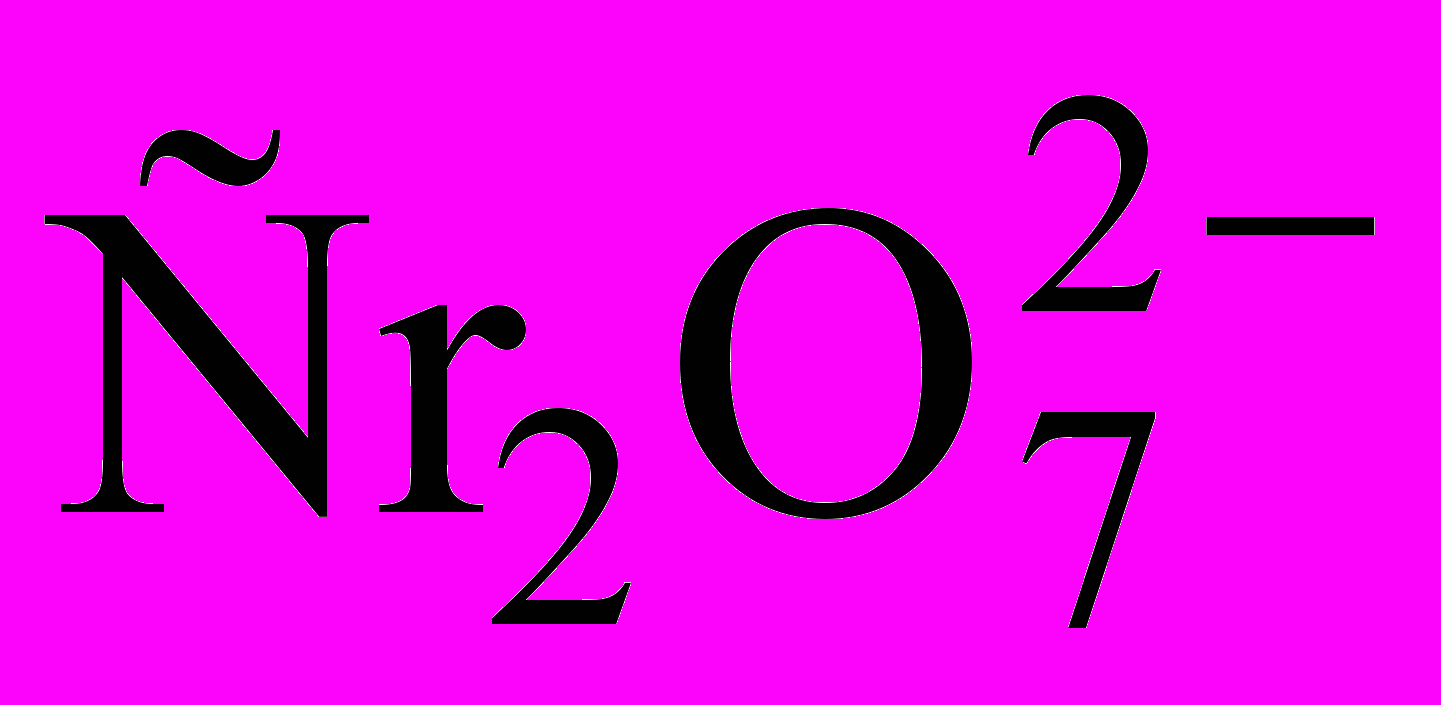 = 2
= 2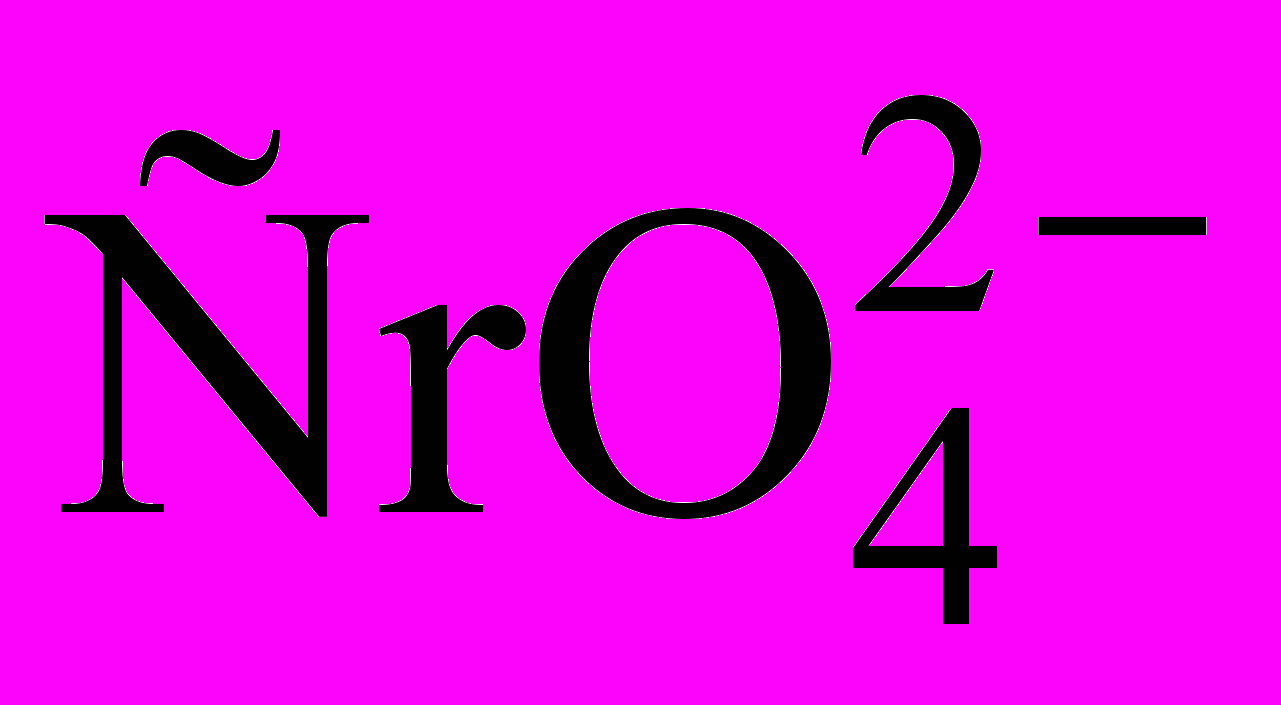 + 2H+ характеризуется кинетическим уравнением, соответствующим стехиометрическому. Напишите выражение скорости реакции через концентрации реагирующих веществ; установите соотношение между рН и концентрацией
+ 2H+ характеризуется кинетическим уравнением, соответствующим стехиометрическому. Напишите выражение скорости реакции через концентрации реагирующих веществ; установите соотношение между рН и концентрацией 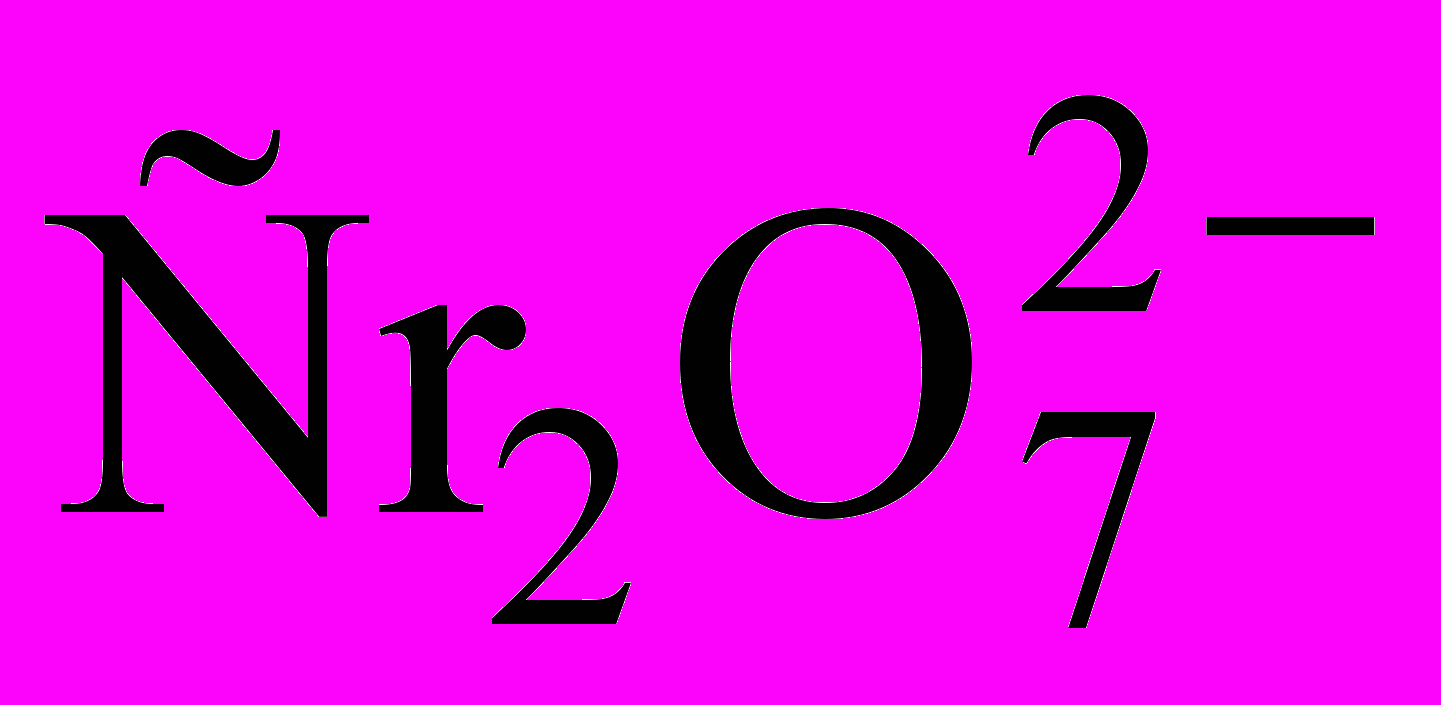 .
.4. Для газофазной реакции N2O5 = N2O + 0,5 O2 при 25 оС получены следующие опытные данные:
| Время, мин | 0 | 20 | 30 | 40 | 50 | 60 |
| Давление кислорода, торр | 0,0 | 7,0 | 11,9 | 17,1 | 20,2 | 24,9 |
Покажите, что речь идет о реакции нулевого порядка; вычислите значение константы скорости реакции при этой температуре и укажите ее размерность.
5. Для реакции разложения муравьиной кислоты при температуре 50 оС получены следующие данные:
 , с , с | 0 | 60 | 120 | 240 | 360 | 480 | 660 | 840 |
 , моль/л , моль/л | 0,0 | 0,120 | 0,223 | 0,390 | 0,521 | 0,6223 | 0,735 | 0,810 |
Найдите порядок реакции и вычислите значение константы скорости.
ЛАБОРАТОРНАЯ РАБОТА К8
ИНТЕГРАЛЬНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКОВ РЕАКЦИИ. МЕТОД ПОДСТАНОВКИ
Цели работы
1. Познакомиться с интегральным методом определения порядка реакции.
2. Определить порядок исследуемой реакции интегральным методом.
3. Найти величину константы скорости реакции.
Рекомендации по работе и задание на лабораторную работу
Сначала программа по введенным студентом данным строит кинетическую кривую, а затем строит анаморфозы этой кривой в трех различных координатах, соответствующим целочисленным порядкам реакции: первому, второму и третьему. Студент должен сделать правильный выбор порядка реакции по виду полученных анаморфоз, и затем перейти к определению величины константы скорости.
Согласно варианту лабораторной работы, указываемому преподавателем, исследовать три разных реакции. Стехиометрические уравнения реакций не приводятся, но известно, что все они имеют целочисленный порядок и протекают при 298 К.
Можно в общем виде каждую реакцию представить одним из следующих уравнений:
А продукты; 2А продукты; А1+А2 продукты;
3А продукты; А1+2А2продукты; А1+А2+А3 продукты.
Поскольку определяется общий порядок реакции, то для реакций, в которых участвует несколько исходных веществ, их начальные концентрации берутся одинаковыми.
Для каждой реакции даны три опыта, в которых различается начальная концентрация того исходного вещества, по изменению концентрации которого определяется скорость реакции.
В рамках лабораторной работы необходимо:
1) построить кинетические кривые по каждому опыту;
2) представить опытные данные в координатах, соответствующих трем целочисленным порядкам реакции: первому, второму и третьему;
3) определить порядки всех трех реакций интегральным методом (графически, методом подстановки).
4) найти константы скоростей исследуемых трех реакций.
Все это требуется сделать для всех реакций и для всех концентраций, т.е. обработке подлежат девять опытов.
Отчет по лабораторной работе
В отчете по лабораторной работе должны быть
1) краткая теоретическая часть по сути интегрального метода определения порядка реакции;
2) графическое изображение одной кинетической кривой для одной из реакций;
3) для этой кинетической кривой нужно привести три графика с анаморфозами кривой в соответствующих координатах;
4) таблицы с данными расчета о порядках реакции и константах скоростей по всем девяти опытам.
В выводах по работе нужно отразить:
1) какой порядок имеют исследуемые реакции и чему равны их константы скоростей;
2) влияние концентрации реагента на начальную скорость реакции;
3) влияние концентрации реагента на константу скорости.
Таблица 1
Номера опытов, необходимых для выполнения лабораторной работы
-
Вариант 1
Вариант 2
Реакция I
Опыты 1; 2; 3
Реакция I
Опыты 4; 5; 6
Реакция II
Опыты 31; 32; 33
Реакция II
Опыты 28; 29; 30
Реакция III
Опыты 64; 65; 66
Реакция III
Опыты 61; 62; 63
Вариант 3
Вариант 4
Реакция I
Опыты 7; 8; 9
Реакция I
Опыты 10; 11; 12
Реакция II
Опыты 34; 35; 36
Реакция II
Опыты 37; 38; 39
Реакция III
Опыты 58; 59; 60
Реакция III
Опыты 100; 101; 102
Вариант 5
Вариант 6
Реакция I
Опыты 13;14; 15
Реакция I
Опыты 16; 17; 18
Реакция II
Опыты 40;41; 42
Реакция II
Опыты 43; 44; 45
Реакция III
Опыты 67; 68; 69
Реакция III
Опыты 79; 71; 72
Вариант 7
Вариант 8
Реакция I
Опыты 19; 20; 21
Реакция I
Опыты 97; 98; 99
Реакция II
Опыты 46; 47; 48
Реакция II
Опыты 49; 50; 51
Реакция III
Опыты 73; 74; 75
Реакция III
Опыты 55; 56; 57
Вариант 9
Вариант 10
Реакция I
Опыты 64; 65; 66
Реакция I
Опыты 4; 5; 6
Реакция II
Опыты 52; 53; 54
Реакция II
Опыты 79; 80; 81
Реакция III
Опыты 76; 77; 76
Реакция III
Опыты 88; 89; 90
Задачи по лабораторной работе
1. Считают, что газофазная реакция А = В + С имеет первый порядок. Известно, что при определенной температуре начальное давление
 равно 200 торр, а через 2 мин протекания реакции общее давление
равно 200 торр, а через 2 мин протекания реакции общее давление 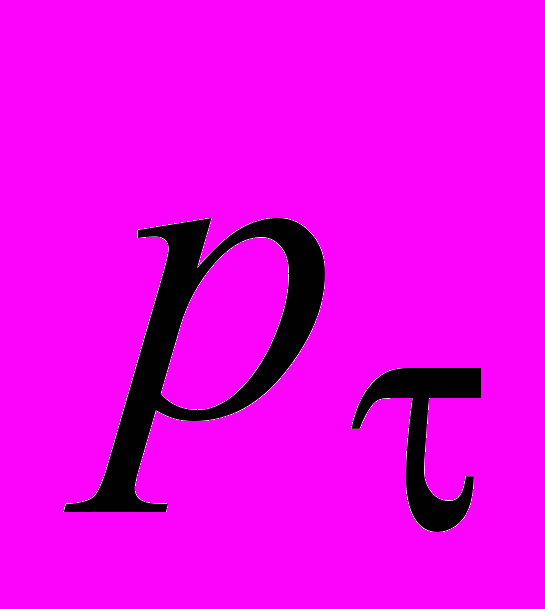 равно 220 торр. Определите константу скорости и укажите ее размерность.
равно 220 торр. Определите константу скорости и укажите ее размерность.2. Для реакции между триэтиламином (C2H5)3N и иодистым метилом CH3I, протекающей в растворе при одинаковых начальных концентрациях реагентов, равных 0,05 моль/л, получены результаты:
-
Время, с
325
1295
1550
1975
% израсходованных реагентов
31,5
64,9
68,8
73,7
Покажите, что реакция имеет второй порядок; рассчитай те константу скорости этой реакции и укажите ее размерность.
3. Для реакций разных порядков, протекающих при одинаковых начальных концентрациях реагентов, равных 1 моль/л , половина исходного вещества превращается за время равное
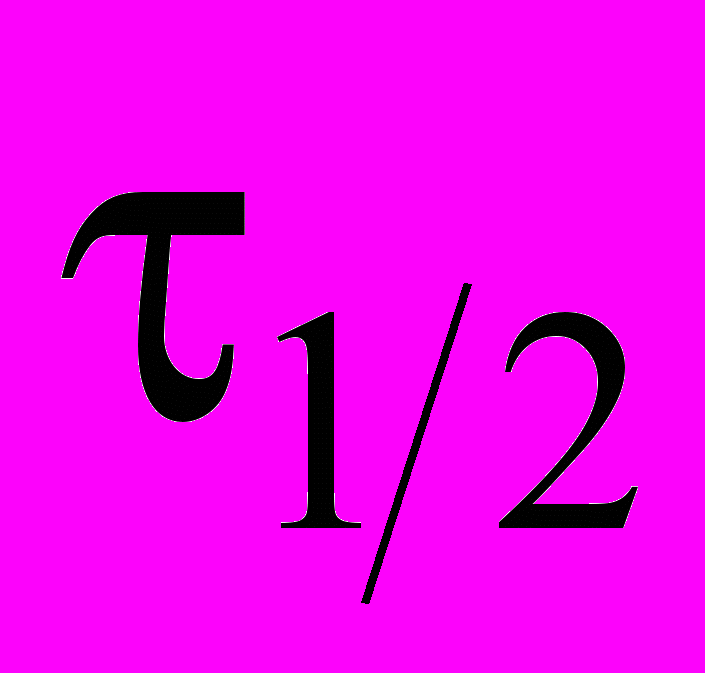 . Покажите, сколько требуется времени (выразите в
. Покажите, сколько требуется времени (выразите в 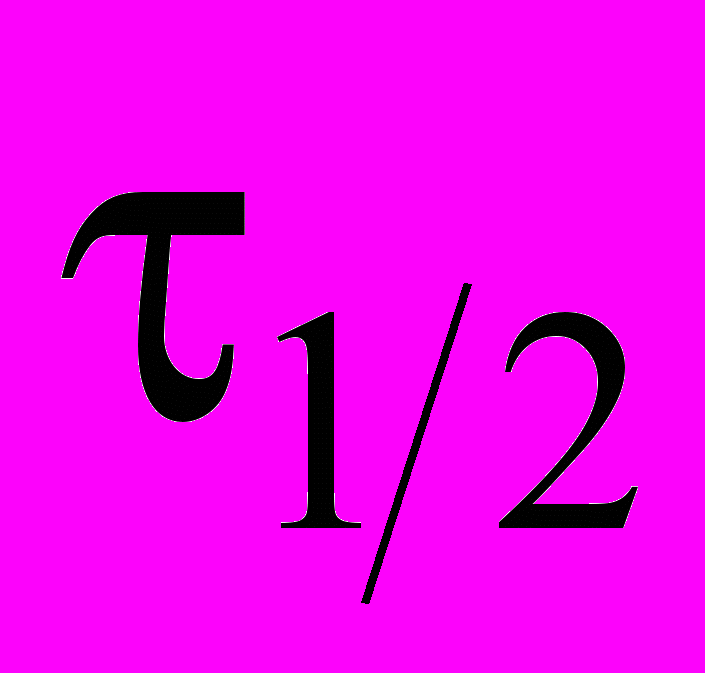 ), чтобы практически все количество исходного вещества превратилось в продукты для реакций нулевого, первого и второго порядков.
), чтобы практически все количество исходного вещества превратилось в продукты для реакций нулевого, первого и второго порядков.4.Азодифенилметан в растворе толуола распадается с выделением азота:
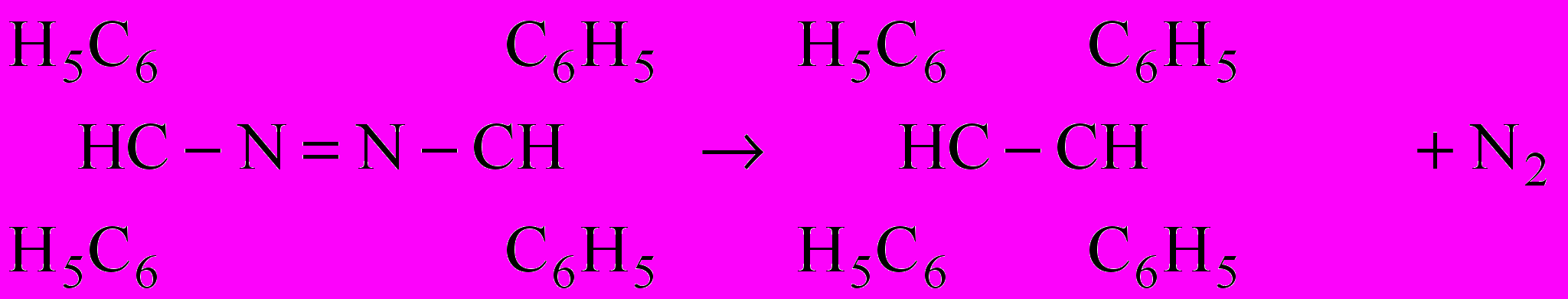
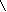
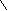
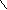




Кинетику этой реакции изучают при 54 оС ( 1 л раствора содержит 0,01 моль реагента), измеряя объем выделившегося азота при давлении 1 атм:
-
 , мин
, мин
20
34
100
200
V, см3
30,:
49
121,8
188,2
Покажите, что порядок этой реакции равен единице, и определите значение константы скорости, указав ее размерность.
5. При изучении реакции между пиридином и иодистым этилом
C5H5N + C2H5I = C7H10N+ + I для одинаковых концентраций реагентов, равных 0,1 моль/л измерялась концентрация ионов I через определенные промежутки времени; эти данные приведены ниже:
-
 , с
, с
235
465
720
1040
1440
1920
2370
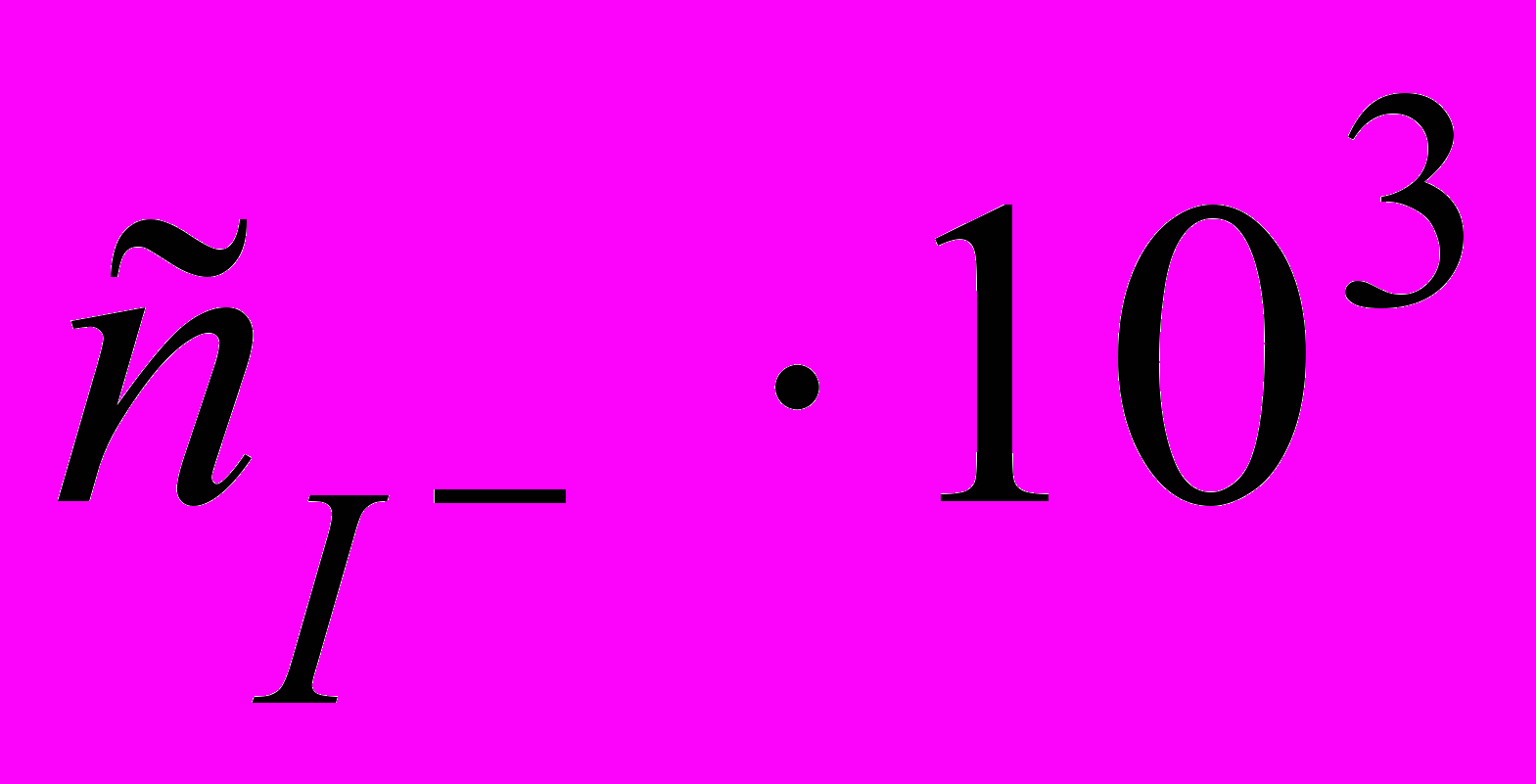 ,моль/л
,моль/л
15
26
35
44
52
59
64
Определите порядок реакции и вычислите значение константы скорости.
