Методические указания к электронным лабораторным работам по курсу физической химии для студентов дневной формы обучения химико-технологического факультета и факультета строительного материаловедения
| Вид материала | Методические указания |
- Методические указания к лабораторным работам по курсу "Математическое моделирование, 921.14kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 803.64kb.
- Методические указания к выполнению курсовой работы по дисциплине "Технология программирования", 278.46kb.
- Методические указания к лабораторным работам по биологической химии для студентов, 948.06kb.
- Методические указания к лабораторной работе по курсу «Информатика» Основы алгоритмизации, 441.82kb.
- Методические указания к лабораторным работам по курсу, 438.32kb.
- Методические указания для студентов заочной формы обучения факультета Коммерции и маркетинга, 405.26kb.
- Методические указания для студентов заочной формы обучения факультета Национальной, 287.81kb.
- Методические указания и вопросы самостоятельной работы по курсу «свиноводство и технология, 590.32kb.
- Рабочая программа и методические указания к контрольным работам для студентов специальности, 482.62kb.
ЛАБОРАТОРНАЯ РАБОТА К9
МЕТОД ПОЛУПРЕВРАЩЕНИЯ. МЕТОД ОСТВАЛЬДА-НОЙЕСА
Цели работы
- Познакомиться с теоретическими основами методов.
- Определить порядок реакции и константу скорости методом полупревращения.
- Определить порядок реакции и константу скорости методом Оствальда-Нойеса.
Рекомендации по работе и задание на лабораторную работу
Сначала программа по введенным студентом данным строит кинетическую кривую, при этом на координатной плоскости и появляется горизонтальная полоса, соответствующая определенной доле от начальной концентрации. Это сделано для удобства определения времени превращения исходного вещества на эту долю.
Согласно варианту лабораторной работы, указываемому преподавателем, нужно по табл. 2 определить номера опытов, характеризующих исследуемую реакцию, а экспериментальные данные по этим опытам нужно найти в табл. 1 Приложения.
Таблица 2
Номера опытов, необходимых для выполнения лабораторной работы
| Вариант | Номера опытов | |||||
| 1 | 109 | 110 | 111 | 112 | 113 | 114 |
| 2 | 121 | 122 | 123 | 124 | 125 | 126 |
| 3 | 133 | 134 | 135 | 136 | 137 | 138 |
| 4 | 151 | 152 | 153 | 154 | 155 | 156 |
| 5 | 169 | 170 | 171 | 172 | 173 | 174 |
| 6 | 115 | 116 | 117 | 118 | 119 | 120 |
| 7 | 187 | 188 | 189 | 190 | 191 | 192 |
| 8 | 127 | 128 | 129 | 130 | 131 | 132 |
| 9 | 139 | 140 | 141 | 142 | 143 | 144 |
| 10 | 163 | 164 | 165 | 166 | 167 | 168 |
| 11 | 145 | 146 | 147 | 148 | 149 | 150 |
| 12 | 157 | 158 | 159 | 160 | 161 | 162 |
| 13 | 175 | 176 | 177 | 178 | 179 | 180 |
| 14 | 181 | 183 | 183 | 184 | 185 | 186 |
| 15 | 151 | 152 | 153 | 154 | 155 | 156 |
| 16 | 169 | 170 | 171 | 172 | 173 | 174 |
| 17 | 115 | 116 | 117 | 118 | 119 | 120 |
| 18 | 187 | 188 | 189 | 190 | 191 | 192 |
| 19 | 127 | 128 | 129 | 130 | 131 | 132 |
| 20 | 121 | 122 | 123 | 124 | 125 | 126 |
Первая часть работы посвящена определению порядка реакции по времени полупревращения. Для выполнения этой части нужно выбрать две или три кинетические кривые из указанного списка.
Вторая часть работы позволяет определить порядок реакции по методу Оствальда-Ноейса. Тут, поскольку используется графический метод, нужно использовать данные по всем кинетическим кривым.
Анализу подвергаются результаты опытов, в которых изменяется только лишь начальная концентрация реагента. Если в реакции участвует несколько веществ, то их начальные концентрации берутся одинаковыми. Температура проведения реакции во всех опытах одинакова и равна 298 К.
Следуя указаниям программы студент находит порядок реакции и величину константы скорости реакции.
Программа составлена таким образом, что вначале порядок исследуемой реакции определяется методом полупревращения (расчетным), а затем методом Оствальда-Нойеса (графическим).
Стехиометрические уравнения реакций не приводятся, но известно, что реакции имеют дробный порядок и протекают при 298 К.
Выполнение лабораторной работы не представляет особой трудности, если следовать указаниям программы и внимательно вводить экспериментальные данные в соответствующие таблицы программы.
В отчете по лабораторной работе нужно привести:
1. Краткую теоретическую часть по указанному методу.
2. Таблицу с вычисленными значениями времен полупревращения, или времен превращения на какую-либо часть.
3. Графическую зависимость, позволяющую определить порядок реакции.
4. Выводы.
Задачи по лабораторной работе
1. Найдите порядок реакции термического разложения N2O при температуре 1030 К на основании следующих экспериментальных данных:
-
Начальное давление, торр
86,5
164,0
290,0
360,0
Время полупревращения, с
634
393
255
212
2. При изучении реакции C2H5I + OH = C2H5OH + I проводимой при условии, что
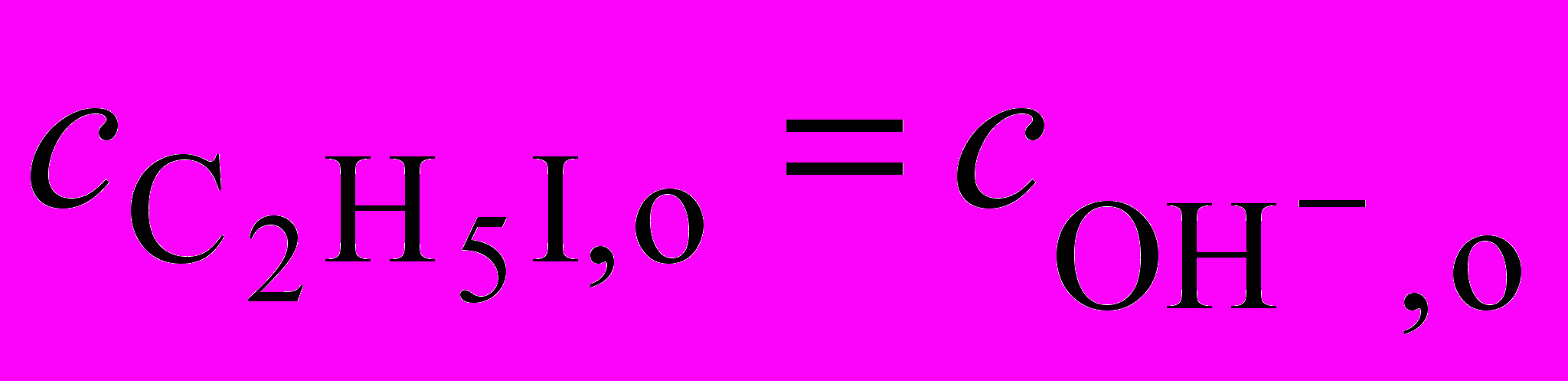 , были измерены времена полупревращения для различных начальных концентраций реагентов при 298 К:
, были измерены времена полупревращения для различных начальных концентраций реагентов при 298 К:-
Начальная концентрация, моль/л
0,01
0,025
0,05
0,075
0,100
Время полупревращения, мин
1110
445
220
150
110
Покажите, что эти результаты отвечают кинетике второго порядка и найдите значение константы скорости реакции.
3. Для газофазной реакции разложения N2O при 1030 К получены экспериментальные результаты по зависимости времени полупревращения от начального давления N2O:
-
Начальное давление N2O , торр
360
290
139
52,5
Время полупревращения, с
212
255
470
860
Определите порядок реакции и найдите значение константы скорости.
4. Для газофазной реакции между NO и H2 при 1100 К получены опытные данные времени полупревращения в зависимости от начального давления реагентов при условии, что
 . Найдите общий порядок реакции.
. Найдите общий порядок реакции.-
Начальное давление , торр
354
341
288
202
Время полупревращения, с
81
102
140
224
5.Для определения порядка реакции разложения амида серебра
3AgNH2 = 2NH3 + Ag3N провели три опыта с различными начальными концентрациями AgNH2 , измеряя в каждом опыте времена полупревращения
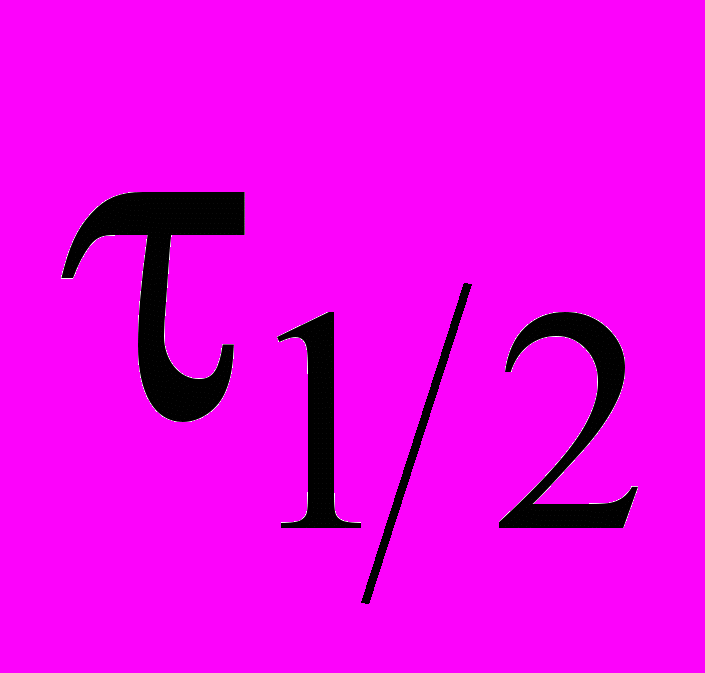 и превращения на четверть
и превращения на четверть 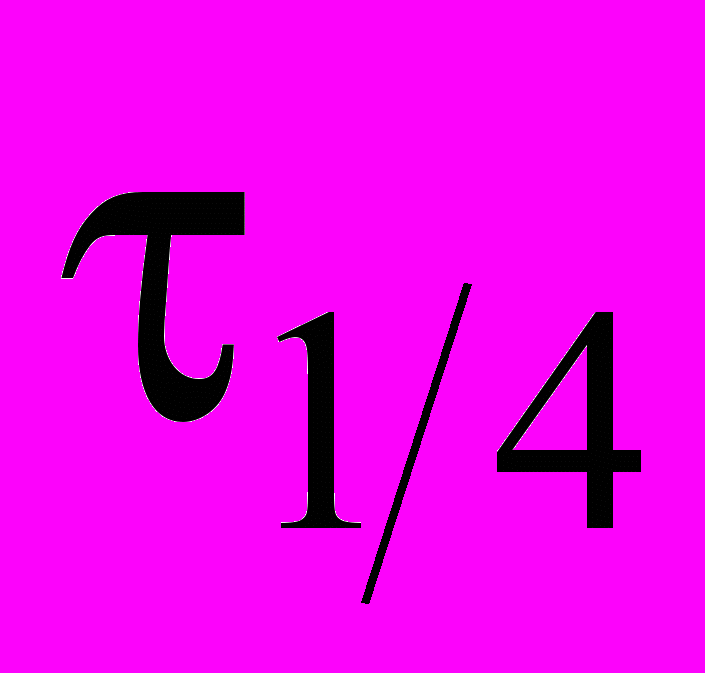 . Получены следующие результаты
. Получены следующие результаты-
Начальная концентрация, моль/л
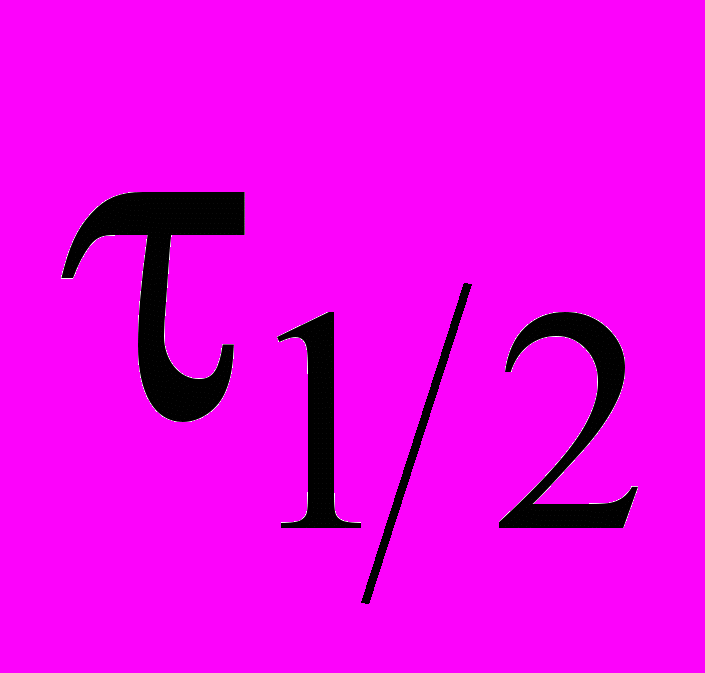 , ч
, ч
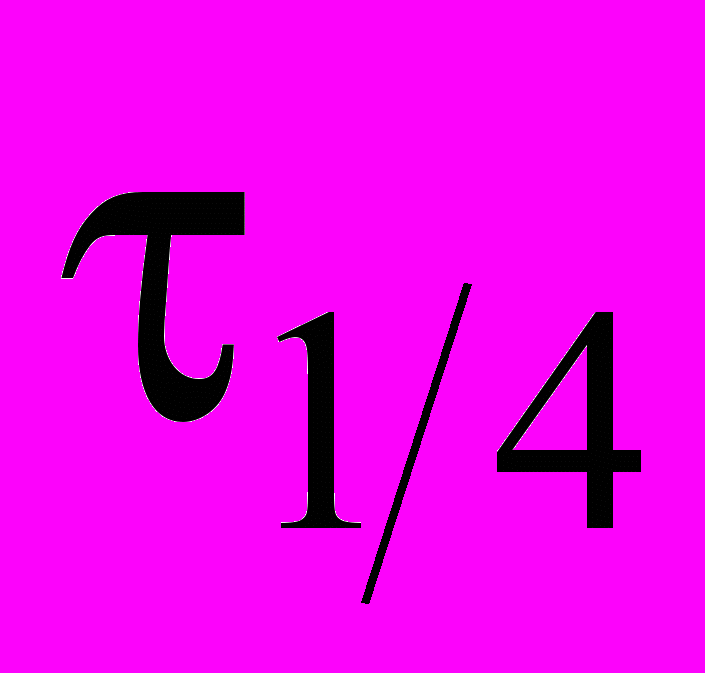 ,ч
,ч
1,0
15
7
0,66
34
16
0,50
60
28
Установите порядок реакции, протекающей по простому механизму.
ЛАБОРАТОРНАЯ РАБОТА К10
ДИФФЕРЕНЦИАЛЬНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ПОРЯДКОВ РЕАКЦИИ
Цели работы
- Ознакомиться с основами дифференциального метода определения порядков реакции
- Проанализировать серию опытов и определить дифференциальным методом порядок исследуемой реакции.
Рекомендации по работе и задание на лабораторную работу
Для определения порядка реакции по одному из исходных веществ этим методом нужно будет проанализировать серию кинетических кривых и по начальным скоростям реакций, протекающих при разных начальных концентрациях реагента, определить порядок реакции.
Общий вид стехиометрического уравнения исследуемой реакции
А + В = продукты.
Начальная концентрация вещества В равна увеличенной в 102 раз начальной концентрации вещества А.
Сначала программа по введенным студентом данным строит кинетическую кривую одного какого-либо опыта. По этой кинетической кривой нужно определить начальную скорость реакции. Методика определения начальной скорости подробно рассмотрена в лабораторной работе К-7, однако для удобства в рамках этой лабораторной работы также приведен фрагмент работы К-7.
Следуя указаниям программы, студент определяет начальные скорости реакции по всем кинетическим кривым и находит затем и порядок реакции и константу скорости реакции.
Исследованию подвергаются кинетические кривые, полученные в шести опытах, номера которых согласно варианту, указанному преподавателем, находятся по таблице 2.
Исследуемая реакция во всей серии опытов проводится при одной температуре, известно, что порядок реакции по веществу А дробный.
Возможно определение частного порядка реакции по одной кинетической кривой. Тогда нужно уметь определять скорости реакции в любой момент времени. Об этом подробно также рассказано в лабораторной работе К-7, однако, для удобства выполнения работы К-10, в нее включен фрагмент расчета лабораторной работы К-7.
Выбрать кинетическую кривую для анализа студент должен самостоятельно из предложенной серии опытов.
Отчет по лабораторной работе должен содержать:
- Краткую теоретическую часть по сути вопроса.
- Таблицу расчетных данных по скоростям реакций.
- Графическую зависимость, позволяющую определить частный порядок реакции и константу скорости.
- Выводы.
В выводах следует не только привести полученные значения порядка реакции и константы скорости, но и пояснить, каким образом можно определить порядок реакции по одному компоненту, если в реакции участвует два вещества.
Задачи по лабораторной работе
1. Изучение термического разложения диметилсульфоксида (DMSO) при 340 оС проводили путем измерения начальной скорости образования продукта метана. Для начальной концентрации DMSO равной 4,3 103 моль/л получены следующие результаты:
| Время, с | 30 | 150 | 300 | 600 |
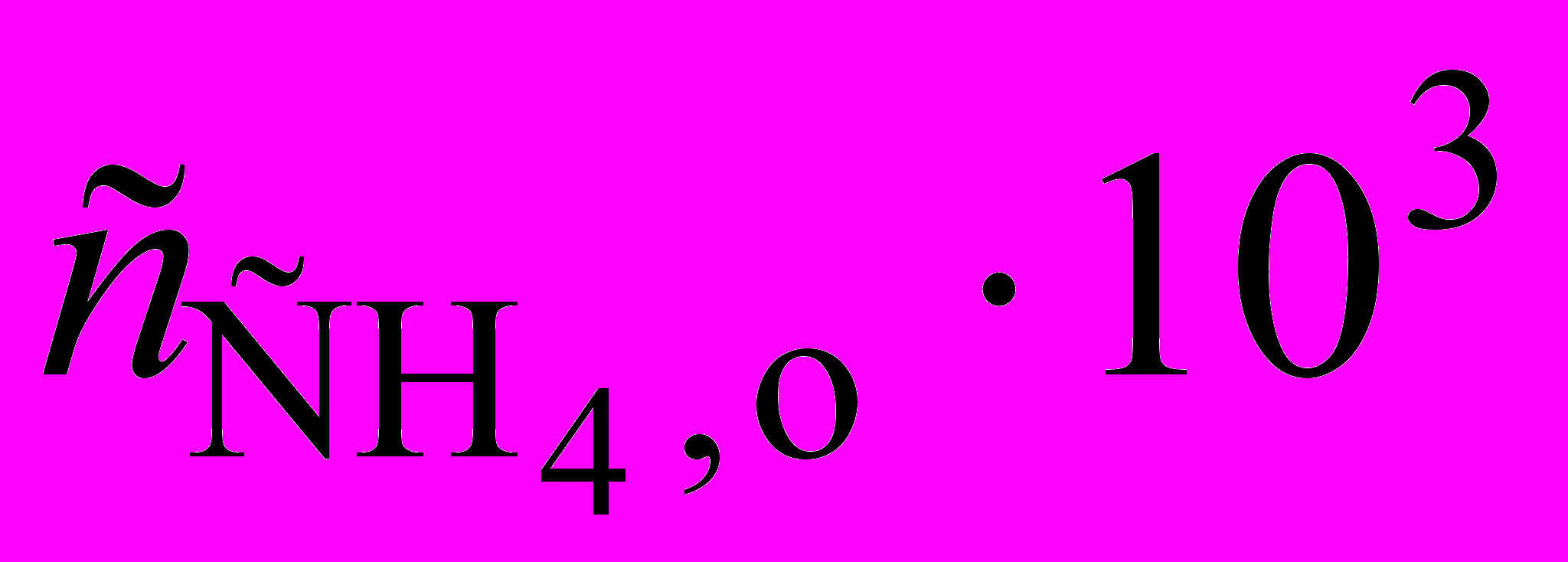 , моль/л , моль/л | 0,125 | 0,50 | 1,00 | 1,85 |
Определите начальную скорость образования метана; найдите начальный порядок реакции и константу скорости образования метана, если известны значения начальных скоростей для других начальных концентраций при 340 оС:
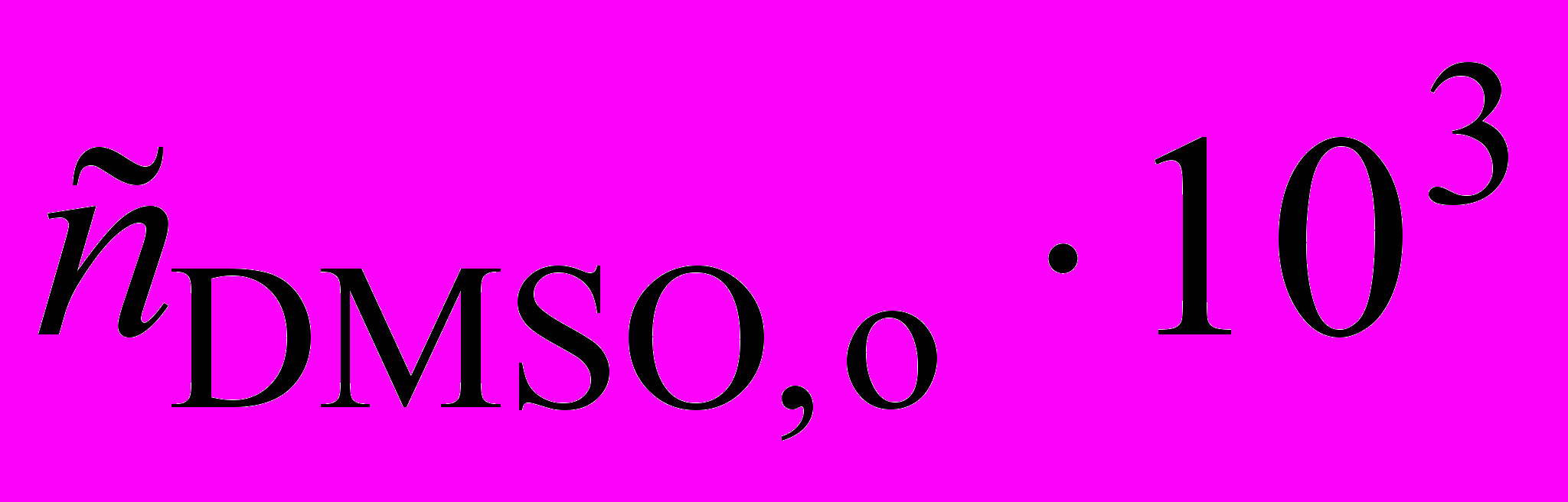 , моль/л , моль/л | 2,5 | 10 |
| wo106 , моль/(лc) | 1,95 | 7,94 |
2. Окисление в газовой фазе углеводорода RH приводит к образованию гидропероксида RO2H. В опытах, проведенных при температуре 127 оС и постоянном объеме, получены следующие значения для начальной скорости окисления wо , измеренные при анализе гидропероксида:
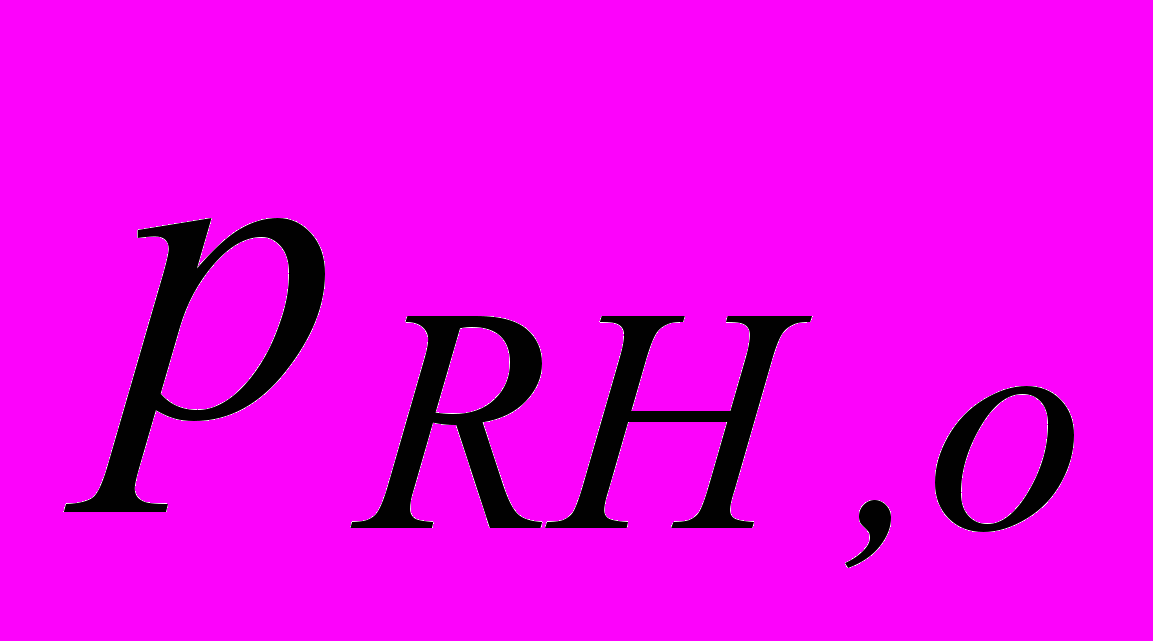 , торр , торр | 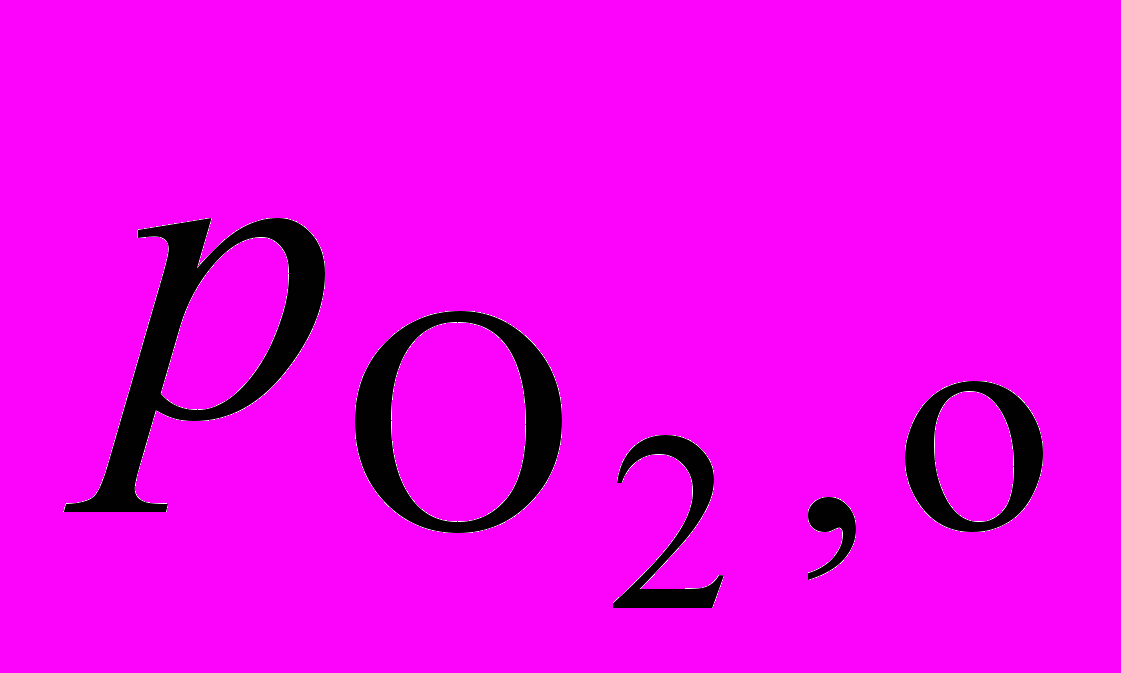 , торр , торр | wo108 , моль/(лc) |
| 200 | 152 | 9,30 |
| 200 | 130 | 8,37 |
| 200 | 85 | 5,45 |
| 150 | 85 | 4,10 |
| 120 | 85 | 3,45 |
Найдите порядок реакции по каждому реагенту и рассчитайте константу скорости.
- Изучение газофазной реакции при постоянной температуре
2NO + Cl2 = 2 NOCl позволило получить следующие экспериментальные данные:
| | Опыт 1 | Опыт 2 | Опыт 3 |
| Начальное давление 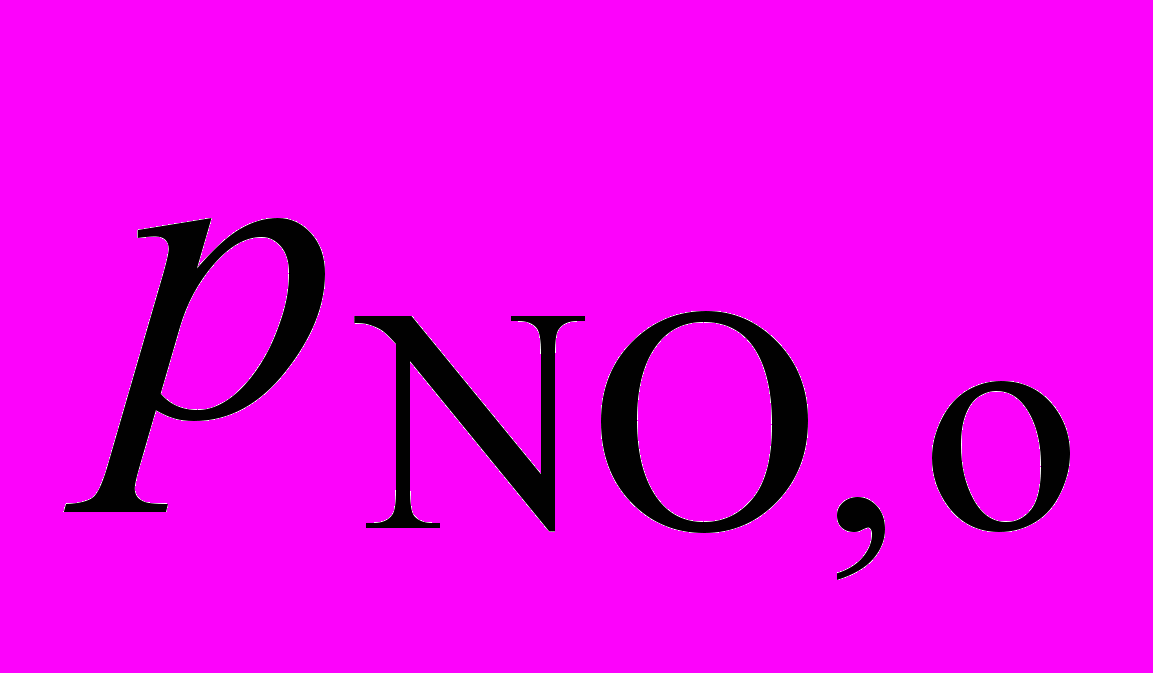 , атм , атм | 0,50 | 1,0 | 0,50 |
| Начальное давление 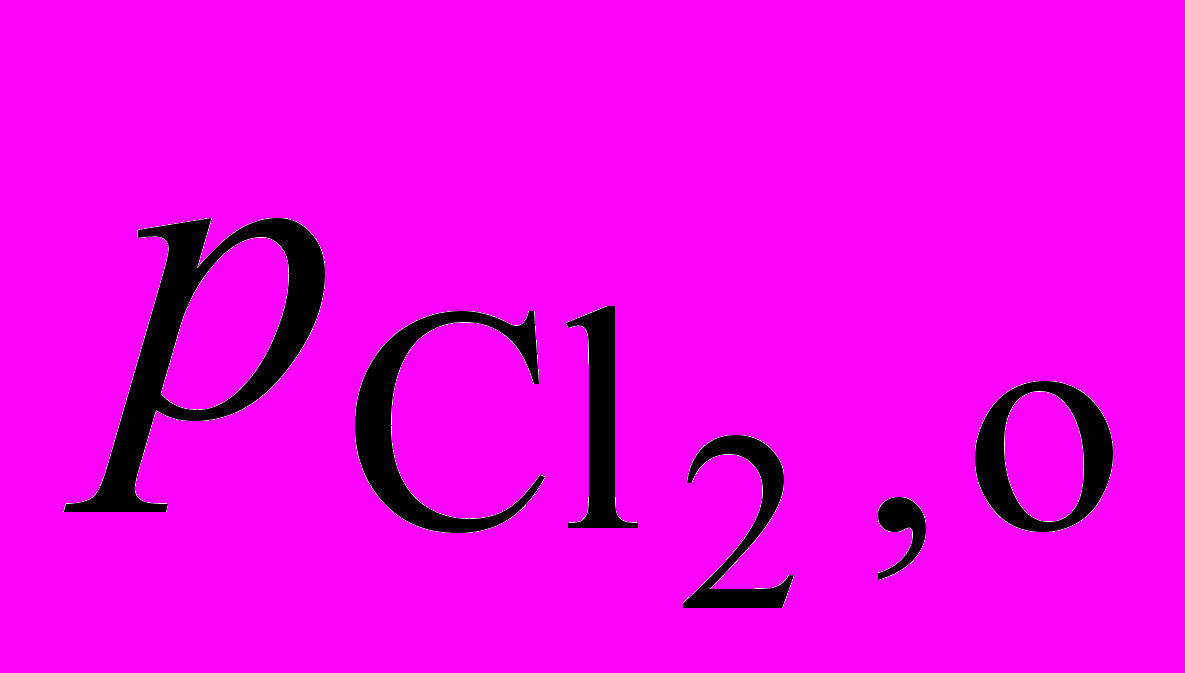 , атм , атм | 0,50 | 1,0 | 1,0 |
| Начальная скорость wо, атм/с | 5,1103 | 4,0102 | 1,0102 |
Получите кинетическое уравнение скорости данной реакции; укажите порядок реакции по веществам и в целом; определите значение константы скорости.
4. Для реакции типа 2А + 3В = Р1 + Р2 при одинаковой температуре получены следующие опытные данные:
| | Опыт 1 | Опыт 2 | Опыт 3 |
| Начальная концентрация А, моль/л | 0,10 | 0,20 | 0,20 |
| Начальная концентрация В, моль/л | 0,10 | 0,10 | 0,20 |
| Начальная скорость wо, моль (А)л1с1 | 0,10 | 0,40 | 0,40 |
Установите кинетическое уравнение скорости реакции; укажите порядок реакции по веществам и в целом; вычислите значение константы скорости и скорость самой реакции для текущих концентраций
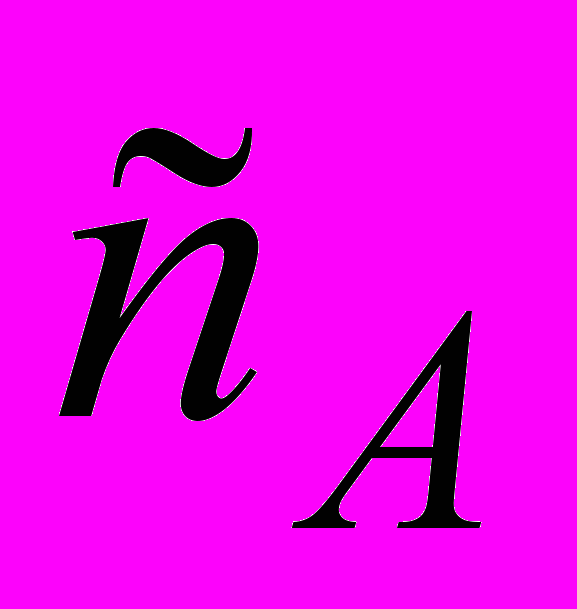 =
=  = 0,30 моль/л.
= 0,30 моль/л.. Для реакции 2NO + 2H2= N2+ 2H2O при определенной температуре получены следующие экспериментальные результаты:
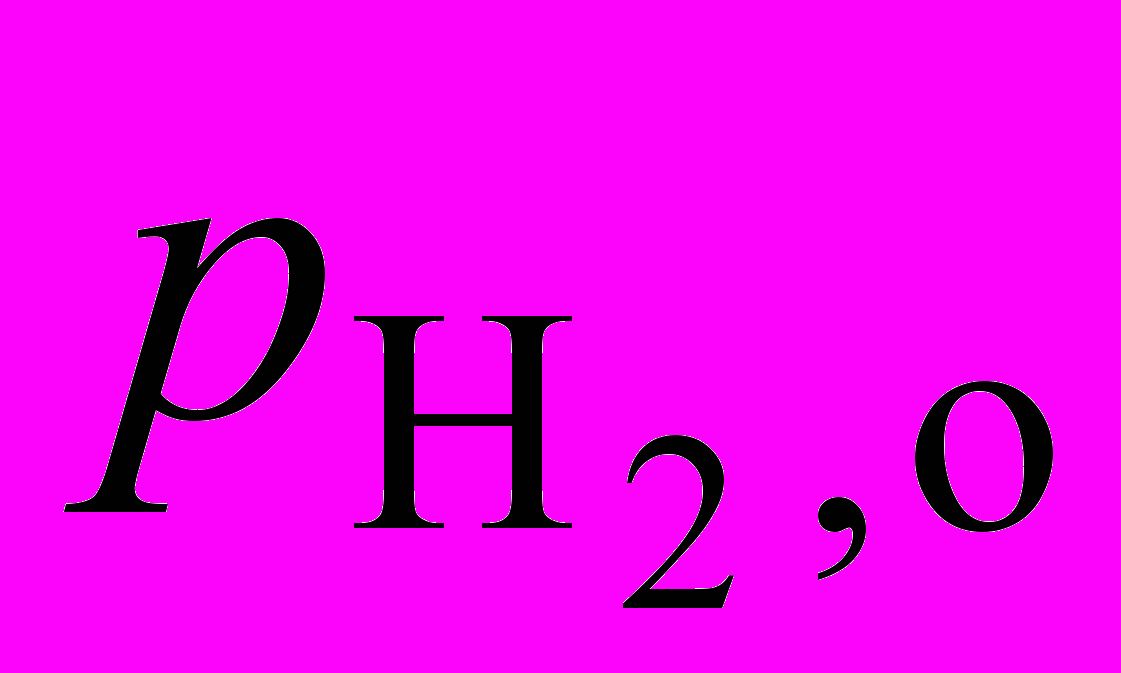 , торр , торр | 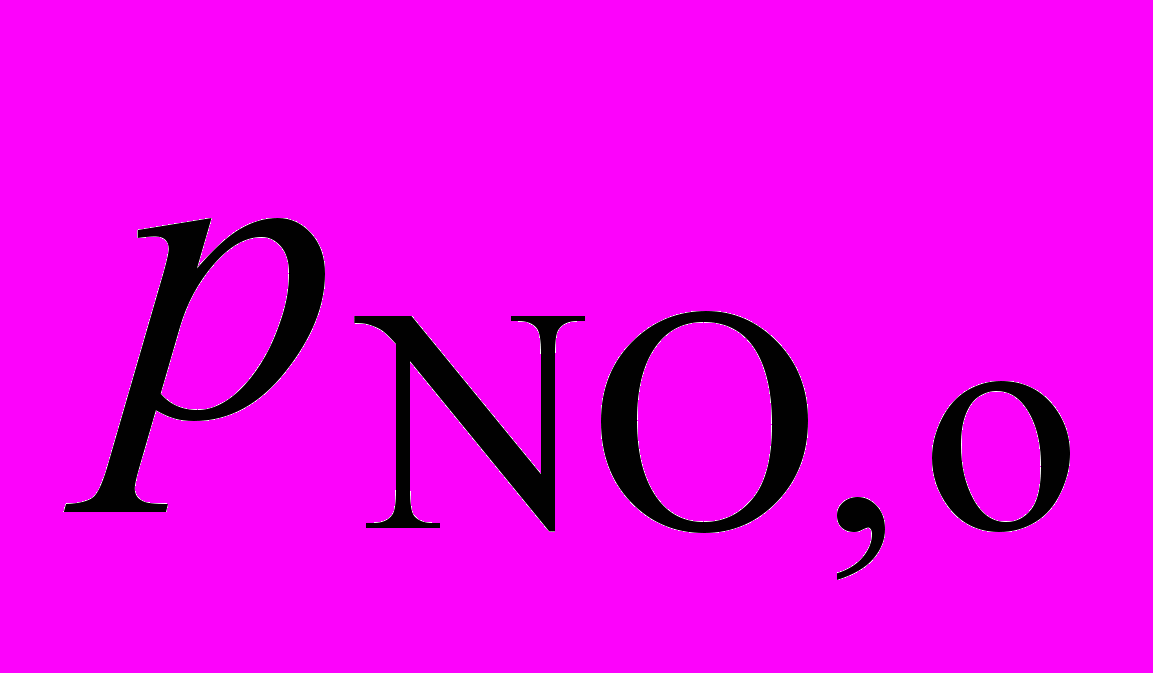 , торр , торр | wо, атм/с | 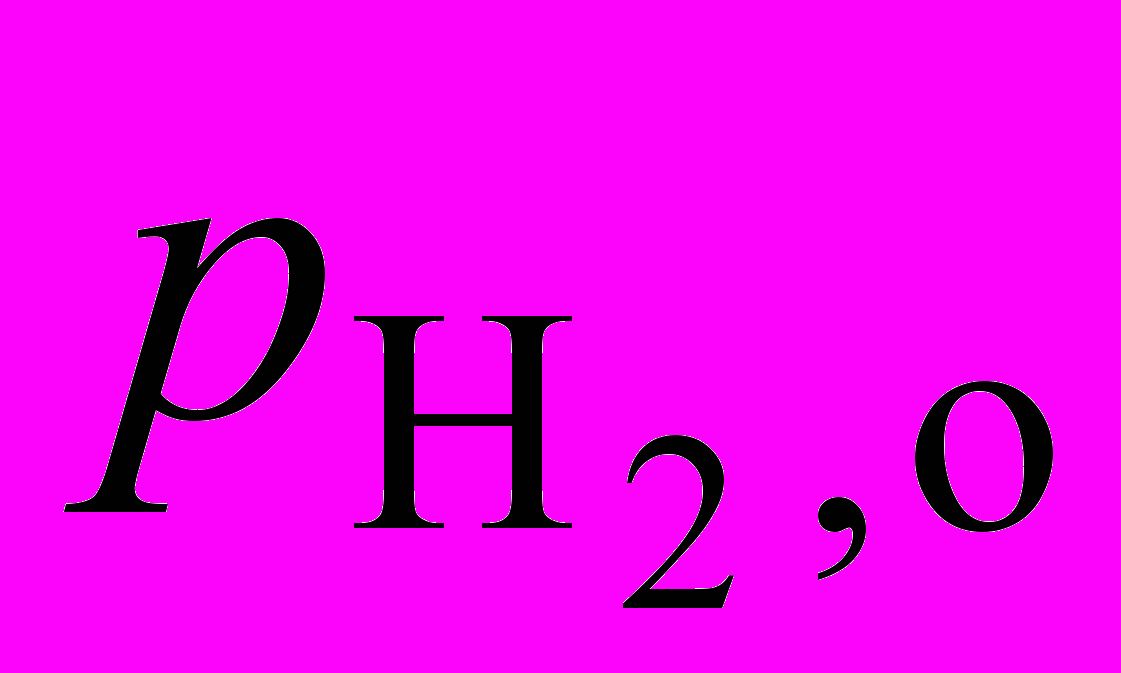 , торр , торр | 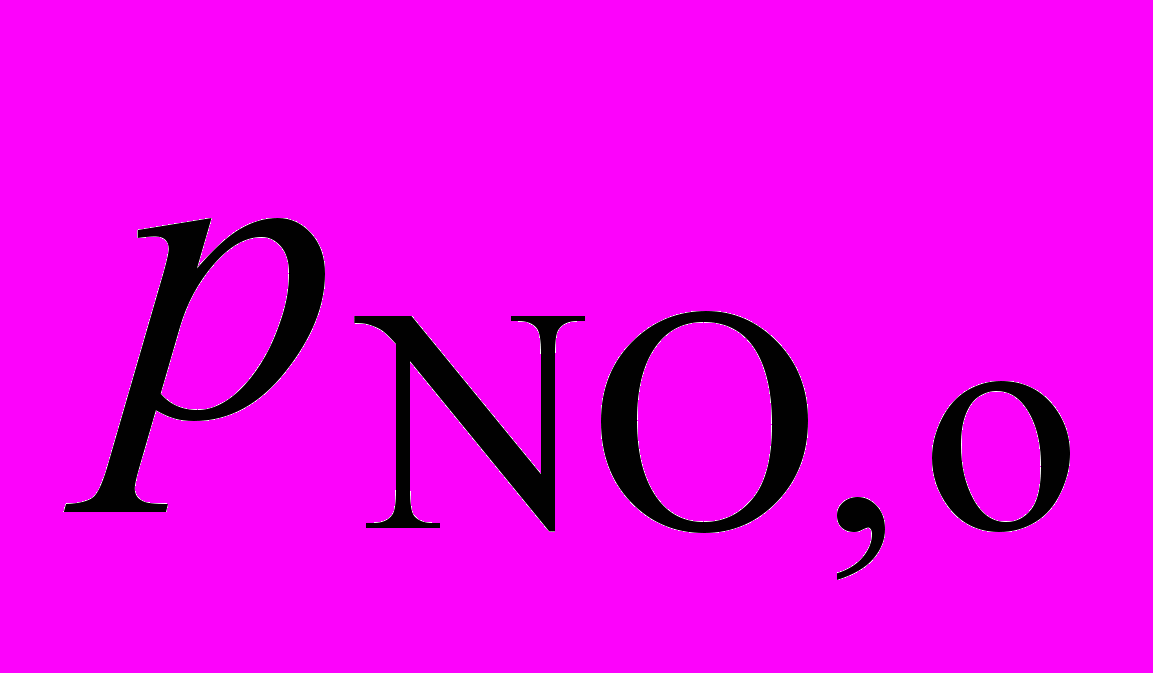 , торр , торр | wо, атм/с |
| 289 | 400 | 0,160 | 400 | 359 | 0,150 |
| 205 | 400 | 0,110 | 400 | 300 | 0,103 |
| 147 | 400 | 0,079 | 400 | 152 | 0,025 |
Определите порядок реакции по каждому веществу и получите кинетическое уравнение реакции.
