Положение металлов в периодической системе
| Вид материала | Документы |
- Реферат по теме: «Металлы. Свойства металлов.», 196.2kb.
- Положение металлов в Периодической системе Д. И. Менделеева, строение их атомов. Физические, 90.2kb.
- Тема: Металлы, 107.83kb.
- Задачи урока. Образовательные: обобщить и систематизировать материал по теме, углубить, 73.88kb.
- Урок тема: Металлы главных подгрупп, 62.33kb.
- Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых, 461.43kb.
- Урок по теме: «металлы, самый, самый…и его роль в организме человека», 145.15kb.
- Задачи: Обучающая: Познакомить учащихся со свойствами щелочных металлов, Щелочно-земельных, 51.5kb.
- Впервые в исследовательской литературе предпринимается попытка выявления места альманаха, 122.06kb.
- Их положение в периодической системе Д. И. Менделеева, строение атомов их кристаллов., 74.33kb.
Металлы в периодической системе. Строение атомов-металлов. Общая характеристика металлов.
Положение металлов в периодической системе
Если в таблице Д. И. Менделеева провести диагональ от бора к астату, то в главных подгруппах под диагональю окажутся атомы-металлы, а в побочных подгруппах все элементы ― металлы. Элементы, расположенные вблизи диагонали, обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых ― как неметаллы.
Строение атомов металлов
В периодах и главных подгруппах действуют закономерности в изменении металлических свойств.
Атомы многих металлов имеют 1, 2 или 3 валентных электрона, например:
Na (+ 11): 1S2 2S22p6 3S1
Са (+ 20): 1S2 2S22p6 3S23p63d0 4S2
Щелочные металлы (1 группа, главная подгруппа): ...nS1.
Щелочно-земельные (2 группа, главная подгруппа): ...nS2.
Свойства атомов–металлов находятся в периодической зависимости от их местоположения в таблице Д. И. Менделеева.
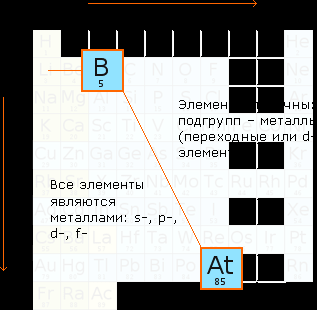
В ГЛАВНОЙ ПОДГРУППЕ:
- Число электронов на внешнем слое не изменяется.
- Радиус атома увеличивается
- Электроотрицательность уменьшается.
- Восстановительные свойства усиливаются.
- Металлические свойства усиливаются.
В ПЕРИОДЕ:
- Заряды ядер атомов увеличиваются.
- Радиусы атомов уменьшаются.
- Число электронов на внешнем слое увеличивается.
- Электроотрицательность увеличивается.
- Восстановительные свойства уменьшаются.
- Металлические свойства ослабевают.
Строение кристаллов металлов
Большинство твердых веществ существует в кристаллической форме: их частицы расположены в строгом порядке, образуя регулярную пространственную структуру ― кристаллическую решетку.
Кристалл ― твердое тело, частицы которого (атомы, молекулы, ионы) расположены в определенном, периодически повторяющемся порядке (в узлах). При мысленном соединении узлов линиями образуется пространственный каркас ― кристаллическая решетка.
Кристаллические структуры металлов в виде шаровых упаковок
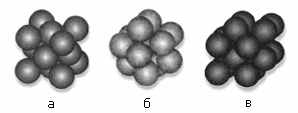
а ― медь; б ― магний; в ― α-модификация железа
Атомы металлов стремятся отдать свои внешние электроны. В куске металла, слитке или металлическом изделии атомы металла отдают внешние электроны и посылают их в этот кусок, слиток или изделие, превращаясь при этом в ионы. «Оторвавшиеся» электроны перемещаются от одного иона к другому, временно снова соединяются с ними в атомы, снова отрываются, и этот процесс происходит непрерывно. Металлы имеют кристаллическую решетку, в узлах которой находятся атомы или ионы (+); между ними находятся свободные электроны (электронный газ). Схему связи в металле можно отобразить так:
М0 ↔ nē + Мn+,
атом ― ион
где n ― число внешних электронов, участвующих в связи (у Na ― 1 ē, у Са ― 2 ē, у Al ― 3 ē).
Наблюдается этот тип связи в металлах ― простых веществах-металлах и в сплавах.
Металлическая связь ― это связь между положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов.
Металлическая связь имеет некоторое сходство с ковалентной, но и некоторое отличие, поскольку металлическая связь основана на обобществлении электронов (сходство), в обобществлении этих электронов принимают участие все атомы (отличие). Именно поэтому кристаллы с металлический связью пластичны, электропроводны и имеют металлический блеск. Однако в парообразном состоянии атомы металлов связаны между собой ковалентной связью, пары металлов состоят из отдельных молекул (одноатомных и двухатомных).
Общая характеристика металлов
| Способность атомов отдавать электроны (окисляться) | Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au ← Возрастает | |||
| Взаимодействие с кислородом воздуха | Быстро окисляются при обычной температуре | Медленно окисляются при обычной температуре или при нагревании | Не окисляются | |
| Взаимодействие с водой | При обычной температуре выделяется Н2 и образуется гидроксид | При нагревании выделяется Н2 | Н2 из воды не вытесняют | |
| Взаимодействие с кислотами | Вытесняют Н2 из разбавленных кислот | Не вытесняют Н2 из разбавленных кислот | ||
| Реагируют с конц. и разб. HNO3 и с конц. H2SO4 при нагревании | С кислотами не реагируют | |||
| Нахождение в природе | Только в соединениях | В соединениях и в свободном виде | Главным образом в свободном виде | |
| Способы получения | Электролиз расплавов | Восстановлением углем, оксидом углерода(2), алюмотермия, или электролиз водных растворов солей | | |
| Способность ионов присоединять электроны (восстанавливаться) | Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au | |||
| Возрастает → | ||||
