Положение металлов в периодической системе
| Вид материала | Документы |
СодержаниеМеталлы в природе. Способы получения металлов. Общая характеристика металлов IА-группы. Основные сведения об элементах IА группы Физические свойства Химические свойства Области применения Соединения калия и натрия КОН используется для получения жидкого мыла и стекла. NaОН Нахождение соединений металлов IA группы в природе. Общая характеристика элементов IIА-группы. Основные сведения об элементах IIА-группы Be бериллий Соединения кальция Жесткость воды Способы устранения жесткости воды Биологическая роль кальция Общая характеристика элементов IIIА-группы. Основные сведения об элементах IIIА-группы Физические свойства ... 4 Металлы в природе.Нахождение металлов в природе. Большинство металлов встречается в природе в виде различных соединений: активные металлы находятся только в виде соединений; малоактивные металлы ― в виде соединений и в свободном виде; благородные металлы (Аg, Рt, Аu...) в свободном виде. Самородные металлы обычно содержатся в небольших количествах в виде зерен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов ― самородки. Многие металлы в природе существуют в связанном состоянии в виде химических природных соединений ― минералов. Очень часто это оксиды, например минералы железа: красный железняк Fe2O3, бурый железняк 2Fe2O3 ∙ 3Н2О, магнитный железняк Fe3O4. Минералы входят в состав горных пород и руд. Рудами называют содержащие минералы природные образования, в которых металлы находятся в количествах, пригодных в технологическом и экономическом отношении для получения металлов в промышленности. По химическому составу минерала, входящего в руду, различают оксидные, сульфидные и другие руды. Обычно перед получением металлов из руды ее предварительно обогащают ― отделяют пустую горную породу, примеси, в результате образуется концентрат, служащий сырьем для металлургического производства. Способы получения металлов. Получение металлов из их соединений ― это задача металлургии. Любой металлургический процесс является процессом восстановления ионов металла с помощью различных восстановителей, в результате чего получаются металлы в свободном виде. В зависимости от способа проведения металлургического процесса различают пирометаллургию, гидрометаллургию и электрометаллургию. Пирометаллургия ― это получение металлов из их соединений при высоких температурах с помощью различных восстановителей: углерода, оксида углерода (II), водорода, металлов (алюминия, магния) и др. Примеры восстановления металлов
ZnO + C → Zn + CO2;
Fe2O3 + 3CO → 2Fe + 3CO2;
WO3 + 3H2 → W + 3Н2О; CoO + H2 → Co + Н2О;
4Al + 3MnO2 → 2Al2O3 + 3Mn; Cr2O3 + 2Al = 2Al2O3 + 2Cr;
TiCl4 + 2Mg = Ti + 2MgCl2. Гидрометаллургия ― это получение металлов, которое состоит из двух процессов: 1) природное соединение металла растворяется в кислоте, в результате чего получается раствор соли металла; 2) из полученного раствора данный металл вытесняется более активным металлом. Например:
CuO + H2SO4 = CuSO4 + H2O.
Электрометаллургия ― это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя в процессе электролиза играет электрический ток. Общая характеристика металлов IА-группы. К металлам главной подгруппы первой группы (IА-группы) относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr). Эти металлы называются щелочными, так как они и их оксиды при взаимодействии с водой образуют щелочи. Щелочные металлы относятся к s-элементам. На внешнем электронном слое у атомов металлов один s-электрон (ns1). Калий, натрий ― простые вещества 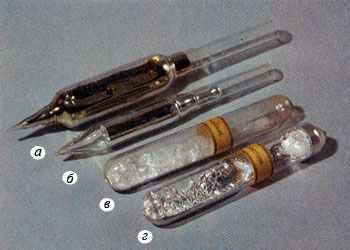 Щелочные металлы в ампулах: а - цезий; б - рубидий; в - калий; г – натрий Основные сведения об элементах IА группы
Физические свойства Калий и натрий ― мягкие серебристые металлы (режутся ножом); ρ(К) = 860 кг/м3, Тпл(К) = 63,7°С, ρ(Na) = 970 кг/м3, Тпл(Na) = 97,8°С. Обладают высокой тепло- и электропроводностью, окрашивают пламя в характерные цвета: К ― в бледно-фиолетовый цвет, Na ― в желтый цвет. 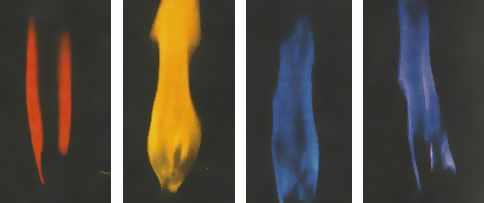 Окрашивание пламени соединениями щелочных металлов: лития, натрия, калия, рубидия Окрашивание пламени соединениями щелочных металлов: лития, натрия, калия, рубидияХимические свойства Калий и натрий ― сильные восстановители. На воздухе очень активно реагируют с кислородом и парами воды, поэтому их хранят в запаянных сосудах или в керосине. Взаимодействие с простыми веществами (неметаллами):
 Реакция серы с натрием Реакция серы с натриемВзаимодействие со сложными веществами:
 Реакция натрия, калия с водой Реакция натрия, калия с водойСпособы получения В промышленности калий и натрий получают электролизом расплавов их хлоридов и гидроксидов. Области применения Расплавы калия и натрия используются в качестве теплоносителя в атомных реакторах и в авиационных двигателях. Пары натрия используют в уличных люминесцентных светильниках. Металлический калий и натрий применяют для получения пероксида натрия (Na2О2) и супероксида калия (КО2), которые используются в подводных лодках и космических кораблях для регенерации кислорода: 2Na2О2 + 2СО2 → 2Na2СО3 + О2 2Na2О2 + 2 КО2 + 2СО2 → Na2СО3 + К2СО3 + 2О2 Натрий служит катализатором в производстве каучука. Соединения калия и натрия Оксиды ― К2О и Na2О ― твердые вещества, проявляют свойства основных оксидов: К2О + Н2О → 2КОН; К2О +2НCl → 2КCl + Н2О. Гидроксиды ― NaОН и КОН ― белые кристаллические вещества, легко растворяются в воде с выделением теплоты. NaОН и КОН называют едкими щелочами, так как они разъедают бумагу, кожу, ткани. В водных растворах NaОН и КОН проявляют все характерные свойства оснований: NaОН + НCl → NaCl + Н2О; 2NaОН + СО2 → Na2СО3 + Н2О; 6КОН + Fe2(SO4)3 → 3K2SO4 + 2Fe(OH)3. КОН используется для получения жидкого мыла и стекла. NaОН применяется для производства бумаги, искусственных тканей, мыла, для чистки нефтепроводов, в производстве искусственного волокна, в щелочных аккумуляторах. Нахождение соединений металлов IA группы в природе. Соли ― NaCl ― хлорид натрия, NaNO3 ― нитрат натрия (чилийская селитра), Na2СО3 ― карбонат натрия (сода), NaНСО3 ― гидрокарбонат натрия (пищевая сода), Na2SO4 ― сульфат натрия, Na2SO4·10Н2О ― глауберова соль, КCl ― хлорид калия, КNO3 ― нитрат калия (калийная селитра), К2SO4 ― сульфат калия, К2СО3 ― карбонат калия (поташ) ― кристаллические ионные вещества, почти все растворимые в воде. Соли натрия и калия проявляют свойства средних солей:
ссылка скрыта Сульфат натрия, сернокислый натрий (глауберова соль) NaCl ― сырье для получения натрия, гидроксида натрия, хлора, соляной кислоты; в пищевой промышленности ― консервирование продуктов и приправа к пище; в медицине для приготовления физиологического раствора (~1%-ный раствор NaCl в воде).  Увеличенный кристалл соли ссылка скрыта Кристаллы поваренной соли  Соляная шахта Соляная шахтаNa2СО3 служит для производства бумаги, мыла, стекла; NaНСО3 ― в медицине, кулинарии, в производстве минеральных вод, в огнетушителях; К2СО3 ― для получения жидкого мыла и стекла; ссылка скрыта Поташ – карбонат калия NaNO3, КNO3, КCl, К2SO4 ― важнейшие калийные удобрения.  Нитрат калия – калийная селитра Биологическая роль К+ и Na+ Калий и натрий важны для всех живых организмов. Калий необходим для нормальной работы мышечных клеток и нервной системы животных и человека, в растениях способствует процессу фотосинтеза и стимулирует процесс прорастания семян. Ионы натрия обеспечивают поддержание водного режима организма. Раствор NaCl (~1%-ный) называют физиологическим раствором, применяют для внутривенных вливаний при больших кровопотерях.  Морская соль содержит 90-95 % NaCl (хлорид натрия) и до 5 % других минералов: соли магния, соли кальция, соли калия, соли марганца, соли фосфора, соли йода и др. Все вместе свыше 40 полезных элементов таблицы Менделеева – все это существует в морской воде. Мертвое море Есть в нем что-то необычайное, почти фантастическое. В восточных землях даже самый крошечный ручеек влаги – источник жизни, там цветут сады, зреют злаки. Но эта вода убивает все живое. Многие народы побывали на этих берегах: арабы, иудеи, греки, римляне; каждый из них называл это огромное озеро на своем языке, но смысл имени был один: мертвое, гиблое, безжизненное.  Мы стояли на пустынном берегу, унылый вид которого навевал грусть: мертвый край – ни травы, ни птиц. На другой стороне озера из зеленой воды круто поднимались красноватые горы. Голые, изрезанные морщинами склоны. Казалось, какая-то-сила сорвала с них естественный покров, и обнажилась мускулатура земли. Мы решили искупаться, но вода оказалась холодной, мы лишь умылись густой, струящейся, как крутой рассол, водой. Через несколько минут лицо и руки покрылись белым налетом соли, а на губах остался нестерпимо горький вкус, от которого долго нельзя было отделаться. В этом море нельзя утонуть: густая вода сама удерживает человека на поверхности. Иногда из Иордана в Мертвое море заплывает рыба. Она гибнет уже через минуту. Одну такую рыбешку, выброшенную на берег, мы нашли. Она была твердая, как палка, в крепком солевом панцире. Это море может стать источником богатства для народа. Ведь это гигантская кладовая минеральных солей.  Каждый литр воды Мертвого моря содержит 275 граммов солей калия, натрия, брома, магния, кальция. Запасы минерального сырья исчисляются здесь в 43 миллиарда тонн. Бром и поташ можно добывать чрезвычайно дешево, и ничто не ограничивает масштабов производства. Страна располагает огромными запасами фосфатов, которые имеют большой спрос на мировом рынке, а добывается их ничтожное количество. Общая характеристика элементов IIА-группы. К металлам главной подгруппы второй группы (IIА-группы) относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra). Эти металлы называются щелочноземельными, так как их гидроксиды Ме(ОН)2 обладают щелочными свойствами, а их оксиды МеО по своей тугоплавкости сходны с оксидами тяжелых металлов, называвшимися раньше «землями». Щелочноземельные металлы относятся к s-элементам. На внешнем электронном слое у атомов металлов два s-электрона (ns2). Основные сведения об элементах IIА-группы
Щелочноземельные ― легкие серебристо-белые металлы. Стронций имеет золотистый оттенок, значительно тверже щелочных металлов. Барий по мягкости напоминает свинец. На воздухе при обычной температуре поверхность бериллия и магния покрывается защитной оксидной пленкой. Щелочноземельные металлы взаимодействуют с кислородом воздуха активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы. Кальций ― простое вещество Физические свойства Природный кальций ― смесь стабильных изотопов. Наиболее распространен кальций ― 40 (96,97 %). Кальций ― серебристо-белый металл; ρ = 1550 кг/м3, Тпл = 839°С. Окрашивает пламя в оранжево-красный цвет. Химические свойства Взаимодействие с простыми веществами (неметаллами):
 Горение кальция на воздухе  Взаимодействие кальция и серы Взаимодействие со сложными веществами:
Способы получения В промышленности кальций получают электролизом расплава СaCl2. Применение Кальций применяют для производств редких металлов и легких свинцовых сплавов (изготовление подшипников и оболочек кабелей). Соединения кальция Оксид ― СаО ― твердое белое тугоплавкое вещество, устойчивое к воздействию высоких температур, проявляет свойства основных оксидов: СаО + Н2О → Са(ОН)2, реакция сопровождается выделением большого количества теплоты и называется гашением извести, а образующийся Са(ОН)2 ― гашеной известью.  Гашение извести (реакция оксида кальция с водой) СаО + 2НCl → СаCl2 + Н2О; СаО + SO3 → СаSO4; СаО + C → СаC2 + CО. Гидроксид ― Ca(ОН)2 ― белое кристаллическое вещество, растворяется в воде. Водный раствор Ca(ОН)2 проявляет характерные свойства оснований: Ca(ОН)2 + 2НCl → СaCl2 + 2Н2О; Ca(ОН)2 + СО2 → СaСО3 + Н2О; Ca(OH)2 + SO2 → CaSO3 + H2O; 3Ca(ОН)2 + К3PO4 → Са3(PO4)2 + 6КOH. Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь Ca(ОН)2 в воде ― известковым молоком. Гашеная известь широко применяется в строительстве для приготовления строительного раствора смешиванием Ca(ОН)2 с песком и водой (для штукатурных работ, кирпичной кладки). Соли: СaСО3 карбонат кальция ― одно из самых распространенных на Земле соединений: мел, мрамор, известняк. Самый важный из этих минералов ― известняк. Он сам является прекрасным строительным камнем, кроме того, он является сырьем для получения цемента, гашеной извести, стекла, и др. Известковой щебенкой укрепляют дороги, а порошком уменьшают кислотность почв. Природный мел представляет собой останки раковин древних животных. Он используется как школьные мелки, в составе зубных паст, для производства бумаги и резины.  Мрамор (минерал для скульпторов, архитекторов и облицовщиков) ссылка скрыта   Карбонат кальция входит в состав наружного скелета кораллов Карбонат кальция входит в состав наружного скелета коралловссылка скрыта ссылка скрыта  Раковины морских животных СаSO4 ― сульфат кальция, встречается в природе в виде минерала гипса СаSO4·2Н2О, используется в строительстве, в медицине для наложения неподвижных гипсовых повязок, для получения слепков.  Кристаллы гипса СаС2 ― карбид кальция, применяется для получения ацетилена: СаС2 + Н2О → Ca(ОН)2 + С2Н2↑. Са3(PO4)2 ― фосфат кальция, входит в состав фосфоритов (горная порода) и апатитов (минералов), а также в состав костей и зубов. В организме взрослого человека содержится более 1 кг кальция в виде соединения Са3(PO4)2.  Уравнения Са(ОН)2 + СО2 = СаСО3 +Н2О и СаСО3 + Н2О + СО2 = Са(НСО3)2 играют большую роль в природе и в формировании облика нашей планеты. Углекислый газ в образе ваятеля и зодчего создает подземные дворцы в толщах карбонатных пород. Он способен под землей перемещать сотни и тысячи тонн известняка. По трещинам в горных породах вода, содержащая растворенный в ней углекислый газ, попадает в толщу известняка, образуя полости ― карстовые пещеры. Гидрокарбонат кальция существует только в растворе. Грунтовые воды перемещаются в земной коре, испаряя в подходящих условиях воду: Са(НСО3)2 = СаСО3 + Н2О + СО2 , так образуются сталактиты и сталагмиты, схема образования которых предложена известным геохимиком А. Е. Ферсманом. Очень много карстовых пещер в Крыму. Их изучением занимается наука спелеология. Жесткость воды Жесткая вода образует накипь на котлах, которая приводит к коррозии стенок котлов и повышает расход топлива. В ней плохо разваривается мясо, овощи (очень жесткая вода непригодна для питья). Мыло в такой воде плохо пенится, образуются хлопья. Расход мыла при стирке повышается на 25-30 %. Мало растворимые соли кальция и магния оседают на ткани, делая ее грубой, с плохой воздухо- и влагопроницаемостью. Ткань быстрее изнашивается, рвется. А при мытье головы волосы делаются липкими и ломкими. Поэтому для стирки в жесткой воде лучше применять синтетические моющие средства, а для мытья гели и шампуни. Общая жесткость воды представляет собой сумму временной и постоянной жесткости. Способы устранения жесткости воды
Биологическая роль кальция В живых организмах кальций играет большую роль. Так, у человека он участвует в процессе свертывания крови, образовании кровяного сгустка ― тромба. Кальция много не только в неживой природе: он входит в состав тканей организма, поэтому необходимо постоянно пополнять его запас. Кальция много в молоке, твороге и других молочных продуктах. Суточная потребность в кальции у человека ― 800 мкг/сутки или 0,5 литра молока или 100 г сыра. Детям необходимо 1,5-2 г/сутки. При недостатке кальция кости становятся хрупкими, ломкими, может возникнуть заболевание ― рахит. Общая характеристика элементов IIIА-группы. К элементам главной подгруппы третьей группы (IIIА-группы) относятся бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl). Все элементы IIIА-группы относятся к р-элементам. На внешнем электронном слое у атомов два s-электрона и один р-электрон (ns2 np1), и все, за исключением бора, являются типичными металлами. Основные сведения об элементах IIIА-группы
*Алюмосиликаты: Al2O3·2SiO2·nH2O ― белая глина, K2O·Al2O3·2SiO2 полевой шпат, K2O·Al2O3·2SiO2·H2O ― слюда.   Белая глина Полевой шпат  Слюда Алюминий ― простое вещество Алюминий ― самый распространенный металл в природе. Общее содержание алюминия в земной коре составляет 8,8%. В свободном виде алюминия в природе нет.   Алюминиевая проволока Листовой алюминий Физические свойства Алюминий ― серебристо-белый легкий пластичный металл, легко вытягивается в проволоку и прокатывается в фольгу толщиной до 0,01 мм; ρ = 2700 кг/м3, Тпл = 660°С. Удельное электросопротивление 0,029 мкОм·м. С другими металлами образует легкие и прочные сплавы. Химические свойства Алюминий ― очень активный металл. В ряду напряжений он находится сразу же после щелочных и щелочноземельных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой пленкой оксида, которая защищает металл от воздействия компонентов воздуха и воды. Алюминий, как и все металлы, легко реагируют с неметаллами. Взаимодействие с простыми веществами (неметаллами):
  Реакция алюминия с бромом Реакция алюминия с йодом  Взаимодействие алюминия с кислородом Взаимодействие со сложными веществами:
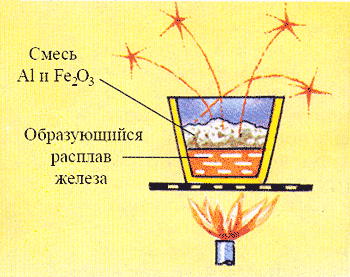 Алюмотермия - восстановление металлов из их оксидов под действием алюминия Способы получения В промышленности алюминий получают электролизом расплава Al2O3. Применение Алюминий почти втрое легче стали и устойчив к коррозии, поэтому выгоднее в тех областях применения, где требуются эти свойства: машиностроении, авиастроении, судостроении. Алюминиевой посудой широко пользуются в быту. Соединения алюминия Оксид алюминия ― Al2O3 ― твердое белое вещество нерастворимое в воде, устойчивое к воздействию высоких температур, Тпл = 2050°С, проявляет свойства амфотерных оксидов: Al2O3 + 2NaОH → 2NaAlО2 + 2Н2О; Al2O3 + 6НCl → 2AlCl3 + 3Н2О. Оксид алюминия используется для получения алюминия, абразивных материалов, драгоценных камней (рубин, сапфир).   Рубин Сапфир Гидроксид алюминия ― Al(ОН)3 ― белое твердое вещество, не растворяется в воде, обладает амфотерными свойствами. Al(ОН)3 + 3НCl → AlCl3 + 3Н2О; Al(ОН)3 + NaОH → NaAlО2 + 2Н2О. При высокой температуре Al(ОН)3 разлагается на оксид алюминия и воду: 2Al(ОН)3 → Al2O3 + 3Н2О. Гидроксид алюминия используют для очистки воды. Соли: Все соли алюминия, кроме AlPO4 и Al2(SiO3)3, хорошо растворимы в воде и проявляют все свойства солей. AlCl3 + 3NaOH → Al(ОН)3↓ + 3NaCl. Характерным свойством солей алюминия является их гидролиз: Al2S3 + 6Н2О → Al(ОН)3↓ + 3H2S↑. Соли AlCl3, AlBr3, AlI3 используются в качестве катализаторов при переработке нефти. КAl(SO4)2·12Н2О применяется для дубления кожи и в производстве хлопчатобумажных тканей. Биологическая роль алюминия Алюминий входит в состав межклеточных растворов и тканей живых организмов. Больше всего алюминия, в основном в связанном виде с белками, концентрируется в мозге, печени и легких. Из растений наиболее богаты алюминием перец, огурцы, абрикосы и черная смородина. Однако избыток алюминия в пище оказывает вредное влияние на организмы. |
