Курс лекций 1999-2000 гг
| Вид материала | Курс лекций |
- Курс лекций для студентов заочного обучения Бурмистрова Л. А., Финансы предприятий:, 1991.45kb.
- Курс лекций. Спб, 1118.16kb.
- Курс лекций. Спб, 172.51kb.
- Курс лекций. Спб, 639.95kb.
- Цнж курс «Управление газетой», 1997 г.; «Триз-шанс» (Москва) курс «Приемы рекламы, 21.89kb.
- Курс лекций 1999-2000, 11782.85kb.
- В. Б. Аксенов Краткий курс лекций, 1098.72kb.
- Курс лекций Барнаул 2001 удк 621. 385 Хмелев В. Н., Обложкина А. Д. Материаловедение, 1417.04kb.
- Основы политологии: Курс лекций. 2-е изд., доп. Ростов на/Дону.: Феникс, 1999. 573, 14.9kb.
- Г. И. Невельского Н. Н. Жеретинцева Курс лекции, 1964.49kb.
Лекция 7
Разобравшись с элементарными взаимодействиями, — рассмотрим сегодня вторичную структуру белков. Прежде всего у нас речь пойдет о регулярных вторичных структурах — об -спиралях и о -структуре, — но не только о них.
Укладка и -структур в глобулу определяет третичную структуру белка (Рис.7-1). Эти вторичные структуры отличаются определенными, периодическими конформациями главной цепи — при разнообразии конформаций боковых групп.
Рис.7-1. Вторичная структура полипептидной цепи (-спираль и тяж -листа) и третичная структура белковой глобулы.
Начнем со спиралей. Они могут быть левые и правые (Рис.7-2), у них может быть разный период и шаг. Правые (R) спирали приходят к нам, завиваясь против часовой стрелки (что отвечает положительному отсчету угла в тригонометрии); левые (L) — приходят, вращаясь по стрелке.
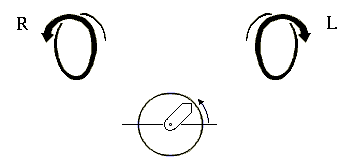
Рис.7-2. Правые (R) и левые (L) спирали. Под ними показан отсчет положительного угла в тригонометрии: при этом "близкая к нам" стрелка вращается против хода часов.
Важнейшие спирали в полипептидной цепи держатся водородными связями, где С=О группы остова полипептида связаны с лежащими от них в направлении С-конца цепи H-N группами. В принципе, возможны следующие спирали, стянутые Н-связями (Рис.7-3): 27, 310, 413 (обычно именуемая ) и 516 (она же ). Здесь в названии "27" — "2" означает связь со 2-м по цепи остатком (см. Рис.7-3), а "7" — число атомов в цикле (O......H-N-C'-C-N-C'), замыкаемом этой связью. Тот же смысл имеют цифры и в названии других спиралей.

Рис.7-3. Водородные связи (они показаны стрелками), характерные для разных спиралей.
Какие из этих спиральных структур преобладают в белках? -спирали. Почему? Ответ на этот вопрос дает карта Рамачандрана для типичного аминокислотного остатка — аланина (Рис.7- 4), на которой отмечены конформации, периодическое повторение которых приводит к завязыванию изображенных на Рис.7-3 водородных связей.
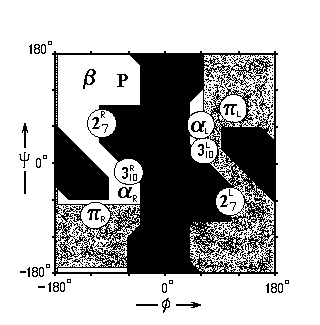
Рис.7-4. Конформации различных вторичных структур на фоне карты разрешенных и запрещенных конформаций аминокислотных остатков. 27R, 27L: правая и левая спираль 27; 310R, 310L: правая и левая спираль 310; R, L — правая и левая -спираль; R, L — правая и левая -спираль. — -структура (подробности см. на Рис.7-8б). Р — спираль Poly(Pro)II.
 — конформации, разрешенные для аланина (Ala);
— конформации, разрешенные для аланина (Ala);  — области, разрешенные лишь для глицина, но не для аланина и других остатков;
— области, разрешенные лишь для глицина, но не для аланина и других остатков;  — области, запрещенные для всех остатков. и — углы внутреннего вращения в белковой цепи.
— области, запрещенные для всех остатков. и — углы внутреннего вращения в белковой цепи. Видно, что только спираль R (-правая) лежит достаточно глубоко внутри области, разрешенной для аланина (и для всех других остатков). Другие спирали лежат либо на краю этой области (например, левая спираль L или правая спираль 310), где конформационные напряжения уже возрастают, либо в области, доступной только глицину.
Поэтому можно ожидать, что именно правая -спираль должна быть, как правило, более стабильной, и потому преобладать в белках — что и наблюдается. В правой -спирали (Рис.7-5) все атомы упакованы оптимально: плотно, но без напряжений; поэтому не удивительно, что в белках таких спиралей много, а в фибриллярных белках они достигают гигантской длины и включают сотни аминокислотных остатков.
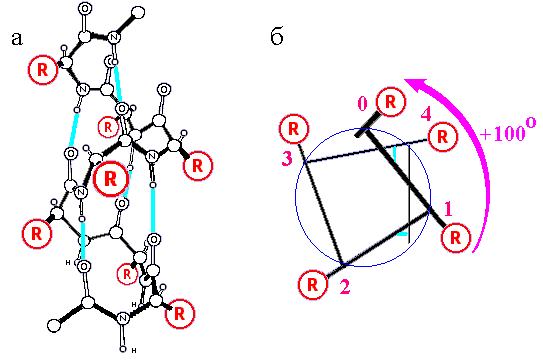
Рис.7-5. Правая -спираль. (а) Атомарная структура. R — боковые группы. Голубые линии — водородные связи. (б) Схематическое изображение одного витка той же -спирали, вид с торца. Стрелка показывает поворот спирали (в расчете на один остаток) по мере ее приближения к нам. Картинка (а) взята из [3] и адаптирована.
Левых -спиралей в белках практически нет. Нет и спиралей 27, которые, мало того что лежат на самом краю разрешенной области, но еще имеют энергетически невыгодный, почти прямой угол схождения N-H и О=С групп.
Практически нет в белках и спиралей . Они тоже лежат на самом краю разрешенной области, да еще и витки в них слишком широки, так что -спирали имеют энергетически невыгодную пустую "дырку" на оси. А вот спирали 310 (в основном — правые, — левые пригодны практически лишь для глицинов) в белках есть — правда, в виде коротких (из трех-четырех остатков) и деформированных фрагментов (из-за стерических напряжений: слишком тугая спираль! — соответствующая ей конформация лежит на самом краю разрешенной области).
Отметим одно свойство спиралей, хорошо видное на Рис.7-5а: на их N-конце сидят свободные от внутриспиральных водородных связей Н атомы N-H групп, а на С-конце — свободные от водородных связей О атомы С=О групп. Так как электронное облако с Н атома частично стянуто электроотрицательным N атомом, а электроотрицательный О атом сам стягивает электрон с С' атома, — N-конец спирали несет положительный, а С-конец — отрицательный парциальный заряд. То есть спираль представляет собой длинный диполь: величина суммарного (поставляемого тремя NH-группами) парциального "+" заряда на ее N-конце составляет около половины протонного, а "-" заряда на С-конце -спирали — около половины электронного заряда.
Теперь рассмотрим регулярные структуры без водородных связей внутри каждой, но соединенные водородными связями между собой.
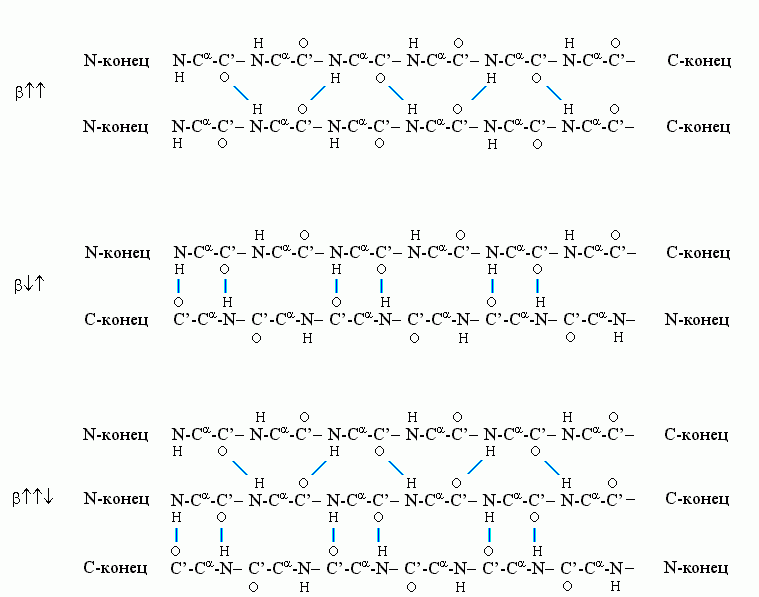
Рис.7-6. Схема хода цепи и расположения водородных связей в параллельной
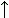
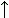 , антипараллельной
, антипараллельной 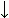
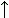 и смешанной
и смешанной 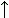
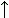
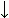 -структуре. Видно, что Н-связи одного остатка в -тяже направлены одну сторону, следующего — в противоположную, и т.д.
-структуре. Видно, что Н-связи одного остатка в -тяже направлены одну сторону, следующего — в противоположную, и т.д. Почти вытянутые (все углы в главной цепи — почти trans), слегка скрученные цепи образуют -структуру. Она бывает (Рис.7-6) параллельной (
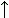
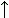 ), антипараллельной (
), антипараллельной (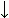
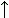 ) и смешанной (состоящей из
) и смешанной (состоящей из 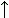
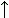 и
и 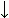
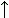 ).
). -структура стянута водородными связями (символы / , \ и | на схемах 7-6). Она существует в виде более или менее крупных листов. Так как поверхность структуры — рифленая, ее еще называют "складчатой -структурой" (Рис.7-7).
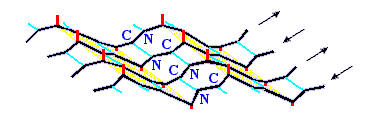
Рис.7-7. Лист структуры имеет складчатую поверхность. Боковые группы (см. маленькие отростки) расположены на складках; каждая обращена в ту же, что и складка, сторону, т.е. направленные вниз и вверх боковые группы чередуются вдоль -тяжа. Картинка взята из [3] и адаптирована.
-структурные листы всегда несколько скручены (Рис.7-8а) из-за того, что несколько скручены (Рис.7-8б) отдельные -тяжи — и потому по ходу тяжа несколько меняется направленность водородных связей. А тяжи, в свою очередь, скручены из-за того, что наиболее энергетически выгодная конформация остатков с боковыми группами сдвинута к центру стерически разрешенной области (Рис.7-8в). Скрученность отдельного -тяжа — левая (у L аминокислот! — у D было бы наоборот): вы видите (Рис.7-8б), что боковые группы тяжа поворачиваются по часовой стрелке (на -165o на каждый остаток) по мере приближения тяжа к нам.
В результате, поворачиваются и Н-связи (на -165o на каждый остаток, т.е. на -330o=+30o на пару остатков - повторяющуюся единицу -структуры), так что угол между соседними тяжами -структуры (если смотреть с кромки листа, Рис.7-8а) обычно составляет около -25о ("минус", как всегда, означает, что ближний к нам -тяж повернут по часовой стрелки относительно более далекого). Таким образом, -лист имеет левое скручивание, если смотреть с края этого листа (и правое, если смотреть вдоль -тяжей на поворот линии Н-связей).
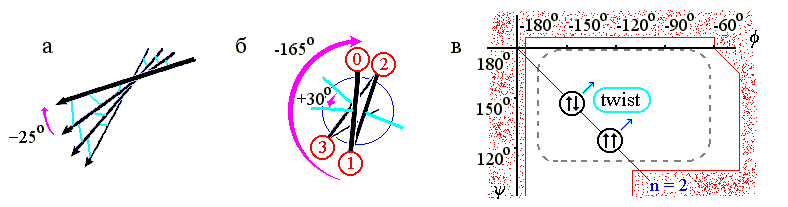
Рис.7-8. (а) Скрученность -листа. -тяжи изображены стрелками, водородные связи между ними — голубыми линиями. (б) Схематическое изображение одного витка -тяжа, вид с торца. Кружки — боковые группы; их номера возрастают по мере удаления от читателя. Голубые линии укаывают направление С=О групп, завязывающих Н-связи в листе, большей стрелкой — поворот -тяжа при приближении к нам на один остаток, меньшей стрелкой — поворот направленных в одну сторону водородных связей при приближении к нам на два остатка. (в) Конформация идеальной (не скрученной) параллельной (
 ) и антипараллельной (
) и антипараллельной (
 ) -структуры для поли(Gly), и усредненная конформация реальной (сложенной из L аминокислот) скрученной (twist) -структуры. Пунктир показывает область энергетического минимума для отдельно взятого остатка Ala; контуром показаны границы области разрешенных конформаций этого остатка. Диагональ -карты соответствует плоской периодичной структуре, имеющей 2 остатка на виток. Над диагональю лежат левые (L) спирали, под ней — правые (R). Картинки (а), (в) взяты из [3] и адаптированы.
) -структуры для поли(Gly), и усредненная конформация реальной (сложенной из L аминокислот) скрученной (twist) -структуры. Пунктир показывает область энергетического минимума для отдельно взятого остатка Ala; контуром показаны границы области разрешенных конформаций этого остатка. Диагональ -карты соответствует плоской периодичной структуре, имеющей 2 остатка на виток. Над диагональю лежат левые (L) спирали, под ней — правые (R). Картинки (а), (в) взяты из [3] и адаптированы. Есть спирали и без водородных связей, где плотная (а значит — энергетически выгодная) упаковка держится чисто на Вандерваальсовых контактах. Это — полипролиновая спираль. При этом три скрученные в довольно растянутую левую спираль цепи образуют правую суперсуперспираль — они плотно закручиваются друг вокруг друга. Из двух возможных типов полипролиновой спирали для нас важна спираль poly(Pro)II: она реализуется в коллагене. В этой спирали пептидные группы пролинов находятся в обычной (trans) конформации. Отложим более подробное рассмотрение коллагеновой спирали до соответствующего места курса, а пока ограничимся общим ее видом (Рис.7-9) и отметим на Рис.7-4 область соответствующей ей конформации цепи: видно, что она довольно близка к структуре.
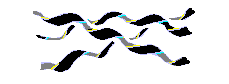
Рис.7-9. Общий вид тройной правой суперспирали из левых спиралей Poly(Pro)II.
Параметры наиболее важных регулярных вторичных структур белковых цепей суммируются в следующей таблице:
Таблица 7/1. Основные геометрические параметры наиболее распространенных в белках вторичных структур.
-
Структура
H-связь
Остаток/виток
Смещение/остаток ( )
)
Спираль R
CO0—HN+4
+3.6
1.5
-600
-450
Спираль (310)R
CO0—HN+3
+3
2.0
-500
-250
Лист 
меж цепей*
-2.3
3.4
-1350
+1500
Лист 
меж цепей*
-2.3
3.2
-1200
+1350
Спираль Poly(Pro) II
нет
-3
3.0
-800
+1550
* Расстояние между тяжами в -листе: 4.8

Примечание. Данные взяты из [3, 6]. Все цифры округлены. "+" означает правую спираль, "-" — левую.
Кроме регулярных, в полипептидных цепях есть еще и нерегулярные вторичные структуры, — т.е. стандартные структуры, не образующие длинных периодических систем.
Это — так называемые -изгибы ("" — потому, что они часто стягивают верхушки соседних -тяжей в антипараллельных шпильках). Характерный вид наиболее важных -изгибов и конформации входящих в них остатков представлены на Рис.7-10. Сравните Рис.7-10в с Рис.7-4 и Таблицей 7/1, и обратите внимание на то, что изгибы I (и особенно III) близки по конформации к витку спирали 310.
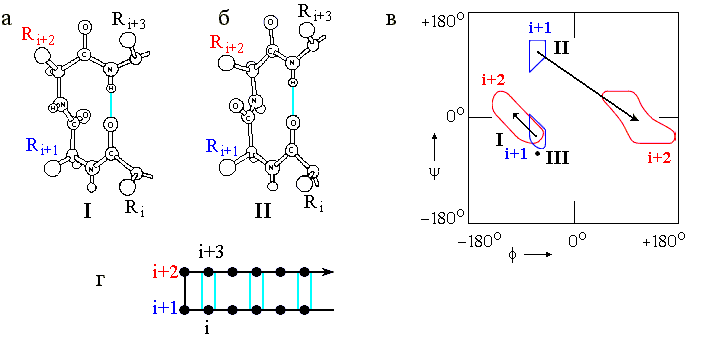
Рис.7-10. -изгибы. (а) -изгиб типа I (-изгиб типа III очень на него похож и потому не нарисован отдельно). (б) -изгиб типа II. Его основное отличие от -изгиба I — переворот пептидной группы, соединяющей остатки i+1 и i+2. (в) Конформации фиксируемых водородной связью остатков i+1 и i+2 в -изгибах. В -изгибе III оба остатка i+1 и i+2 имеют одинаковую конформацию (отмечена жирной точкой). Конформации остатков i и i+3 в -изгибах не фиксированы; они фиксируются -структурой - если она прирастает из изгиба, как на рисунке (г), где дана схема -шпильки с -изгибом в ее вершине. Картинки (а), (б), (в) взяты из [3] и адаптированы.
В заключение — несколько слов о том, как экспериментально обнаруживается вторичная структура.
Конечно, если сделан рентген (или точный многомерный ЯМР) белка — вторичная структура берется из атомных координат.
Впрочем, ЯМР (ядерный магнитный резонанс), который хорошо фиксирует сближенность (до 4 — 5 и менее
 ) ядер Н-атомов, позволяет определять вторичную структуру даже тогда, когда полную атомную структуру белка построить еще не удается.
) ядер Н-атомов, позволяет определять вторичную структуру даже тогда, когда полную атомную структуру белка построить еще не удается. Метод ЯМР основан на возбуждении радиоволнами ориентированных в сильном магнитном поле ядер, — тех ядер, которые имеют нечетное число нуклонов (протонов и нейтронов): только они имеют спин и, вследствие этого, — магнитный момент. В белке это — природные "легкие" водороды (1H), а также вводимые изотопы (13С, 15N и т.д.). Магнитный резонанс наступает на радиочастоте, характерной для данного атома, причем эта частота слегка модифицируется его соседями по химическим связям и по пространству (что и позволяет судить, атом какого остатка возбудился). Возбужденное ядро может передать свое возбуждение соседнему с ним в пространстве ядру с магнитным моментом, и оно отрапортует о полученном возбуждении уже на своей частоте (что и позволит судить о сближенности этих двух магнитных ядер).
Для -спиралей особенно характерна сближенность H-атома группы CH с H-атомом NH-группы 4-го от нее (к С-концу цепи) остатка, а для -структуры — сближенность Н-атомов NH- и CH-групп у остатков, непосредственно соседствующих по цепи, и у остатков, связанных Н-связями в -листе (Рис.7-11).
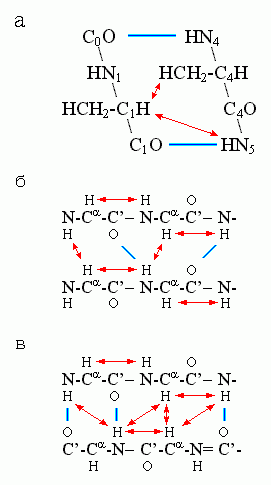
Рис.7-11. Сближенность () ядер водородных атомов, наиболее характерная для -спирали (а), параллельной (б) и антипараллельной (в) -структуры. Индексы при атомах главной цепи в рисунке (а) показывают взаимное расположение остатков в цепи.
Однако наиболее важную, пожалуй, роль в определении вторичной структуры играет метод кругового дихроизма (КД). Он не требует знания общей пространственной структуры белка. Наоборот, структурное исследование белка обычно начинается с получения спектров КД. Метод КД основан на различии в поглощении право- и левополяризованного света в спиралях различной закрученности. Из-за этого различия в поглощении плоскополяризованный свет превращается в эллиптически поляризованный.
Характерные спектры эллиптичности в области "дальнего" ультрафиолета (190-240 нм) приведены на Рис.7-12. Показанные спектры зависят от асимметрии окружения пептидных групп и потому рапортуют о том, есть ли в белке вторичная структуре, какая, и сколько ее.
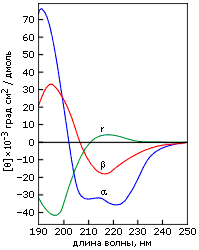
Рис.7-12. Характерные формы спектров КД для полилизина в форме -спирали (), -структуры () и неупорядоченного клубка (r). Картинка взята из [6] и адаптирована.
Пептидные группы оптически возбуждаются в "дальнем УФ", при длине волны порядка 200 нм. Это — примерно вдвое большая длина волны, чем та, на которой возбуждаются отдельные атомы. Причина того, что пептидная группа возбуждается более длинноволновым (т.е. менее "жестким") светом, — в делокализации электронов пептидной группы по нескольким атомам, о чем мы уже говорили.
Еще больше делокализованы электроны в ароматических группах — там они "размазаны" не по трем, как в пептидной группе, а по шести атомам. Спектры КД ароматических групп приходятся на длину волны ~250-280 нм (хотя "хвост" этих спектров доходит до ~220 нм). В этом диапазоне длин волн, ~250-280 нм, (в "ближнем" ультрафиолете) изучают асимметрию окружения ароматических боковых групп, — т.е. эффекты, связанные с образованием уже не вторичной, а третичной структуры белка.
В скобках отмечу, что при еще большей делокализации электрона (в более крупных молекулах с кратными связями) — он начинает возбуждаться уже не ультрафиолетовым, а видимым светом (400- 600 нм): свечение таких молекул видно на глаз, т.е. они являются красителями.
Кроме ультрафиолетовых спектров, для регистрации вторичной структуры полипептидов и белков используются инфракрасные спектры. Они отражают различия в колебаниях пептидных групп, вовлеченных и не вовлеченных в разные вторичные структуры (Рис.7-13). Эти измерения более сложны, чем измерения УФ-спектров, так как обычная вода (H2O) поглощает в той же области; поэтому такие измерения обычно проводятся в тяжелой воде (D2O). Кроме того, они требуют больше белка, чем измерения УФ-спектров, и более высоких концентраций белка в растворе.
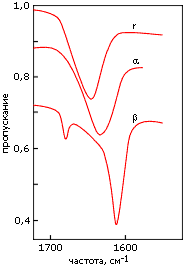
Рис.7-13. Характерные формы инфракрасных спектров пропускания, измеренных в тяжелой воде (D2O) для полилизина в форме -спирали (), -структуры () и неупорядоченного клубка (r). Измерения, в данном случае, проводились в области "амид I", отражающей колебания С=О связи. Картинка взята из [6] и адаптирована.
