Курс лекций 1999-2000 гг
| Вид материала | Курс лекций |
- Курс лекций для студентов заочного обучения Бурмистрова Л. А., Финансы предприятий:, 1991.45kb.
- Курс лекций. Спб, 1118.16kb.
- Курс лекций. Спб, 172.51kb.
- Курс лекций. Спб, 639.95kb.
- Цнж курс «Управление газетой», 1997 г.; «Триз-шанс» (Москва) курс «Приемы рекламы, 21.89kb.
- Курс лекций 1999-2000, 11782.85kb.
- В. Б. Аксенов Краткий курс лекций, 1098.72kb.
- Курс лекций Барнаул 2001 удк 621. 385 Хмелев В. Н., Обложкина А. Д. Материаловедение, 1417.04kb.
- Основы политологии: Курс лекций. 2-е изд., доп. Ростов на/Дону.: Феникс, 1999. 573, 14.9kb.
- Г. И. Невельского Н. Н. Жеретинцева Курс лекции, 1964.49kb.
10
Обсудим теперь свойства боковых групп аминокислотных остатков. В особенности я хочу остановиться на том, какие именно структуры стабилизуют те или иные остатки.
Список 20 "стандартных", т.е. кодируемых ДНК аминокислотных остатков дан в Таблице 10/1; там же дан их молекулярный вес и встречаемость в белках. Структуры аминокислотных остатков представлены на картинке 10-1.
Таблица 10/1. Основные свойства аминокислотных остатков
| _____ Аминокислотный остаток _____ | % в белках E.coli | Мол вес при pH7 (дальтон) | Gводаспирт бок. группы при 250С (ккал/моль) | ||
| название | код | ||||
| | 3-букв. | 1-букв. | |||
| Глицин | Gly | G | 8 | 57 | 0 |
| Аланин | Ala | A | 13 | 71 | -0.4 |
| Пролин | Pro | P | 5 | 97 | -1.0 |
| Глутаминовая кислота | Glu | E | 6 | 128 | +0.9 |
| Глутамин | Gln | Q | 5 | 128 | +.03 |
| Аспарагиновая кислота | Asp | D | 5 | 114 | +1.1 |
| Аспарагин | Asn | N | 5 | 114 | +0.8 |
| Серин | Ser | S | 6 | 87 | +0.1 |
| Гистидин | His | H | 1 | 137 | -0.2 |
| Лизин | Lys | K | 7 | 129 | +1.5 |
| Аргинин | Arg | R | 5 | 157 | +1.5 |
| Треонин | Thr | T | 5 | 101 | -0.3 |
| Валин | Val | V | 6 | 99 | -2.4 |
| Изолейцин | Ile | I | 4 | 113 | -1.6 |
| Лейцин | Leu | L | 8 | 113 | -2.3 |
| Метионин | Met | M | 4 | 131 | -1.6 |
| Фенилаланин | Phe | F | 3 | 147 | -2.4 |
| Тирозин | Tyr | Y | 2 | 163 | -1.3 |
| Цистеин | Cys | C | 2 | 103 | -2.1 |
| Триптофан | Trp | W | 1 | 186 | -3.0 |
Примечания. Все данные взяты из [3], — за исключением данных по гидрофобности боковых групп, которые взяты из I.I.Fauchere, V.Pliska, Eur. J. Med. Chem.-Chim. Ther. (1983) 18:369. Объем (в
 3), приходящийся на аминокислотный остаток в белке или в растворе, близок к его молекулярному весу в (дальтонах), умноженному на 1.3. Точнее, — процентов на 5 побольше, чем (мол. вес) x 1.3, если в остатке много алифатических (-СН2-, -СН3) групп, и процентов на 5 поменьше, чем (мол. вес) x 1.3, если в остатке много полярных (О, N) атомов.
3), приходящийся на аминокислотный остаток в белке или в растворе, близок к его молекулярному весу в (дальтонах), умноженному на 1.3. Точнее, — процентов на 5 побольше, чем (мол. вес) x 1.3, если в остатке много алифатических (-СН2-, -СН3) групп, и процентов на 5 поменьше, чем (мол. вес) x 1.3, если в остатке много полярных (О, N) атомов. 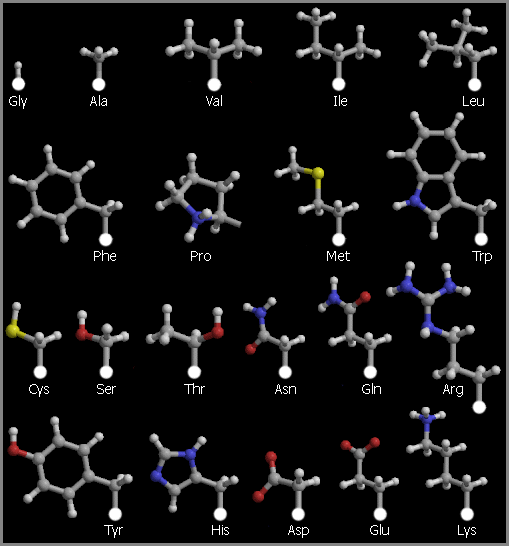
Рис.10-1. Боковые цепи двадцати стандартных аминокислотных остатков.
Рассмотрим теперь структурные тенденции аминокислотных остатков; они стали известными после многолетнего статистического исследования белковых структур. Такие исследования отвечают на вопрос: "Что чаще всего бывает, и чего чаще всего не бывает?".
Для систематизации ответов полезной может быть следующая ниже Таблица 10/2, куда я вписал, наряду со встречаемостью аминокислотных остатков в разных местах белков, такие свойства остатков, как: наличие NH группы в главной цепи (ее нет только у иминокислоты пролина); наличие С атома в боковой цепи (его нет только у глицина); число не-водородных атомов в боковой цепи; наличие и вид полярных группировок в боковой цепи (диполей или зарядов — со знаком; жирным выделено то зарядовое состояние, что относится к "нормальному" рН7).
Таблица 10/2. Основные структурные свойства аминокислотных остатков
| A.к. | Наличие | число | Диполь/заряд | pK | Яркая тенденция быть в: | ||||||||
| ост. | NH | C | | до | спираль | за | | клубок | ядро | ||||
| N | |N | | C| | C | | ||||||||
| Gly |  | | | | | | | - | | | - | + | |
| Ala |  |  | | | | | | + | | | | - | |
| Pro | |  | 1 | | | | + | - | - | - | - | + | |
| Glu |  |  | 1 | COOH CO2- | 4.3 | + | + | | - | - | - | | - |
| Asp |  |  | 1 | COOH CO2- | 3.9 | + | + | - | - | - | - | + | - |
| Gln |  |  | 1 | OCNH2 | | | | | | | | | - |
| Asn |  |  | 1 | OCNH2 | | + | | - | | + | - | + | - |
| Ser |  |  | 1 | OH | | + | | | | | | + | |
| His |  |  | 1 | NH; и N NH+ | 6.5 | | - | | + | + | | | |
| Lys |  |  | 1 | NH2 NH3+ | 10.5 | - | - | | + | + | - | | - |
| Arg |  |  | 1 | HNC(NH2)2+ | 12.5 | - | - | | + | + | - | + | - |
| Thr |  |  | 2 | OH | | + | | | | | + | | |
| Ile |  |  | 2 | | | | | | | | + | - | + |
| Val |  |  | 2 | | | | | | | | + | - | + |
| Leu |  |  | 1 | | | | | + | | | + | - | + |
| Met |  |  | 1 | | | | | + | | | + | - | + |
| Phe |  |  | 1 | | | | | | | | + | - | + |
| Tyr |  |  | 1 | OH O- | 10.1 | | | - | | | + | | + |
| Cys |  |  | 1 | SH S- | 9.2 | | | - | | | + | | + |
| Trp |  |  | 1 | NH | | | | | | | + | | + |
Примечания. К "структурным свойствам" отнесена тенденция быть в -спирали (), и особо — в ее N- и С-концевых витках, а также — непосредственно перед N- и за С-концом спирали; тенденция быть в -структуре; тенденция быть в нерегулярных структурах, т.е. "петлях" (включая сюда и -изгибы цепи); и, наконец, — тенденция быть в гидрофобном ядре глобулы, а не на ее поверхности. Тенденцию "быть" я отмечал значком "+", "не быть " — значком "-". Жирным значком отмечалась особо сильная тенденция.
Попробуем понять основные закономерности этой таблицы исходя из того, что мы уже изучили. При этом мы будем использовать следующую логику: так как белок в целом стабилен — значит, он должен в основном состоять из стабильных элементов, т.е. именно они должны наблюдаться в его структуре чаще всего, а нестабильные должны наблюдаться редко.
Почему пролин не любит вторичной структуры? — Потому, что у него нет NH-группы в главной цепи, т.е. у него вдвое уменьшена возможность завязывать водородные связи — а именно на них и держится вторичная структура. Почему он, тем не менее, любит N-конец спирали? — Потому, что здесь, на N-конце, NH-группы "торчат" из спирали — т.е. они и так не вовлечены в водородные связи — и здесь пролину нечего терять... С другой стороны, угол в пролине фиксирован его кольцом примерно при -60о — т.е. его конформация уже почти "готова" для -спирали (Рис.10-2а).
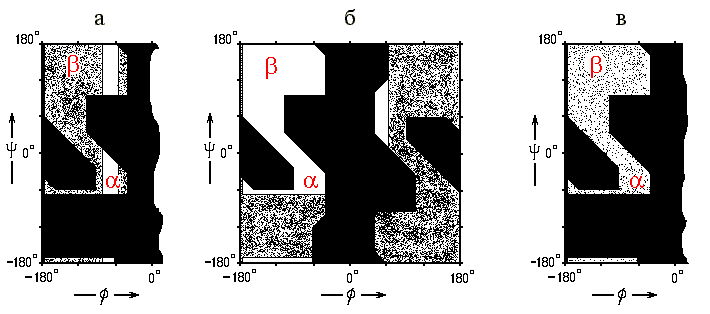
Рис.10-2. Запрещенные и разрешенные конформации различных аминокислотных остатков и — на их фоне — конформации и структуры. (а) Разрешенные (
 ) для пролина конформации на фоне конформаций, разрешенных для аланина (
) для пролина конформации на фоне конформаций, разрешенных для аланина ( );
);  — конформации, запрещенные для них обоих. (б) Разрешенные (
— конформации, запрещенные для них обоих. (б) Разрешенные ( ) конформации аланина на фоне конформаций
) конформации аланина на фоне конформаций  , разрешенные лишь для глицина;
, разрешенные лишь для глицина;  — области, запрещенные для всех остатков. (в) Карта запрещенных (
— области, запрещенные для всех остатков. (в) Карта запрещенных ( ) и разрешенных (
) и разрешенных ( ,
,  ) конформаций более крупных остатков. В области
) конформаций более крупных остатков. В области  разрешены все конформации боковой группы по углу 1, в области
разрешены все конформации боковой группы по углу 1, в области  часть углов 1 запрещена.
часть углов 1 запрещена. Почему глицин не любит вторичной структуры и предпочитает нерегулярные участки ("клубок")? — Потому, что для него допустима очень широкая область углов () на карте Рамачандрана (Рис.10-2б), — ему легко принимать самые разнообразные конформации, лежащие вне вторичной структуры.
Наоборот, аланин — с более узкой, но включающей и , и конформацию разрешенной областью на карте Рамачандрана (Рис.10-2б) — предпочитает нерегулярным конформациям -спираль (и отчасти -структуру).
Остальные гидрофобные остатки (т.е. остатки без зарядов и диполей в боковой цепи) предпочитают, как правило, -структуру. Почему? Потому, что их крупные -атомы могут там располагаться более свободно (Рис.10-2в). Особенно это важно для боковых групп с двумя крупными -атомами — и, действительно, они любят -структуру особенно сильно.
А вот аминокислоты с полярными группами в боковых цепях предпочитают нерегулярные участки ("клубок"), где эти полярные группы могут завязать водородные связи. Особенно заметна эта тенденция для наиболее полярных, заряженных при "нормальном" рН7 остатков, и для самых коротких (см. Рис.10-1), наиболее приближенных к главной цепи полярных боковых цепей. Кстати, по той же причине, — поскольку у них там есть возможность завязать дополнительную водородную связь, — короткие полярные боковые группы любят места у обоих концов спирали.
Некое исключение среди аминокислот с диполями в боковой цепи составляют триптофан и тирозин, имеющие маленький диполь на фоне большой гидрофобной части, и цистеин, у которого (т.е. у SН-группы которого) водородные связи совсем слабые. Они ведут себя, в общем, так же, как гидрофобные остатки.
Мы видим также, что отрицательно заряженные боковые группы предпочитают N-конец спирали (точнее: N-концевой виток и один-два остатка перед ним) и не любят С-концевой виток (и пару остатков за ним), а положительно заряженные — предпочитают C-конец спирали и не любят ее N-конец. Почему? — Потому, что на N-конце из спирали торчат NH-группы и на нем образуется заметный положительный заряд, и "минусы" боковых цепей притягиваются к нему, а "плюсы" — отталкиваются от него (Рис.10-3). А С-конец спирали заряжен, наоборот, отрицательно, — и там эффект противоположен: около С-конца любят собираться "плюсы" боковых цепей, а "минусы" его избегают.
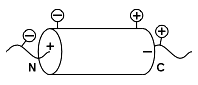 Рис.10-3.
Рис.10-3.Что касается расположения остатков внутри белка или на его поверхности — здесь общая тенденция заключается в том, что полярные (гидрофильные) боковые группы находятся снаружи, где они могут контактировать с полярной же водой ("подобное растворяется в подобном"!). Отрываться от воды полярным группам плохо — теряются водородные связи. Особенно плохо отрываться заряженным группам: переход из среды с высокой диэлектрической проницаемостью (из воды) в среду с низкой (ядро белка) ведет к большому повышению свободной энергии. И действительно, — ионизированных групп внутри белка практически нет (а почти все исключения связаны с активными центрами — ради которых, собственно, белок и создан...).
Наоборот, большинство гидрофобных боковых групп находятся внутри белка — они-то и создают здесь гидрофобное ядро (опять: "подобное растворяется в подобном"!). Мы уже говорили, что гидрофобность группы тем больше, чем больше ее неполярная поверхность: именно ее нужно упрятать от воды. Для чисто неполярных групп гидрофобный эффект прямо пропорционален их поверхности, а для групп с полярными вкраплениями — их поверхности, за вычетом поверхности этих вкраплений.
Слипание гидрофобных групп — главная движущая сила образования белковой глобулы. Главная, но не единственная — еще есть образование водородных связей во вторичной структуре (о чем мы уже говорили) и образование плотной, квазикристаллической упаковки внутри белка (о чем мы еще поговорим в свое время).
Для создания гидрофобного ядра белковой цепью, она должна входить в него с уже насыщенными водородными связями — ведь иначе ее полярным пептидным группам от воды придется оторваться, а разрыв водородной связи дорог. Поэтому в гидрофобное ядро вовлекается цепь, уже образовавшая (или образующая при этом) вторичную структуру и тем самым насытившая водородные связи пептидных групп в главной цепи. Однако при этом в ядро должны увлекаться только гидрофобные остатки вторичной структуры, а входящие в нее полярные остатки должны остаться вне ядра, — потому и на -спиралях, и на -структурных участках выделяются гидрофобные и гидрофильные поверхности; для их создания необходимо определенное чередование соответствующих групп в белковой цепи (Рис.10-4).
Рис.10-4. Боковые группы, которые (если все они — неполярные) могут формировать единые гидрофобные поверхности на -спиралях и на -структурных участках. Аналогичные сочетания полярных групп в цепи приводят к образованию гидрофильных областей на противоположных поверхностях на -спиралей и на -тяжей.
Все закономерности, о которых мы сейчас говорили, используются как для конструирования искусственных белков, так и для предсказания — по аминокислотным последовательностям — вторичной структуры белков, а также для предсказаний тех участков их цепи, что глубоко погружены в белок, — или, наоборот, тех участков, что лежат на поверхности белка. К этим вопросам мы еще вернемся.
В заключение — еще немного о заряженных (или, точнее, ионизуемых) боковых группах. Повышение рН всегда делает группу "более отрицательной" — нейтральная группа приобретает отрицательный заряд, а положительно заряженная — разряжается, см. Рис.10-5. Переход из незаряженного в заряженное или из заряженного в незаряженное состояние происходит у разных групп при разных рН, однако ширина перехода при этом всегда одна и та же — около 2 единиц рН (в этом интервале отношение заряженной и незаряженной форм меняется от 10:1 до 1:10).
Следует обратить особое внимание на группы, переходящие из незаряженного в заряженное состояние при рН близком к 7, характерном для жизни белка в клетке: именно такие легко перезаряжаемые группы (и особенно гистидин) часто используются в активных центрах белков.
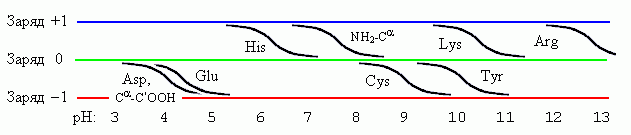
Рис.10-5. Заряженность ионизуемых боковых групп, а также N-конца пептидной цепи (NH2-C) и ее С-конца (C-C'OOH) при разных рН.
