Курс лекций 1999-2000 гг
| Вид материала | Курс лекций |
- Курс лекций для студентов заочного обучения Бурмистрова Л. А., Финансы предприятий:, 1991.45kb.
- Курс лекций. Спб, 1118.16kb.
- Курс лекций. Спб, 172.51kb.
- Курс лекций. Спб, 639.95kb.
- Цнж курс «Управление газетой», 1997 г.; «Триз-шанс» (Москва) курс «Приемы рекламы, 21.89kb.
- Курс лекций 1999-2000, 11782.85kb.
- В. Б. Аксенов Краткий курс лекций, 1098.72kb.
- Курс лекций Барнаул 2001 удк 621. 385 Хмелев В. Н., Обложкина А. Д. Материаловедение, 1417.04kb.
- Основы политологии: Курс лекций. 2-е изд., доп. Ростов на/Дону.: Феникс, 1999. 573, 14.9kb.
- Г. И. Невельского Н. Н. Жеретинцева Курс лекции, 1964.49kb.
Лекция 11
Теперь, когда мы знаем свойства вторичных структур полипептидов и свойства аминокислотных остатков — обратимся, наконец, к белкам.
Как уже говорилось, по "жизненным условиям", по стабилизующим структуру белков взаимодействиям и общему типу строения белки можно разбить на три класса: (1) фибриллярные белки; (2) мембранные белки; и (3) водорастворимые глобулярные белки.
Рассмотрим сначала фибриллярные белки.
Фибриллярные белки играют в основном структурную роль. Они образуют микрофиламенты, микротрубочки, — а также фибриллы, волосы, шелк и другие защитные покровы; они армируют мембраны и поддерживают структуру клеток и тканей.
Фибриллярные белки часто образуют огромные агрегаты; их пространственная структура высоко регулярна, сложена в основном из очень больших блоков вторичной структуры, и держится в значительной степени на взаимодействии между разными полипептидными цепями. Первичная структура фибриллярных белков также высоко регулярна, периодична, — потому-то из нее и образуется обширная регулярная вторичная структура.
Типичными представителями фибриллярных белков являются:
а) -структурный белок фиброин шелка. У -листа, как мы знаем, периодичность состоит в чередовании остатков, обращенных "вверх" и "вниз" (Рис.11-1).

Рис.11-1. Лист -структуры. Подчеркнута его складчатость и периодичность. Голубые линии - водородные связи между цепями, слагающими -листа.
Соответственно, в фиброине шелка основной мотив первичной структуры выглядит как повтор восьми блоков, где в каждом из блоков идет чередование маленьких (Gly) и более крупных остатков, например:
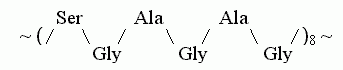 ,
,и этот восьмикратный повтор шести остатков повторяется около 50 раз.
Антипараллельные (такие, как на Рис.11-1) -слои фиброина шелка уложены друга на друга по принципу "лицом к лицу, спина к спине": двойной слой глицинов (расстояние между плоскостями — 3.5
 ) — двойной слой аланинов/серинов (расстояние между плоскостями — 5.7
) — двойной слой аланинов/серинов (расстояние между плоскостями — 5.7 ; это хорошо видит рентген) — двойной слой глицинов — и т.д.
; это хорошо видит рентген) — двойной слой глицинов — и т.д. б) -структурные фибриллярные белки, сложенные из длинных перевитых спиралей (coiled coil) (Рис.11-2). В -кератине или тропомиозине такие спирали охватывают всю белковую цепь, — да и большая часть миозиновой цепи образует фибриллу такого типа. Такие структуры содержатся также в шелке — но не обычном шелке тутового шелкопряда, а шелке пчел и муравьев.
Слипаясь, отдельные цепи образуют суперспираль.
| Рис.11-2. Перевитые правые -спирали. В комплексе они лежат параллельно друг другу и слегка закручены одна вокруг другой так, что каждая из них образует левую суперспираль. Контактирующие аминокислотные остатки занимают в цепи позиции a и d (см. Рис.11-3, 11-4). | 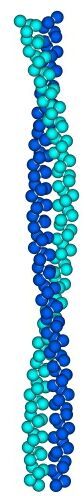 |
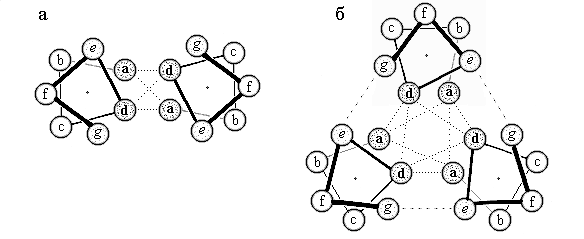
Рис.11-3. Взаимодействие -спиралей в двойной (а) и тройной (б) суперспирали (вид с торца спирали). В двойной суперспирали непосредственно контактируют с другой спиралью только остатки а и d, а в тройной — еще и остатки e и g (хотя и более слабо).
На следующем структурном уровне изображенные на Рис.11-2 суперспирали часто (но не всегда — например, не в тропомиозине) слипаются друг с другом и образуют фибриллы.
Входящие в суперспираль -спирали обычно параллельны, и перевиты они — в разных белках — по две, три или четыре. У -спирали, как мы уже знаем, период равен 3.6 остатка на виток. В перевитых спиралях периодичность — 7 остатков на два витка -спирали, т.е. 3.5 остатка на виток (Рис.11-3, 11-4).
Типичная первичная структура при этом выглядит, как на Рис.11-4.
 Рис.11-4.
Рис.11-4.На этом рисунке жирные буквы соответствуют гидрофобным (жирным, слипающимся) аминокислотам, а прочие буквы — аминокислотам гидрофильным. Интересно, что небольшое увеличение гидрофобности остатков e и g превращает двойную перевитую спираль (Рис.11-3а) в тройную (Рис.11-3б), а еще большее — в четверную.
Остановимся чуть подробнее на том, как спирали слипаются между собой. На -спирали (Рис.11-5, слева) есть несколько спиральных нарезок — "хребтов" из сближенных в пространстве боковых групп. Одни хребты имеют периодичность типа 1 — 4 — 7 — ... , и та их часть, что входит в зону контакта, состоит из пар a1 — d4, a8 — d11, ... (Рис.11-5, в центре). Другие хребты имеют периодичность типа 0 — 4 — 8 — 12 — ... . Та часть этих хребтов, что входит в зону контакта, состоит из пар d4 — a8, d11 — a15, ... (Рис.11-5, справа).
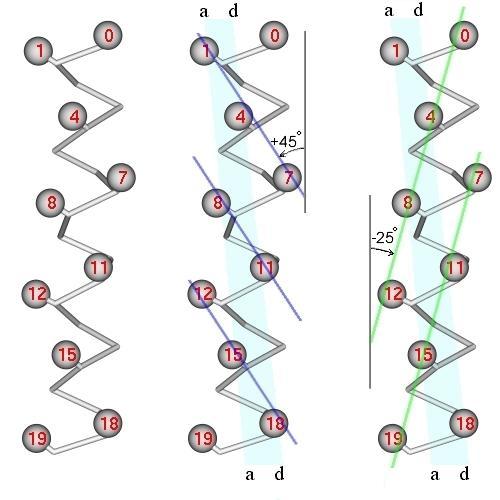
Рис.11-5. -Спираль (главная цепь и C-атомы) и два сорта хребтов (тонкие линии) из сближенных боковых групп на ее поверхности. В центре: хребты типа i, i+3; справа: хребты типа i, i+4. Полосой показана контактная поверхность; ее краями выделены линии остатков a и d. Отмечены типичные углы наклона хребтов i, i+3 и i, i+4 относительно оси спирали (на рисунке углы представляются меньшими, так как типичные хребты проходят через массивные боковые группы, а на рисунке - через центры C-атомов).
Первые хребты (если проводить их через выступы, образованные боковыми группами) идут под углом примерно 25о к оси спирали, вторые — под углом примерно 45о (Рис.11-5б и 11-5в). Если, перевернув вокруг вертикальной оси, наложить одну поверхность на другую (Рис.11-6, слева), а затем повернуть на 20о вокруг вертикальной оси, — то хребты типа "1 — 4 — 7" одной спирали окажутся между хребтами типа "0 — 4 — 8" другой, что обеспечит их плотный контакт (Рис.11-6, справа). При этом группы а одной спирали окажутся между группами d другой, а зона контакта образует на поверхности обеих спиралей (пока они не суперспирализованы) слабо скрученную спиральную полосу. А когда эти спирали суперспирализуются (Рис.11-2) и обовьются вокруг общей оси — зона контакта окажется в центре слегка перевитого пучка.
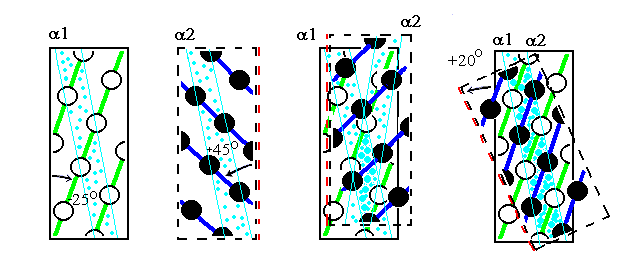
Рис.11-6. Плотная упаковка хребтов боковых групп при контакте спиралей требует разворота на 20о одной спирали относительно другой. Мы смотрим на зону контакта сквозь одну спираль (сквозь перевернутую вдоль оси 2). Остатки "нижней" спирали 1 изображены более светлыми, а верхней (2) — более темными. Бледно-голубыми линиями показаны линии контактирующих остатков a и d.
Это — не единственный способ плотного контакта спиралей (с другими мы познакомимся, когда будем говорить о глобулярных белках), — но единственный, пригодный для очень длинных спиралей, типичных для фибриллярных белков. Он был предсказан еще Криком в том же 1953 году, когда он — вместе с Уотсоном — предсказал двойную спираль ДНК.
в) Коллаген. Главный опорный белок. Он образуется особой, тройной суперспиралью, сложенной из трех полипептидов (Рис.11-7). При этом внутри каждого полипептида, внутри каждой нити этой тройной спирали водородных связей нет — они есть только между нитями.
Конформация всех остатков в каждой цепи коллагена близка к конформации полипролиновой [точнее — poly(Pro)II] спирали. Это — левая спираль, и период ее равен трем. Соответственно, основной мотив первичной структуры в коллагене выглядит как многократный повтор троек (Gly-Pro-Pro)n, или, точнее, (Gly-нечто-Pro)n, причем Gly в такой тройке необходим для образования водородных связей: у него есть NH-группа (в отличие от Pro), и нет боковой группы, — а любая боковая группа была бы лишней в центре тугой коллагеновой спирали, где сидит глицин.
Интересно, что экзоны, кодирующие коллагеновую цепь, всегда начинаются с глицинов и всегда содержат число кодонов, кратное трем. Я надеюсь, вы помните, что гены эукариот содержат экзоны, кодирующие белки, и интроны, которые выщепляются из матричной РНК (и потому белки не кодируют).
| Рис.11-7. Модель тройной суперспирали коллагена для последовательности (глицин — пролин — пролин)n. Каждая цепь выделена своим цветом. Отмечены завязывающие водородные связи Н-атомы NH-групп глицина (синим) и О-атомы СО-групп первого пролина тройки Gly-Pro-Pro (красным). При этом Gly цепи "1" завязывает связь с цепью "2", а Pro — с цепью "3", и т.д. Завиваясь вокруг двух других, каждая цепь коллагена образует правую суперспираль. "Супер" — потому что на более мелком масштабе, на масштабе конформаций отдельных остатков, коллагеновая цепь уже образует спираль типа poly(Pro)II (причем эта "микроспираль" — левая); ее можно проследить по направлению пролиновых колец. | 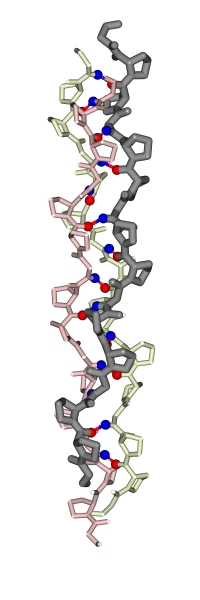 |
На следующем структурном уровне, коллагеновые суперспирали также слипаются друг с другом и образуют фибриллы коллагена.
Биосинтез коллагена, его последующая модификация и образование зрелой структуры коллагеновой фибриллы хорошо изучены (Рис.11-8). Замечу, что сам по себе коллаген не способен к спонтанной и при этом правильной самоорганизации своей пространственной структуры in vitro — так же, как и фиброин шелка, — и в отличие от глобулярных белков, о которых я буду говорить потом. Для самоорганизации нужен проколлаген, включающий, кроме коллагеновых нитей, глобулярные головки и хвостики. Лишенные головок и хвостиков коллагеновые нити, самоорганизуясь из развернутого состояния in vitro, тоже складываются в тройные спирали — но "неправильные", без присущей нативному коллагену гетерогенности тройной спирали (включающей нити двух сортов), без присущего ему регистра (т.е. с неправильным сдвигом нитей относительно друг друга), и т.д.
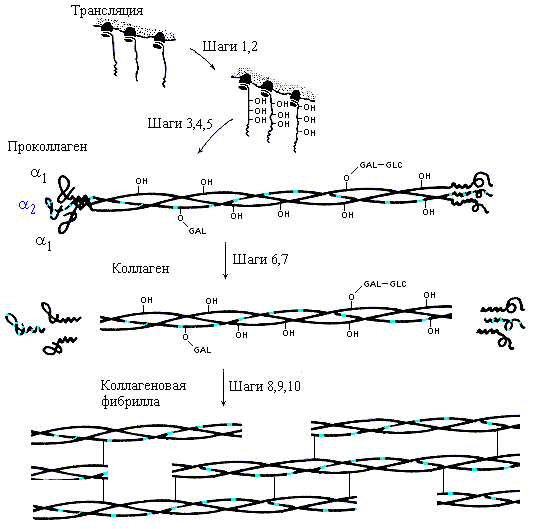
Рис.11-8. Образование коллагена in vivo. Шаг 1. Биосинтез про-1-цепей и про-2-цепей (по 1300 остатков в каждой) в пропорции 2:1. Шаг 2. Гидроксилирование некоторых остатков Pro и Lys. Шаг 3. Присоединение сахаров (GLC-GAL) к гидроксилированным остаткам. Шаг 4. Образование тримера и SS связей на его концах. Шаг 5. Образование тройной спирали в середине проколлагена. Шаг 6. Секреция проколлагена во внеклеточное пространство. Шаг 7. Отщепление глобулярных частей. Шаги 8-10. Спонтанное образование фибрилл из тройных суперспиралей, окончательная модификация аминокислотных остатков и образование ковалентных сшивок модифицированных остатков коллагеновых цепей. Картинка взята из [3] и адаптирована.
В заключение, я хочу подчеркнуть, что фибриллярные белки устроены относительно просто в силу периодичности своей первичной и, в силу этого, — также и своей вторичной структуры.
