Курс лекций 1999-2000 гг
| Вид материала | Курс лекций |
- Курс лекций для студентов заочного обучения Бурмистрова Л. А., Финансы предприятий:, 1991.45kb.
- Курс лекций. Спб, 1118.16kb.
- Курс лекций. Спб, 172.51kb.
- Курс лекций. Спб, 639.95kb.
- Цнж курс «Управление газетой», 1997 г.; «Триз-шанс» (Москва) курс «Приемы рекламы, 21.89kb.
- Курс лекций 1999-2000, 11782.85kb.
- В. Б. Аксенов Краткий курс лекций, 1098.72kb.
- Курс лекций Барнаул 2001 удк 621. 385 Хмелев В. Н., Обложкина А. Д. Материаловедение, 1417.04kb.
- Основы политологии: Курс лекций. 2-е изд., доп. Ростов на/Дону.: Феникс, 1999. 573, 14.9kb.
- Г. И. Невельского Н. Н. Жеретинцева Курс лекции, 1964.49kb.
Лекция 2
Аминокислоты, из которых сложена полипептидная цепь (Рис.2-1), могут находиться в двух стерических формах: L и D.
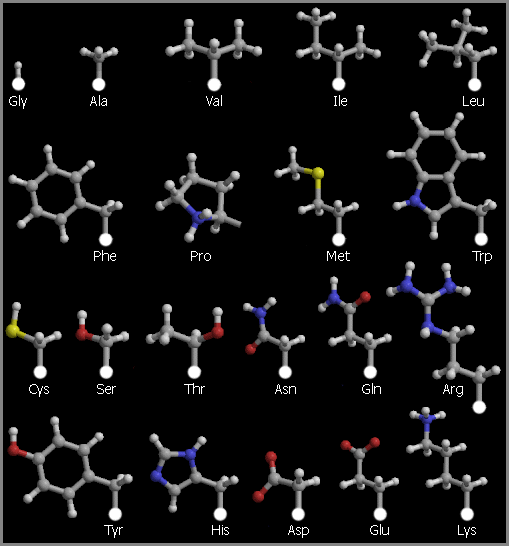
Рис.2-1. Боковые цепи двадцати стандартных аминокислотных остатков, исходящие из С атомов главной цепи. Белыми кружками показаны С атомы главной цепи, серыми — С атомы боковых групп, светло-серыми — H атомы боковых групп, синими — N атомы боковых групп, красными — O атомы боковых групп, желтыми — S атомы боковых групп.
Эти формы, L и D, зеркально-симметричны: в них массивный боковой радикал (R) и Н-атом, стоящие при -углероде (С) аминокислоты, меняются местами (стрелки указывают углубление атомов в рисунок):
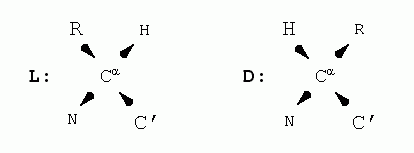
L и D форм нет только у глицина (Gly), "боковая цепь" которого состоит лишь из Н-атома.
Белковые цепи сложены только из остатков L-аминокислот. Только они кодируются генами. D-аминокислотные остатки — они встречаются в пептидах — не кодируются при матричном синтезе белка, а синтезируются специальными ферментами. Рацемизация (L D переход) спонтанно в белках практически не происходит. Не происходит она и при биосинтезе, — хотя часто встречается при чисто химическом синтезе пептидов, где на борьбу с рацемизацией уходит много сил.
Аминокислоты в белковой цепи связаны между собой пептидными связями C' и N атомов (Рис.2-2).
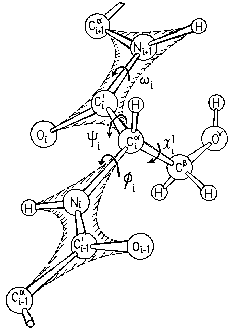
Рис.2-2. Полипептид: главная цепь и боковая группа (Ser) на ней. Пептидные группы заштрихованы. Показаны углы внутреннего вращения в главной () и боковой () цепях. Стрелки указывают направление вращения, ведущее к росту угла поворота ближней к нам части цепи относительно более отдаленной ее части. Картинка взята из [3] и адаптирована.
Важную роль в структуре белка играет как жесткость этих связей, так и плоская форма всей пептидной группировки
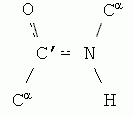
И то, и другое обеспечивается так называемой sp2-гибридизацией электронов N и С' атомов. "Гибридизация" электронных орбит — это чисто квантовый эффект. Sp2-гибридизация преобразует одну сферическую s- и две вытянутые p-орбиты электронов атома в три sp2-орбиты. Эти три орбиты вовлекают атом в три ковалентные связи, лежащие в одной плоскости (<). Вовлеченные в sp2-гибридизацию электроны ковалентно связанных C' и N атомов создают "делокализованное" электронное облако, охватывающее оба эти атома, и распространяющиеся также — через связь СО — на атом О (именно поэтому связи C'
 N и C
N и C O рисуются как равноправные "полуторные",
O рисуются как равноправные "полуторные",  ). Но у C и N атомов есть еще p-электроны кроме тех, что уже задействованных в sp2 орбитах! И так как эти p-орбиты имеют форму "восьмерок", перпендикулярных всем трем sp2-орбитам (<), то дополнительная связь этих p-электронов — связь, требующая сближения "восьмерочных" орбит и "обобществления" (т.е. переходов с атома на атом) находящихся на них электронов,
). Но у C и N атомов есть еще p-электроны кроме тех, что уже задействованных в sp2 орбитах! И так как эти p-орбиты имеют форму "восьмерок", перпендикулярных всем трем sp2-орбитам (<), то дополнительная связь этих p-электронов — связь, требующая сближения "восьмерочных" орбит и "обобществления" (т.е. переходов с атома на атом) находящихся на них электронов, 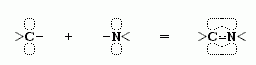
— это обобществление p-электронов препятствует вращению вокруг С'-N связи.
Хочу напомнить, что делокализация электронов, их переход с атома на атом — основная причина образования химических связей. Это следует из принципа неопределенности Гайзенберга:
-
px 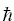
(2.1)
Здесь p — неопределенность в импульсе частицы, x — неопределенность в ее координате, а
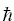 h/2, где h — постоянная Планка. Так как направление движения электрона в атоме не может быть известно, то p |p| = mv, где v — скорость, а m — масса частицы. Следовательно,
h/2, где h — постоянная Планка. Так как направление движения электрона в атоме не может быть известно, то p |p| = mv, где v — скорость, а m — масса частицы. Следовательно, v
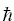 /(mx) .
/(mx) . В то же время, кинетическая энергия частицы E = mv2/2, т.е.
-
E 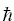 2/mx2).
2/mx2).
(2.2)
Следовательно, при делокализации, когда x возрастает, — энергия частицы падает, и она переходит в более стабильное состояние. Видно, что этот эффект наиболее силен для легких частиц — т.е. электронов. Так делокализация электрона приводит к химической связи.
Длина химической связи близка к Вандерваальсову радиусу атома, т.е. составляет 1 — 2
 (точнее: около 1
(точнее: около 1  — для связи C-H, N-H или O-H, около 1.2 — 1.3
— для связи C-H, N-H или O-H, около 1.2 — 1.3  — для С=О, C
— для С=О, C O, C
O, C N и С=С, 1.5
N и С=С, 1.5  — для С-С, и около 1.8
— для С-С, и около 1.8  — для S-S).
— для S-S). Характерные величины валентных углов составляют около 120о и около 109о. Углы в 120о находятся при sp2-гибридизованных атомах типа C'<, N<, где три валентные связи направлены из центра к вершинам плоского треугольника, углы в 109о — при sp3-гибридизованных атомах типа C<, где четыре связи направлены из центра к вершинам тетраэдра, а также при завязывающих по две связи O< или S< атомах.
Остановимся теперь на характерных величинах флуктуаций, т.е. тепловых колебаний валентных связей и углов. Они могут вносить вклад в гибкость белковой цепи.
Частоты колебаний проявляются в инфракрасных (ИК) спектрах белков. Характерные частоты колебаний таковы: ~ 7x1013 сек-1 — для колебания атома Н, — например, в С-Н связи (при этом длина волны =c/~5мк); и ~ 2x1013 сек-1 — для колебания "тяжелых" групп, — например, в СН3-СН3 связи (при этом =c/~15мк; здесь c — скорость света, 300000 км/сек).
Возбуждены ли эти колебания теплом при комнатной температуре?
Для ответа на этот вопрос мы должны сравнить тепловую энергию, приходящуюся на одну степень свободы ("тепловой квант" kT) с энергией колебания. Оценим величину kT при "нормальной" температуре. Здесь T — абсолютная температура в градусах Кельвина (Т=300оК при 27оС, т.е. при примерно "комнатной" температуре; К — обозначение градуса Кельвина), а k (иногда еще пишут kB) — постоянная Больцмана [равная 2 (кал/моль)/К, или 0.33x10-23 кал/К в расчете на одну частицу, так как в одном моле — 6x1023 частиц]. Значит, при комнатной температуре "тепловой квант" kT = 600 кал/моль, или (600кал)/(6x1023 частиц), т.е. 10-21 калорий на частицу.
Соответствующую такому тепловому кванту частоту T можно найти из соотношения kT = hT [где постоянная Планка h2
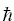 =6.6x10-34 Джxсек = 1.6x10-34 калxсек; напомню, что 1 калория (кал) = 4.2 джоуля (Дж)]. Итак, частота T равна 7x1012 сек-1 при T=300K, т.е. при 27оС.
=6.6x10-34 Джxсек = 1.6x10-34 калxсек; напомню, что 1 калория (кал) = 4.2 джоуля (Дж)]. Итак, частота T равна 7x1012 сек-1 при T=300K, т.е. при 27оС. "Тепловой квант" не может возбудить более жесткие, более частые, чем он сам, колебания.
Значит, при комнатной температуре валентные связи "тверды" и не флуктуируют: для этих связей частота колебаний ~ 2x1013 — 7x1013 сек-1, т.е. она на порядок больше, чем T = 7x1012 Джxсек-1.
Однако валентные связи могут раскачиваться падающим инфракрасным светом, и на этом основана ИК-спектроскопия белков. Собственно, именно ИК спектроскопия и дает сведения о колебаниях атомов, валентных связей и валентных углов. Конечно, экспериментально их исследуют на малых молекулах, а затем полученную информацию используют при изучении белков.
В отличие от колебаний длин связей, тепловые колебания валентных углов, на порядок более мягкие, — их частоты лежат в пределах 1012 — 1013 сек-1, т.е. она на порядок больше, чем T = 7x1012 Джxсек-1.
Однако валентные связи могут раскачиваться падающим инфракрасным светом, и на этом основана ИК-спектроскопия белков. Собственно, именно ИК спектроскопия и дает сведения о колебаниях атомов, валентных связей и валентных углов. Конечно, экспериментально их исследуют на малых молекулах, а затем полученную информацию используют при изучении белков.
В отличие от колебаний длин связей, тепловые колебания валентных углов, на порядок более мягкие, — их частоты лежат в пределах 1012 — 1013 сек-1, — возбуждены при комнатной температуре. Однако их характерная амплитуда невелика — около 5о.
Итак, колебания валентных связей вовсе не вносят вклада в гибкость белковой цепи, а колебания валентных углов вносят весьма скромный вклад. На самом деле гибкость белковой цепи, а значит — и ее способность складываться и в спирали, и в глобулы обеспечивается вращением (хотя и не вполне свободным вращением, см. ниже) вокруг валентных связей. Поэтому и структура цепи в целом часто описывается просто в терминах углов вращения вокруг валентных связей — тогда она называется "конформацией". Впрочем, очень часто термины "структура" и "конформация" употребляются просто как синонимы.
Основные сведения о вращении атомных группировок вокруг валентных связей тоже поставляет ИК-спектроскопия; как и раньше, я остановлюсь только на результатах.
Взаимное расположение атомных группировок, связанных валентной связью, описывается двугранным углом (двугранным — так как это угол между двумя плоскостями — "гранями"). Рисунки 2-2, 2-3 иллюстрируют отсчет этого угла. Отсчет — такой же, как в школьной тригонометрии, если рассматривать ближнюю к нам валентную связь как "вращающуюся стрелку", дальнюю от нас — как "координатную ось", а центральную валентную связь — как "ось вращения". То есть вращение "стрелки" против хода часов увеличивает угол поворота, а по ходу — уменьшает.
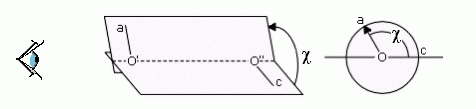
Рис.2-3. Отсчет величины двугранного угла (угла поворота): вид поперек (слева) и вдоль (справа) оси вращения. Дальняя от нас валентная связь 0''— c — "ось координатного круга", центральная связь 0'— 0'' — "ось вращения", ближняя к нам связь 0'— a — "стрелка на координатном круге".
Рисунок 2-4 показывает характерное поведение энергии при вращении вокруг связи, соединяющей два sp3-гибридизованных атома (на примере Н3С-СН3 и СН2С-СН2С связей). Такие связи характерны для алифатических боковых групп. Углы вращения боковых групп называются углами , "хи" (см. Рис.2-2). Максимумы такого трехкратного (соответственно симметрии sp3-sp3 связи) потенциала (т.е. потенциала, имеющего три максимума и три минимума при повороте на 360o) соответствуют трем "затененным" конформациям (0о, +120о и -120о), приводящим к сближению (и отталкиванию) электронных облаков. Эти облака отталкиваются, так как образующие их электроны уже задействованы в ковалентных связях. Величина возникающих при этом потенциальных барьеров вращения вокруг Н3С-СН3 связи — около 3 ккал/моль, а характерный размах тепловых флуктуаций вокруг этих минимумов (т.е. те отклонения от них, при которых энергия возрастает на kT) — 15-20о.
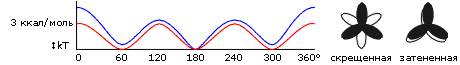
Рис.2-4. Характерный потенциал вращения вокруг одинарной связи между двумя sp3-гибридизованными атомами: вокруг Н3С-СН3 связи (красная кривая) и вокруг (С-СН2)-(СН2-С) связи (синяя кривая). Главный энергетический эффект дает отталкивание электронных облаков: оно максимально в "затененной" конформации (при 0, 120, 240о) и минимально в "скрещенной" (при 60, 180, 300о). Отталкивание маленьких Н-атомов несущественно. Однако отталкивание тяжелых, окруженных большими электронными облаками С-атомов в окрестности 0о создает добавочный энергетический эффект, отличающий поворот вокруг (С-СН2)-(СН2-С)связи от поворота вокруг (Н3С)-(СН3) связи. Для сравнения, стрелкой
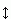 отмечена величина kT.
отмечена величина kT. Когда некоторые из валентностей при sp3 гибридизованных атомах заняты не водородами, а более массивными атомами — их отталкивание повышает соответствующую слишком тесному сближению этих массивных атомов часть барьера. Это показано на Рис.2-4 на примере вращения вокруг центральной связи в (С-СН2)-(СН2-С).
Рисунок 2-5 показывает характерное поведение энергии при вращении вокруг пептидной связи, соединяющей два sp2-гибридизованных атома (С' и N). Угол вращения вокруг этой связи называется углом (Рис.2-2). Потенциал двукратен (т.е. имеет два максимума и два минимума при повороте на 360o), соответственно симметрии sp2-sp2 связи. Потенциальные барьеры велики из-за участия в пептидной связи p-электронов (как о том говорилось в начале лекции), минимумы потенциала приходятся на 0o и 180o (где p-орбиты, стягивающие С'- и N-атомы, наиболее сближены), а его максимумы — на 90o и 270o (где эти стягивающие p-орбиты наименее сближены и, следовательно, хуже всего связаны друг с другом). Из-за высоких барьеров характерный размах тепловых флуктуаций угла вращения вокруг таких связей невелик — около 10о.
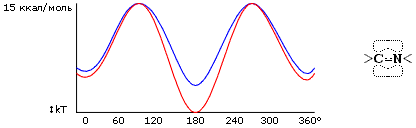
Рис.2-5. Характерный потенциал вращения вокруг кратной связи, соединяющей два sp2-гибридизованных атома (С' и N) в пептидной связи. Справа показана связь электронных p-орбит при угле, равном 0o (или 180o). Для всех (за исключением пред-пролиновых) пептидных связей энергия (красная кривая) при 0о выше, чем при 180о, из-за отталкивания массивных C-атомов. Эта разность энергий мала для пептидной связи, находящейся перед Pro (синяя кривая), имеющим не один, а два С-атома при N-атоме. См. текст и рисунок, где приведена структурая формула пролина.
Стоит отметить, что отталкивание массивных C атомов делает cis конформацию (=0о) энергетически довольно невыгодной; поэтому почти все пептидные группы в белках находятся в trans конформации (=180о).
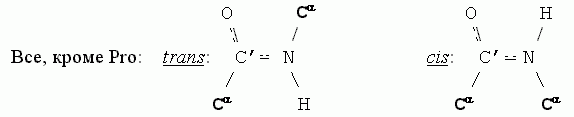
Исключение составляет пептидная связь, предшествующая пролину (имино-, а не аминокислоте): в Pro — два почти симметричных массивных радикала при N атоме (-СНС2 и -СН2С, см. Рис.2-1), так что для этой связи trans конформация лишь ненамного лучше, чем cis.
И в глобулярных белках, и в развернутых (т.е. флуктуирующих, не имеющих фиксированной структуры) пептидах наблюдается около 90% trans и 10% cis пролинов. Хочу обратить ваше внимание на эту закономерность — что выгодно само по себе, то чаще встречается и в глобулярных белках. Мы столкнемся с ней еще не раз.
Наконец, рассмотрим потенциал вращения вокруг связи, соединяющей sp3 гибридизованный и sp2 гибридизованный атомы. Углы вращения вокруг такой связи называются углами (вращение вокруг N-C связи) и (вращение вокруг C-С' связи) (Рис.2-2). При вращении по каждому из них возникает шестикратный (6 минимумов и 6 максимумов при повороте на 360o) потенциал с довольно низкими барьерами (Рис.2-6): их высота, 1 ккал/моль — порядка энергии тепловых колебаний (составляющей, как мы помним, 0.6 ккал/моль при комнатной температуре). Именно почти свободное вращение по углам и вокруг такого рода связей (между N и С и между C и C') в главной цепи полипептида и обеспечивает основную гибкость белковой цепи.
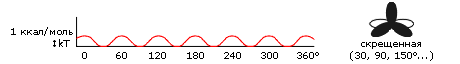
Рис.2-6. Характерный потенциал вращения вокруг одинарной связи между sp3- и sp2-гибридизованными атомами (на примере вращения вокруг Н3С-С5Н6 связи).
