Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова Российской Академии Наук
| Вид материала | Диссертация |
- План научно-исследовательской работы на 2012 г. Учреждения Российской Академии наук, 797.38kb.
- Vi московский международный конгресс, 625.54kb.
- М. М. Шемякина и Ю. А. Овчинникова ран институт молекулярной генетики ран нейрохимическое, 386.57kb.
- Ордена Трудового Красного Знамени Институт биоорганической химии имени академиков, 191.71kb.
- В. Т. Иванов, директор Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова, 719.75kb.
- Синтетические пептиды, взаимодействующие с различными типами холинорецепторов, 487.49kb.
- Международная научно-практическая конференция, 130.29kb.
- Международная научно-практическая конференция, 148.88kb.
- Международная научно-практическая конференция, 301.89kb.
- Программа отчетной конференции по программе фундаментальных исследований Президиума, 123.52kb.
Институт биоорганической химии
имени академиков М.М. Шемякина и Ю.А. Овчинникова
Российской Академии Наук
На правах рукописи
ХАЙДУКОВ
Сергей Валерьевич
МНОГОЦВЕТНЫЙ АНАЛИЗ В ПРОТОЧНОЙ ЦИТОМЕТРИИ ДЛЯ
МЕДИКО-БИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
14.00.46 - клиническая лабораторная диагностика,
14.00.36 - аллергология и иммунология
Диссертация в виде научного доклада на соискание ученой степени
доктора биологических наук
Санкт-Петербург - 2008
Научные консультанты:
академик РАН, академик РАМН,
доктор медицинских наук, профессор ЧЕРЕШНЕВ Валерий Александрович
доктор медицинских наук, профессор ЗУРОЧКА Александр Владимирович
Официальные оппоненты:
доктор медицинских наук, профессор ТОТОЛЯН Арег Артемович
доктор биологических наук, профессор ПОЛЕВЩИКОВ Александр Витальевич
доктор биологических наук, профессор ЗЫБИНА Наталья Николаевна
Ведущая организация:
ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию».
Защита состоится «25» декабря 2008 г. в 12.00 часов на заседании диссертационного совета Д 205.001.01 при Федеральном государственном учреждении здравоохранения «Всероссийский центр экстренной и радиационной медицины имени А.М. Никифорова» МЧС России (194044, Санкт-Петербург, ул. Академика Лебедева, д. 4/2).
С диссертацией в виде научного доклада можно ознакомиться в библиотеке Федерального государственного учреждения здравоохранения «Всероссийский центр экстренной и радиационной медицины имени А.М. Никифорова» МЧС России
Диссертация в виде научного доклада разослана « » 2008 г.
Ученый секретарь
диссертационного совета
д.м.н. профессор С.С. Алексанин
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. За последние годы проточная цитометрия становится одним из наиболее востребованных методов, как для фундаментальных исследований, так и для диагностики в клинико-иммунологической практике. Расширилась приборная база, и значительно увеличились возможности анализа клеток иммунной системы, позволяющие охарактеризовать не только качественные и количественные параметры основных популяций клеток, но и их более широкий субпопуляционный состав. Используя различные методологические подходы и новую реагентную базу, при помощи проточной цитометрии стало возможным оценивать функциональные свойства популяций и субпопуляций клеток иммунной системы. Значительно расширились возможности для диагностики иммунодисфункций, аллергии, специфических Т-эффекторов и многое другое (Mandy F.F. et al, 2003; Boumiza R. et al., 2005; He X.H. et al., 2006).
Логика развития современной технической, методологической и идеологической базы проточной цитометрии формируется на основе очень широких возможностей современных приборов. Оснащенные гибким программным обеспечением, они способны одновременно анализировать колоссальное количество клеток, идентифицировать отдельные их группы, классы, популяции, субклассы, субпопуляции и т.д., измерять их поверхностные и внутриклеточные маркеры, оценивать их функциональное состояние (Shapiro H.M. 2003).
Развитие современных клеточных технологий и разнообразие новых методологических подходов к исследованиям, связанным с использованием проточной цитометрии в биологии и медицине, поставило целый ряд вопросов о стандартизации данного метода. Эти вопросы особенно важны как для врачей лабораторной диагностики, так и для ученых и специалистов (Луговская С.А. и др., 2005; Gallego A. et al., 2003; Luider J. et al., 2004).
Столь высоко информативный инструмент анализа создает предпосылки для появления множества новых методологических подходов для диагностики различных клеточных дисфункций. Например, уже сейчас 4-5 параметрический анализ позволяет выявить не только ту или иную субпопуляцию клеток, но и ее функциональную активацию или депрессию. В то же время, если увеличить анализ до 9-15 параметровой системы оценки рецепторов клеток, появляется возможность значительно более углубленного анализа, который оправдан для научных исследований, но с точки зрения практической медицины такой подход навряд ли применим, поскольку связан со значительными методологическими трудностями. Именно поэтому возникла необходимость остановиться на тех методологических подходах, которые позволяют по-новому взглянуть на динамическую систему взаимодействия клеток иммунной системы во всем ее разнообразии с четкой характеристикой субпопуляций клеток.
Цель работы. Обосновать методологию, критерии и направления применения многоцветного цитометрического анализа субпопуляций лимфоцитов в медико-биологических исследованиях и оценить их эффективность.
Задачи исследований:
1. Разработать критерии применения многоцветных параметров для иммунофенотипирования клеток на основе стандартизации протоколов исследований в проточной цитометрии.
2. Экспериментально обосновать возможные пути применения и расширения спектра исследований с использованием многоцветного анализа в проточной цитометрии.
3. Обосновать и оценить эффективность применения многоцветного анализа при изучении фенотипа лимфоцитов для лабораторной диагностики нарушений иммунного статуса человека.
4. На основе применения цитометрического анализа разработать алгоритм использования панели для скрининговых исследований и расширенной панели для более углубленного анализа при выявлении отдельных субпопуляций лимфоцитов, параметры которых не попадают в референтные значения.
5. Обосновать методологию использования многоцветного анализа для проведения углубленных научных исследований активности субпопуляций лимфоцитов.
Научная новизна исследований.
Впервые предложен алгоритм оптимизации работы на проточных цитометрах от пре-аналитического, аналитического до пост-аналитического этапов исследований, позволивший разработать критерии стандартизации методов исследований. На их основе разработаны критерии включения тех или иных параметров исследований клеток для практического использования.
Экспериментально обоснованы современные подходы к расширению спектра исследований с учетом использования многоцветного анализа в клинической и научно-исследовательской практике.
Обоснована возможность оценки функциональной активности клеток иммунной системы в процессе их дифференцировки при воздействии различных химических соединений (например, к действию кальциевых ионофоров).
Предложена и внедрена многопараметрическая панель моноклональных антител к различным кластерам дифференцировки, которая охватывает большинство лимфоцитов периферической крови и включает степень активации различных субпопуляций Т-клеток, В-клеток и NK-клеток, что позволяет более точно диагностировать наиболее часто встречающиеся нарушения иммунной системы. Данная панель включает:
IgG/IgG/IgG/CD45 - изотипический контроль
CD19/CD5/CD27/CD45 - В1, В2, В-клетки памяти
CD16/CD56/CD3/CD45 - субпопуляции NK-клеток
CD8/CD4/CD3/CD45 - субпопуляции Т-клеток
CD8/CD38/CD3/CD45 - активированные Т-цитотоксические и NK-клетки
CD4/CD25/HLA-DR/CD45 - активированные Т хелперы
CD45RA/CD45R0/CD4/CD45 - активированные Т хелперы и Т-клетки памяти
TCR-αβ/TCR-γδ/CD3/CD45 - αβ- и γδ-Т-клетки
CD4/CD25/CD127/CD45 - регуляторные Т-клетки.
Предложенные подходы позволили повысить качество диагностики нарушений иммунного статуса и значительно расширили возможности исследования клеток иммунной системы в норме и патологии.
Основные положения, выносимые на защиту:
- Разработанный алгоритм оптимизации настройки приборов и создания протоколов для многопараметрического анализа применим при работе на большинстве проточных цитометров ведущих фирм производителей, и может быть использован для стандартизации исследований и разработки критериев включения новых параметров исследования клеток иммунной системы.
- Среднестатистические значения параметров иммунного статуса условно здоровых лиц в различных регионах России сопоставимы со среднестатистическими значениями параметров иммунного статуса человека, опубликованными в литературе.
- Введение в первичную панель скринигового исследования иммунной системы антител для выявления аутореактивных клонов В-клеток (CD19,CD5) улучшает диагностику и мониторинг за пациентами с аутоиммунными заболеваниями.
- При наличии отдельных субпопуляций лимфоцитов, параметры которых не попадают в референтные значения в ходе скрининговых исследований иммунной системы человека, необходимо проведение дополнительных исследований с оценкой некоторых минорных субпопуляций лимфоцитов и анализа функциональных характеристик клеток.
- В клинико-диагностической практике наиболее предпочтителен четырехцветный цитометрический анализ по сравнению с двух- и трехцветным, что дает возможность получать достоверные данные, характеризующие как субпопуляционный состав, так и ряд функциональных параметров иммунокомпетентных клеток при уменьшении количества образцов и времени, затраченного на получение конечного результата.
- Изменение репертуара поверхностных рецепторов CD4+ Т-лимфоцитов в процессе активации и дифференцировки сопровождается резистентностью их к действию кальциевых ионофоров.
Практическая значимость работы. Разработанные подходы к стандартизации исследований в проточной цитометрии, алгоритмы оптимизации исследований отдельных субпопуляций и комплексной оценки клеток иммунной системы, предложенные в работе, позволяют применять полученные данные в повседневной практике клинико-диагностических и научно-исследовательских лабораторий, оснащенных современными приборами.
Результаты исследований внедрены в учебный процесс обучения врачей на курсе клинической лабораторной диагностики ГОУ ВПО Челябинской государственной медицинской академии Росздрава, Санкт-Петербургский Государственный Медицинский Университет им. академика И.П.Павлова; в работу научно-исследовательских лабораторий Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН (г. Москва), ГУ НИИ фармакологии им. В.В. Закусова (г. Москва), Всероссийском Центре Экстренной и Радиационной Медицины им. А.Н.Никифорова, МЧС России (г. Санкт-Петербург), ММА им. И.М. Сеченова (г. Москва), Пятигорском ГНИИ курортологии, и ряде других.
Апробация работы. Материалы диссертационной работы апробированы как на отечественных, так и на международных симпозиумах и конференциях: Первый Всесоюзный иммунологический съезд (Сочи, 1989); 11th Meeting of European Federation of Immunological societies. (Espoo, Finland. 1991); 8th International Congress of Immunology, (Budapest, Hungary, 1992); 5th International Workshop and Conference on Human Leukocyte Differentiation Antigens, Tissue Antigens (Boston, USA, 1993); 6th International Workshop and Conference on Human Leukocyte Differentiation Antigens, Tissue Antigens, (Kobe, Japan, 1996); Fourth International Symposium on Clinical Immunology (Amsterdam, Holland 1997); 10 International Congress of Immunology (New Delhi, India, 1998); John HUMPHRY Advanced Summer Program in Immunology (Pushchino, 1998, 2000, 2002, 2004); The 8th Annual Meeting of Tissue Engineering Society International, (Shanghai International Conventional, P.R. China, 2005); “Дни иммунологии в Санкт-Петербурге” (Санкт-Петербург, 1999, 2000, 2001, 2002, 2003, 2004, 2005, 2007); 2-я конференция “Иммунология репродукции” (Сочи, 2007); Симпозиум “Иммунология слизистых оболочек и аллергология: теория и практика” (Анталия, Турция, 2007); XX Зимняя международная молодежная научная школа “Перспективные направления физико-химической биологии и биотехнологии” (Москва, 2008).
Личный вклад автора в работу. Диссертационная работа является результатом многолетних (1986-2008 гг.) исследований по изучению механизма функционирования иммунной системы человека и животных при помощи метода проточной цитометрии и различных флуоресцентных зондов. Все результаты получены лично автором или при его непосредственном участии. Доля личного участия в совместных публикациях пропорциональна числу соавторов.
Публикации. По теме диссертации опубликовано 89 работ, в том числе 3 монографии, 82 работы опубликованы в рецензируемых журналах по перечню ВАК Министерства образования и науки Российской Федерации.
СОДЕРЖАНИЕ РАБОТЫ.
Материалы и методы исследования.
Пациенты. При скрининговом исследовании использовали для анализа периферическую кровь 356 условно здоровых лиц.
Для исследования гомеостаза ионов кальция у CD4+ Т-лимфоцитов в процессе их активации и дифференцировки in vivo использовали кровь лиц, показатели иммунного статуса которых соответствовали нормам для здоровых людей. Было обследовано 112 человек.
Для оценки активности и количества, различных субпопуляций клеток иммунной системы было обследовано 214 человек с заболеваниями, в основе которых лежат иммунные механизмы (аутоиммунный тиреоидит, ревматоидный артрит и др.).
Выделение клеточных популяций и реагенты для исследования. Фракцию мононуклеаров выделяли из венозной крови доноров центрифугированием на Ficoll-Paque. Клетки инкубировали с иономицином при 37° в течение 10 мин в среде Хенкса с 1% ФСК. После инкубации с иономицином клетки промывали ФСБ с 5% ФСК для удаления Са2+-ионофора. Чувствительные и резистентные к иономицину Т-клетки разделяли на Ficoll-Paque (d = 1,077 г/см3). Чувствительные к иономицину клетки не сохраняли жизнеспособность после обработки ионофором. Фракцию иономицин-резистентных (ИР-фракция) клеток собирали с поверхности Ficoll-Paque, окрашивали МА.
В работе использовали среду Хенкса, брефелдин А, ФСК, ФСБ, ДМСО, ФМА, ConA, ФГА и культуральный пластик фирмы ICN (США), иономицин и гепарин (Calbiochem, Швейцария), Ficoll-Paque (Pharmacia, Швеция). Все используемые в работе моноклональные антитела (МА) получены от фирмы Beckman Coulter (США).
Проточная цитофлуориметрия. Для разработки алгоритма настройки цитометров, создания протоколов и последующего анализа были использованы контрольный материал ImmunoTrol, ImmunoTrol Low (Beckman-Coulter, США) и цельная периферическая кровь, полученная от условно здоровых лиц. Для окрашивания клеток использовали следующую панель МА меченых FITC (изотиоцианат флуоресцеина), PE (фикоэритрин), PC5 (комплекс PE с цианином-5), ECD (комплекс PE с техасским красным) или PC5 (комплекс PE с цианином-7): CD4, CD5, CD8, CD14, CD19, CD25, CD26, CD27, CD29, CD38, CD45, CD45RA, CD45R0, CD62L, CD69, CD95 CD127, CD234, CD294, γδ-TCR, αβ-TCR, Vβ1-TCR, Vβ2-TCR, Vβ14-TCR и HLA-DR (Beckman Coulter, США). Для удаления эритроцитов пробоподготовку проводили по безотмывочной технологии с использованием следующих лизирующих растворов: OptiLyse C, OptiLyse B, ImmunoPrep и Whole Blood Lysing Reagents (Beckman Coulter, США).
Для анализа окрашенных клеток и настройки были использованы следующие проточные цитометры: EPICS XL, EPICS XL-MCL, EPICS “Elite”, EPICS “Altra”, Cytomics FC500, Cytomics FC500 MPL (Beckman Coulter, США), FACSCalibur (Becton-Dickinson, США) и PAS-III (Partec GmbH, Германия).
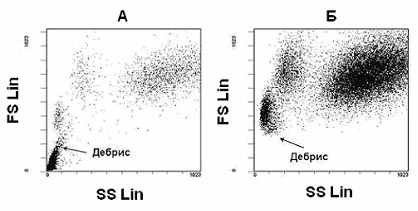
Для корректного исключения из зоны анализа всех частиц, которые не соответствовали по размерам и гранулярности живым лимфоцитам, вводили необходимые логические ограничения в гистограммы распределения частиц по малоугловому, боковому светорассеянию и CD45. Математическую обработку цитометрических данных проводили при помощи программ EXPO-32 и CXP v. 2.2 (Beckman Coulter, США). В каждой пробе анализировали не менее 104 клеток. Абсолютные значения получены как в одноплатформенной (с помощью реагента Flow Count (Beckman Coulter, США)), так и в двухплатформенной (с использованием результатов гематологического анализа) системах.
Статистическая обработка результатов. Статистическая обработка результатов проводилась с использованием стандартного пакета прикладных программ «Statistic for Windows 6.0». Полученные данные обрабатывали дискриптивными методами и представляли в виде средней арифметической и её стандартной ошибки (M±m).
Проточная цитометрия как современный метод анализа в биологии и медицине.
Проточная цитометрия как современная технология быстрого измерения характеристик клеток появилась в результате естественного развития традиционных гистохимических и цитохимических методов анализа. Созданная для ускорения анализа в клинической цитологии и цитодиагностике, эта технология постепенно развилась в эффективный подход к решению многих важных задач биологии клетки, иммунологии, клеточной инженерии и т.д.
Две существенные особенности проточной цитометрии делают этот метод особенно ценным для клинической практики:
- во-первых, этот метод позволяет охарактеризовать гетерогенные клеточные популяции по фенотипу. Анализы такого рода служат для выявления отклонений, происходящих в процессе онкогенеза. Большинство современных применений цитометрии связано в первую очередь с анализами по фенотипу;
- во-вторых, это способность обнаружить и охарактеризовать редкие события, т.е. встречающиеся с частотой 10-5-10-7, что возможно благодаря огромной производительности. Так, современные цитометры могут регистрировать несколько параметров для каждой отдельной клетки со скоростью до 100000 клеток в секунду.
Информация, извлекаемая из сигналов светорассеяния и измерения времени пролета клеток через зону анализа, позволила исследователям судить о морфологических характеристиках клеток (размере, отношении размеров ядра и цитоплазмы, гранулярности цитоплазмы, степени асимметрии клеток). В свою очередь, это привело к возможности типировать клетки без применения флуоресцентных красителей, что особенно ценно при работе с периферической кровью. Данный подход позволяет разделить и расположить в виде гистограммы лейкоциты периферической крови на три группы клеток - лимфоциты, моноциты и гранулоциты (Bossuyt X. et al., 1997).
Развитие гибридомной технологии привело к тому, что у исследователей появился в руках такой инструмент, как моноклональные антитела. МА предоставили возможность типировать клетки не только благодаря их морфологическим различиям, но и за счет набора поверхностных антигенов и рецепторов, характерных для определенных клеток и их функционального состояния (Leucocyte typing VI., 1997). В настоящее время известно 339 кластеров дифференцировки (Cluster of Differentiation, CD) клеток человека (Zola H., et al., 2005).
Использование МА напрямую меченых различными флуорохромами позволило значительно повысить информативность цитометрического анализа за счет многоцветности. Поскольку современные цитометры, как правило, оборудованы более чем тремя фотоэлектронными умножителями (от 3 до 12 ФЭУ), это позволяет на одном образце периферической крови анализировать практически все основные субпопуляции клеток.
Высокий уровень автоматизации, простота в эксплуатации, небольшие размеры современных приборов, их высокая точность, специфичность и воспроизводимость результатов позволяют использовать их не только как исследовательские, но и как клинико-диагностические.
Перечисленные возможности метода проточной цитометрии определяют клинические и общебиологические области его применения. К первой относятся - иммунология, онкология, онкогематология (включая диагностику, оценку эффективности лечения и мониторинг пациентов, входящих в группу риска), трансплантология, общая гематология и др. Ко второй - клеточная кинетика, клеточная энзимология, клеточная физиология, генетика и др.
Процесс развития иммунного ответа организма на проникновение инфекции или какие-либо другие воздействия сопровождается значительными изменениями субпопуляционного состава иммунокомпетентных клеток. Это относится как к изменению абсолютного количества иммунокомпетентных клеток, их субпопуляционного состава, так и к появлению на клеточной поверхности определенных функциональных молекул. Под воздействием различных агентов клетки приспосабливаются и отвечают на это изменением экспрессии тех или иных мембранных и внутриклеточных маркеров. Таким образом, одним из эффективных механизмов иммунорегуляции является модуляция экспрессии функционально значимых молекул. В свою очередь, не менее важным является и изменение абсолютных количеств иммунокомпетентных клеток в периферической крови.
Таблица 1. Среднестатистическое содержание основных субпопуляций лимфоцитов в периферической крови взрослых условно здоровых лиц полученное в результате скринингового исследования (N = 362).
| Субпопуляции лимфоцитов | Относительные количества | Абсолютные количества (кл./л) |
| Лимфоциты (CD45bright) | 32 ± 4%* | 1,363-2,808 x 109 |
| Т-клетки (CD3+,CD19-) | 73 ± 12% | 0,946-2,079 x 109 |
| Т хелперы(CD3+,CD4+) | 45 ± 10% | 0,576-1,336 x 109 |
| Т хелперы активированные/памяти (CD3+, CD4+, CD45R0+, CD29+) | 15 ± 10% | 0,068-0,702 x 109 |
| Т хелперы наивные (CD3+,CD4+,CD45RА+) | 30 ± 10% | 0,272-1,123 x 109 |
| Т цитотоксические (CD3+,CD8+) | 27 ± 8% | 0,372-0,974 x 109 |
| Т-клетки активированные (CD3+, HLA-DR+, CD25+, CD38+) | 3 ± 3% | 0,007-0,165 x 109 |
| Т-NK клетки (CD3+, CD16+, CD56+) | 3 ± 3% | 0,007-0,165 x 109 |
| В-клетки (CD3-, CD19+, CD20+, HLA-DR+) | 12 ± 5% | 0,111-0,376 x 109 |
| NK-клетки (LGL) (CD3-, CD16+, CD56+, CD38±, CD8±) | 13 ± 5% | 0,123-0,369 x 109 |
| Индекс соотношения CD4+/CD8+ | 1,5-2,6 | |
* Относительные и абсолютные количества лимфоцитов определяли от общего количества лейкоцитов. Относительные и абсолютные количества субпопуляций Т-, В-, и NK-клеток определяли от общего количества лимфоцитов.
Определение субпопуляционного состава или фенотипа лимфоцитов в настоящее время является важным диагностическим признаком, позволяющим судить о течении процессов, происходящих в организме. Под фенотипом следует понимать совокупность функционально значимых маркеров, характерных для определенных стадий дифференцировки, пролиферации, активации или программируемой клеточной гибели (апоптоза). Относительное и абсолютное количество клеток, имеющих тот или иной фенотип, как раз и является конечным результатом иммунофенотипирования.
При подтвержденной ВИЧ инфекции на «абсолютном содержании CD4+ Т-клеток в единице объема» построена система стадирования течения заболевания, что является одним из основных критериев назначения антиретровирусной терапии.
Иммунофенотипирование позволяет судить о типе клеток и их функциональном состоянии по наличию того или иного набора клеточных маркеров. В отличие от флуоресцентной микроскопии, метод проточной цитометрии позволяет наиболее полно и наиболее корректно оценить иммунофенотип пациентов. Иммунофенотипирование с использованием многоцветного анализа особенно важно для характеристики высоко специализированных субпопуляций лимфоцитов, таких как клетки иммунологической памяти, антиген-специфические и регуляторные T клетки и субтипы NK-клеток.
Очень важным разделом для биологии и медицины при появлении новых методик исследования является формирование нормативных показателей. Не является исключением и проточная цитометрия. Проведенные исследования условно здоровых лиц в различных регионах России с использованием скрининговой панели позволили определить среднестатистические значения параметров иммунного статуса человека. Результаты, представленные в Таблице 1, свидетельствуют о близости среднестатистических параметров иммунного статуса условно здоровых лиц к данным в отечественной и зарубежной литературе (Zidovec Lepej S., et al., 2003, Pope V., et al., 1994, Comans-Bitter W.M., et al., 1997).
Подходы к стандартизации метода проточной цитометрии для иммунофенотипирования. Оптимизация настройки цитометров и подготовка протоколов для анализа.
Иммунофенотипирование позволяет охарактеризовать клетки при помощи МА и дает возможность судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров. Однако следует учитывать, что многие маркеры могут одновременно экспрессироваться на различных типах клеток и определять их наличие следует в режиме не менее чем двухцветного анализа, а типирование лейкозов желательно проводить в четырех- и более цветном анализе (Nagata H., et al., 2001; Claude L., et al., 2005).
В настоящее время все большее количество клинико-диагностических лабораторий используют метод проточной цитометрии для определения иммунного статуса пациентов, диагностики лимфопролиферативных заболеваний и многих других важных параметров иммунной системы. Однако, отсутствие стандартных подходов к настройке цитометров, созданию протоколов для исследования и подготовке образцов для анализа, по-прежнему делает метод проточной цитометрии достаточно субъективным и, в значительной степени, зависимым от опыта оператора.
В процессе цитометрического анализа могут быть допущены ошибки на разных этапах. Во-первых, цитометр должен находиться в рабочем состоянии и проходить все тесты проверки его работоспособности. Во-вторых, протоколы конкретного анализа должны быть правильно настроены. Данная процедура не зависит от типа прибора, поскольку процедуры подготовки инструментов для соответствующего анализа осуществляются практически по одному и тому же алгоритму. В-третьих, на конечный результат значительное влияние оказывает использование некачественных реагентов или реагентов с истекшим сроком годности. И, наконец, в-четвертых, на результат оказывают влияние ошибки, допущенные в ходе подготовки образца для анализа.
Одним из наиболее важных этапов при проведении стандартной процедуры анализа фенотипа клеток ПКЧ является правильность настройки протоколов для конкретных типов анализа.
Данный этап состоит в следующем: настройка дискриминатора, настройка параметров светорассеяния, настройка параметров чувствительности фотоэлектронных умножителей (ФЭУ) для флюоресценции, введение коэффициентов компенсации.