Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова Российской Академии Наук
| Вид материала | Диссертация |
- План научно-исследовательской работы на 2012 г. Учреждения Российской Академии наук, 797.38kb.
- Vi московский международный конгресс, 625.54kb.
- М. М. Шемякина и Ю. А. Овчинникова ран институт молекулярной генетики ран нейрохимическое, 386.57kb.
- Ордена Трудового Красного Знамени Институт биоорганической химии имени академиков, 191.71kb.
- В. Т. Иванов, директор Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова, 719.75kb.
- Синтетические пептиды, взаимодействующие с различными типами холинорецепторов, 487.49kb.
- Международная научно-практическая конференция, 130.29kb.
- Международная научно-практическая конференция, 148.88kb.
- Международная научно-практическая конференция, 301.89kb.
- Программа отчетной конференции по программе фундаментальных исследований Президиума, 123.52kb.
Рис. 20. Гистограммы распределения Т-клеток экспрессирующих TCR-Vβ. Квадранты С2 содержат клетки с фенотипом CD3+TCR-Vβ1+ и CD3+TCR-Vβ14+.
Следует отметить, что уже выявлена специфичность отдельных вариантов V-сегмента ТCR. Так Vβ17 является мишенью для суперантигена микоплазмы (MAS) и стафилококкового энтеротоксина B, а Vβ8 для стафилококкового энтеротоксина Е. Описано, что при инфицировании вирусом Эпшейн-Бара наблюдалась быстрая клональная пролиферация CD8+ Т-клеток, экспрессирующих TCR Vβ14, хотя в норме TCR Vβ14 Т-клетки составляют только 2-7% (Рис. 20) (Haynes B.F., et al., 1995; Van den Beemd R., et al., 2000; Kelsen J., et al., 2004; Wada T., et al., 2007). Не исключено, что в будущем анализ наличия тех или иных Vβ-субъединиц TCR может быть использован для персонифицированной терапии пациентов.
Примерно 87,2-98,4 % Т-клеток представляют собой вариант αβ-TCR, и обозначаются эти клетки как αβ–Т-клетки. Остальные 1.7-8.9 % T-клеток несут на своей поверхности γδ-TCR и обозначаются как γδ–Т-клетки (Таблица 4).
Таблица 4. Среднестатистическое содержание -T клеток и -T клеток в периферической крови взрослых условно здоровых лиц (N = 60).
| Субпопуляции | Относительно лимфоцитов (%) | Относительно общих Т-клеток (%) | Абсолютное количество (кл/л) |
| Общие T-клетки | 73 12,0 | | 0,946-2,079 x 109 |
| -T клетки | 4,6 2,8 | 5,3 3,6 | 0,022-0,115 х 109 |
| -T клетки | 70,5 9,7 | 92,8 5,6 | 0,924-1,964 х 109 |
αβ–Т-клетки подразделяются на две различные неперекрывающиеся субпопуляции. Клетки одной из них несут маркер CD4 и в основном "помогают" в осуществлении иммунного ответа или "индуцируют" его, данная субпопуляция получила название Т-хелперы. T-клетки другой субпопуляции несут маркер CD8 и обладают преимущественно цитотоксической активностью.
Небольшая часть αβ–Т-клеток не экспрессируют ни CD4, ни CD8. С другой стороны, большинство γδ–Т-клеток, циркулирующих в периферической крови, также "дважды отрицательны". Однако некоторые из αβ–Т-клеток все же экспрессируют молекулы CD8. Напротив, большая часть γδ–Т-клеток в тканях экспрессируют CD8. Кроме молекулы CD8 γδ –Т-клетки на своей поверхности могут экспрессировать CD56, CD94, CD161. Также было продемонстрировано, что цитостатическую активность γδ–Т-клеток возможно стимулировать через CD122 (β-цепь рецептора IL-2) (Ichikawa Y., et al., 1991; Battistini L., et al., 1997; Fujimiya Y., et al., 1997).
γδ–Т-клетки были изучены относительно недавно. Одной из особенностей γδ–Т-клеток в отличие от αβ–Т-клеток является то, что они распознают непептидные антигены, полученные из микробных патогенов, независимо от MHC. Данная субпопуляция выполняет целый ряд важных функций, так они могут усиливать иммунный ответ, производя большие количества интерферона-γ (IFN-γ), фактора некроза опухолей-α (TNF-α) и хемокины. Кроме этого, γδ–Т-клетки имеют эффекторную (цитотоксическую) активность. С эволюционной точки зрения, γδ-Т-клетки занимают уникальное место между высоко специфичными αβ-Т-клетками и врожденной иммунной системой для выполнения защиты организма от патогенов. Экспериментальные данные показали, что роль γδ-Т-клеток была весьма существенна в устойчивости организма против целого ряда микроорганизмов. Так функциональную значимость γδ-Т-клеток отмечали в устойчивости к Mycobacterium, Borellia, Francisella tularensis, Salmonella и вирусов, включая вирус ВИЧ. Кроме того, γδ-Т-клетки играют существенную роль и в противоопухолевом ответе, в частности было описано значительное увеличение этих клеток у пациентов с лимфомой. γδ-Т-клетки также вовлечены в восстановление эпителия и гомеостаз. С другой стороны, γδ–Т-клетки могут быть вовлечены в патогенез заболеваний с гиперактивацией иммунной системы, например, сахарного диабета, болезни Бехчета, а также бронхиальной астмы (Ichikawa Y., et al., 1991; McClanahan J., et al., 1999; Robak E., et al., 1999; Yin Z., et al., 2000).
Содержание γδ-Т-клеток в периферической крови варьирует, существуют половые и возрастные различия. Их количество увеличивается с момента рождения до наступления полового созревания, а в дальнейшем постепенно снижается. У женщин количество γδ-Т-клеток несколько выше, и этот уровень сохраняется значительно дольше, чем у мужчин (Caccamo N., et al., 2006).
γδ-Т-клетки обладают очень быстрой (начинающейся после 4-6 дней), высокой (в 200 раз) и длительной (>7 месяцев) пролиферативной способностью в ответ на антиген. Кроме того, в течение иммунного ответа антиген-специфические γδ-Т-клетки могут составлять до 48-98 % от общего количества циркулирующих γδ-Т-клеток. Таким образом, обнаружение увеличенной циркулирующей субпопуляции γδ-Т-клеток может позволить сделать предположение о недавней или продолжающейся хронической стимуляции, особенно на слизистых оболочках или участках кожи. Эта информация позволяет клиницистам делать предположение о возможном медленно прогрессирующем инфекционном заболевании (Chen Z.W., et al., 2003).
На клеточной поверхности и αβ-, и γδ-антигенраспознающие рецепторы T-клеток располагаются непосредственно рядом с полипептидным комплексом, имеющим групповое название CD3. Это соседство и ассоциация с CD3 являются необходимым условием для экспрессии всего рецепторного комплекса на поверхности клеток.
Приведенные выше факты свидетельствуют в пользу того, что для более полной характеристики Т-клеток пациента анализ следует проводить не только по такому линейно-специфическому маркеру как CD3, но и по наличию субпопуляций αβ-T-клеток и γδ–Т-клеток. Важность определения последних становится очевидной для целого ряда заболеваний. В первую очередь к ним относятся такие заболевания как ВИЧ-инфекция, вторичные и первичные иммунодефицитные состояния, сопровождающиеся длительной персистенцией микроорганизмов в организме человека на фоне депрессии Т-клеточного звена иммунной системы. И особенно важным становится определение γδ–Т-клеток при оценке общего количества Т-клеток в тех случаях, когда от их количества зависит доза назначаемых препаратов (например, назначение антиретровирусной терапии ВИЧ-инфицированным пациентам).
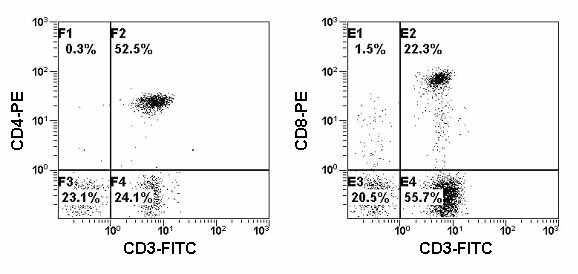
Рис. 21. Гистограммы распределения Т-клеток и их субпопуляций, полученные в результате многоцветного анализа лимфоцитов периферической крови с использованием комбинации моноклональных антител CD3/CD4/CD8/CD45. Анализ проводили на CD45 позитивных клетках.
Количественный анализ T-клеток является наиболее востребованным исследованием для иммунологического контроля состояний при синдроме приобретенного иммунодефицита (СПИД), мониторинга как за пациентами после трансплантации костного мозга, так и эффективности иммунодепрессивной терапии. Стандартные протоколы иммунофенотипирования, использующие четыре цвета, позволяют проводить идентификацию субпопуляций T лимфоцитов в одном образце (Рис. 21). Этот анализ предоставляет исследователю намного больше информации, но до последнего времени она находилась вне зоны внимания клиницистов (Reimann K.A., et al., 2000).
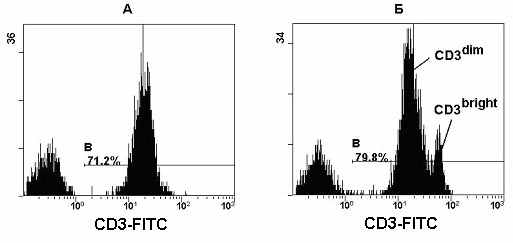
Рис. 22. Гистограммы распределения Т-клеток по плотности экслрессии CD3 на их поверхности. А – распределение CD3 позитивных Т-клеток у здорового донора. Б - распределение CD3 позитивных Т-клеток у пациента с вирусом Эпштейн-Бара.
Так, при использовании комбинации МА CD3/CD4/CD8/CD45 при обычном анализе периферических T-клеток достаточно часто наблюдается бимодальное распределение экспрессии CD3, которое предполагает наличие двух отличных субпопуляции T-клеток (Рис. 22Б). Помимо молекул CD3 антиген-специфический T-клеточный рецептор является другим пан-T-клеточным маркером, который необходимо использовать при анализе пациентов с иммунологическими расстройствами. Как было описано выше, существует два отличных типа TCR - αβ-TCR и γδ-TCR, которые различаются по происхождению в онтогенезе и функциональным свойствам. В медицинской практике, как правило, внимание клиницистов сосредоточено, прежде всего, на αβ-T-клетках, которые составляют большую часть T-лимфоцитов. Остающиеся около 5% γδ-T-клеток, как правило, выпадают из зоны внимания клиницистов, и эти клетки рассматривали исключительно при исследовании иммунитета слизистых оболочек и в тимусе.
Данный этап необходим, так как большинство γδ–Т-клеток, циркулирующих в периферической крови "дважды отрицательны" по CD4 и CD8. Другая их особенность заключается в том, что они имеют более высокую плотность экспрессии молекулы CD3 на своей поверхности (CD3bright). На Рис. 22 изображено достаточно часто встречающееся распределение CD3 положительных лимфоцитов при бактериальных и вирусных инфекциях, первичных и вторичных иммунодефицитах. Как видно из Рис. 23, клетки находящиеся в зонах А, Б и В экспрессируют высокий уровень CD3. В свою очередь клетки в зоне А имеют фенотип CD3brightCD4-, в зоне Б CD3brightCD8dim и зоне В CD3brightCD8-. Все эти признаки характерны для γδ-T-клеток. Чтобы выявить γδ- и αβ-T-клеток, как правило, используют следующую комбинацию МА αβ-TCR/γδ-TCR/CD3/CD45.
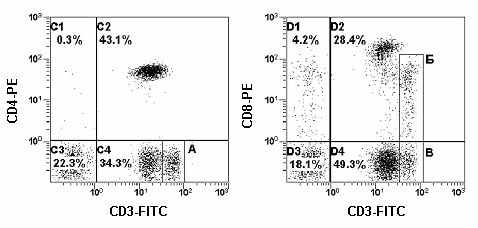
Рис. 23. Гистограммы распределения Т-клеток и их субпопуляций, полученные в результате многоцветного анализа лимфоцитов периферической крови пациента с хроническим носительством вируса Эпштейн-Бара. В зонах А, Б и В находятся CD3bright Т-клетки.
На Рис. 24 представлены гистограммы распределения Т-клеток, полученные в результате многоцветного анализа лимфоцитов периферической крови пациента с хроническим носительством вируса Эпштейн-Бара. На Рис. 24А в квадранте F2 находятся γδ-T-клетки, на Рис. 24Б в квадранте Е2 - αβ-T-клетки.
Все изложенное выше свидетельствует в пользу того, что для наиболее полной фенотипической характеристики T-клеток необходимо проводить анализ не только линейно-специфичного маркера T-клеток CD3, но и определять субпопуляционный состав T-клеток по экспрессии Т-клеточного рецептора, а именно γδ- и αβ-TCR. Для этих целей следует использовать многоцветный анализ и следующие комбинации МА: CD3/CD4/CD8/CD45 и αβ-TCR/γδ-TCR/CD3/CD45.
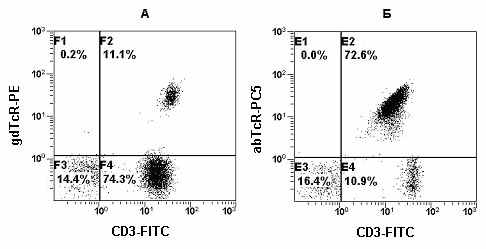
Рис. 24. Гистограммы распределения Т-клеток, полученные в результате многоцветного анализа лимфоцитов периферической крови пациента с хроническим носительством вируса Эпштейн-Бара.
Таким образом, более полная информация об экспрессии Т-клеточного рецептора в клинической практике значительно расширяет возможности для анализа состояния Т-клеточного звена иммунной системы не только с точки зрения адекватного выявления его дефектов, но и для правильного назначения химиотерапевтических препаратов, направленных на восстановление нормального функционирования защитных систем организма.
Идентификация регуляторных Т-клеток и Т-клеток памяти.
В крови человека присутствуют как наивные Т-клетки, так и Т-клетки памяти, различающиеся между собой по функциональным и фенотипическим признакам. Жизненный цикл Т-клеток в организме делится на две фазы. Независимая от чужеродного антигена стадия дифференцировки Т-клеток и стадия, связанная с присутствием чужеродного антигена. Первая из них завершается появлением в русле крови зрелых наивных Т-лимфоцитов, каждый из которых способен отвечать только на «свой» антиген. Стимулированные антигеном в ходе первичного ответа Т-клетки проходят дальнейшую дифференцировку (Sprent J., 1994).
Все Т-клетки памяти появляются в результате дифференцировки активированных антигеном наивных предшественников в ходе нормального развития первичного иммунного ответа in vivo. Экспрессия на клеточной поверхности различных изоформ молекулы CD45 позволяет разделить CD4+ Т-лимфоциты человека на наивные Т-клетки и Т-клетки памяти. Принято относить субпопуляцию CD4+CD45RA–CD45R0+ Т-лимфоцитов к Т-клеткам памяти и соответственно CD4+CD45RA+CD45R0– – к наивным Т-клеткам (Рис. 25). Подобное разделение основано исключительно на способности CD4+CD45RA–CD45R0+ Т-клеток, а не наивных Т-лимфоцитов, интенсивно отвечать на повторный контакт с антигеном in vitro. В свою очередь, быстрый и усиленный ответ Т-клеток памяти на специфический антиген является их важнейшим функциональным отличием от наивных предшественников (Sanders M.E., et al., 1988; Michie, C.A., et al., 1992).
Покоящиеся CD4+ Т-лимфоциты памяти также отличаются от наивных предшественников системой внутриклеточной сигнализации, приводящей к резистентности к действию Са2+-ионофоров. Чувствительная к действию Са2+-ионофоров популяция CD4+ Т-клеток человека составляет основную часть покоящихся наивных CD4+CD45RA+CD45R0– Т-лимфоцитов. В свою очередь, большинство резистентных к действию Са2+-ионофоров CD4+ Т-клеток являются покоящимися CD4+CD45RA–CD45R0+ Т-лимфоцитами памяти (Ishida Y., et al., 1988; Miller R.A., et al., 1991; Sigova A., et al., 1999; Хайдуков С.В., и др., 2003).
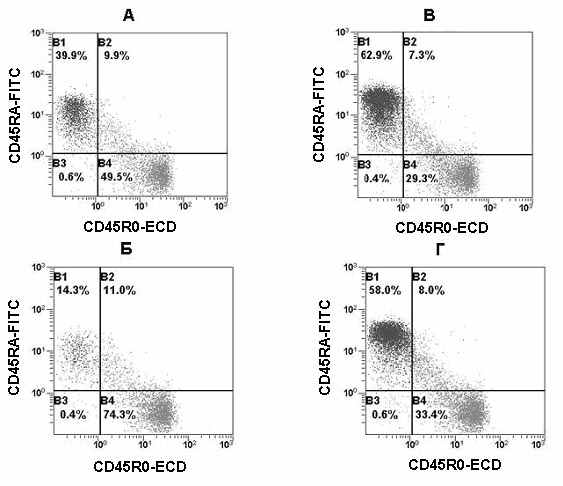
Рис. 25 Распределение лимфоцитов условно здорового лица (А и В) и пациента в послеоперационный период (Б и Г). На гистограммах В и Г анализ лимфоцитов проводили только с гейтированием по CD45. На гистограммах А и Б анализировали клетки при помощи многоэтапного гейтирования по CD45 и CD4.
Основная методическая сложность в исследованиях процесса дифференцировки CD4+ Т-лимфоцитов в периферической крови здоровых лиц связана с тем, что активированные клетки составляют лишь незначительную часть. Как правило, в крови здоровых лиц доля активированных CD4+ Т-клеток составляет менее 10% от общего числа CD4+ Т-лимфоцитов (Reimann K.A., et al., 2000).
Однозначным фенотипическим признаком дифференцировки покоящихся наивных CD4+CD45RA+CD45R0– Т-лимфоцитов человека в покоящиеся Т-клетки памяти принято считать появление на поверхности клеток молекул CD45R0 взамен изоформы CD45RA. Данная особенность позволяет выявить три субпопуляции CD4+ Т-лимфоцитов человека: покоящиеся наивные CD45RA+CD45R0– T-клетки, покоящиеся CD45RA–CD45R0+ T-клетки памяти и активированные – CD45RА+CD45R0+ Т-клетки (рис. 25). Все активированные CD4+CD45RA+CD45R0+ Т-лимфоциты возникают в процессе стимуляции наивных Т-клеток антигеном in vivo (Sanders M.E., et al., 1988; Michie, C.A., et al., 1992).
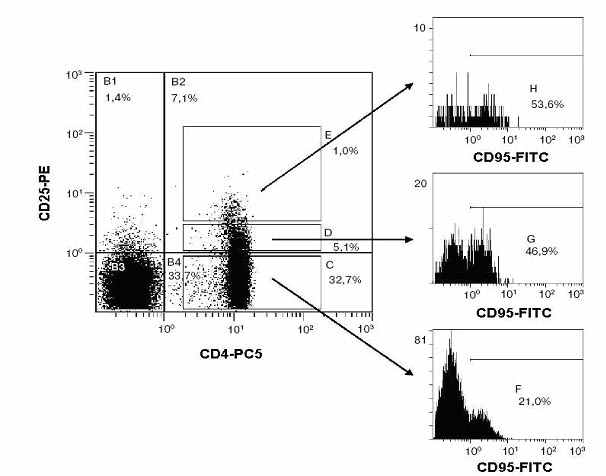
Рис. 26 Алгоритм анализа субпопуляций CD4+CD25+ Т-лимфоцитов человека: CD4+CD25high – зона E, CD4+CD25low – зона D, CD4+CD25– – зона C. В однопараметрических гистограммах представлено распределения молекул CD95+ на CD4+CD25high, CD4+CD25low и CD4+CD25– Т-лимфоцитах. Распределения молекул CD38, CD62L и HLA-DR на поверхности CD4+CD25high, CD4+CD25low и CD4+CD25– Т-клеток оценивалось аналогичным способом.
Появление молекул CD69 считают основным фенотипическим признаком наиболее ранней (первые часы) стадии активации наивных CD4+ Т-лимфоцитов. Как правило, в крови здоровых лиц не удается обнаружить присутствие более чем 1–4% CD4+CD69+ Т-клеток (Gerosa F., et al., 1991; Mascher B., et al., 1999; Pala P., et al., 2000).
Определение относительного количества CD4+CD45RA+CD45R0– и CD4+CD45RA–CD45R0+ лимфоцитов может служить хорошим диагностическим признаком. Этот эффект четко проявляется при развитии инфекции или при хирургическом вмешательстве, поскольку происходит накопление доли CD4+CD45RA–CD45R0+ клеток и снижение CD4+CD45RA+CD45R0–. Как видно из Рис. 25, определение относительного количества CD45RA+ и CD45R0+ клеток по всей популяции лимфоцитов мало информативен и только анализ по зоне CD4 позитивных клеток позволяет четко увидеть это различие.
Популяция CD4+CD25+ Т-клеток человека гетерогенна по функциональным свойствам и фенотипическим признакам. Она включает в себя популяции пролиферирующих CD4+CD45RA+CD45R0+CD25low Т-клеток и «регуляторных» (T-reg – T regulatory) CD4+CD45R0+CD25high Т-лимфоцитов. Идентификацию этих популяций клеток принято проводить по совокупности количественных параметров экспрессии молекул CD38, CD62L, CD95 и HLA-DR. В подобном случае правильный выбор областей анализа (Рис. 26 и 28) в наибольшей степени определяет корректность описания субпопуляций CD4+CD25+ Т-лимфоцитов человека. Согласно проведенному анализу, фенотипические признаки субпопуляции CD25high, CD25low и CD25– Т-лимфоцитов полностью отвечают существующим критериям для данных типов Т-клеток (Jonuleit H., et al., 2001; Baecher-Allan C., et al., 2001; Shevach E.M., 2002).
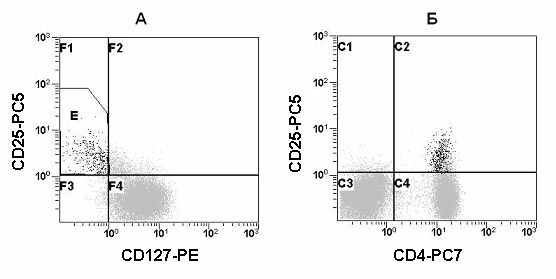
Рис. 27. Многоэтапное гейтирование при анализе T-reg клеток в периферической крови. А – гистограмма распределения CD127 и CD25 после одновременного гейтирования по CD4 и CD45. В зоне Е находятся регуляторные клетки. Б - гистограмма распределения CD4 и CD25 после гейтирования только по CD45. Черные точки – T-reg клетки.
T-reg клетки имеют следующий фенотип CD3+CD4+CD25highCD45R0+CD95+, однако наиболее важным их маркером является FOXP3. Исследования показали, что FOXP3, который кодирует фактор транскрипции скурфин (scurfin), является главным регулирующим геном для развития и функционирования CD4+CD25high регуляторных T клеток. Таким образом, самым точным маркером для идентификации T-reg клеток является как раз фактор транскрипции FOXP3. Однако он является внутриклеточным маркером, что значительно затрудняет работу по идентификации T-reg (Schubert L.A., et al., 2001).
Исследования последних лет показали, что экспрессия CD127 на T-reg клетках снижена или отсутствует. В свою очередь, эксперементы in vitro выявили, что экспрессия CD127 после активации Т клеток резко снижается. CD127 представляет из себя α-цепь гетеродимерного рецептора IL-7, который состоит из CD127 и общей γ-цепи, которая представлена и у других рецепторов цитокинов (IL-2R, IL-4R, IL-9R, IL-15R, и IL-21R). CD127 экспрессируется на тимоцитах, T- и B-предшествинниках, зрелых T клетках, моноцитах, и некоторых других лимфоидных и миелоидных клетках. Показано, что IL-7R играет важную роль в пролиферации и дифференцировке зрелых T клеток (Ryan D.H., et al., 1997; Zaunders J.J., et al., 2006).
Таким образом, окончательный фенотип T-reg клеток будет выглядеть следующим образом: CD3+CD4+CD25brightCD127dim-to-negFOXP3+ и для их детектирования можно использовать данный фенотип T-reg, без выявления FOXP3. Для более точной локализации T-reg клеток предпочтительно использовать многоцветный анализ и многоэтапное гейтирование с использованием следующего набора МА – CD45-FITC, CD4-PC7, CD25-PC5 и CD127-PE (Рис. 27). Среднестатистические результаты анализа T-reg клеток взрослых условно здоровых лиц представлены в Таблице 5.
Таблица 5. Среднестатистическое содержание субпопуляций регуляторных Т-клеток в периферической крови взрослых условно здоровых лиц (N = 60).
| Субпопуляции | Содержание | |
| Относительное (%) | Абсолютное количество (кл/л) | |
| Общие Т хелперы | 45 ± 10 | 0,576-1,336 x 109 |
| Регуляторные Т-клетки (относительно Т хелперов) | 3,7± 2,05 | 0,009-0,078 х 109 |
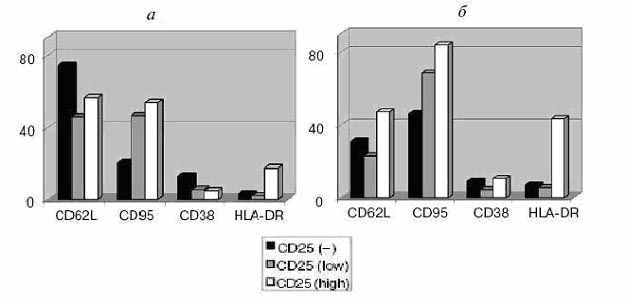
Субпопуляции CD4+CD25+ Т-клеток проявляют неодинаковую чувствительность к действию иономицина. В иономицин резистентной фракции (ИР-фракции) значительно возрастает доля CD4+CD25high Т-клеток по сравнению с кровью того же донора, а содержание CD4+CD25low Т-лимфоцитов – уменьшается. Следовательно, большинство CD4+CD25high Т-лимфоцитов представлено резистентными к действию иономицина клетками. Полного исчезновения CD4+CD25low Т-лимфоцитов в ИР-фракции никогда не наблюдалось. Следовательно, и в составе CD4+CD25low Т-лимфоцитов присутствуют клетки, различающиеся по своей чувствительности к действию иономицина. Изменение содержания субпопуляций CD4+CD25+ Т-лимфоцитов в ответ на действие иономицина напрямую зависело от исходной доли Т-клеток с данным фенотипом в крови. Однако обогащение ИР-фракции CD4+CD25high Т-клетками и одновременное с ним снижение доли CD4+CD25low Т-лимфоцитов наблюдалось наиболее часто.
В сравнении с CD4+CD25high Т-лимфоцитами ПКЧ, ИР-популяция (Рис. 28) всегда обогащена клетками с высоким уровнем экспрессии молекул HLA-DR и CD95. Одновременно ИР CD4+CD25high Т-лимфоциты характеризуются меньшей долей CD62L+ клеток (Рис. 28) и заметным снижением уровня экспрессии этих молекул. По сравнению с CD4+CD25low Т-клетками ПКЧ, ИР-фракция обогащена CD95+ клетками с высоким уровнем экспрессии этих молекул (Рис. 28). При этом в ИР-фракции CD4+CD25low Т-лимфоцитов наблюдалось выраженное уменьшение доли CD62L+ клеток и снижение уровня экспрессии этих молекул. Среди ИР CD4+CD25low Т-лимфоцитов уменьшение доли CD38+ клеток (Рис. 28) происходит за счет лимфоцитов с низким уровнем экспрессии этого маркера.
Появление молекул HLA-DR на CD4+ Т-лимфоцитах считается признаком поздней стадии активации этих клеток. Существование CD4+CD25+HLA-DR+ Т-клеток в ПКЧ не позволяет полностью разграничить данный этап активации Т-лимфоцитов от предыдущего. Большинство CD4+HLA-DR+ Т-клеток ПКЧ имеют, как правило, фенотип CD4+CD45RA–CD45R0+. Скорее всего, на поздних стадиях активации in vivo в ходе нормального развития первичного иммунного ответа основная часть этих CD4+ Т-лимфоцитов человека качественно изменяет свой характер регуляции внутриклеточного Ca2+ и приобретает резистентность к действию низких доз иономицина.