Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова Российской Академии Наук
| Вид материала | Диссертация |
- План научно-исследовательской работы на 2012 г. Учреждения Российской Академии наук, 797.38kb.
- Vi московский международный конгресс, 625.54kb.
- М. М. Шемякина и Ю. А. Овчинникова ран институт молекулярной генетики ран нейрохимическое, 386.57kb.
- Ордена Трудового Красного Знамени Институт биоорганической химии имени академиков, 191.71kb.
- В. Т. Иванов, директор Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова, 719.75kb.
- Синтетические пептиды, взаимодействующие с различными типами холинорецепторов, 487.49kb.
- Международная научно-практическая конференция, 130.29kb.
- Международная научно-практическая конференция, 148.88kb.
- Международная научно-практическая конференция, 301.89kb.
- Программа отчетной конференции по программе фундаментальных исследований Президиума, 123.52kb.
Рис. 1. Пример использования дискриминатора для удаления из зоны анализа частиц, не соответствующих клеткам по параметрам светорассеяния. А - анализ образца в отсутствии дискриминатора; Б - анализ образца при включенном дискриминаторе.
Оптимизация настройки дискриминатора. Современные цитометры обладают высокой чувствительностью по малоугловому светорассеянию, т.е. по размерам исследуемых частиц (чувствительность достигает 0,1 мкм), поэтому они регистрируют множество объектов, которые не являются клетками. Особенно это проявляется на образцах, приготовленных по так называемой «безотмывочной» технологии. Наличие в образце множества объектов, которые не являются лейкоцитами, приводит к тому, что цитометр «захлебывается» от обилия данных и это приводит к получению недостоверных результатов. Чтобы избежать этого эффекта, необходимо ввести ограничения по отображаемым на гистограмме событиям, т.е. задать границы чувствительности цитометра. Для этих целей служит дискриминатор. Необходимо ввести такие его значения, чтобы были видны все основные популяции клеток анализируемого образца, а частицы, которые не являются клетками (дебрис), не попадали в зону анализа. Как правило, это ограничение ставится на канал малоуглового рассеяния света (Рис. 1). Следует отметить, что слишком завышенные значения дискриминатора могут убрать из анализа часть интересующей исследователя популяции клеток, поэтому к этому этапу настройки цитометра необходимо подходить со всей ответственностью.
Оптимизация настройки параметров светорассеяния. Как правило, современные цитометры используют два канала светорассеяния: регистрируется сигналы от малоуглового светорассеяния и рассеяния света под углом 90о. Малоугловое светорассеяние (Forward Scatter, FS) представляет собой рассеяние света от поверхности клеток под малыми углами (1-19о) и пропорционально диаметру исследуемого объекта. В свою очередь, канал бокового светорассеяния или рассеяния света под углом 90о (Side Scatter, SS) регистрирует весь свет, рассеянный как самой клеткой, так и ее органеллами, т.е. характеризует структуру и гранулярность объекта. Таким образом, два вида светорассеяния позволяют регистрировать два морфологических параметра клеток.
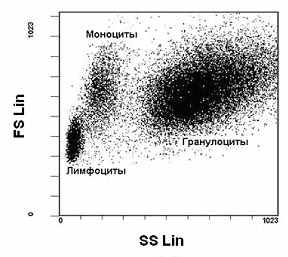 | Рис. 2. Распределение клеток периферической крови при оптимальной настройке каналов светорассеяния. FS – малоугловое светорассеяние; SS – светорассеяние под углом 90о. |
Использование двух этих параметров позволяет в гетерогенной популяции клеток локализовать все входящие в нее компоненты. Данная процедура производится за счет использования «гейтирования». GATE (ворота) – логически ограниченная область клеток с определенными характеристиками на гистограмме их распределения, позволяющая анализировать события, заключенные исключительно в данную область. Гейтирование (от gating) – введение данных логических ограничений из одной гистограммы в другие. Данная функция позволяет отображать и анализировать события, попадающие исключительно в интересующую нас область.
Примером могут служить лейкоциты периферической крови, состоящие из лимфоцитов, моноцитов и гранулоцитов (Рис. 2). При анализе периферической крови необходимо соблюдать правило: все основные популяции клеток должны быть отображены на гистограмме распределения клеток по двум светорассеяниям, что облегчит работу.
Использование морфологических параметров (FS и SS) для локализации лимфоцитов достаточно часто приводит к получению некорректных результатов. Это бывает связано, как правило, с неполным лизисом эритроцитов, попаданием базофилов в зону лимфоцитов и т.д. Для диагностики состояния иммунной системы и ее аномалий более корректным представляется локализация лимфоцитов, опираясь на экспрессию общего для лейкоцитов антигена (CD45) в многоцветном анализе (анализ больше трех цветов) и многостадийное гейтирование. В последнее время все чаще используется метод локализации лимфоцитов именно по наличию CD45.
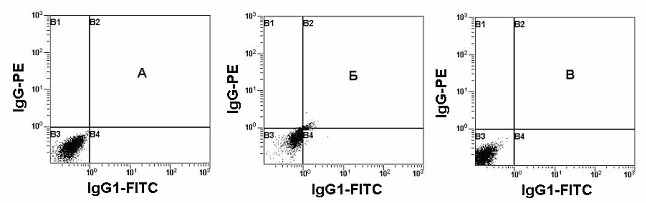
Рис. 3. Оптимизация настройки каналов флуоресценции. Негативные клетки должны находиться в середине первой декады логарифмической шкалы интенсивности флуоресценции (А). Б и В - примеры неправильной настройки цитометра. Б - слишком высокое напряжение на ФЭУ. В - слишком низкое напряжение на ФЭУ.
Оптимизация настройки параметров фотоэлектронных умножителей (ФЭУ) для флюоресценции. После настройки каналов светорассеяния приступают к настройке чувствительности каналов флюоресценции. Этот процесс начинают с анализа негативного контроля, который представляет собой клетки образца, окрашенные неспецифическими антителами мечеными теми же флуорохромами с которыми предстоит работать в дальнейшем (изотипический контроль). Негативные клетки должны попадать в первую декаду на логарифмической шкале интенсивности флюоресценции по всем задействованным каналам (Рис. 3А). Необходимо добиться того, чтобы клетки контроля легли, по возможности, в центре первой декады. Следует сразу отметить, что неспецифическое взаимодействие антител различных классов с поверхностью клеток мишеней не одинаково. Исходя из этого, антитела для контрольного образца должны быть того же изотипа и в той же концентрации, что и МА к CD маркерам, используемые для анализа.
На Рис. 3Б и Рис. 3В приведены гистограммы, полученные на цитометрах, настроенных некорректно. Если контрольные клетки попадают во вторую декаду, это, в конечном счете, может привести к ложно-позитивным результатам (Рис. 3Б), а низкая чувствительность приводит к занижению реальных значений (Рис. 3В). И то и другое при клинико-диагностических исследованиях недопустимо.
Оптимизация введения коэффициентов компенсации. После настройки чувствительности прибора в случае многоцветного анализа возникают проблемы. Даже в случаях использования для анализа линейных маркеров, таких как CD19 и CD3, можно увидеть дубль позитивные клетки, хотя они в природе не встречаются. Данный парадокс связан с тем, что спектры, испускаемые флуорохромами, не бывают точечными, а имеют свое распределение в определенном диапазоне. Практически невозможно избежать дополнительного вклада излучения во все ФЭУ, предназначенные для регистрации других флуорохромов, даже если использовать различные наборы барьерных светофильтров. Таким образом, необходимо провести вычитание из общей интенсивности флуоресценции на каждом ФЭУ дополнительного сигнала, генерируемого другими флуорохромами. Данное вычитание называется введением в программу анализа коэффициентов компенсации.
 | Рис. 4. Гистограмма распределения клеток периферической крови иллюстрирующая первое правило введения коэффициентов компенсации. Значениям MEAN X и MEAN Y соответствуют значения максимумов проекций гистограмм распределения клеток на оси X и Y. |
В процессе анализа регистрируется ряд статистических параметров, среди которых есть такое значение как MEAN (рис 4). Этот параметр отражает среднестатистическое положение максимума пика распределения частиц на гистограммах в выбранном канале флюоресценции или светорассеяния. Для процедуры введения коэффициентов компенсации необходимо использовать клетки, окрашенные антителами, связанными с разными флуорохромами, (например, CD3-FITC и CD19-PE) и анализировать их в двухпараметрическом режиме. Антитела для этой процедуры подбирают таким образом, чтобы они относились к двум непересекающимся CD маркерам. Гистограмму разбивают на четыре квадранта, в которых определяют значение MEAN для каждого типа флуоресценции. Первое правило введения коэффициентов компенсации гласит: коэффициенты компенсации введены правильно, если MEAN квадранта 1 равен MEAN квадранта 3 по оси Х, а MEAN квадранта 4 равен MEAN квадранта 3 по оси У (рис 4).
 | Рис. 5. Гистограмма распределения клеток периферической крови иллюстрирующая второе правило введения коэффициентов компенсации. |
Второе правило оптимизации введения коэффициентов компенсации гласит: если мысленно нарисовать линии из центров областей позитивных клеток, то они должны быть приблизительно параллельны осям X и Y или должен образоваться прямоугольник (рис 5).
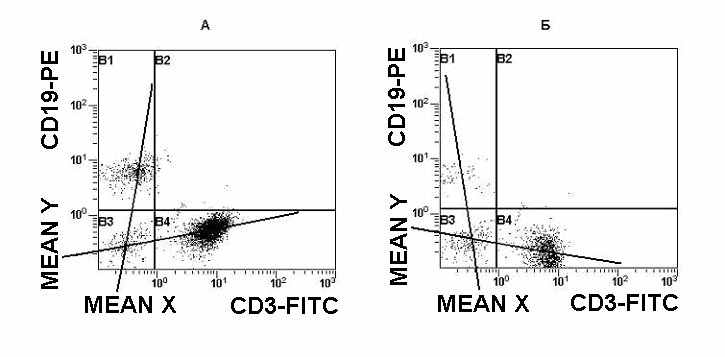
Рис. 6. Примеры неправильного использования коэффициентов компенсации. При недокомпенсации (А): MEAN квадранта 4 больше, чем MEAN квадранта 3 по оси У, а MEAN квадранта 1 больше, чем MEAN квадранта 3 по оси Х. При перекомпенсации (Б): MEAN квадранта 3 больше, чем MEAN квадранта 4 по оси У, а MEAN квадранта 3 больше, чем MEAN квадранта 1 по оси Х.
Всегда существует вероятность пере- или недокомпенсации. На Рис. 6 представлены оба этих случая. При недокомпенсации исследователь может получить завышенный результат и ложно позитивные клетки (рис 6А). При перекомпенсации можно потерять часть позитивных клеток и, как следствие этого, получить заниженный результат (рис 6Б).
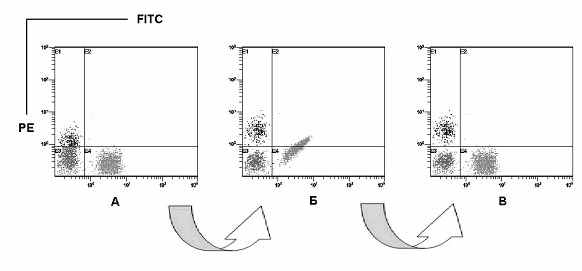
Рис. 7. Оптимизация двухпараметрического анализа FITC (FL1) против PE (FL2) при изменении чувствительности одного из каналов флуоресценции: А - низкая чувствительность по FL2; Б - повышение чувствительности по каналу флуоресценции FL2 за счет увеличения напряжения на ФЭУ; В - вычитание дополнительного вклада интенсивности флуоресценции FITC за счет увеличения коэффициента компенсации.
Между напряжением на ФЭУ и коэффициентами компенсации существует взаимосвязь. В некоторых случаях, когда используют МА от разных фирм производителей, возникает необходимость изменить чувствительность по одному из каналов флюоресценции. Эта процедура приводит к тому, что изменяется и отображение флюоресценции на двухпараметрических гистограммах. Повышая чувствительность по одному из каналов, необходимо изменить и соответствующий этому каналу коэффициент компенсации. Например, в двухпараметрическом анализе FITC против PE, задействованы два канала флюоресценции (FL1 и FL2). Для повышения чувствительности по каналу флюоресценции FL2 поднимают напряжение на ФЭУ. При этом наблюдается дополнительный вклад интенсивности флуоресценции FITC в канал FL2, который необходимо вычесть за счет увеличения коэффициента компенсации (Рис. 7).
Таким образом, алгоритм настройки рабочего протокола выглядит следующим образом: проверка работы цитометра; настройка дискриминатора; настройка каналов светорассеяния; настройка каналов флюоресценции; введение коэффициентов компенсации.
Предложенный подход для настройки проточных цитометров и последующего анализа окрашенных клеток применим к большинству производимых цитометров.
Стандартные настройки и создание протоколов позволяют более корректно проводить анализ как в клинико-диагностических, так и научно-исследовательских целях. В свою очередь, это позволяет использовать подготовленные протоколы для исследований и включать или исключать те или иные параметры в анализ, в зависимости от целей поставленных перед врачом-лаборантом или научным работником.
Идентификация субпопуляций В-клеток.
При оценке относительного количества и характеристик клеток, участвующих в иммунном ответе на антигены, очень важно иметь представление обо всех типах клеток, участвующих в формировании специфического (адаптивного) иммунного ответа организма на внедрение патогена. При формировании иммунной реакции одна из ведущих ролей принадлежит клеткам тимического происхождения, получивших название Т-лимфоциты. В то же время эффекторные механизмы специфической иммунореактивности обеспечиваются либо эффекторными Т-клетками (Т-эффекторами ГЗТ, цитотоксическими Т-клетками), либо специфическими гуморальными факторами, секретируемые определенной субпопуляцией лейкоцитов. Специфический гуморальный иммунный ответ обеспечивают хорошо всем известные антитела. Они обладают способностью взаимодействовать с внедрившимися микроорганизмами, активировать систему комплемента и стимулировать фагоцитарную активность клеток-фагоцитов, взаимодействуя с их мембранными рецепторами.
Популяцией лимфоцитов, отвечающей за продукцию антител, являются В-клетки. Каждый лимфоцит, относящийся к В-клеткам, запрограммирован на продукцию антител одной-единственной специфичности, и эти антитела присутствуют на его поверхности в качестве рецептора для соответствующего антигена. Один В-лимфоцит несет на своей поверхности примерно 105 идентичных молекул антител. Данные антитела называют поверхностным или мембранными иммуноглобулинами (Робсон А., и др., 2006).
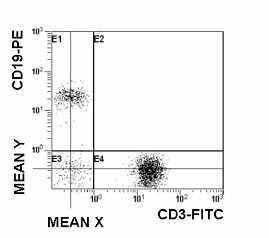
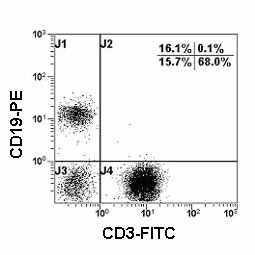 | Рис. 8 Гистограмма распределения CD3 и CD19 на лимфоцитах периферической крови. CD3-CD19+ В-клетки (квадрант J1), CD3+CD19- Т-клетки (квадрант J4). |
Основной формой мембранных иммуноглобулинов являются иммуноглобулины класса М (IgM). Они экспрессируются на мембране всех зрелых В-клеток, которые не имели контакта с антигеном. Однако, на поверхности В-клеток, дифференцировка которых уже завершилась, присутствуют и иммуноглобулины класса D (IgD). В процессе формирования иммунного ответа происходит переключение изотипов мембранных иммуноглобулинов на IgG, IgA, IgE (Ярилин А.А., 1999).
Кроме мембранных иммуноглобулинов, В-клетки экспрессируют целый ряд мембранных маркеров, которые необходимы для формирования В-клеточного рецептора (BCR) и играют важную роль в передаче сигнала в процессе распознавания антигена, а также являются маркерами линейной принадлежности B-клеток, что особенно полезно при идентификации данной популяции лимфоцитов. К таким маркерам, прежде всего, относятся CD19 и CD21. Данные молекулы формируют ко-рецепторный комплекс, в который вовлечен также и CD81 (Hultin L.E., et al., 1993).
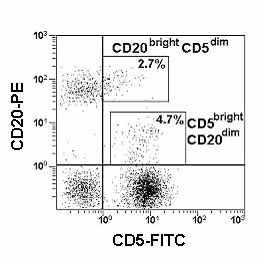 | Рис. 9 Гистограмма распределения CD20 и CD5 на лимфоцитах периферической крови у пациента с ревматоидным артритом. |
CD19 антиген (также известный как B4) - представляет собой мембранный гликопротеин, принимающий участие в регулирование развития B-лимфоцитов, их активации и дифференцировки. Эта молекула экспрессируется на всех нормальных B-клетках, включая про-B-лимфоциты, но исчезает у плазматических клеток в процессе их созревания. Молекула CD19 отсутствует на мембране нормальных T-клеток, NK-клетках, моноцитах и гранулоцитах (Рис. 8). В связи с этим данный антиген рекомендуется для количественной оценки общей популяции B-клеток (Hultin L.E., et al., 1993).
Кроме перечисленных выше структур, в состав В-клеточного рецепторного комплекса вовлечены и другие молекулы, например CD20 - интегральный не гликозилированный мембранный белок. Данная молекула является Ca2+-каналом и участвует в активации и пролиферации В-клеток за счет регуляции трансмембранной проводимости ионов Ca2+. Молекула CD20 присутствует на всех нормальных B лимфоцитах периферической крови, лимфатических узлов, селезенки, миндалин и костного мозга, но отсутствует на плазматических клетках (Hultin L.E., et al., 1993).
Иногда для локализации В-клеток используют CD20, но данная молекула может экспрессироваться в низкой плотности на других популяциях лимфоцитов. Хотя CD20 первоначально был описан как B-клеточный линейный маркер, оказалось, что небольшая субпопуляция Т-клеток человека экспрессирует CD20. Причем, B-клетки экспрессируют CD20 в высокой плотности (CD20bright), а T-клетки в низкой (CD20dim) и составляют 2.4 +/- 1.5 % от лимфоцитов периферической крови.
Хотя оценка экспрессии CD20 полезна при характеристике B-клеток, необходимо достаточно осторожно подходить к интерпретации получаемых результатов (Рис. 9). Особенно это относится к случаям фенотипирования костного мозга. Сходная проблема может возникнуть при фенотипирования периферической крови у пациентов с ревматоидным артритом.
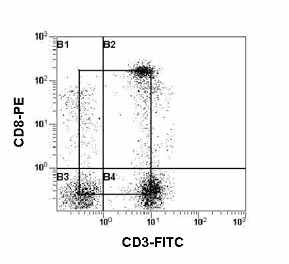
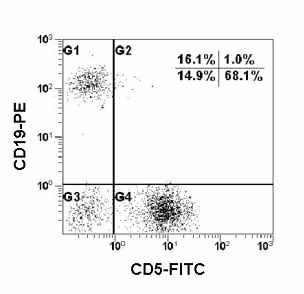 | Рис. 10. Гистограмма распределения CD5 и CD19 на лимфоцитах периферической крови. Субпопуляции В-клеток: CD19+CD5+ В-1 (квадрант G2); CD19+CD5- B-2 (квадрант G1). |
В настоящее время среди В-клеток выделяют три основные субпопуляции, а именно: В-1, В-2 и В-клетки памяти. Достаточно важная роль при данном делении отводится молекуле CD5 (Рис. 10). CD5 обнаружен на всех зрелых T-лимфоцитах и на большинстве тимоцитов. CD5 также присутствует на субпопуляциях B-лимфоцитов, но отсутствует на гранулоцитах и моноцитах. Молекула CD5 является лигандом для CD72 антигена, который присутствует на B-лимфоцитах. Точная функциональная роль CD5 все еще до конца не изучена, однако для этих молекул была показана физическая ассоциация с антиген-специфическим рецепторным комплексом как на T-, так и на B-лимфоцитах и возможность модулировать передачу сигналов через этот комплекс. В последние годы было показано, что CD5 может быть посредником негативной регуляции при передачи сигналов для BCR.
Кроме роли, связанной с передачей сигналов при активации, молекула CD5 была расценена как возможный маркер B-клеток, позволяющий различать их субпопуляции: CD5+ B-клетки (также называемые B-1 клетки) и CD5- B-клетки (или B-2 клетки) (Рис. 10).
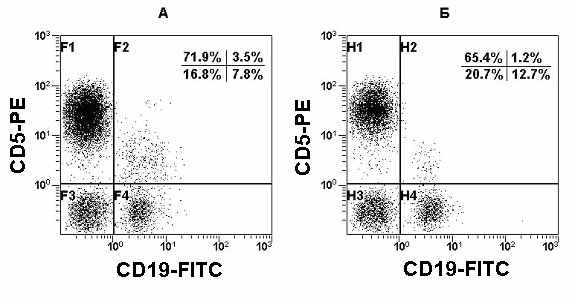
Рис. 11. Гистограммы распределения CD5 и CD19 на лимфоцитах периферической крови. Субпопуляции В-1 лимфоцитов у пациента К. с аутоиммунным тиреоидитом: А - до лечения; Б – в процессе лечения.
Анализ В-1 и В-2 клеток в ПКЧ условно здоровых лиц позволил определить среднестатистическое количество этих субпопуляций. Было проанализировано 60 условно здоровых лиц, и результаты представлены в Таблице 2.
Таблица 2. Среднестатистическое содержание субпопуляций В-1 и В-2 лимфоцитов в периферической крови взрослых условно здоровых лиц (N = 60).
| Субпопуляции | Содержание | ||
| Относительно лимфоцитов (%) | Относительно общих В-клеток (%) | Абсолютное количество (кл/л) | |
| Общие В-клетки | 12 5,0 | | 0,099-0,336 х 109 |
| В-1 клетки | 1,3 0,8 | 10,8 6,7 | 0,022-0,115 х 109 |
| В-2 клетки | 10,7 4,2 | 89,2 7,1 | 0,081-0,323 х 109 |
B-1 клетки вызывают значительный интерес за счет того, что их ассоциируют с продукцией аутоантител, в том числе и при аутоиммунной патологии. Значительная роль B-1 клеток была отмечена при ревматоидном артрите, системной красной волчанке и синдроме Шегрена. Увеличение количества CD5+ B-клеток наблюдали у пациентов, страдающих миастенией, инсулин-зависимым диабетом и тиреоидитом Хашимото. Доля CD5+ В-клеток может составлять треть и более от всех В-клеток (Рис. 11).
Следующей субпопуляцией В-клеток, вызывающей значительный интерес у исследователей, являются В-клетки памяти. Идентификация CD27 как маркера памяти B-клеток позволила надежно и эффективно идентифицировать в периферической крови наивные В-клетки (IgM+/CD27-) и B-клетки памяти (CD27+) (Рис. 12).
CD27 антиген представляет собой трансмембранный гликопротеин. Он обнаружен на медуллярных тимоцитах, периферических T лимфоцитах, активированных B лимфоцитах и NK клетках. Его лигандом является молекула CD70.Взаимодействие CD27 с его лигандом (CD70) на T клетках является одним из условий дифференцировки B-клеток в плазматические клетки. В свою очередь, существующие данные указывают на то, что отсутствие IgD-CD27+ B-клеток памяти в значительной степени объясняет нарушение продукции иммуноглобулинов, несмотря на функциональную передачу сигналов молекулой CD40 у пациентов с синдромом X-связанного гипер-IgM.
Таблица 3. Среднестатистическое содержание субпопуляций В-клеток памяти в периферической крови взрослых условно здоровых лиц (N = 60).
| Субпопуляции | Содержание | ||
| Относительно лимфоцитов (%) | Относительно общих В-клеток (%) | Абсолютное количество (кл/л) | |
| Общие В-клетки | 12 5,0 | | 0,099-0,336 х 109 |
| В-клетки памяти | 4,3 2,5 | 31,25 8,45 | 0,012-0,040 х 109 |
