Ордена Трудового Красного Знамени Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова Лаборатория структурной биологии, группа ямр кузьмичёв Павел Константинович исследование
| Вид материала | Исследование |
- План научно-исследовательской работы на 2012 г. Учреждения Российской Академии наук, 797.38kb.
- Vi московский международный конгресс, 625.54kb.
- Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова, 871.3kb.
- М. М. Шемякина и Ю. А. Овчинникова ран институт молекулярной генетики ран нейрохимическое, 386.57kb.
- Трудового Красного Знамени юридический институт имени Р. А. Руденко производство, 1168.28kb.
- В. Т. Иванов, директор Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова, 719.75kb.
- Синтетические пептиды, взаимодействующие с различными типами холинорецепторов, 487.49kb.
- Международная научно-практическая конференция, 130.29kb.
- Международная научно-практическая конференция, 301.89kb.
- Международная научно-практическая конференция, 148.88kb.
М

 осковский Ордена Трудового Красного Знамени Физико-технический институт (государственный университет)
осковский Ордена Трудового Красного Знамени Физико-технический институт (государственный университет)Факультет молекулярной и биологической физики
Кафедра физико-химической биологии и биотехнологии
Ордена Трудового Красного Знамени Институт биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова
Лаборатория структурной биологии, группа ЯМР
Кузьмичёв Павел Константинович
ИССЛЕДОВАНИЕ ПРОЦЕССОВ РЕФОЛДИНГА МЕМБРАННЫХ БЕЛКОВ
Реферат
Научный руководитель:
Чупин В.В., д.х.н., доцент
Москва, ИБХ РАН, 2006
СОДЕРЖАНИЕ
Глава Стр.
- Введение……………………………………………………………………………..3
- Трудности и их преодоление в изучении мембранных белков…………........4
- Использование детергентов………………………………………………………5
- Рефолдинг калиевого канала KcsA
Использование оптических методов изучения……………………………......7
- Исследование структуры белков с помощью ЯМР………………………....10
- Исследование KcsA с помощью ЯМР………………………………………...12
- Перспективы…………………………………………………………………….15
- Список литературы…………………………………………………………….16
ВВЕДЕНИЕ
Известно, что мембранные белки составляют значительную часть в большинстве организмов -- около четверти генома прокариотов и эукариотов кодируют именно эти белки [1]. Многие из этих белков находятся в плазматической мембране. Мембранные белки играют жизненно важную роль в клеточных функциях, таких как передача сигналов, производство энергии, распознавание и транспорт веществ через мембрану.
Хотя в последнее время были достигнуты немалые успехи в изучении структур и функций различных мембранных белков, очень многое ещё только предстоит сделать. Менее чем 1% всех структур в Protein Data Bank это мембранные белки, и доступная на сегодняшний день информация о структуре и механизмах действия крайне скудна, что связано с трудностью проведения структурных и функциональных исследований мембранных белков.
Нарушения в функционировании мембранных белков приводят к возникновению и развитию различных паталогий, таких как диабет, сердечнососудистые, нейродегенеративные заболевания и другие. Действие многих современных лекарств направлено на мембранные белки-мишени, в первую очередь мембранные рецепторы и ионные каналы. Для целенаправленного создания новых видов лекарств необходимо знание пространственной структуры мембранных белков, что позволяет использовать для поиска высокоэффективных лигандов мембранных белков современные вычислительные технологии. Однако, на сегодняшний день количество мембранных белков, полученных в нативном виде и, как следствие этого, данные о пространственной структуре этих белков ограничены.
ТРУДНОСТИ И ИХ ПРЕОДОЛЕНИЕ В ИЗУЧЕНИИ МЕМБРАННЫХ БЕЛКОВ
 |
| Рис. 1 Олигомерный мембранный белок |
 Из-за трудностей, возникающих при изучении структуры и функций мембранных белков в составе биологических мембран, оказывается удобным перенос белка в более удобную для исследования искусственную среду. Такие среды состоят из солюбилизирующих компонетнов и должны предохранять гидрофобные участки трансмембранных сегментов от контакта с водной фазой. Был разработан ряд подходов, удовлетворяющий этим требованиям, который в настоящее время используется для солюбилизации и ренатурации (рефолдинга) мембранных белков in vitro. Подобные системы можно использовать и для получения кристаллов белка для последующего применения метода рентгеноструктурной кристаллографии и метода ЯМР спектроскопии с целью определения структуры. К настоящему времени не существует универсальных приемов рефолдинга мембранных белков, а значит, правильное применение такого подхода, к сожалению, остаётся в некотором смысле «искусством». Особую сложность представляет собой рефолдинг олигомерных мембранных белков (Рис. 1), к которым относится большинство рецепторов и ионных каналов.
Из-за трудностей, возникающих при изучении структуры и функций мембранных белков в составе биологических мембран, оказывается удобным перенос белка в более удобную для исследования искусственную среду. Такие среды состоят из солюбилизирующих компонетнов и должны предохранять гидрофобные участки трансмембранных сегментов от контакта с водной фазой. Был разработан ряд подходов, удовлетворяющий этим требованиям, который в настоящее время используется для солюбилизации и ренатурации (рефолдинга) мембранных белков in vitro. Подобные системы можно использовать и для получения кристаллов белка для последующего применения метода рентгеноструктурной кристаллографии и метода ЯМР спектроскопии с целью определения структуры. К настоящему времени не существует универсальных приемов рефолдинга мембранных белков, а значит, правильное применение такого подхода, к сожалению, остаётся в некотором смысле «искусством». Особую сложность представляет собой рефолдинг олигомерных мембранных белков (Рис. 1), к которым относится большинство рецепторов и ионных каналов. Другая проблема заключается в невозможности выделения мембранных белков в достаточных количествах из их нативного окружения, так как мембранные белки обычно присутствуют в биологических мембранах в очень низкой концентрации. Возможный путь решения этой проблемы состоит в экспрессии мембранных белков в бактериальных клетках и последующей экстракции белков из мембран. Однако этот подход зачастую не приносит желаемых результатов из-за токсичности экспрессируемых мембранных белков. Более удобным оказывается другой подход -- экспрессия мембранных белков в тельца включения. При этом также требуется ренатурация (рефолдинг) мембранных белков в нативную структуру in vitro путем солюбилизации мембранных белков в мицеллах, бицеллах или липидных бислоях. Известен способ ренатурации мембранных белков, полученных из телец включения, путем последовательной замены детергентов в мицеллярном окружении мембранных белков [3]. Однако, такой подход имеет серьезные ограничения в случае ренатурации олигомерных мембранных белков, так как в случае мицеллярных систем межмолекулярные белок-белковые контакты затруднены. Как следствие этого, эффективность олигомеризации падает.
ИСПОЛЬЗОВАНИЕ ДЕТЕРГЕНТОВ
На сегодняшний день трудно переоценить всю важность использования детергентов в изучении мембранных белков. Обычно они необходимы при выделении и очистке и используются на первом шаге солюбилизации при ренатурации белков. Существуют детальные описания взаимодействий белков с детергентами и приводится обзор методов, которые могут быть применены для исследования структуры мембранных белков, солюбилизированных детергентами [7-9]. Детергенты – амфипатические молекулы, состоящие из полярной головной части и гридрофобной хвостовой, проявляющие уникальные свойства в водных растворах, в которых они самопроизвольно образуют, как правило, мицеллярные структуры. Подобные структуры близко моделируют свойства биологических мембран.
Существует классификация детергентов по строению, которая подразделяет их на 3 основные группы.
Ионные детергенты содержат заряженную головную часть (при этом, существуют как анионные, так и катионные детергенты). Также они содержат гидрофобный углеводородный хвост или стероидную группу. Критическая концентрация мицеллообразования (ККМ) для ионных детергентов определяется суммарным вкладом эффекта отталкивания головных групп и гидрофобного взаимодействия хвостовых частей. Ионные детергенты, такие как додецилсульфат натрия (SDS), высоко эффективны для солюбилизации, но они всегда, до некоторой степени, денатурируют белок (жёсткие детергенты – сильно, а мягкие, соответственно, слабо). Некоторые белки возможно ренатурируют после обработки SDS путём переноса белка в ренатурирующий детергент. Как было показано, бактериородопсин bR (светопоглощающий белок) [10]. Соли желчных кислот -- это ионные детергенты, которые отличаются от SDS тем, что скелет содержит жёсткие стероидные группы. В результате, такие соли содержат как полярные, так и неполярные части, в отличие от хорошо известных головных групп, и тем самым, они формируют почкообразные формирования в отличие от шаровых мицелл из обычных ионных линейных детергентов. А также, соли желчных кислот чаще всего являются относительно мягкими детергентами, что значительно расширяет возможность их применения, по сравнению с обычными ионными детергентами.
Неионные детергенты состоят из незаряженной гидрофильной головной части, такой как полиоксиэтилен или гликозидные группы. Неионные детергенты, в целом, считаются мягкими и малоденатурирующими белок, так как они гораздо лучше разрушают липид-липидные и липид-белковые нежели белок-белковые взаимодействия. Это позволяет солюбилизировать белки без потерь каких-либо структурных особенностей белков, а значит, их можно изолировать в биологически активной форме. Однако, короткие (С7-С10) неионные детергенты (например, n-октил--D-глюкопиранозид (OG)), часто могут денатурировать белок, в отличие от средних (С12--С14). В последнее время, всё чаще используется n-додецил- -D-мальтозид (DDM).
Цвиттерионные детергенты проявляют свойства как ионных, так и неионных детергентов и, в общем, они больше деактивирируют белок, чем неионные детергенты. Тем не менее, они находят применение в изучении структуры мембранных белков. Например, додецилдиметил-N- аминооксид (DDAO) использовался в работе по кристаллизации реакционного центра Rhodopseudomonas sphaerodies [11].
Дополнительная трудность возникает при удалении избытка или замене детергента. Существуют различные способы решения этой проблемы, путём перевода мембранного белка в липосому или другой детергент. Использование того или иного метода зависит от свойств рассматриваемого детергента, его ККМ, заряда или агрегационного числа (числа мономеров в мицелле).
Наряду с детергентными широкое применение нашли детергент-липидные мицеллы и бицеллы. Например, добавление липидов к OG мицеллам повышает термостабильность нативного состояния bR [12]. Бицеллы имеют гораздо более низкую концентрацию детергента, по сравнению с традиционными мицеллами и некотороые бислойные характеристики улучшают солюбилизацию мембранных белков без потери нативной структуры. К тому же бицелла более похожа на мембрану, нежели мицелла, так как мембрана является бислойным образованием. Кроме того, бицеллы способны переориентироваться в магнитном поле, что делает возможным применения методов ЯМР для исследования структуры мембранных белков. Однако, в связи с тем, что бицелла является более крупным образованием, нежели мицелла, то необходимо помнить, что переход от мицеллы к бицелле вызывает уширение ЯМР сигналов.
РЕФОЛДИНГ КАЛИЕВОГО КАНАЛА KcsA
ИСПОЛЬЗОВАНИЕ ОПТИЧЕСКИХ МЕТОДОВ ИЗУЧЕНИЯ
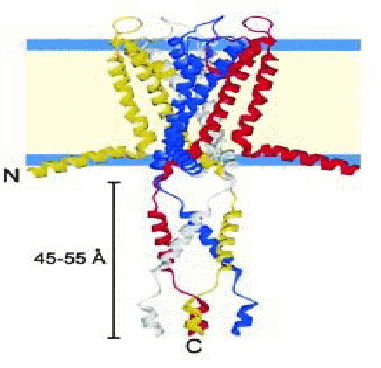 |
| Рис. 2 Структура мембранного белка KcsA |
Известен также способ, основанный на включении мембранного белка KcsA в искусственные липидные бислои [5]. Способ включает стадии солюбилизации денатурированного белка детергентом, формирования смешанных белок/детергент/фосфолипид мицелл, удаления детергента диализом и получения искусственных липосом. Однако, при данном подходе выход тетрамера KcsA составил те же 25-30% вне зависимости от типа использовавшихся фосфолипидов. Кроме того, в данном способе получения липосом невозможно полностью исключить из бислоев детергент, который может ингибировать образование олигомеров мембранных белков.
Третий способ ренатурации KcsA основан на том, что получение ренатурированных мембранных белков включает предварительное получение гомогенного раствора мембранного белка и липида или смеси липидов, последующее удаление растворителя и полное гидратирование полученной липид-белковой смеси.
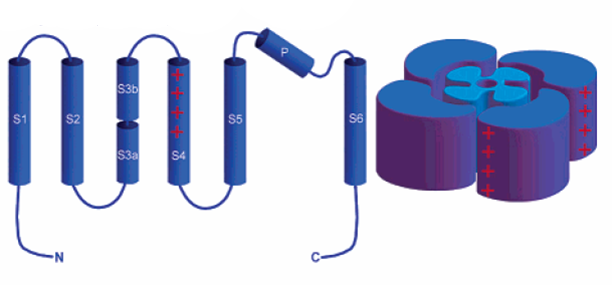 | ||
| Вольт-сенсорный домен (ВСД) | Поровый домен | Общая пространственная организация |
| Схематическое устройство потенциал-зависимых К+ каналов. Спирали пронумерованы и помечены латинскими буквами (S1-S6). Поровая шпилька имеет в своем составе дополнительную спираль (P). | ||
Мембранный белок KcsA из бактерии Streptomyces lividans получали экспрессией в Escherichia coli (хотя возможен и любой другой способ, помимо экспрессии) и последующей экстракцией детергентом из внутренней мембраны E.coli. Удаление детергента осуществляли диализом против буфера, не содержащего детергент. Осадок белка промывали водой и растворяли в органическом растворителе.
Гомогенный раствор белка и липидов получался смешиванием раствора KcsA с раствором фосфолипидов в органическом растворителе. Растворитель удалялся в вакууме при температурах, исключающих кристаллизацию белка и липидов. Гомогенных смеси белка и липидов получались также их растворением в смеси вода/органический растворитель, быстрого замораживания раствора и удаления растворителей лиофилизацией.
Сухую липид-белоковую смесь гидратировали буфером, содержащим KCl или другие соли, что приводит к образованию мультиламеллярных липосом. По мере необходимости, обмен белковыми и липидными молекулами между отдельными бислоями и липосомами обеспечивался циклами замораживания оттаивания белок-липидных дисперсий. В случае насыщенных фосфолипидов или их смесей с температурой фазового перехода выше 0оС, изменение толщины бислоя достигалось инкубациями при температурах выше и ниже фазового перехода.
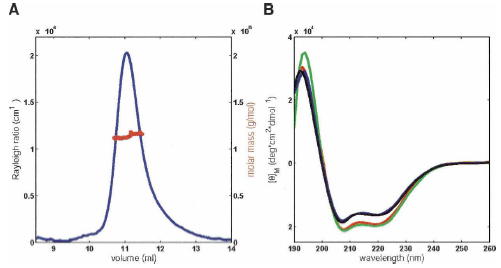 |
| Рис. 4 (А) Исследование SDS-KscA мицелл методом динамического светорассеяния в совокупности с гель-проникающей хроматографией. Светорассеяние, пропорциональное концентрации, показано как функция элюирующего объёма (голубой). Молекулярная масса, определённая методом светорассеяния и измерения коэффициента преломления (красный), для элюирующего SDS-KcsA 10,7 - 11,5 мл получается 115 кДа. (В) КД спектры 25 мкМ образцов KcsA в различных детергентах. Кривые для KcsA в SDS мицеллах pH 6 и pH 8 показаны соотвественно (чёрным) и (голубым). Очень схожие кривые получаются для KcsA в смеси 4:1 в DPC и SDS, и KcsA в DM показаны (красным) и (зелёным). Ожидаемые содержания спиралей 47%, 51%, 57% и 59% для SDS pH 6, SDS pH 8, 4:1 DPC:SDS и DM соответственно. |
 онтроль за тетрамеризацией KcsA осуществлялся с помощью гель-электрофореза, мономер KcsA соответствует полосе с молекулярной массой 18.6 кД, а тетрамер – 74.4 кД (рис.5). Известно, что KcsA в SDS мицеллах ведёт себя как высокостабильный молекулярный ансамбль [6], который мигрирует как тетрамер в SDS-PAGE даже при высоких температурах (инкубация при 75оС в течение 60 мин), pH 10 или 4 М мочевина. Для определения молекулярной массы комплекса использовался метод динамического светорассеяния. Было получено, что молекулярная масса составляет приблизительно 115 кДа для белок-детергентного ансамбля (Рис. 4А.). Содержание элементов вторичной структуры определялось методом КД, откуда было получено, что белок калиевого канала KcsA в мицеллах SDS формирует вторичную структуру, которая представлена на 60% -спиралями (рис. 4В). Аналогичные результаты получались при использовании в качестве детергента додецилфосфохолина (DPC) и DM. Кроме того, специфические изменения химического сдвига в спектрах ЯМР селективного фильтра KcsA при добавлении ионов K+ убедительно указывает на то, что KcsA в мицеллах SDS находится в нативной конформации.
онтроль за тетрамеризацией KcsA осуществлялся с помощью гель-электрофореза, мономер KcsA соответствует полосе с молекулярной массой 18.6 кД, а тетрамер – 74.4 кД (рис.5). Известно, что KcsA в SDS мицеллах ведёт себя как высокостабильный молекулярный ансамбль [6], который мигрирует как тетрамер в SDS-PAGE даже при высоких температурах (инкубация при 75оС в течение 60 мин), pH 10 или 4 М мочевина. Для определения молекулярной массы комплекса использовался метод динамического светорассеяния. Было получено, что молекулярная масса составляет приблизительно 115 кДа для белок-детергентного ансамбля (Рис. 4А.). Содержание элементов вторичной структуры определялось методом КД, откуда было получено, что белок калиевого канала KcsA в мицеллах SDS формирует вторичную структуру, которая представлена на 60% -спиралями (рис. 4В). Аналогичные результаты получались при использовании в качестве детергента додецилфосфохолина (DPC) и DM. Кроме того, специфические изменения химического сдвига в спектрах ЯМР селективного фильтра KcsA при добавлении ионов K+ убедительно указывает на то, что KcsA в мицеллах SDS находится в нативной конформации.  | Рис. 5. Данные SDS-ПААГ электрофореза. Линия 1 – KcsA в трифторэтаноле, Линия 2 – KcsA после ренатурации в бислоях из эквимолярной смеси 1,2-диолеоилфосфатидилэтаноламина и 1,2-диолеоилфосфатидилглицериналенный |
ИССЛЕДОВАНИЕ СТРУКТУРЫ БЕЛКОВ С ПОМОЩЬЮ ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА (ЯМР)
Для определения структур мембранных белков-рецепторов одним из наиболее перспективных методов является метод ЯМР спектроскопии. В отличие от кристаллографических методов, метод ЯМР не требует приготовления правильных кристаллов исследуемого белка, что для мембранных белков представляет собой не простую задачу. Также метод ЯМР позволяет исследовать белковые молекулы в средах, максимально близко моделирующих биологическую мембрану (детергенты или липид-детергентные смеси).
Однако метод ЯМР имеет и некоторые недостатки, в основном связанные с размером систем которые могут изучаться. Дело в том, что при увеличении размера белковой молекулы или белково-липидного комплекса скорость вращения изучаемых молекул в растворе замедляется, что приводит к ускорению скорости релаксации намагниченности, уширению сигналов ЯМР и, соответственно, к значительному понижению чувствительности эксперимента. Следовательно, необходимо выработать технологию, позволяющую расширить диапазон применимости метода ЯМР на молекулы и комплексы большей массы. Для достижения этой цели использовались методы, по замедлению релаксации ядерной намагниченности вводя в исследуемые белковые молекулы ядра 2Н (дейтерия), а так же подбирая детергенты, образующие с белками комплексы наименьшего размера. Так в ходе представленного исследования были разработаны технологии по получению 2Н-меченых белков, а так же по последующей их солюбилизации в растворы детергентов и замене дейтерия в составе амидных групп на протоны (1Н) необходимые для структурных исследований.
Спектроскопия ЯМР основана на наблюдении сигналов различных ядер биомолекул помещенных в сильное магнитное поле. Для успешного восстановления структуры по данным ЯМР необходимо, что бы большинство сигналов ядер макромолекулы были разрешены в спектрах, то есть отдельные сигналы должны иметь малую степень перекрывания и достаточную интенсивность для получения точных ЯМР данных. Однако число и интенсивность ЯМР-сигналов ядер напрямую зависят от размера изучаемой системы. Основную роль в этом играют следующие факторы.
1) Увеличение размеров белковой молекулы ведет к пропорциональному росту числа ядер в ней, и соответственно к росту числа сигналов в ЯМР спектрах. В результате даже для сравнительно небольших молекул, сигналы отдельных ядер сильно перекрываются и становятся неразличимы. В настоящее время эта проблема успешно решается путем использования многомерной спектроскопии ЯМР, в которой ЯМР спектр биомолекулы раскладывается на несколько частотных направлений, приводя к двумерным, трехмерным, четырех и т.д. спектрам ЯМР. Для использования этого метода необходимо получение 13C-15N-изотопно меченых белковых молекул. Этот подход позволяет идентифицировать отдельные ядра не только по их резонансной частоте, но и по частоте ядер соседей.
2) Увеличение размеров изучаемой молекулы или молекулярного комплекса ведет также к значительному замедлению его переориентации в растворе. Эмпирическое выражение для этой зависимости дается формулой (1), где τС – характерное время корреляции для реориентации молекулы в растворе, а МВ – масса комплекса.
τС [ns] ~ 0.4*МВ [кДа] (1)
Замедление скорости вращения молекулы в растворе ведет к ускорению скорости релаксации ядерной намагниченности, уширению сигналов ЯМР и, соответственно, к значительному понижению чувствительности эксперимента. Это особенно актуально для мембранных белков, которые исследуются в составе белок-липидного или белок-детергентного комплексов, суммарная масса которых складывается из массы белка и массы присоединенных липидов. Уменьшение скорости релаксации может быть достигнуто двумя методами, либо уменьшением размера комплекса, например подбором липидов образующих маленькие мицеллы (что не всегда возможно, так как структура мембранного белка часто зависит от окружения), либо изменением свойств самой молекулы. Например, замена всех алифатических и ароматических протонов (1H) на дейтерий (2H) не меняя структуры молекулы, значительно замедляет скорость релаксации ядер 13C и амидных протонов.
При этом, необходимо также помнить, что использование методов ЯМР при изучении структуры больших мембранных белков целесообразно только, если белки имеют нативную структуру. А значит, при изучении мембранных белков необходимо предварительно проводить солюбилизацию.
ИССЛЕДОВАНИЕ KcsA С ПОМОЩЬЮ ЯМР
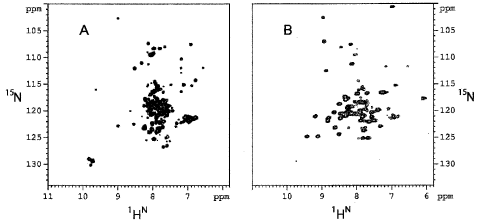 |
| Рис.6. TROCY-HSQC для двух KcsA доменов. 1H – 15N – TROSY – HSQC для полипептидного остова немембранного домена, KcsAE (A), и трансмембранного домена, KcsATM (B). |
 Как уже отмечалось ранее, SDS мицеллы, содержащие тетрамерный 68-кДа калиевый канал KcsA, выделенный из бактерии Streptomyces lividans., удобны для определения структуры белка [6]. Вторичная структура, определённая по изменению химических сдвигов и по данным протон-дейтериевого взаимодействия, хорошо согласовывалась с данными рентгенокристаллографии и указала на наличие относительно длинных альфа-спиралей в С-концевом цитоплазматическом домене. Одна из спиралей, длиной в 14 остатков, принимает участие в тетрамеризации. Количественные кросс-релаксационные измерения позволили нарисовать «карту» взаимодействий между детергентом и белком. В результате была получена структура, аналогичная изображённой на Рис.2. В калиевом канале KcsA в мицеллах SDS индуцированные ионами K+ изменения химических сдвигов в селективном фильтре, показали, что при данных условиях канал сохраняет свою биологическую активность. При изменении pH наблюдали изменения структурной организации обоих трансмембранных доменов pH- зависимого калиевого канала KcsA, что также указывало на нативность структуры калиевого канала KcsA в мицеллах SDS.
Как уже отмечалось ранее, SDS мицеллы, содержащие тетрамерный 68-кДа калиевый канал KcsA, выделенный из бактерии Streptomyces lividans., удобны для определения структуры белка [6]. Вторичная структура, определённая по изменению химических сдвигов и по данным протон-дейтериевого взаимодействия, хорошо согласовывалась с данными рентгенокристаллографии и указала на наличие относительно длинных альфа-спиралей в С-концевом цитоплазматическом домене. Одна из спиралей, длиной в 14 остатков, принимает участие в тетрамеризации. Количественные кросс-релаксационные измерения позволили нарисовать «карту» взаимодействий между детергентом и белком. В результате была получена структура, аналогичная изображённой на Рис.2. В калиевом канале KcsA в мицеллах SDS индуцированные ионами K+ изменения химических сдвигов в селективном фильтре, показали, что при данных условиях канал сохраняет свою биологическую активность. При изменении pH наблюдали изменения структурной организации обоих трансмембранных доменов pH- зависимого калиевого канала KcsA, что также указывало на нативность структуры калиевого канала KcsA в мицеллах SDS. 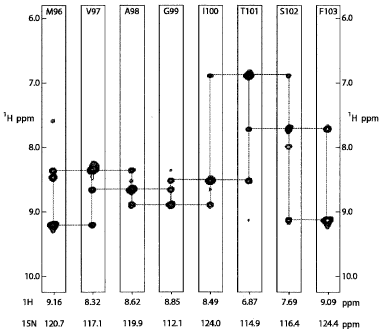 |
| Рис. 7. Соотнесение сигналов полипептидного остова KcsATM, используя 1HN – 1HN связи между аминокислотными остатками. Полосы получены из 15N – separated NOE – HMQC спектра KcsATM и образуют характерную спиральную 1HN – 1HN NOE картину, что позволяет улучшить соотнесение сигналов данного домена. Каждая полоса предсталяет собой одиночный KcsATM амидный протон, с 1H и 15N хим.сдвиги пиков, показанных ниже полос. Недиагональные кросс-пики показывают резонансную частоту двух ближайших амидных протонов, позволяющих определить соседние остатки. Данная диаграмма показывает остатки 96-103 ТМ2 спирали. |
 |
| Рис. 8. Соотнесение пиков KcsA. Серым выделены остатки с необменными или очень медленно обменивающимися в D2O протонами и представляют KcsATM домен. Остальные остатки относятся к KcsAE домену. Выделеные в серую рамку остатки наблюдаются в обоих доменах. Серые подписи обозначают две ТМ мембраны и поровую спираль. Селективный фильтр (остатки 75-79) жирно подчёркнут, а остатки 114-118, проявляющие большие pH-индуцированные изменения в химическом сдвиге, слегка подчёркнуты. N – концевой His6 – Tag неизображён. |
Используя хорошо известную взаимосвязь между 13С химическими сдвигами и вторичной структурой, можно также установить вторичную структуру KcsA в SDS мицеллах. В случае KcsA, данные ЯМР позволяли увидеть в белке 4 спиральных фрагмента, связанных петлями. полученные данные указывают на присутствие альфа-спиралей в трансмембранных сегментах (на остатках 31-52 сегмент ТМ1, 62-73 порового домена селективного фильтра, 86-115 ТМ2) (Рис. 9). Четвёртый спиральный сегмент на остатках 142-155 указывает на дополнительную спираль на С-концевом цитоплазматическом домене. Суммарное количество спиралей в KcsA хорошо согласуется с результатами КД спектроскопии.
Для изучения локализации калиевых каналов KcsA в SDS мицеллах измеряли диполь-дипольную кросс-релаксацию между детергентом и амидными протонами полипептидного остова. Это позволило охарактеризовать пространственную организацию мицелл, включающих в свой состав калиевый канал KcsA. Также изучалось влияние pH на структуру KcsA. Изменение химических сдвигов показали, что структура KcsA сильно зависит от изменения pH.
Данные ЯМР также указывают на то, что могут произойти конформационные изменения спирали ТМ1 при сближении четырёх субединиц и повлиять на поток ионов К+ через канал. Механизм такого влияния ещё не изучен. Хотя изменение химического сдвига в ТМ1 не вызывают полномасштабного изменения конформации KcsA, следует отметить, что эти изменения не обнаружены при низких значения pH, так как при этих условиях SDS-солюбилизированный KcsA теряет термостабильность.
 |
| Рис. 9. Сигналы ЯМР остова предсказывают вторичную структуру KcsA. Отклонения величин химических сдвигов для 13C (A) и 13C’(B) ядер. Положительные отклонения 13С пиков указывает на спиральную конформацию. (С) 1HN(i) – 1HN(i+1) NOE связи наблюдаются на 15N- separated NOE-HMQC спектрах KcsA. |
ПЕРСПЕКТИВЫ
Мембранные белки составляют значительную часть в большинстве организмов и играют жизненно важную роль в клеточных функциях, таких как передача сигналов, производство энергии, распознавание и транспорт. Также они играют огромную важность как потенциальные мишени для различных лекарственных средств. Хотя в последнее время были достигнуты немалые успехи в изучении структур и функций различных мембранных белков, и в частности, калиевых каналов, очень многое ещё только предстоит сделать. Менее чем 1% всех структур в Protein Data Bank это мембранные белки, и доступная на сегодняшний день информация о механизмах действия крайне скудна, что связано с трудностью проведения структурных исследований мембранных белков. Для решения этой проблемы перспективным явился подход, основанный на получении рекомбинантных мембранных белков и их последующем рефолдинге в системах, моделирующих мембранное окружение. Создание таких систем позволит определить структуру мембранных белков с помощью таких методов, как ЯМР спектроскопия, КД, рентгеноструктурный анализ. К сожалению, пока рефолдинг мембранных белков осуществляется только лишь методом проб и ошибок. Некоторые мембранные белки солюбилизируются в одних детергентных смесях, хорошо удовлетворяя всем требованиям солюбилизации; другие солюбилизируются в других, но остаются активными только в одном детергенте. Понимание того, как параметры детергентной системы определяют солюбилизацию и функциональность, в будущем должно стать решающим фактором создания систем, позволяющих определить пространственную структуру мембранных белков.
СПИСОК ЛИТЕРАТУРЫ
- Wallin, E., von Heijne, G. 1998. Genome-wide analysis of integral membrane proteins from eubacterial, archaean, and eukaryotic organisms. Protein Science 7:1029-1038.
- Jordan, H. C., et al. 2006. NMR study of tetrameric KcsA potassium channel in detergent micelles. Protein Science
- Kiefer, H. et al. 2003. In vitro folding of alpha-helical membrane proteins. Biochim. Biophys. Acta 1610: 57-62
- van Dalen, A. et al. 2002. Influence of lipids on membrane assembly and stability of the potassium channel KcsA. Febs Lett. 525:33-38
- Valiyaveetil, F.I. et al., 2002. Lipids in the structure, folding, and function of the KcsA K+ channel. Biochemistry 41:10771-10777
- Heginbotham, L. et al., 1997 Tetrameric stoichiometry of prokaryotik K+ channels. Biochemistry 36:10335-10342
- Maire, le M. et al., 2000. Interaction of membrane proteins and lipids with solubilizing detergents. Biochim. Biophys. Acta 1508:86-111
- Garavito, R.M. et al., 2001. Detergents as tools in membrane biochemistry. J. Biol. Chem. 276:32403-32406
- Gohon, Y. et al., 2003. Membrane protein-surfactant complexes. Curr. Opin. Colloid Interface Sci. 8:15-22
- Booth., P.J. et al., 1995. Intermediates in the folding of the membrane protein bacteriorhodopsin. Nat. Struct. Biol. 2:139-143
- Deisenhofer, J. et al., 1985. Structure of the protein subunits in the photosynthetic reaction centre of Rhodopseudomonas viridis. Nature 318:618-624
- Riensberg, D.et al., 2000. Folding, assembly and stability of the major light harvesting complex of higher plants, LCHII, in the presence of native lipids. Biochemistry 39:14305-14313
- Seddon, A. et al., 2004. Membrane proteins, lipids and detergents: not just a soap opera. BBA 1666:105-117
- Sansom, M.S. et al., 2002. Potassium channels: structures, models, simulations. BBA 1565:294-307
- Howe, W.A. et al., 2004. A straight-forward method of optimising protein solubility for NMR. Journal of Biomolecular NMR 30:283-286
