Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова Российской Академии Наук
| Вид материала | Диссертация |
- План научно-исследовательской работы на 2012 г. Учреждения Российской Академии наук, 797.38kb.
- Vi московский международный конгресс, 625.54kb.
- М. М. Шемякина и Ю. А. Овчинникова ран институт молекулярной генетики ран нейрохимическое, 386.57kb.
- Ордена Трудового Красного Знамени Институт биоорганической химии имени академиков, 191.71kb.
- В. Т. Иванов, директор Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова, 719.75kb.
- Синтетические пептиды, взаимодействующие с различными типами холинорецепторов, 487.49kb.
- Международная научно-практическая конференция, 130.29kb.
- Международная научно-практическая конференция, 148.88kb.
- Международная научно-практическая конференция, 301.89kb.
- Программа отчетной конференции по программе фундаментальных исследований Президиума, 123.52kb.
Анализ В-клеток памяти в ПКЧ условно здоровых лиц позволил определить среднестатистическое количество этой субпопуляции. Было проанализировано 60 условно здоровых лиц, и результаты представлены в Таблице 3.
Гуморальный иммунный ответ играет значимую роль в устранении как внутриклеточных, так и внеклеточных патогенов. Этот процесс проистекает за счет дифференцировки зрелых B-клеток в плазматические клетки, которые секретируют большие количества антител. Однако большинство антигенов вызывают иммунную реакцию лишь при наличии и участии Т–лимфоцитов. Это относится к белковым и клеточным антигенам, а также к вирусам, которые объединяют в понятие "Т-зависимые" антигены. Лишь небольшое количество антигенов способно вызывать иммунный ответ без участия Т-клеток. Некоторые бактериальные липополисахариды при достаточно высокой концентрации способны к поликлональной активации значительной части популяции В-лимфоцитов, т.е. для такой стимуляции антигенная специфичность роли не играет. Линейные антигены, медленно распадающиеся в организме и имеющие организованную определенным образом и часто повторяющуюся детерминанту (полисахарид пневмококков, полимеры D-аминокислот, поливинилпироллидон) также способны непосредственно стимулировать В-лимфоциты. Индуцируемый Т-независимыми антигенами иммунный ответ практически не сопровождается формированием клеток памяти. При иммунном ответе на Т-независимые антигены вырабатываются иммуноглобулины класса М и эффективность Т-независимого ответа во много раз ниже. В свою очередь, Т-зависимые антигены в отсутствии Т-клеток лишены иммуногенности. При ответе на эти антигены требуется подключение Т-лимфоцитов. Т-зависимые антигены обеспечивают и определяют кооперативное взаимодействие В- и Т-клеток. В результате такого взаимодействия происходит переключение синтеза с IgM на IgG.
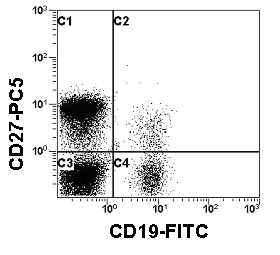 | Рис. 12. Гистограмма распределения CD27 и CD19 на лимфоцитах периферической крови. Квадрант С2 - субпопуляция В-клеток памяти. |
Основываясь на современных данных, различают два пути образования различных репертуаров антител: T-зависимый путь в герминальных центрах и T-независимый путь вне них. Точная функция второго пути и генерирование IgM+CD27+ B-клеток в настоящее время окончательно не выяснена. Однако, IgM+CD27+ B-клетки играют существенную роль в гуморальном ответе против T-независимых патогенов таких, как инкапсулированные бактерии (Weller S., et al., 2004).
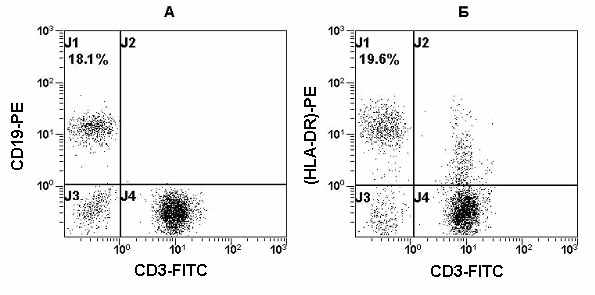
Рис. 13 Гистограммы распределения CD3, HLA-DR и CD19 на лимфоцитах периферической крови. CD3-CD19+ В-клетки (квадрант А-J1), CD3-HLA-DR+ клетки (квадрант Б-J1).
Активация зрелых B-клеток с T-зависимым антигеном приводит к образованию плазматических клеток двумя независимыми путями дифференцировки. Активированные B клетки могут войти в экстрафолликулярные пролиферативные центры, где они быстро дифференцируются в короткоживущие плазматические клетки, секретирующие IgM. С другой стороны, активированные B-клетки могут попасть в герминальный центр, где происходят различные молекулярные перестройки, такие, как соматические гипермутации, переключение изотипов Ig и отбор высокоафинных вариантов. Антиген-селективные В-клетки герминального центра являются предшественниками двух типов клеток (высокоафинных В-клеток памяти и долгоживущих плазматических клеток), которые являются ответственными за долгосрочную гуморальную устойчивость (Calame K., 2001; Banchereau J., et al., 1992).
Помимо перечисленных выше молекул рецепторного и ко-рецепторного комплекса, на поверхности В-клеток экспрессируются антигены МНС класса II (HLA-DR). Они принимают участие в представление антигенов, а В-клетки являются антиген-представляющими клетками. Однако HLA-DR антигены также представлены на активированных Т- и NK-клетках. Этим объясняется несовпадение относительного количества CD3-CD19+ В-клетки и CD3-HLA-DR+ клетки при некоторых патологиях (Рис. 13).

Рис. 14. Гистограммы распределения CD19, CD5 и CD27 на лимфоцитах периферической крови. А – анализ по зоне СD19 позитивных клеток (зона D). Б – распределение СD19 позитивных клеток находящихся в зоне D. Квадрант Е1 - В-1 клетки (CD19+CD5+), квадрант Е4 - В-клетки памяти (CD19+CD27+).
Оценка относительного и абсолютного количества В-клеток является одним из важных диагностических признаков. При воспалительных заболеваниях наблюдаются колебания количества В-клеток в зависимости от типа и стадии иммунного ответа.
Все изложенное выше приводит к тому, что наиболее полную характеристику относительного количества B-клеток и их субпопуляционного состава можно получить при следующей комбинации МА: CD19/CD5/CD27/CD45.
В связи с тем, что молекула CD19 представляет собой линейно специфический маркер В-клеток и не встречается на других популяциях клеток периферической крови, данный антиген рекомендуется для количественной оценки общей популяции B-клеток. Однако, CD5 и CD27 также экспрессируются на поверхности Т-клеток. Гейтирование по зоне СD19 позитивных клеток, как показано на Рис. 14, позволяет четко локализовать как В-1 клетки (CD19+CD5+), так и В-клетки памяти (CD19+CD27+).
Таким образом, в настоящее время оценка и характеристика В-клеточной популяции лимфоцитов является не только важной задачей с точки зрения научных интересов, но и позволяет врачу-клиницисту получить дополнительную информацию о возможном наличии аутоиммунного процесса. Одновременно, что очень важно, современные подходы позволяют оценить эффективность уже сформировавшегося ответа по наличию В-клеток памяти. Расширение потенциальных возможностей современной проточной цитометрии значительно увеличивают точность оценки всех этих диагностически-значимых моментов. Применение многоцветного окрашивания и многоэтапного гейтирования позволяют провести многопараметрический анализ клеток периферической крови с высокой точностью и достоверностью в одной пробе пациента. Данный подход значительно облегчает интерпретацию полученных результатов анализа и позволяет судить о функционировании В-клеточного звена иммунной системы больных при разнообразных патологических состояниях.
Идентификация NK-клеток (натуральных киллеров).
Среди больших гранулярных лимфоцитов (LGL, Large Granular Lymphocytes) выделяют отдельную популяцию клеток, получившую название натуральных киллеров или NK-клеток (Natural Killer). NK-клетки являются важным компонентом врожденной иммунной системы за счет наличия цитолитической активности против клеток-мишеней и способности продуцировать цитокины. Первоначально они были описаны на основании их функциональной способности уничтожать клетки некоторых опухолей гемопоэтического происхождения без предшествующей стимуляции. Таким образом, одной из основных функций данной субпопуляции клеток иммуной системы является защита собственного организма от видоизмененного «своего».
Как уже было сказано выше, NK-клетки являются носителями двух основных функций. Первая - это лизис опухолей и инфицированных вирусами клеток. Вторая - регуляция врожденного и адаптивного иммунных ответов за счет секреции хемокинов (CCL3, CCL4, CCL5 и XCL1) и цитокинов (GM-CSF, TNF-α, и IFN-γ).
Способность NK-клеток взаимодействовать и убивать опухолевые, но не нормальные клетки была описана, а позже и объяснена рядом авторов. Этот эффект происходит за счет нескольких специализированных рецепторов, распознающих молекулы MHC класса I, которые экспрессируются на нормальных клетках. Эти рецепторы формируются на NK-клетках при ассоциации молекул CD94 с молекулами семейства NKG2 (CD159).
NK-клетки являются субпопуляцией лимфоцитов наиболее чувствительной к физиологическим и психологическим стрессам. В настоящее время доказано выраженное воздействие высоких физических нагрузок на NK-клетки. Их цитолитическая активность увеличивается при нарастании физической нагрузки и уменьшается после ее окончания.
В периферической крови NK-клетки составляют от 5 до 20 % циркулирующих лимфоцитов. По другим данным, среди лимфоидной популяции периферической крови человека NK-клетки составляет приблизительно 10-15%. Существует взаимосвязь между изменением активности NK-клеток и их количеством с клиническими признаками заболеваний у людей. Так, относительное количество NK-клеток и их активность существенно изменяется не только при опухолевых процессах и вирусной инфекции, но и при гнойном воспалении, нарушении функций центральной нервной системы (ЦНС), аутоиммунных заболеваниях и так далее (Whiteside T.L. et al., 1994).. Вероятно, что в результате применения более тонких и точных методов исследований, таких как проточная цитометрия и многопараметрический анализ, будут выявлены и другие изменения в субпопуляциях этих клеток при иных патологиях.
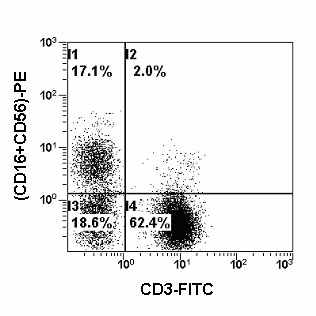 | Рис. 15. Гистограмма распределения лимфоцитов периферической крови с использованием моноклональных антител против CD3 и CD16+CD56, меченых FITC и PE. На данной гистограмме отображены только CD45 позитивные лимфоциты. Квадранты: I1- NK-клетки; I2 – T-NK-клетки; I3 – негативные по CD3 и CD16+CD56 лимфоциты; I4 - T- клетки. |
Для выявления NK-клеток среди других лимфоцитов используют МА, распознающие различные маркеры, экспрессируемые на их поверхности. Однако многие поверхностные молекулы NK-клеток представлены и на других субпопуляциях лимфоцитов, и это накладывает свои особенности на идентификацию натуральных киллеров. В связи с этим для их локализации среди других лимфоцитов используют уникальную комбинацию из нескольких маркеров, таких как, CD56 и CD16 (Рис. 15). С другой стороны, NK-клетки не экспрессируют такие линейные маркеры, как CD3, CD14 и поверхностные Ig и это также используется при их локализации.
Одним из основных маркеров используемых для выявления NK-клеток является молекула CD16. Антиген CD16 представляет собой низко-аффинный рецептор для IgG (FcγRIII). Данный антиген существует в двух различных формах, кодируемых двумя различными генами: FcγRIIIA (или III-2) и FcγRIIIB (или III-1). Генетическая разнородность CD16 приводит к альтернативным путям ассоциации молекул с мембраной клеток. Первая трансмембранная форма (FcγRIIIA, 50-65 kDa) экспрессируется на NK-клетках, моноцитах и макрофагах. Вторая форма (FcγRIIIB, 48 kDa), ассоциированная с мембраной за счет гликозилфосфатидилинозитола (GPI), экспрессируется только на нейтрофилах.
Другим антигеном является молекула CD56. Данный антиген умеренно экспрессируется на субпопуляциях клеток периферической крови, таких как большие гранулярные лимфоциты и всех клетках с NK активностью. Молекула CD56 также экспрессируется отдельными субпопуляциями T лимфоцитов (Dargent J.L., et al., 1998).
Циркулирующие зрелые NK-клетки имеют фенотип CD3-CD56+CD16+CD2dim и отличаются от T-клеток отсутствием T-клеточного рецептора и CD3. В свою очередь, отличие от B-клеток заключается в том, что NK-клетки никогда не экспрессируют мембранные иммуноглобулины (Ig), однако, за счет экспрессии FcγRIII, они могут быть позитивными при окрашивании антителами. Поверхностные маркеры, экспрессируемые активированными NK-клетками, включают целый ряд молекул, таких как CD25, β1 (CD29) и β2 (CD18) интегрины, различные активационные антигены, включая HLA-DR, CD71 и CD69. В зависимости от степени активации NK-клеток поверхностные рецепторы могут изменять свою экспрессию за счет повышения или понижения (Whiteside T.L., et al., 1994; Rabinowich H., et al., 1993).
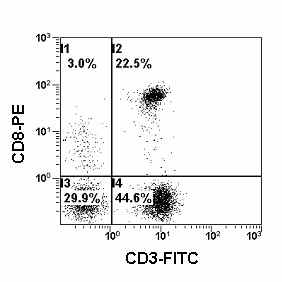 | Рис. 16. Гистограмма распределения лимфоцитов периферической крови с использованием моноклональных антител против CD3 и CD8, меченных FITC и PE. На данной гистограмме отображены только CD45 позитивные лимфоциты. В зоне I1 находятся CD8+ NK-клетки. |
Популяция NK-клеток обладает достаточной гетерогенностью по своему составу. Исследователи выделяют несколько их субтипов, а именно пре-NK-клетки, зрелые NK-клетки и активированные NK-клетки. Данная особенность связана с различной экспрессией маркеров клеточной поверхности. Среди популяции циркулирующих NK-клеток выделяют две основные субпопуляции. Первая экспрессирует CD16 и низкий уровень CD56 (CD16+(or high)CD56dim). Вторая экспрессирует CD56, однако, CD16 на них представлен в низкой плотности или полностью отсутствует (CD16-(or low)CD56bright). Последняя субпопуляция составляет приблизительно 10-20 % от общего количества NK-клеток. Они секретируют IFN-γ и другие цитокины, и имеют меньшую цитолитическую активность. В свою очередь субпопуляция CD16highCD56dim составляет приблизительно 80-90% от NK-клеток периферической крови, они слабо секретируют цитокины, но обладают высокой цитолитической активностью (Warren H.S., et al., 1991).
Перечень других маркеров, экспрессируемых на своей поверхности NK-клетками, достаточно широк. Это – CD2, CD5, CD7, CD8, CD94, CD96, CD158, CD159 и многие другие. В настоящее время для локализации и характеристики NK-клеток наиболее широко используют двухпараметрический анализ экспрессии CD16 и/или CD56 на CD3-негативных клетках. Данная комбинация МА позволяет локализовать общую популяцию NK-клеток и количественно ее охарактеризовать (Рис. 15), но не охарактеризовать их субтипы.
Достаточно часто NK-клетки экспрессируют на своей поверхности α-цепь CD8 (Рис. 16), но в более низкой плотности, чем цитотоксические Т-клетки. Функция CD8 у NK-клеток до последнего времени была неясна, однако было показано, что субпопуляции NK-клеток человека, экспрессирующие αα гомодимер CD8 обладают большей цитотоксичностью, чем CD8- NK-клетки, но механизмы этого оставались неизвестными. Позднее выяснилось, что соединение CD8α цепей в гомодимер индуцирует быстрое повышение внутриклеточного Ca2+ и, инициированное этим, увеличение экспрессии CD69. Хотя секреция цитолитических ферментов инициирует апоптоз NK-клеток, приток экзогенного кальция защищает CD8α+ NK-клетки от данного процесса. Данная защита от апоптоза может быть снята преинкубацией NK клеток с антителами против MHC класса I. Таким образом, данный механизм позволяет CD8α+ NK-клеткам сохранять жизнеспособность и принимать участие в многократном лизисе клеток-мишеней.
В последние годы исследователи уделяют большое внимание экспрессии CD38 на поверхности NK-клеток. Молекула CD38 это мембранный гликопротеин, представляющий собой фермент, регулирующий концентрацию цитоплазматического кальция. Кроме этого данный фермент обладает целым рядом других активностей таких, как аденозиндифосфат (ADP) рибозил циклазная, циклический аденозиндифосфат рибозил гидролазная и NAD гликогидролазная. Данная молекула также играет роль рецептора, модулируя межклеточные взаимодействия, и является переносчиком трансмембранных сигналов. Молекула CD38 экспрессируется на активированных Т-, В-, NK-клетках и некоторых других типах клеток.
В ряде работ приведены данные о том, что обработка CD38+ NK-клеток антителами против CD38 приводит к активации их литической способности. Однако это происходило только в тех случаях, когда было возможно взаимодействие CD38 со специализированными сигнальными молекулами. В случае NK-клеток роль такой молекулы играет CD16.
Представленные выше данные свидетельствуют в пользу того, что для наиболее полной характеристики NK-клеток необходимо определить на CD3-негативных клетках следующие поверхностные маркеры: CD16, CD56, CD38 и CD8. В свою очередь следует отметить, что CD38 и CD8 позволяют оценить цитотоксическую активность NK-клеток пациента и, как следствие этого, более корректно представлять картину, происходящую на данном этапе развития иммунного ответа. Для этих целей рекомендуется использовать следующие комбинации МА: CD3/CD16/CD56/CD45 и CD3/CD8/CD38/CD45.
Как уже было сказано выше, применение двухцветного окрашивания лимфоцитов с использованием комбинации антител CD3, CD56+CD16 позволяет локализовать NK-клетки и оценить их абсолютное и относительное количество (Рис. 15). Однако в этом случае отсутствует возможность определить их субтипы.
Другим вариантом окрашивания лимфоцитов для выявления NK-клеток является использование комбинации антител CD16 и CD56. На Рис. 17А представлена двухпараметрическая гистограмма распределения лимфоцитов периферической крови с использованием МА против CD16 и CD56, меченных FITC и PE. Но в этом случае результат получается несколько завышенным, поскольку дополнительный вклад вносят Т-клетки, так как они могут экспрессировать на своей поверхности CD56 и CD16. Это особенно ярко проявляется при наличии различных патологий, когда резко возрастает количество Т-клеток, экспрессирующих данные структуры.
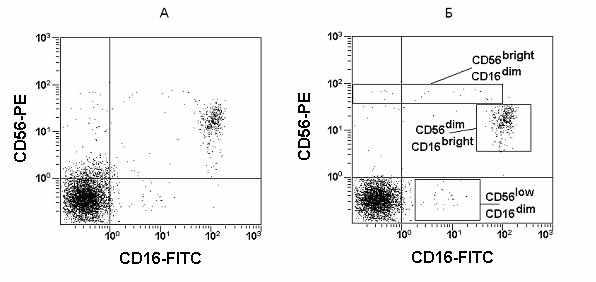
Рис. 17. Гистограммы распределения лимфоцитов периферической крови с использованием моноклональных антител против CD16 и CD56, меченных FITC и PE. На гистограмме А отображены все CD45+ позитивные лимфоциты. На гистограмме Б отображены только CD45+CD3- лимфоциты.
Данную задачу позволяет решить применение многоцветного анализа и следующей комбинации МА CD3/CD16/CD56/CD45. В данной комбинации CD3 позволяет исключить из анализа Т-клетки (Рис. 17Б).
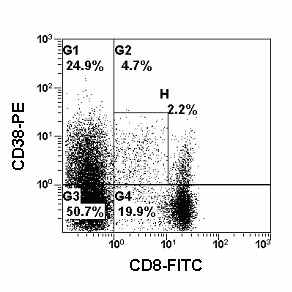 | Рис. 18. Гистограмма распределения лимфоцитов периферической крови с использованием моноклональных антител против CD8 и CD38, меченных FITC и PE. На данной гистограмме отображены только CD45 позитивные лимфоциты. Область Н содержит CD8+CD38+ NK-клетки. |
Ранее сообщалось, что CD38+CD8+ NK-клетки обладают высокой цитолитической активностью. Таким образом, знание о наличии данной субпопуляции, ее относительном и абсолютном количестве имеет важное диагностическое значение.
Для локализации CD38+CD8+ NK-клеток возможно использовать двухпараметрический анализ (Рис. 18), но более корректно применять трех- и четырехцветный анализ (CD3/CD8/CD38 и CD3/CD8/CD38/CD45).
В случае использования комбинации CD3/CD8/CD38 для выделения лимфоцитов используют морфологические параметры, но в результате этого всегда существует вероятность исключить из анализа часть больших гранулярных лимфоцитов, которые могут просто не попасть в выделенную зону при гейтировании. Использование CD45 для локализации всей популяции лимфоцитов является более корректным.
Комбинация моноклональных антител CD3/CD8/CD38/CD45 и многоэтапное позитивное и негативное гейтирование позволяет четко выделить активированные NK-клетки. На Рис. 19А представлена двухпараметрическая гистограмма распределения лимфоцитов периферической крови с использованием МА против CD3
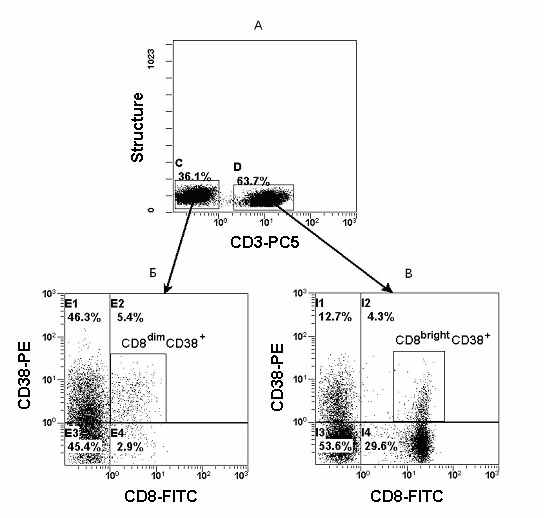
Рис. 19. Многоцветный анализ и последовательное гейтирование для локализации активированных NK-клеток. А - гистограмма распределения лимфоцитов периферической крови с использованием CD3 и светорассеяния под углом 90о. Область D содержит Т-клетки, а область C - CD3 негативные лимфоциты. Б - гистограмма распределения CD3- лимфоцитов периферической крови с использованием CD8 и CD38. CD8dimCD38+ активированные NK-клетки. В - гистограмма распределения CD3+ лимфоцитов периферической крови с использованием CD8 и CD38. CD8brightCD38+ активированные цитотоксические Т-клетки.
Дальнейший анализ проводят на отдельных гистограммах с использованием логических ограничений в зонах позитивных и негативных по CD3. На гистограмме, полученной с использованием гейтирования по CD3+, в зоне второго квадранта находятся активированные цитотоксические Т-клетки с фенотипом CD8brightCD38+ (Рис. 19В).
Гейтирование по зоне CD3 негативных клеток, позволяет выявить активированные NK-клетки с фенотипом CD8dimCD38+ (Рис. 19Б). Данное утверждение правомерно, поскольку CD8 экспрессируется не только на Т-клетках, но и на части популяции CD3 негативных клеток, а именно на NK-клетках.
Таким образом, используя данную комбинацию, МА возможно в одном образце определить активированные цитотоксические Т-клетки и активированные NK-клетки.
В последние годы становится весьма очевидной необходимость при типировании NK-клеток выявлять как общее количество, так и содержание отдельных их субпопуляций. Это связано с большим количеством вновь полученного фактического материала и несколькими направлениями развития современной иммунологии.
Результаты исследований показали, во-первых, ведущее значение NK-клеток и их цитотоксической функции при опухолевых и вирус-индуцированных процессах.
Во-вторых, наличие регуляторной функции у отдельных субпопуляций NK-клеток ставит вопрос об их клиническом и патогенетическом значении.
В-третьих, данные о наличии активационных рецепторов NK-клеток позволяют по-новому оценить их функциональную активность, не ставя трудоемких и весьма затратных экспериментов по киллингу клеток-мишеней.
В-четвертых, появилась возможность оценить степень воздействия лекарственной терапии на собственно NK-клетки как в норме, так и патологии, как in vivo, так и in vitro. Это позволяет значительно расширить возможности клинической фармакологии по поиску средств, напрямую влияющих на данную группу клеток (химиотерапия опухолей, антивирусная терапия и др.).
И, в-пятых, изучение субпопуляций NK-клеток и их функциональной активности может повлиять на наши представления о природе патологических процессов. Это весьма важно как для известных патологий, где значение NK-клеток уже определено, так и для других процессов, при которых значимость врожденных механизмов иммунитета недостаточно изучена. Как следствие этого, новые данные могут способствовать более корректной иммунотерапии различных патологических состояний с учетом ее влияния на данные клетки.
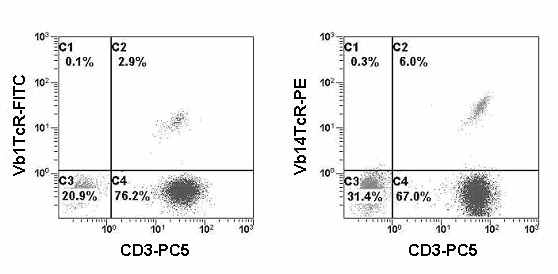
Идентификация Т-клеток и их субпопуляций по экспрессии αβ-TCR и γδ-TCR.
Многие микроорганизмы являются внутриклеточными паразитами и, обитая внутри клеток организма-хозяина, недоступны для антител. Облигатные внутриклеточные паразиты, в частности вирусы, способны размножаться только внутри клеток, используя репликационную систему клеток хозяина. Факультативно внутриклеточные микроорганизмы, такие как микобактерии и лейшмании, могут размножаться как в клетках, главным образом в макрофагах, так и вне клеток, но внутриклеточный способ существования для них более предпочтителен, поскольку обеспечивает защиту от факторов иммунной системы. Против данных микроорганизмов действует особый механизм приобретенного иммунитета, а именно клеточный иммунитет. Он обеспечивается отдельной субпопуляцией лимфоцитов, получившей название Т-клетки. В отличие от В-клеток, они дифференцируются в тимусе. Т-лимфоциты специализируются на уничтожении клеток организма, которые инфицированы размножающимися внутриклеточно возбудителями инфекции. Т-лимфоциты играют важную роль в элиминации опухолевых клеток, в реакциях трансплантат против хозяина и хозяин против трансплантата, гиперчуствительности замедленного типа и других реакциях организма, направленных на поддержание гомеостаза.
Оценка как относительного, так и абсолютного количества Т-клеток и их основных субпопуляций получила широкое распространение в лабораторной практике. При фенотипировании лимфоцитов эти данные являются диагностически значимыми при различных патологических состояниях иммунной системы, включая первичные и вторичные иммунодефициты. Динамика изменения субпопуляционного состава Т-клеток при некоторых патологиях представляет собой значительную ценность для контроля эффективности терапии, прогноза развития и течения заболевания (Hayball J.D., et al., 2000; Mandy F.F., et al., 2003).
К маркерам, характеризующим T-клетки, в первую очередь относят Т-клеточный рецептор (T-Cell Receptor, TCR). Подобно В-лимфоцитам, Т-лимфоциты несут на своей поверхности специфический рецептор для распознавания антигена. TCR является гетеродимером, состоящим из двух цепей.
Существует два типа TCR, каждый из которых ассоциируется с разными типами T-лимфоцитов. TCR1, состоящий из γ- и δ-цепей, появляется на ранних стадиях онтогенеза. TCR2 состоит из α- и β-цепей (Davis M.M., et al., 1988; Autran B., et al., 1989; Jarry A., et al., 1990;Van den Beemd R., et al., 2000).
Гены α- и β-цепей T-клеточного рецептора организованы так же, как и гены иммуноглобулинов. Имеются также сегменты V, D и J и гены константных областей (С). Формирование иммунокомпетентных T-клеток сопровождается транслокацией фрагментов V, D и J с образованием непрерывной последовательности VDJ. Как и при синтезе иммуноглобулинов, образование мРНК предусматривает удаление интронов между VDJ и С.