Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова Российской Академии Наук
| Вид материала | Диссертация |
- План научно-исследовательской работы на 2012 г. Учреждения Российской Академии наук, 797.38kb.
- Vi московский международный конгресс, 625.54kb.
- М. М. Шемякина и Ю. А. Овчинникова ран институт молекулярной генетики ран нейрохимическое, 386.57kb.
- Ордена Трудового Красного Знамени Институт биоорганической химии имени академиков, 191.71kb.
- В. Т. Иванов, директор Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова, 719.75kb.
- Синтетические пептиды, взаимодействующие с различными типами холинорецепторов, 487.49kb.
- Международная научно-практическая конференция, 130.29kb.
- Международная научно-практическая конференция, 148.88kb.
- Международная научно-практическая конференция, 301.89kb.
- Программа отчетной конференции по программе фундаментальных исследований Президиума, 123.52kb.
Рис. 28. Анализ субпопуляций CD4+ Т-лимфоцитов человека до (а) и после (б) инкубации клеток с иономицином, проведенный методом проточной цитофлуориметрии и разработанного алгоритма (см. Рис. 26). По оси ординат приведены значения долей клеток в составе соответствующей субпопуляции.
Маркер наиболее поздней стадии активации in vivo Т-лимфоцитов человека – молекулы CD29 (VLA – Very Late Antigen) – часто используется как дополнительный признак покоящихся CD4+CD45RA–CD45R0+ Т-клеток памяти. В составе ИР-фракции CD4+CD45R0+CD29+ Т-клеток значительно больше, чем в исходной популяции того же донора (Рис. 29). Вместе с тем, на значительной доле (в среднем около половины) CD4+CD45RA–CD45R0+ Т-лимфоцитов ИР-фракции этот антиген отсутствует. Никаких экспериментальных данных в литературе о взаимосвязи молекул CD29 и CD45R0 до настоящего времени не описано. Степень обогащения ИР-фракции CD4+CD45R0+CD29+ Т-лимфоцитами зависит от исходной доли клеток с данным фенотипом в составе лимфоцитов ПКЧ, но во всех исследованных случаях молекулы CD29 экспрессируются на меньшей доле ИР CD4+CD45RA–CD45R0+ Т-клеток. Как правило, CD4+CD45R0–CD29+ Т-клетки в ощутимых количествах встречаются только в крови больных хроническими инфекциями. Сопоставимые результаты были получены для лимфоцитов здоровых лиц. Вероятнее всего, на поздней стадии активации большая часть CD4+CD45R0+CD29+ Т-лимфоцитов состоит из резистентных к действию иономицина клеток, а, возможно, определенная часть CD4+CD45R0+CD29– Т-лимфоцитов является чувствительными к его действию клетками.
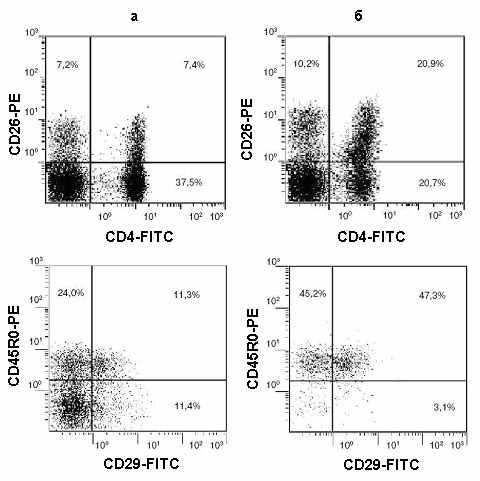
Рис. 29 Анализ состава CD4+ Т-лимфоцитов человека до (а) и после (б) инкубации клеток с иономицином. Гистограммы показывают экспрессию CD45R0, CD26 и CD29 молекул на поверхности CD4+ Т-клеток.
Появление CD4+CD26+ Т-лимфоцитов также принято считать признаком специфической активации Т-клеток, хотя до сих пор остается неясным, на какой стадии дифференцировки появляется данный маркер. В норме, около четверти CD4+ Т-клеток ПКЧ экспрессируют молекулы CD26. В ИР-фракции доля CD4+CD26+ Т-лимфоцитов всегда значительно выше, чем в ПКЧ того же донора, и составляла, как правило, более половины соответствующей популяции (Рис. 29). Таким образом, значительная часть CD4+CD26+CD45RA–CD45R0+ Т-лимфоцитов человека является резистентной к действию иономицина.
В целом возникновение резистентности к действию низких доз иономицина и изменение гомеостаза ионов кальция в CD4+ Т-клетках наиболее характерно для самых поздних стадий дифференцировки активированных in vivo CD4+ Т-лимфоцитов человека. В полной мере это свойство характерно для долгоживущих покоящихся CD4+CD45RA–CD45R0+ Т-лимфоцитов памяти человека.
Как и следует ожидать от системы, работающей по принципу клональной селекции, каждый антиген активирует лишь ничтожно малую часть всей популяции Т-лимфоцитов. Для выполнения своих функций наивным Т-лимфоцитам необходима пролиферация (поскольку на антиген реагируют лишь немногие клоны, содержащие малое число клеток, и для развития интенсивного ответа требуется их предварительное размножение). По этой причине подавляющее большинство работ по изучению закономерностей активации Т-лимфоцитов выполнены in vitro с использованием митогенных лектинов (ConA и ФГА), смеси ФМА с Ca2+-ионофорами (иономицин), или МА к комплексу CD3-TCR. Каждый этап специфической активации Т-клеток in vivo происходит в конкретном микроокружении, полностью смоделировать которое в реальных условиях эксперимента вряд ли представляется возможным.
Общепринятый фенотип наивных CD4+ Т-клеток человека может быть описан как CD45RA+CD45R0–CD25–CD29–CD62L+CD69–CD95–HLA-DR–. Большинство покоящихся наивных CD4+CD45RA+CD45R0– Т-лимфоцитов, как и Т-клетки тимуса, являются чувствительными к действию Ca2+-ионофоров. Многократное возрастание ионов Ca2+ всегда происходит наиболее резко в первые минуты стимуляции Т-лимфоцитов и достигает максимума в течение 5–10 мин. Следовательно, чувствительность к присутствию ионов кальция в среде и к действию иономицина является необходимым условием для осуществления стадий индукции активации наивных Т-лимфоцитов.
Чувствительность ранних этапов активации (от момента начала поликлональной стимуляции и до появления на поверхности Т-лимфоцитов молекул CD25) к присутствию ионов кальция во внешней среде и их зависимость от амплитуды роста внутриклеточного Ca2+ в ответ на стимул признается большинством исследователей. Данный этап активации по продолжительности колеблется от 8 до 12 ч. Этот же временной интервал принято характеризовать и по появлению молекул CD69. Экспрессия молекул CD69 в активированных Т-клетках полностью подавляется EGTA. Среди лимфоцитов ИР-фракции присутствие CD4+CD45R0–CD45RA+CD69+ Т-клеток никогда не наблюдается. Скорее всего, большинство CD4+CD45RA+CD45R0lowCD69+ Т_лимфоцитов человека представляют собой чувствительные к действию иономицина клетки. Возможно, до появления молекул CD25 на активированных CD4+CD45R0–CD45RA+ Т-лимфоцитах эти клетки и проходят несколько этапов начальной стадии активации, но все они не сопровождаются качественными изменениями их чувствительности к действию иономицина. Следовательно, для инициации процесса активации чувствительность Т-клеток к иономицину совпадает с их наиболее сильной зависимостью от присутствия Ca2+ в среде. Так как ионы кальция всегда присутствуют в организме, то резистентность к действию иономицина просто не может появиться на данном этапе активации.
Одной из ключевых стадий процесса активации принято считать появление CD4+CD25+ Т-клеток. Влияние удаления ионов кальция с помощью EGTA из среды на экспрессию молекул CD25 Т-клетками сильно зависело от времени добавления хелатора. Как правило, чем на более ранней стадии ионы кальция были удалены из среды инкубации клеток, тем большее влияние это оказывало на экспрессию молекул CD25. Скорее всего, для индукции синтеза молекул CD25 de novo присутствие ионов кальция абсолютно необходимо. Экспрессия молекул CD25 на активированных Т-клетках, прошедших стадию индукции, значительно меньше зависит от EGTA. Для более поздних стадий активации какого-либо эффекта EGTA на CD25+ Т-клетки отмечено не было. Это свидетельствует о значительном снижении зависимости этой и, возможно, последующих стадий активации Т-клеток от присутствия ионов кальция в среде.
Доля CD4+CD25+ Т-клеток в составе ИР-фракции лишь незначительно отличалась от их содержания в крови того же донора. Это позволяет предположить появление ИР Т-клеток, в которых произошла перестройка гомеостаза ионов кальция, именно на данной стадии активации in vivo CD4+ Т-лимфоцитов. В популяции CD4+CD25+ Т-клеток ПКЧ присутствуют пролиферирующие и регуляторные CD4+ Т-лимфоциты. Существуют ли взаимные переходы между CD4+CD25high и CD4+CD25low популяциями, до сих пор остается неизвестным. Субпопуляции этих клеток проявляют неодинаковую чувствительность к Ca2+-ионофору. Большинство CD4+CD25high Т-лимфоцитов представлено резистентными к действию иономицина клетками. В сравнении с CD4+CD25high Т-лимфоцитами ПКЧ, ИР-фракция всегда обогащена HLA-DR+, CD95+ и CD38+ клетками с высоким уровнем экспрессии этих молекул, но одновременно содержит меньше CD62L+ клеток. В сравнении с CD4+CD25low Т-клетками ПКЧ, ИР популяция обогащена CD95+ клетками с высоким уровнем экспрессии этих молекул. При этом в ИР-фракции CD4+CD25low Т-лимфоцитов наблюдается выраженное уменьшение доли CD62L+ клеток. Скорее всего, Т-клетки с измененным гомеостазом ионов кальция появляются на стадии интенсивной пролиферации активированных CD4+ Т-лимфоцитов, но составляют меньшую долю этой популяции. В популяции регуляторных CD4+CD25high Т-лимфоцитов доля ИР-клеток значительно выше. Какие-либо данные о зависимости этих популяций от присутствия ионов кальция в среде на настоящий момент отсутствуют.
Появление молекул HLA-DR является общепринятым признаком поздней стадии активации CD4+ Т-лимфоцитов. Специальных работ по изучению роли ионов кальция в экспрессии молекул HLA-DR не проводилось, но отмечается минимальный вклад кальмодулин-зависимых процессов (cAMP- или cGMP-зависимые протеинкиназы) в осуществление экспрессии. Доля ИР CD4+HLA-DR+ Т-клеток всегда была значительно выше, чем в крови того же донора. Скорее всего, на поздних стадиях активации in vivo большая часть активированных CD4+ Т-клеток качественно изменяет характер внутриклеточной регуляции ионов кальция и приобретает резистентность к действию иономицина.
Молекулы CD29 часто используются в качестве дополнительного признака покоящихся CD4+CD45RA–CD45R0+ Т-клеток памяти. Для этого маркера отсутствуют четкие указания на зависимость его экспрессии от стадии активации CD4+ Т-лимфоцитов. Роль ионов кальция в индукции экспрессии этих молекул также до сих пор неизвестна. ИР-фракция значительно обогащена CD4+CD45R0+CD29+ Т-клетками по сравнению с исходной популяцией в крови донора. Однако на значительной доле (в среднем около половины) CD4+CD45RA–CD45R0+ ИР Т-клеток этот антиген отсутствует. Скорее всего, на этой, достаточно поздней стадии активации CD4+ Т-лимфоцитов, происходит полная замена изоформы CD45RA на CD45R0. Вероятно, на этой стадии активации большая часть CD4+CD29+ Т-лимфоцитов состоит из резистентных к действию иономицина клеток. Никаких работ по сравнительному анализу функциональных свойств CD45R0+CD29– и CD45R0+CD29+CD4+ Т-клеток до настоящего времени не проводилось.
Дополнительным признаком покоящихся CD4+CD45RA–CD45R0+ Т-лимфоцитов памяти человека принято считать присутствие в популяции CD28+ клеток. Действие иономицина на лимфоциты ПКЧ сопровождается значительным обогащением популяции CD4+CD45RA–CD45R0+CD28+CD29+CD62Llow Т-клетками. Неодинаковая чувствительность к иономицину CD62Lhigh и CD62Llow Т-лимфоцитов хорошо совпадает с общепринятым подразделением популяции CD4+ Т-клеток человека по путям миграции по организму. Для CD4+ Т-лимфоцитов человека имеются указания на различную чувствительность к апоптозу CD28– и CD28+ клеток – наиболее готовыми к апоптозу клетками принято считать CD4+CD95highCD28– клетки. Согласно современной классификации, наиболее полно фенотип ИР CD4+ Т-клеток человека совпадает с популяцией «центрального ядра» Т-клеток памяти. В этой популяции CD4+ Т-лимфоцитов памяти представлены покоящиеся Т-клетки человека, полностью прошедшие зависимую от антигена дифференцировку в ходе первичного иммунного ответа. Данные клетки обладают ограниченной способностью к миграции по высоко-эндотелиальным венулам.
ИР Т-клетки были описаны ранее для селезенки и лимфатических узлов мыши. Использование лабораторных животных дает редкую возможность проводить эксперименты методом адоптивного переноса: выделенные и охарактеризованные популяции иммунных клеток доноров (мышей) переносят наивным сингенным реципиентам, в которых и проверяют in vivo функциональные свойства перенесенных клеток. Только выделенные ИР Т-клетки из селезенок переболевших или вакцинированных мышей-доноров оказались способны адоптивно переносить наивным реципиентам невосприимчивость к последующему заражению Mycobacterium tuberculosis и Neisseria meningitidis в соответствующих моделях. Приведенные данные прямо свидетельствуют о способности ИР Т-клеток к выполнению основных функций Т-лимфоцитов памяти, связанных с распознаванием антигенов возбудителя и быстрого и усиленного ответа на них in vivo, приводящего к эффективной защите реципиентов от патогена. Большинство специфичных к антигену Т-лимфоцитов селезенки и лимфатических узлов мыши также сосредоточено в ИР-фракции Т-клеток.
ИР Т-клетки человека сохраняют способность отвечать на стимуляцию смесью ФМА с иономицином. Для выделенных CD4+CD45R0+ Т-клеток памяти человека также показана значительно меньшая зависимость пролиферации и продукции IL-2 от концентрации ионов кальция в среде при стимуляции МА к CD3, по сравнению с наивными CD4+ Т-клетками того же донора. Следовательно, резистентность к действию иономицина Т-клеток памяти «не мешает» им осуществлять важнейшие функции Т-клеток памяти in vivo и in vitro.
Полученные экспериментальные данные суммированы в виде схемы, приведенной на Рис. 30, иллюстрирующей изменение гомеостаза ионов кальция в CD4+ Т-лимфоцитах в процессе их активации и дифференцировки in vivo. Данная схема носит гипотетический характер, так как не все стадии активации и дифференцировки CD4+ Т-клеток in vivo описаны одинаково подробно.
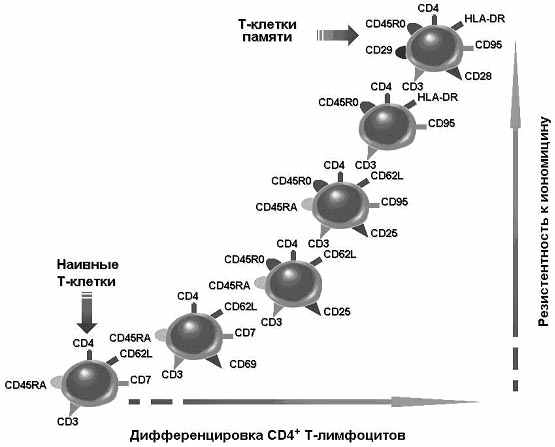
Рис. 30. Диаграмма, иллюстрирующая возникновение резистентности к действию иономицина, CD4+ Т-лимфоцитов памяти человека в ходе зависимой от антигена дифференцировки из наивных предшественников как результат нормального развития первичного иммунного ответа in vivo.
Ионы кальция всегда присутствуют в организме. Они необходимы для протекания множества биохимических реакций в клетках. При дифференцировке in vivo активированных Т-лимфоцитов роль ионов кальция постоянно меняется. Все покоящиеся наивные CD4+CD45RA+CD45R0– Т-клетки чувствительны к действию низких доз иономицина. Индукция активации наивных Т-лимфоцитов всегда приводит к повышению Ca2+ внутри клеток. На этой стадии активации Т-клетки сохраняют чувствительность к действию иономицина. Более поздние стадии активации значительно меньше зависят от присутствия ионов кальция, и часть активированных клеток приобретает резистентность к действию иономицина. Покоящиеся CD4+CD45RA–CD45R0+ Т-клетки памяти вообще резистентны к действию иономицина, но это не препятствует осуществлению ими своих физиологических функций, связанных с распознаванием антигенов возбудителя и быстрого и усиленного ответа на них in vivo, приводящего к эффективной защите организма от патогенов.
ВЫВОДЫ
- Разработанный алгоритм оптимизации настройки приборов и создания протоколов цитометрического анализа для стандартизации исследований изучаемых параметров клеток иммунной системы применим для работы на большинстве проточных цитометров ведущих фирм производителей.
- Последовательное введение логически ограниченных зон при многоцветном анализе лимфоцитов выявляет наличие отдельных минорных субпопуляций, различие в плотности экспрессии маркеров внутри изучаемой субпопуляции клеток, стадию дифференцировки и степень их активации.
- Результаты проведенных скрининговых исследований условно здоровых лиц в различных регионах России с определением среднестатистическиих значений параметров иммунного статуса сопоставимы со среднестатистическими значениями параметров иммунного статуса человека опубликованными в литературе.
- Методологический подход, включающий введение в первичную панель скринигового исследования иммунной системы антител для выявления аутореактивных клонов В-клеток (В1, CD19+CD5+), улучшает диагностику и мониторинг за пациентами с аутоиммунными заболеваниями (аутоиммунный тиреоидит).
- В клинико-диагностической практике наиболее предпочтителен четырехцветный цитометрический анализ по сравнению с двух- и трехцветным, что дает возможность получать достоверные данные, характеризующие как субпопуляционный состав, так и ряд функциональных параметров иммунокомпетентных клеток при уменьшении количества образцов и времени, затраченного на получение конечного результата.
- Предложена и внедрена в практическую работу четырехцветная панель моноклональных антител к различным кластерам дифференцировки лимфоцитов периферической крови учитывающая степень активации различных субпопуляций Т-клеток, В-клеток и NK-клеток:
IgG/IgG/IgGCD45 - изотипический контроль;
CD19/CD5/CD27/CD45 - В1, В2, В-клетки памяти;
CD16/CD56/CD3/CD45 - субпопуляции NK-клеток;
CD8/CD4/CD3/CD45 - субпопуляции Т-клеток;
CD8/CD38/CD3/CD45 - активированные Т-цитотоксические и NK-клетки;
CD4/CD25/HLA-DR/CD45 - активированные Т хелперы;
CD45RA/CD45R0/CD4/CD45 - активированные Т хелперы и Т-клетки памяти;
TCR-αβ/TCR-γδ/CD3/CD45 - αβ- и γδ-Т-клетки;
CD4/CD25/CD127/CD45 - Т-регуляторные клетки.
- Разработаные критерии применения многоцветных параметров для иммунофенотипирования клеток, в том числе при использовании первичной панели для скрининговых исследований и вторичной панели для более углубленного анализа включают: а) анализ гистограмм на наличие клеток с измененной экспрессией линейных маркеров; б) сравнение полученных значений с референтными; в) анализ плотности экспрессии значимых маркеров лимфоцитов; г) оценка степени активации иммунокомпетентных клеток.
- Дифференцировка Т-лимфоцитов от наивных Т-хелперов (CD4+CD7+CD45RA+CD45R0–CD25–CD29–CD62L+CD69–CD95–HLA-DR–) к Т-клеткам памяти (CD4+CD7-CD45RA–CD45R0+CD28+CD29+CD62Llow) сопровождается изменением рецепторного репертуара и перестройкой системы Ca2+-гомеостаза, что приводит к возникновению их резистентности к действию кальциевых ионофоров.
- Обоснованное применение многоцветного цитометрического анализа значительно расширяет возможности клинико-диагностических и научных исследований иммунной системы человека и биологических объектов.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ.
Коллективные монографии и главы в книгах.
- Дозморов И.М., Багаева Л.В., Коваленко Е.И., Кузин И.И., Литвинов И.С., Луцан Н.И., Луценко Г.В., Молотковская И.М., Петров Р.В., Прохорова А.Л., Рысева И.А., Хайдуков С.В., Сапожников А.М., Свирщевская Е.В. Альтернативность в действии гликопептидов бактериальной стенки на иммунную систему и ее компаненты. // Синтетические иммуномодуляторы. Под ред. Р.В. Петрова, М.: Наука, 1991 С. 38-96.
- Nesmeyanov V.A., Khaidukov S.V., Komaleva R.L., Sumaroka M.V., Litvinov I.S., Dorodnikh E.G., Valyakina T.I., Malakhov A., Brisken K. The molecular mechanism of muramyl peptides' biological activity. // Haemotology and Blood Transfusion, Modern Trends in Human Leukemia IX, R.Neth et al. (Eds.), Springer-Verlag Berlin Heidelberg, 1992, P. 290-293.
- Vlasova E.V., Galanina O.E., Khaidukov S.V., Tuzikov A.B., Tzvetkov Y.E., Shashkov A.S., Nifant’ev N.E., Bovin N.V. Specificity of Workshop mAb S071-S076 towards synthetic selection receptors and cell lines A431 and HL-60. // Leucocyte Typing V. White Cell Differentiation Antigens. S.F. Schlossman et al. (Eds.), Oxford University Press vol. 1, 1995, P. 1534-1535.
- Vlasova E.V., Kovalenko E.I., Lukin S.V., Khaidukov S.V., Nifant’ev N.E., Piskarev V.E., Bovin N.V. Myeloid Blind Panel biochemical analysis: Specificity of anti-carbohydrate MA submitted to Myeloid cells section. // Leucocyte Typing VI. White Cell Differentiation Antigens, Tadamitsu Kishimoto (Eds.), Garland Publishing, Inc. NY & London, 1997, P. 1038-1040
- Избранные вопросы современной проточной цитометрии. // Под ред. Хайдукова С.В., Зурочки А.В. Челябинск, Издательство “Челябинская государственная медицинская академия”, 2007, 85 С.
- Сибиряк С.В., Хайдуков С.В., Зурочка А.В., Черешнев В.А. Оценка апоптоза в иммунологических исследованиях: Краткое методическое руководство. // Екатеринбург, УрО РАН, 2008, 60 С.
- Вопросы современной проточной цитометрии. Клиническое применение. // Под ред. Хайдукова С.В., Зурочки А.В. Челябинск. Издательство "Челябинская государственная медицинская академия". 2008, 196 С.
Статьи в журналах по перечню ВАК Министерства образования и науки Российской Федерации.
- Юровский В.В., Сафонова Н.Г., Хайдуков С.В., Василов Р.Г., Демин В.В. Синтез и иммунохимическое изучение антигенной детерминанты H-2d-молекулы главного комплекса гистосовместимости мыши. // Биоорг. химия, 1986, 12(1), С. 89-99
- Гиляревский С.Д., Хайдуков С.В., Лунева Н.М., Несмеянов В.А. Фенотипирование и функциональная характеристика линии клеток лимфосаркомы крысы. // Иммунология, 1987, 2, С. 33-36.
- Несмеянов В.А., Хайдуков С.В., Комалева Р.Л., Андронова Т.М., Иванов В.Т.. Влияние N-ацетилглюкозаминил-β1-4-N-ацетилмурамоил-L-аланил-D-изоглутамина на экспрессию Ia-антигенов макрофагами мыши. // Биологические мембраны, 1989, 6(3), С. 245-249
- Sumaroka M.V., Litvinov I.S., Khaidukov S.V., Golovina T.N., Kamraz M.V., Komal'eva R.L., Andronova T.M., Makarov E.A., Nesmeyanov V.A., Ivanov V.T. Muramyl peptide-binding sites are located inside target cells. // FEBS Lett. 1991, 295(1-3), P. 48-50.
- Stratieva-Taneeva P.A., Khaidukov S.V., Kovalenko V.A., Nazimov I.V., Samochvalova L.V., Nesmeyanov V.A. Bispecific monoclonal antibodies to human Interleikin 2 and horseredish peroxidase. // Hybridoma, 1993, 12(3), P. 271-284.
- Vlasova E.V., Byramova N.E., Tuzikov A.B., Zhegis L.S., Rapoport E.М., Khaidukov S.V., Bovin N.V. Monoclonal antibodies directed to synthetic carbohydrate antigen Ley. // Hybridoma, 1994, 13(4), P. 295-301.
- Pukhalsky A., Toptygina A., Khaidukov S. Interleukin-2 receptor β chain as a possibile target for low doses of mafosfamide. // Mediators of Inflammation, 1995, 4(3), P. 175-180.
- Хайдуков С.В., Комалева Р.Л., Несмеянов В.А. Макрофаги - основная мишень дисахаридсодержащих мурамил-пептидов. // Иммунология, 1995, № 3, С. 26-30.
- Марквичева Е.А., Мареева Т.Ю., Хайдуков С.В., Бронин А.С., Несмеянов В.А., Зубов В.П. Влияние иммобилизации в гранулы гидрогеля на структурно-функциональные особенности гибридных клеток в процессе культивирования. // Биологические мембраны, 1995, 12(2), С. 122-129.
- Khaidukov S.V., Komaleva R.L., Nesmeyanov V.A. N-acetylglucosamine-containing muramyl peptides directly affect macrophages. // Int J Immunopharmacol. 1995, 17(11), P. 903-911.
- Шиян С.Д., Пухальский А.Л., Хайдуков С.В., Топтыгина А.П., Бовин Н.В. Взаимодействие лейкоцитов периферической крови с a1-кислым гликопротеином, его углеводными цепями и неогликоконъюгатами. // Гематалогия и трансфузиология, 1996, 41(2), C. 24-29.
- Шебзухов Ю.В., Токсамбаева С.Ж., Хайдуков С.В., Мысякин Е.Б. Влияние фактора активации тромбоцитов и его синтетических аналогов на экспрессию Ia-антигенов перитонеальными макрофагами мыши. // Журнал Эпидемиологии, Микробиологии и Иммунобиологии, 1996, № 3, C. 114-117.
- Калашникова Е.А., Хайдуков С.В., Пухальский А.Л. Влияние разных доз дексаметазона и состава клеточной популяции на продукцию in vitro фактора некроза опухолей и интерлейкина-6 мононуклеарами периферической крови человека. // Бюллетени Экспериментальной Биологии и Медицины, 1996, № 6, C. 667-672
- Еремеев В.В., Лядова И.В., Майоров К.Б., Хайдуков С.В., Мороз А.М., Апт А.С.. Получение и частичная характеристика специфических к антигенам микобактерий клонов Т-клеток от мышей с генетически различной чувствительностью к туберкулезу. // Бюллетени Экспериментальной Биологии и Медицины, 1997, 123(4), C. 431-434.
- Хайдуков С.В., Бочарова И.В., Межлумова М.Б., Литвинов И.С., Яхин Р.Т., Никоненко Б.В. Иммунологическая память, индуцированная Mycobacterium bovis (BCG) у инбредных мышей. // Бюллетени Экспериментальной Биологии и Медицины, 1997, 123(11), C. 553-555.
- Коваленко Е.И., Саблина М.А., Хирова Е.В., Хайдуков С.В., Бовин Н.В. Встраивание неогликолипидов в мембрану клеток K562. Модель для изучения углеводзависимого лизиса клеток-мишеней естественными киллерами. // Биоорг. Химия, 1998, 24(3), C. 224-228.
- Водовозова Е.Л., Хайдуков С.В., Гаенко Г.П., Бондарчук Т.Н., Михалев И.И., Гречишникова И.В., Молотковский Юл.Г. Транспортировка цитотоксических липосом к злокачественным клеткам с помощью углеводных детерминант. // Биоорг. Химия, 1998, 24 (10) C. 760-767.
- Pichugin A.V., Khaidukov S.V., Moroz A.M., Apt A.S. Capacity of murine T cells to retain long-term responsiveness to mycobacterial antigens is controlled by the H-2 complex. // Clin Exp Immunol. 1998, 111(2) P. 316-324.
- Lyadova I., Yeremeev V., Majorov K., Nikonenko B., Khaidukov S., Kondratieva T., Kobets N., Apt A. An ex vivo study of T lymphocytes recovered from the lungs of I/St mice infected with and susceptible to Mycobacterium tuberculosis. // Infect Immun. 1998, 66(10), P. 4981-4988.
- Рапопорт Е.М., Некрасов М.В., Хайдуков С.В., Свирщевская Е.В., Жигис Л.С., Козлов Л.В., Баталова Т.Н., Зубов В.П., Бовин Н.В. Изучение клеточной локализации галактозосвязывающего лектина из сыворотки крови человека. // Биохимия, 2000, 65(11), P. 1558-1563.
- Lyadova I.V., Eruslanov E.B., Khaidukov S.V., Yeremeev V.V., Majorov K.B., Pichugin A.V., Nikonenko B.V., Kondratieva T.K., Apt A.S. Comparative analysis of T lymphocytes recovered from the lungs of mice genetically susceptible, resistant, and hyperresistant to Mycobacterium tuberculosis-triggered disease. // J Immunol. 2000, 165(10) P. 5921-5931.
- Kondratieva T.K., Kobets N.V., Khaidukov S.V., Yeremeev V.V., Lyadova I.V., Apt A.S., Tam M.F., Stevenson M.M. Characterization of T cell clones derived from lymph nodes and lungs of Pseudomonas aeruginosa-susceptible and resistant mice following immunization with heat-killed bacteria. // Clin Exp Immunol. 2000, 121(2) P. 275-82.
- Никоненко Б.В., Хайдуков С.В., Литвинов И.С., Бочарова И.В., Апт А.С. Иммунологическая память у мышей линий CBA и CBA/N при вакцинации Mycobacterium bovis (BCG). // Бюллетень Экспериментальной Биологии и Медицины, 131(6), 2001, С. 649-651.
- Сащенко Л.П., Козырь А.В., Лукьянова Т.И., Габибов А.Г., Сучков С.В., Бобик Т.В., Хайдуков С.В., Алекберова З.С., Гнучев Н.В.. Каспаззависимая цитотоксичность ДНК-аутоантител. // Доклады Академии Наук, 2001, 380(1), C. 117-119.
- Lyadova I.V., Vordermeier H.M., Eruslanov E.B., Khaidukov S.V., Apt A.S., Hewinson R.G. Intranasal BCG vaccination protects BALB/c mice against virulent Mycobacterium bovis and accelerates production of IFN-gamma in their lungs. // Clin. Exp. Immunol. 2001 126(2) P. 274-9.
- Blishchenko E.Y., Kalinina O.A., Sazonova O.V., Khaidukov S.V., Egorova N.S., Surovoy A.Y., Philippova M.M., Vass A.A., Karelin A.A., Ivanov V.T. Endogenous fragment of hemoglobin, neokyotorphin, as cell growth factor. // Peptides. 2001, 22(12), C. 1999-2008.
- Ночевный В.Т., Хайдуков С.В. Культура клеток кожи перепелиных эмбрионов. // Аграрная наука, 2001, № 6, C. 22-24,
- Петрова Е.Э., Валякина Т.И., Хайдуков С.В., Несмеянов В.А. Эндогенный фактор некроза опухолей демаскирует на поверхности клеток меланомы центры связывания N-ацетилглюкозаминил-(β1–4)-N-ацетилмурамоил-аланил-D-изоглутамина. // Биоорг. Химия, 2001, 27 (4) C. 249-256.
- Гаенко Г.П., Козлов А.М., Сапрыкина Н.С., Доротникова Е.Б., С.В. Хайдуков, Молотковский Ю.Г. Некоторые характеристики фенотипа клеток карциномы легкого Льюис. // Бюллетень Экспериментальной Биологии и Медицины, 2002, Том 134(10): С. 443-446.
- Хайдуков С.В., Холоденко И.В., Литвинов И.С. Иономицин-резистентная субпопуляция CD4+ Т-лимфоцитов периферической крови человека. Фенотипическая характеристика. // Цитология, 2003, 45(3), С. 249-254.
- Хайдуков С.В., Литвинов И.С. Иономицин-резистентная субпопуляция CD4+ Т-лимфоцитов периферической крови человека. Функциональная характеристика. // Биологические мембраны, 2003, т. 20(4), С. 333-340.
- Хайдуков С.В., Литвинов И.С. Фенотипическая характеристика CD4+ Т-лимфоцитов периферической крови человека, экспрессирующих белки множественной лекарственной устойчивости. // Биологические мембраны, 2003, 20(5), С. 381-385.
- Rapoport E., Khaidukov S., Baidina O., Bojenko V., Moiseeva E., Pasynina G., Karsten U., Nifant'ev N., LePendue J., Bovin N. Involvement of the Galbeta1 - 3GalNAcbeta structure in the recognition of apoptotic bodies by THP-1 cells. // Eur J Cell Biol. 2003, 82(6) P. 295-302.
- Sashchenko L.P., Dukhanina E.A., Yashin D.V., Shatalov Y.V., Romanova E.A., Korobko E.V., Demin A.V., Lukyanova T.I., Kabanova O.D., Khaidukov S.V., Kiselev S.L., Gabibov A.G., Gnuchev N.V., Georgiev G.P. Peptidoglycan recognition protein tag7 forms a cytotoxic complex with heat shock protein 70 in solution and in lymphocytes. // J Biol Chem. 2004, 279(3) P. 2117-24.
- Коваленко Е.И., Хирова Е.В., Молотковская И.М., Овчинникова Т.В., Саблина М.А., Сапожников А.М., Хайдуков С.В., Бовин Н.В. Модификация поверхности клеток с помощью липофильных гликоконъюгатов и взаимодействие модифицированных клеток с натуральными киллерами // Биоорг. химия. 2004, 30(3) C. 281-292.
- Гаенко Г.П., С.В. Хайдуков, Молотковский Ю.Г. Экспрессия коллагена IV типа клетками карциномы легкого крысы. // Бюллетень Экспериментальной Биологии и Медицины, 2004, 137(1), С. 78-80.
- Колышкин В.М., Ночевный В.Т., Юрков С.Г., С.В. Хайдуков, Виолин Б.В. Проточная цитометрия для стандартизации линии клеток фибробластов и эмбрионов кур. // Аграрная наука, 2004, № 3, С. 27-29.
- Хайдуков С.В., Литвинов И.С. Изменение гомеостаза ионов кальция в CD4+ Т_лимфоцитах периферической крови человека в процессе дифференцировки in vivo. // Биохимия, 2005, 70(6), С. 838 – 849.
- Хайдуков С.В., Агафонова С.А., Литвинов И.С. Сравнительный анализ фенотипических характеристик наивных Т-клеток и Т-клеток памяти селезенки мышей линии СВА. // Биологические мембраны, 2005, 22(6), С. 482-491.
- Кирилина Е.А., Суворов Н.И., Попова С.С., Хайдуков С.В., Рапопорт Е.М., Фонина Л.А., Михайлов А.А. Индукция дифференцировки в лейкозных клеточных линиях под влиянием миелопептида-4. // Бюллетень Экспериментальной Биологии и Медицины, 2005, 140(11), С. 565-569.
- Гурьянов С.А., Кирилина Е.А., Хайдуков С.В., Суворов Н.И., Молотковская И.М., Михайлова А.А. Специфическое связывание и проникновение внутрь клетки-мишени флуоресцентно меченного миелопептида-4, обладающего дифференцировочной активностью. // Биоорг. химия 2006, 32(6) C. 574-578.
- Petrova E.E., Valyakina T.I., Simonova M.A., Komaleva R.L., Khaidukov S.V., Makarov E.A., Blokhin D.Y., Ivanov P.K., Andronova T.M., Nesmeyanov V.A. Muramyl peptides augment cytotoxic effect of tumor necrosis factor-alpha in combination with cytotoxic drugs on tumor cells. // Int Immunopharmacol. 2006, 6(9), P. 1377-86.
- Ponomarenko N.A., Vorobiev I.I., Alexandrova E.S., Reshetnyak A.V., Telegin G.B., Khaidukov S.V., Avalle B., Karavanov A., Morse H.C. 3rd, Thomas D., Friboulet A., Gabibov A.G. Induction of a protein-targeted catalytic response in autoimmune prone mice: antibody-mediated cleavage of HIV-1 glycoprotein GP120. // Biochemistry. 2006, 45(1), P. 324-30.
- Хайдуков С.В., Зурочка А.В. Проточная цитометрия как современный метод анализа в биологии и медицине. // Медицинская иммунология, 2007, 9(4-5), С. 373-378.
- Хайдуков С.В. Подходы к стандартизации метода проточной цитометрии для иммунофенотипирования. Настройка цитометров и подготовка протоколов для анализа. // Медицинская иммунология, 2007, 9(6), С. 569-574.
- Sashchenko L.P., Dukhanina E.A., Shatalov Y.V., Yashin D.V., Lukyanova T.I., Kabanova O.D., Romanova E.A., Khaidukov S.V., Galkin A.V., Gnuchev N.V., Georgiev G.P. Cytotoxic T lymphocytes carrying a pattern recognition protein Tag7 can detect evasive, HLA-negative but Hsp70-exposing tumor cells, thereby ensuring FasL/Fas-mediated contact killing. // Blood. 2007, 110(6), P. 1997-2004.
- Kovalenko E.I., Abakushina E., Telford W., Kapoor V., Korchagina E., Khaidukov S., Molotkovskaya I., Sapozhnikov A., Vlaskin P., Bovin N. Clustered carbohydrates as a target for natural killer cells: a model system. // Histochem Cell Biol. 2007, 127(3), P. 313-26.
- Хайдуков С.В., Зурочка А.В. Расширение возможностей метода проточной цитометрии для клинико-иммунологической практики. // Медицинская иммунология, 2008, 10(1), С. 5-13.
- Blishchenko E., Sazonova O., Surovoy A., Khaidukov S., Sheikine Y., Sokolov D., Freidlin I., Philippova M., Vass A., Karelin A., Ivanov V. Antiproliferative action of valorphin in cell cultures. // J Pept Sci. 2002, 8(8), P. 438-452.
- Sashchenko L.P., Gnuchev N.V., Lukjanova T.I., Redchenko I.V., Kabanova O.D., Lukanidin E.M., Blishchenko E.Yu., Satpaev D.K., Khaidukov S.V., Chertov O.Yu. Time-dependent changes of LAK cell phenotypes correlate with the secretion of different cytotoxic proteins. // Immunol Lett., 1993, 37(2-3), P. 153-157.
- Kozyr A.V., Sashchenko L.P., Kolesnikov A.V., Zelenova N.A., Khaidukov S.V., Ignatova A.N., Bobik T.V., Gabibov A.G., Alekberova Z.S., Suchkov S.V., Gnuchev NV. Anti-DNA autoantibodies reveal toxicity to tumor cell lines. // Immunol Lett. 2002, 80(1), P. 41-47.
- Хайдуков С.В., Зурочка А.В. Многоцветный цитометрический анализ. Идентификация B-клеток. // Российский Иммунологический Журнал, 2007, 1(10), 3-4, С. 220–228.
- Хайдуков С.В., Зурочка А.В. Многоцветный цитометрический анализ. Идентификация NK-клеток. // Российский Иммунологический Журнал, 2008, 2(11), 1, С. 20–30.
- Хайдуков С.В., Зурочка А.В., Черешнев В.А. Многоцветный цитометрический анализ. Идентификация Т-клеток и их субпопуляций по экспрессии αβ-TCR и γδ-TCR.// Медицинская иммунология, 2008, 10(2-3), C. 115-124.
- Иммунокорригирующие свойства дипептида ГБ-115. Шипаева Е.В., Коваленко Л.П., Хайдуков С.В., Колик Л.Г., Гудашева Т.А., Дурнев А.Д., Середенин С.Б. // Бюллетень Экспериментальной Биологии и Медицины, 2008 г., Том 145, № 5 С. 548-551.
