Лекция №1 введение
| Вид материала | Лекция |
- С. В. Шадрина Лекция 5 сентября, 15: 00-16: 30, Введение в геометрию пространства модулей, 5.97kb.
- Первая лекция. Введение 6 Вторая лекция, 30.95kb.
- Текст лекций н. О. Воскресенская Оглавление Лекция 1: Введение в дисциплину. Предмет, 1185.25kb.
- А. И. Мицкевич Догматика Оглавление Введение Лекция, 2083.65kb.
- Лекция введение в экологию (В. И. Торшин), 1146.79kb.
- Конспект лекций н. О. Воскресенская Москва 2008 Оглавление: Лекция Введение в дисциплину, 567.5kb.
- План лекций педиатрический факультет 1 семестр 1 лекция. Введение в анатомию человека., 216.63kb.
- Сидоров Сергей Владимирович Планы лекций Введение в профессионально-педагогическую, 19.81kb.
- Русской Православной Церкви и их особенности. 22 сентября лекция, 30.24kb.
- План лекций: Лекция №1. Введение в тему, общие сведения. Введение, 99.54kb.
Лекция № 1
ВВЕДЕНИЕ
Одной из основных проблем развития современного производства является надежное обеспечение энергетическими ресурсами. В связи с увеличением топливных энергетических ресурсов и повышения их стоимости, актуальными стали проблемы повышения эффективности использования топливных энергетических ресурсов и загрязнение окружающей среды. Главный путь решения этих проблем заключается в эффективности и рациональном использовании энергетических ресурсов и всестороннее применение энергосберегающих технологий. В настоящее время более 90% энергии приходится на ископаемые органические топлива: уголь, нефть, природный газ. Кроме выбросов углекислого газа в атмосферу, топливо, сжигающее установки, производят тепловое загрязнение (выбросы нагретой воды и газов), химические загрязнения (выбросы оксидов серы и азота), выбросы золы и сажи - все это создает серьезные проблемы. Экономические факторы, также заставляют увеличить степени использования топлива. Коэффициент использования топлива в промышленности не превышает 30-35% . Очевидно, что гораздо эффективнее разрабатывать совершенные технологические процессы, позволяющие снизить расход топлива, чем строить новые топливо - добывающие предприятия, тем более что запасов нефти осталось на 50 лет, газа - 150 лет.
Теплотехника - это наука и отрасль техники, изучающая методы получения и использования теплоты. Изучает способы преобразования теплоты в другие виды энергии, в том числе в механическую работу с помощью тепловых машин. Применение теплотехники позволяет изучить процессы, протекающие в тепловых машинах, превращение теплоты сгорания топлива в энергетических установках в другие виды энергии. Повысить эффективность использования топлива и ликвидировать отрицательные факторы данной деятельности человека. Теплота генерируется в топках котельных установок; камерах сгорания тепловых двигателей путем сжигания органического топлива; в ядерных реакторах; используется теплота земных недр и излучения солнца. Теплота используется во всех областях деятельности человека.
Различают два направления использования теплоты:
- технологическая
- энергетическая
При технологическом использовании, теплота необходима для направленного изменения свойств различных тел (расплавление металла, изменение структуры материалов, ускорение течения процессов и большинства химических процессов)
При энергетическом использовании, теплота преобразуется в механическую работу с помощью тепловых машин с последующим преобразованием в электрическую и другие виды энергии .
Тепловыми машинами называется устройство, в котором тепловая энергия (теплота сгорания топлива) преобразуется в механическую работу. Тепловые машины используют как правило природные энергетические ресурсы (продукты нефтехимии, уголь, ядерное топливо, солнечную энергию и др.) КПД тепловых машин не превышает 45% . Тепловые машины подразделяются на
- поршневые двигатели;
- роторные двигатели;
- газовые турбины;
- реактивные двигатели.
По способу подвода теплоты для нагрева рабочего тела тепловые двигатели подразделяются на:
- двигатели внутреннего сгорания (ДВС)
- двигатели внешнего сгорания (двигатель стирлинга)
ДВС - это тепловой двигатель, внутри которого происходит сжигание топлива и преобразование частей выделившейся теплоты в механическую работу. Термин ДВС применяют преимущественно к поршневым двигателям
Классификация
Теплотехника состоит из 3 основных разделов:
1. Термодинамика.
В зависимости от круга рассматриваемых вопросов и цели исследования, термодинамику делят на физическую (общую), химическую, техническую. В физической дается представление об основах термодинамики и закономерностях превращения энергии в разнообразных физических явлениях. Химическая изучает приложение термодинамических положений явления, в которых процессы обмена энергии, сопровождаются изменением химического состава участвующих тел.
Техническая термодинамика - это наука изучающая применение законов термодинамики процессов взаимного превращения теплоты и работы.
2. Теория теплообмена.
Рассматривает виды теплообмена и способы теплопередачи. Принцип действия и устройство теплообменного аппарата, позволяет выполнить расчет теплообменного аппарата и тепловой изоляции.
3. Промышленная теплотехника.
Рассматривает использование теплоты в различных отраслях народного хозяйства, исследует различные виды топлива и особенности процесса горения. Принцип действия и устройства теплоэнергетических установок ( котельных, паровых и газовых турбин, ДВС ), позволяет выполнить расчет теплоэнергетической установки системы теплоснабжения, промышленных предприятий и коммунального хозяйства Базой изучения теплотехники является физика и математика.
Лекция № 2
ПРЕДМЕТ ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА И ЕГО МЕТОДЫ
Термодинамика - это наука о превращении тепловой энергии в другие виды энергии. Применение закономерности термодинамики позволяет исследовать различные физические и химические явления, обусловленные превращением тепловой энергии. А также предсказывать свойства веществ, при изменении их термодинамического состояния. Слово «термодинамика» происходит от греческого therme -тепло , dinamis -сила. Название науки возникло в начале 19 века. В настоящее время слово «термодинамика» трактуется как «наука о силах связанных с теплотой». Термодинамика основана на 3 экспериментально-установленных законах (начало).
О закон- Это закон теплового равновесия между телами. Согласно этому закону изолированная термодинамическая система стремится к состоянию термодинамического (теплового) равновесия и после его достижения не может самопроизвольно из него выйти .
1 закон является по существу законом сохранения энергии, применительно к термодинамическим процессам. Согласно этому закону не возможен процесс возникновения или исчезновения энергии .
2 закон определяет направление течения реальных термодинамических процессов. Согласно этому закону не возможен процесс, позволяющий полностью превратить теплоту в работу.
Термодинамический метод исследования основан на законах термодинамики и представляет собой логическое и математическое развитие.
Объект исследования термодинамики называют термодинамическими системами, в некоторых случаях - рабочим телом.
Одна из особенностей термодинамики состоит в том, что система (тело) противопоставляется всем другим телам, которые называются окружающей средой.
Термодинамика построена дедуктивно, т.е. частные выводы получены из общих законов.
Термодинамика - это наука феноменологическая, она рассматривает систему (вещество) как сплошную среду и использует для ее исследования макро параметры, такие как давление, объем, температуру.
При изучении физических явлений существует другой подход статистический, им занимается МКТ. Во 2-ом случае вещество рассматривается как совокупность очень большого количества микрочастиц, и о состоянии вещества судят по характеру их движения. Термодинамическая теория и МКТ могут использоваться для исследования одних и тех же физических явлений. Они стоят рядом и дополняют друг друга. Температуру термодинамической системы можно определить.
Достоинства термодинамической теории
- Не использует гипотезы о микроскопическом строении вещества
- Закономерности термодинамики достоверны в той же мере, в какой достоверны ее основные законы (т.е. законы природы)
МКТ обладает достоинством большей наглядности (давление газа зависит от силы удара микрочастиц о стенки сосуда, т.е. от скорости микрочастиц)
Основная задача термодинамики, отыскивание методов взаимного превращения теплоты и работы, т.е. повышение КПД.
ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА
Термодинамическая система - это совокупность макроскопических тел, являющихся объектом изучения и обменивающихся энергией, как друг с другом, так и с окружающей средой. Тела, не входящие в состав изучаемой системы, называют окружающей средой.
Макроскопические тела - это тела, имеющие массу сравнимую с массой окружающих нас предметов и тел. Эти тела состоят из микрочастиц.
Термодинамическая система открытая, если она может обмениваться с внешней средой не только энергией, но и веществом.
Термодинамическая система называется закрытой , если она не обменивается с окружающей средой веществом ,т.е. ее состав остается неизменной.
Термодинамическая система называется изолированной, если она не обменивается с окружающей средой не энергией, не механической работой.
Замкнутая термодинамическая система - это термодинамическая система изолированная в механическом смысле, т.е. не осуществляет обмен энергии с окружающей внешней средой при совершении работы. Особенностями термодинамики является изучение равновесных состояний.
Равновесное состояние - это такое состояние термодинамической системы в котором характеризующие ее параметры не изменяются со временем, при условии постоянных внешних условий, а также в системе отсутствуют потоки энергии или вещества. Перейдя в равновесное состояние, при неизменных внешних условий, система остается в нем сколько угодно долго.
Вывести термодинамическую систему из равновесного состояния можно с
помощью воздействия из вне. Если система изолирована от окружающей среды, то с течением времени система перейдет в равновесное состояние Термодинамический процесс - это переход термодинамической системы из одного состояния в другое, т.е. любое изменение состояние системы, при котором изменяется хотя бы один из ее термодинамических параметров.
Адиабатный процесс - это процесс, который без сопровождения теплоты между окружающей средой и каким-либо телом.
Циклический - при нем система возвращается в исходное состояние.
Изотермический (T=const)
Изохорный (V=const)
Изобарный (P=const)
Лекция № 3
ОСНОВНЫЕ ПАРАМЕТРЫ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ.
Основой термодинамического метода исследования является определение состояний термодинамической системы, характеризующих с помощью термодинамических параметров. Основными параметрами является давление, температура и удельный объем. Параметрами состояния термодинамической системы называются величины, характеризующие состояние ТДС.
Давление - это физическая величина равная отношению силы F равномерно распределенной по поверхности к площади S поверхности расположенной перпендикулярно силе Р = F/S [Па]
1 Па=1Н/1м2
Па = Давление вызываемое силой 1Н равномерно распределенной по поверхности площадью 1м2.В технике используют кратные и дольные единицы
1кПа=103Па
1МПа=106Па
Кроме того в технике используют внесистемные единицы давления. Техническая атмосфера
1аТ=1 кгс/см2=735 мм рт.ст.=10 м вод.ст.=0,981 бар = 0,981*105Па
Физическая атмосфера 1аТм=760мм рт.ст.=1,013*105Па
Удельный объем - физическая величина равная отношению объема вещества к его массе или иначе - это объем к единице массы.
Удельный объем v=[м3/кг]
Физический V=[m3]
Величиной обратной удельному объему является плотность ρ, т.е. масса к единице объема [кг/м3] ρ =m/V
Температура - есть мера интенсивности теплового движения молекул и характеризует тепловое состояние тела. Считается, что тела имеют одинаковую температуру, если между ними не существует теплообмена, т.е. если они находятся между собой в тепловом равновесии. Согласно МКТ средние скорости движения молекул будут равны. Разность температуры тел определяет меру отклонения от теплового равновесия. В этом и состоит нулевой закон термодинамики, который вводит понятие теплового равновесия между телами, а величиной, характеризующей это равновесие, является температура, в системе Си используется две температурные шкалы.
1 .Международная практическая температура
Шкала Цельсия. Температура обозначается t. Измеряется °С . Основными точками отсчета является:
а) тройная точка воды, температура в этой точке равна нулю при нормальном атмосферном давлении
Рн = 760 мм рт.ст. В этой точке в тепловом равновесии находятся все 3 фазы: твердая
( лед), жидкая (вода), газообразная (пар).
б)Точка кипения = 100 ° С
Разность показания температур в двух этих точках деленная на 100,представляет собой 1°С.
2.Термодинамическая шкала температур основана на 2 законе термодинамики. Иначе ее называют абсолютной шкалой температур. Обозначается Т измеряется в К.
За ноль принята температура абсолютного нуля. При абсолютном нуле прекращается
тепловое движение молекул. Соотношение между температурами
Т=273,15 + t . Для измерения температур используют свойства тел (термометрических веществ). Изменяют свои физические свойства при нагревании или охлаждении. Прибор для измерения температур называется термометр.
Уравнение состояния термодинамической шкалы.
Уравнение состояния, связывающее давление, объем и температуру, называется термическим уравнением состояния. f(P,v,T)=0
Состояние термодинамической системы полностью определяется любыми двумя из трех величин.
Например: P=f (T,v); Т = f(P,v); v= f (T,P)
В термодинамике данные зависимости принято обозначать графически в прямоугольной системе координат.
Точка на плоскости (P;v) будет отображать определенное состояние термодинамической системы.
Множество точек будет отображать термодинамический процесс. Например: P=f (v ;Т)
Вопрос получения уравнения термодинамической системы очень сложен и полностью не решен даже для газов.
Идеальный газ.
При изучении свойств рабочих тел в термодинамике прибегают к упрощению и вводят понятия идеальный газ. Идеальным называется газ в котором:
- Можно пренебречь силами взаимодействия между молекулами (силами притяжения)
- Объем молекул мал по сравнению с объемом занимаемым газом и им пренебрегают
- Столкновение молекул между собой и со стенками системы являются абсолютно упругими .
В реальных газах молекулы занимают некоторый объем, и между ними
действуют межмолекулярные силы.
Однако свойства реального газа приближаются к идеальному газу с повышением температуры и понижением давления. Во многих случаях реальные газы (воздух, азот), в условиях их практического использования в тепловых машинах, по свойствам близки к идеальному газу и с достаточной точностью подчиняются законам для идеального газа , поэтому значительное место в термодинамике отводится изучению идеального газа .
Уравнение состояния идеального газа
Соотношение связывающее давление газа с его температурой МКТ, имеет вид: P= n·k·T
n-число молекул в единицу объема n=N/V=۷NA/V
Вывести уравнение состояния идеального газа на основе МКТ
PV=۷RT P=۷NA/ V * КТ
PV=۷NAkT
R=NA k
PV=۷RT - Уравнение состояния идеального газа
Уравнение состояния идеального газа в термодинамике
Экспериментально в 1834г. Б. Клапейроном в результате обобщения законов: Бойля Мариота PV=const, закон Гейлюсака V/T=const ,закон Шарля P/T=const
было получено уравнение состояния для газов близких по свойствам к идеальным. Уравнение устанавливает, что для данной массы газа отношение произведения давления и объема к температуре есть величина постоянная .
PV / Т= const = R'
R' ~ удельная газовая постоянная [Дж/кг*К]
R'вода=287 Дж/кг*К
R'н2=4124Дж/кг*К
Физический смысл удельной газовой постоянной состоит в том, что она численно равна работе расширения одного кг газа при нагревании его на 1 К , при постоянном давлении
PV= R'T- Уравнение Клапейрона для 1 кг газа.
Если левую и правую часть умножить на массу т, то получим уравнение Клапейрона для произвольной массы газа . PV=m R'T
Уравнение Менделеева Клапейрона
1874 г. Менделеев на основе уравнения Клапейрона и закона Авогадра вывел уравнение состояния, которое не содержит индивидуальных для каждого газа константы R' Менделеев ввел в уравнение Клапейрона количество веществ и согласно закону Авогадра одно количество различных газов при одинаковых условиях ( т.е. при одинаковом давлении и температуре) занимают одинаковый объем . Так при НУ Ро=1,013 МПа ,ТО=273,15 К объем одного моля любого газа составляет Vm =22,41 л/моль = 22,41 * 103м3/моль
Таким образом Менделеев получил значение газовой постоянно на основе уравнения Клапейрона .
R'μ=R=P0Vm/T0
R=8,3143Дж/мoль*K
μ =м/моль
Таким образом получено значение R постоянная для 1 моля газа.
Величины R с полярностью ДЖ/моль*К называется молярной газовой постоянной или универсальной газовой постоянной. Физический смысл R состоит в том, что она равна численно работе расширения 1 моля газа при нагревании его на 1 К ,при постоянном
давлении
PVm= RT |*۷
PV= ۷RT-Уравнение Менделеева Клапейрона
V-m3
۷-моль ۷= m / μ
R - Дж / моль*К
Пользуясь уравнением состояния можно получить выражение для определения неизвестного параметра при переходе системы из одного состояния в другое, если известны значения других параметров
P1V1/T1=P2V2/T2
V2=P1V1T2/T1P2
Лекция № 5
Внутренняя энергия, способы изменения передачи энергии Теплота и работа. Работа изменения объема
Как показывает опыт, тела участвуя в термодинамическом процессе обмениваются между собой энергией , в результате энергия одних тел возрастает , а других уменьшается . Передача может происходит разными способами для технической термодинамики важны 2 способа :
- передача энергии в виде теплоты
- в виде механической работы
Как правило при прямом термодинамическом процессе происходит передача теплоты рабочему телу, а затем данным рабочим телом совершается работа. Внутренняя энергия
Тело в любом состоянии обладает внутренней энергией, величина которой зависит от состояния рабочего тела и складывается из следующих видов энергии:
1. внутренней кинетической энергией молекул тела, Зависит от поступательного, вращательного и колебательного движения молекул, т.е. от температуры.
2. Внутренней потенциальной энергией. Зависит от сил межмолекулярного взаимодействия, расстояние между молекулами , т.е. от удельного объема и давления .
Внутренняя кинетическая и потенциальная энергия в сумме составляет полную внутреннюю энергию тела. Таким образом внутренняя энергия зависит от температуры , давления , удельного объема тела .
Внутренняя энергия U [Дж]
Удельная внутренняя энергия u [Дж/кг]
u = f (p, v, T)
U=f (P, V, T)
С помощью уравнения состояния внутреннюю энергию можно определить по двум из трех термодинамических параметров
U=f1 (v, T)
U = f2 (v, P)
U = f3 (T, P)
В МКТ внутренняя энергия определяется по следующей формуле
U= i/2 ·۷RT=i/2·Pv
۷=m/ μ
i - число степеней свободы молекул газа
i=3 для 1 атомного
i=5 для 2 атомного
i=6 для много атомовного
Являясь функцией параметров состояния внутренняя энергия таким образом сама является параметром состояния, и следовательно характеризует состояние термодинамической системы( рабочего тела), таким образом изменяется внутренняя энергия , не зависит от характера процесса , т.е. от промежуточного состояния системы , а полностью определяется и конечным ее состоянием .
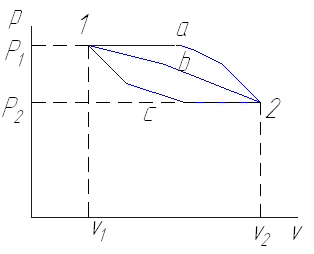
Для процесса а,b,с изменение внутренней энергии будет одинаково.
2
ΔUa= ΔUb= ΔUc= ∫dU=f2(P2v2)-f1(P1 v1)=U2-U1 = ΔU
1
Способы изменения и передачи энергии
- Представляет из себя передачу энергии в форме теплоты. Такая
передача энергии происходит между телами, имеющими различную
температуру и приведенных в соприкосновение или расстояние
электромагнитных волн (тепловое излучение). Количество
переданное данным способом, энергии называется количеством
теплоты. Теплота как и любая энергия в системе CU измеряется в Дж. Обозначается Q или q (Дж/кг). Подведенная к системе теплота
считается положительной , отведенная отрицательной .
- Передача энергии в форме работы.
Количество переданное данным способом энергии называется
работой . Передача энергии происходит при перемещении тела или
его части в пространстве . Для передачи энергии данным способом
тело должно либо двигаться в силовом поле(гравитационное, электромагнитное) , либо изменить свой объем(работа расширения).При передачи телом энергии в форме
работы тело затрачивает работу (совершает работу). Совершенная
телом работа, считается положительной, а работа совершенная над
телом отрицательная .
Работа обозначается L (Дж), ℓ (Дж/кг)
Теплота и работа является формами передачи энергии, поэтому
нельзя говорить, что тело обладает некоторым запасом теплоты либо
работы. Различие между теплотой и работой состоит в том, что
является различными формами передачи энергии. Теплота является
формой передачи энергии между телами на молекулярном уровне,
без видимого движения тел и представляет собой совокупность
микро - физических процессов.
Работа - это передача энергии за счет макро процесса. При этом
происходит либо изменение размеров рабочего тела ( расширение
или перемещение части термодинамической системы.
Количество теплоты , полученное телом и совершенная телом
работы, полностью зависит от характера процесса и не является
параметрами состояния.
Работа изменения объема.
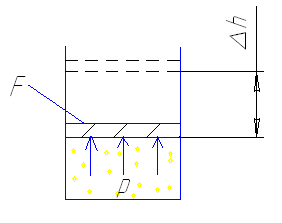
Пусть в цилиндре под поршнем находится 1 кг рабочего тела, производящая на поршень площадью F . При расширении газ совершает работу против сил внешней среды, передавая ей при этом энергию. При сжатии газ воспринимает работу совершенную внешней средой.
Работа, совершенная рабочим телом против действия внешних сил (при расширении), или внешними силами на рабочее тело при сжатии называется работой изменения объема.
При некотором перемещении поршня Δh , работа Δℓ, производимая рабочим телом (считая p=const) равна
Δℓ = р· F· h ,
т.к. F·Δh=Δv
Δℓ =p·Δv
Для некоторого произвольного процесса 1-2
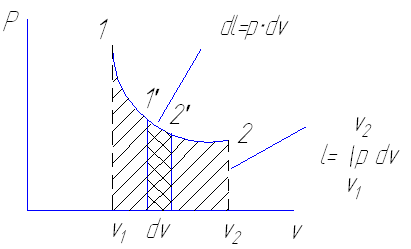
В результате интегрирования уравнения работы в пределах от состояния 1 и 2 получим работу для процесса. Вычисление работы возможно лишь тогда, когда известна функциональная связь между давлением и объемом . P = f(v,T)
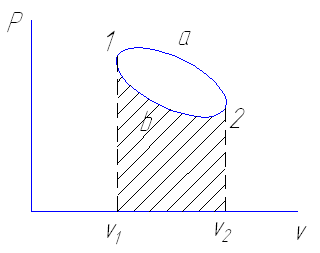
Если взять два процесса 1 а 2 и 1 в 2 протекающие между начальными и конечными расстоянием, то работа в них будет различна. Площади изображающие эти работы, также различны.
ℓ1 а 2> ℓ1 b 2
следовательно между заданными состояниями величина работы изменения
объема зависит от характера процесса .
Работа изменения объема является функцией процесса , и характер
процесса полностью определяет численные значения работы .
L=m ℓ
Лекция № 6
Теплоемкость
Теплоемкостью называется количество теплоты , которое необходимо подвести или отнять от тела для изменения его температуры на 1° . Обозначается с [ Дж/К]
с = Q/ ΔT
Определенно экспериментальным путем и приводится в справочниках. Зная значение теплоемкости, можно вычислить количество теплоты, которое необходимо подвести к телу для изменения его температуры от Т1 до Т2 Q=cΔT=C(T2-T1)
Теплоемкость зависит от нескольких факторов
1) от характера процесса при которых подводиться или отводиться теплота. При экспериментальном определение теплоемкости рассматривают 2 процесса:
а) протекающий при постоянном объеме (Cv)
б) протекающий при постоянном давление (Ср)
Связь между Cv и Ср установил немецкий ученый Юлиус Майер.
Уравнение Майера: Cp=Cv+R
R-газовая постоянная
Ср в процессе с постоянным давлением всегда больше теплоемкости Cv в
процессе с постоянным объемом на величину R
- v=const
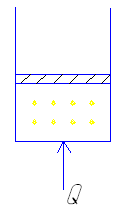
Подведенная при постоянном объеме теплота расходуется только на изменение внутренней энергий dU, так как работа в этом процессе равна нулю. Cv=Q=dU
б) p=const
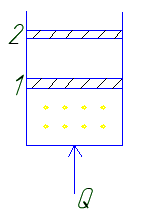
В этом случае некоторое количество теплоты идет на совершение работы L=p ΔV Q=Cp=dU+L
Поэтому для изменения температуры рабочего тела на 1° при p=const требуется большее количество температуры, чем при постоянном объеме v=const и следовательно Ср >Cv
Из уравнения Майера хорошо видно, что газовая постоянная R имеет физический смысл работы расширения газа при нагревание его на 1 К при постоянном давлении. отношение теплоемкости к процессам с v=const и p=const имеет роль в термодинамике.
Cp/CV=К и входит в формулу для адиабатного процесса.
2) от температуры c=f(T)
Т1
Q=∫ cdT
T2
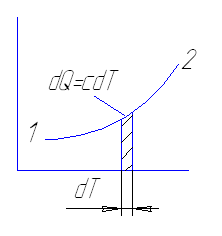
Функция c=f(T) используется для определения количества
подведенной или отведенной теплоты, которая численно равна
площади под характерной 1-2. При приближенных расчетах значением
пренебрегают, берется среднее значение теплоемкости в данном температурном расчете.
Q=Cq(T2-T1)
В зависимости от способов определения количества рабочего тела
используют теплоемкости :
Cv , Ср теплоемкость одного кг вещества [Дж/кг*К ]
C'v, C'p-объемная теплоемкость [Дж/м3*К ]
μCv , μСр молярная теплоемкость, теплоемкость 1 моля вещества [Дж/моль*К ]
Лекция № 7
Первый закон термодинамики
Принцип эквивалентности теплоты и работы
Первый закон термодинамики - это частный случай общего закона сохранения энергии. Выражен в применении к механической энергии и теплоте.
Он устанавливает, что теплота и работа могут взаимно преобразовываться в определенном количественном соотношении между собой. Эквивалентность теплоты и работы по сути представляют собой первый закон термодинамики. Ломоносов 1748 г. высказал фундаментальную мысль о всеобщей связи. Он сказал: «Сколько к одному прибавится энергии, столько же отнимется от другого». Высказался о взаимосвязи механического движения и тепловыми явлениями.
1839г. Юлиус Майер опубликовал свою первую работу о сохранении энергии.
1843г. английский физик Джеймс Джоуль опубликовал результаты своей многолетней работы по установлению механического эквивалента теплоты. Так же в его опытах было доказано, что изменение внутренней энергии не зависит от того, каким образом термодинамическая система перешла из одного состояния в другое, а определяется только начальным и конечным состоянием системы. Опыт Джоуля
В опыте Джоуля механическая (потенциальная) энергия грузов преобразовалась во внутреннюю работу воды в тепло изолированном сосуде (происходило нагревание воды)
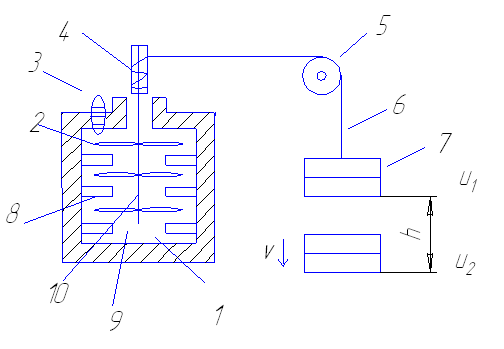
1 -сосуд Джоуля
2-лопатки
3-градусник
4-шкив
5-подвижный блок
6-трос
7-набор грузов
8-перегородки
9-вода
10-деревянная ось
Воду, находящуюся в сосуде с изолированными стенками перемешивали лопатками, насаженными на деревянную палку (нетеплопроводная). Были установлены перегородки, не позволяющие воде приобретать скорость вращения. Благодаря этому по окончании вращения лопаток потоки в воде быстро затухали и система приходила в состояние равновесия. Происходил адиабатный процесс. Теплообмен с окружающими телами отсутствовал, т.к. внешнее давление и объем воды были постоянными , то температура воды полностью определяла состояние термодинамической системы. Зная высоту с которой опускается гиря и ее скорость в нижней точке, можно вычислить изменение механической энергии системы.
L=mgh-mv2/2
Удалось экспериментально определить, что для адиабатного перехода системы из определенного начального состояния в определенное конечное, всегда требуется одинаковая работа. Работа совершенная теплоизолированной системой при переходе из первого состояния с внутренней энергией U1 во второе состояние с внутренней энергией U2.
L12= U1- U2
Данное начало выражает первое начало термодинамики для адиабатного процесса. В опыте Джоуля силы трения совершали положительную работу, поэтому внутренняя энергия (температура) возрастала, а механическая работа грузов уменьшалась.
Таким образом
U2= U1+ L12
Джоуль установил следующее соотношение между механической энергией и теплотой (механический эквивалент теплоты)
1 кал=4,1868 Дж ~ 4,19 Дж
В международных единицах СИ теплота и работа измеряется в (ДЖ)
1Дж=1Н·м=0,9806Дж
1кал=4,19 Дж=4,27 Н·м
Работа совершенная в единицу времени называется мощностью
1Вт=1Дж/1с
1к Вт ч=3600кДж
1л.с.=735,5Вт
1л.бензина=107 Дж
1м3 бров=109 Дж
разряд молнии=1016 Дж
атомная бомба=1014 Дж
Первый закон термодинамики.
В общем случае внутренняя энергия тела может измеряться как за счет
теплообмена с окружающими телами, так за счет совершения работы
внешними силами или самим телом. Является обобщением огромного
количества фактов и формируется следующим образом.
В зависимости от области применения первый закон термодинамики имеет 2 формы:
1) Изменение внутренней энергии системы dU при ее переходе из одного состояния в другое равно сумме количества теплоты Q подведенного к системе из вне и работы внешних сил L вн
dU=Q+Lвн
2) Количество теплоты Q подведенная к системе идет на изменение ее внутренней энергии dU и на совершение системы работы над внешними силами L вн
Q= dU + Lвн
Lвн= -L работа системы
Из первого закона термодинамики следует 3 вывода:
- Все виды энергии могут взаимно превращаться в строго равном друг
другу количестве, т.е. энергия не возникает из ничего и не исчезает, а
переходит из одного вида в другой.
- Невозможно построить такую машину с помощью которой можно
получить полезную работу без затрат энергии из вне. Подобное
устройство называется вечным двигателем. Построение и работа
которого в соответствии с 1 законом термодинамики не возможна.
- Внутренняя энергия замкнутой изолированной системы не изменяется
dU=Q + Lвн
dU=O
1 закон термодинамики для изопроцессов
1) Изохорный процесс идеального газа (V=const, dV-0)
Из уравнения Клапейрона pv=RT следует
Р / Т = const
P1/T1=P2/T2
P1 / Р2=Т1 / Т2
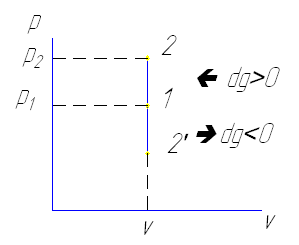
dg>0; dv=0; dp>0; dT>0
dg<0; dp<0;dT<0
Q=dU+L
Q=dU
g=du
В процессе 1-2 происходит изохорный процесс увеличения давления при подводе теплоты, при отводе теплоты 1-2' соответственно уменьшение t, давление падает. dv=O
v2
ℓ = ∫ pdv =0
v1
Согласно 1 закону термодинамики изменения внутренней энергии газа при
изохорном процессе происходит только благодаря обмену с окружающей
средой.
dU=q или иначе вся подведенная в изохорном процессе теплота идет на
увеличение внутренней энергии q= dU
Внутренняя энергия равна U=i/2·m/μ·RT
i- число степеней свободы
i1ат=3
i2ат=5
iмн.ат=6
