Методические указания по изучению дисциплины и задания для выполнения контрольных работ для студентов-заочников специальности 1-74 03 01 зоотехния
| Вид материала | Методические указания |
- Методические указания по изучению дисциплины и задания для контрольных и курсовых работ, 725.2kb.
- Методические указания по выполнению контрольной работы для студентов заочников специальности, 559.27kb.
- Задания для выполнения контрольных работ студентов-заочников по дисциплине, 58.66kb.
- Методические указания и контрольные задания для студентов-заочников Читинского лесотехнического, 346.73kb.
- Методические указания по изучению дисциплины и задание для контрольной и курсовой работы, 471.75kb.
- Методические указания по изучению дисциплины и задания для контрольных работ, 1053.88kb.
- Методические указания по выполнению контрольных работ ч. I общие положения, 556.66kb.
- Методические указания по изучению дисциплины и задания для контрольной работы для студентов-заочников, 398.39kb.
- Методические указания к изучению дисциплины и выполнению контрольной работы для студентов, 1280.73kb.
- Методические указания по изучению дисциплины и задание для контрольной работы для студентов-заочников, 328.95kb.
Министерство сельского хозяйства
и продовольствия республики беларусь

главное управление образования, науки и кадров

Учреждение образования
«Белорусская государственная
сельскохозяйственная академия»

Кафедра химии
Органическая
и биологическая химия
Ч а с т ь 1
Методические указания по изучению
дисциплины и задания
для выполнения контрольных работ
для студентов-заочников
специальности 1-74 03 01 – зоотехния
Горки 2005
Одобрено методической комиссией агробиологического факультета 22.03.2005.
Составили: А. Р. ЦЫГАНОВ, И. В. КОВАЛЕВА, И. В. Сучкова.
УДК 547+547.19(072)
Органическая и биологическая химия. Ч а с т ь 1: Методические указания/Белорусская государственная сельскохозяйственная академия; Сост. А. Р. Ц ы г а н о в, И. В. К о в а л е в а, И. В. С у ч к о в а. Горки, 2005. 76 с.
Приведены методические указания по выполнению контрольных работ по органической химии, варианты заданий, рекомендуемая литература и вопросы для самоконтроля при изучении основных тем курса.
Для студентов-заочников специальности 1-74 03 01–зоотехния.
Таблиц 1. Библиогр. 8.
Рецензент М. М. МУРТАЗАЕВ, канд. биол. наук, доцент.
Составление. А. Р. Цыганов,
И. В. Ковалева, И. В. Сучкова, 2005
Учреждение образования
«Белорусская государственная
сельскохозяйственная академия», 2005
ВВедение
Настоящее и будущее научно-технического прогресса всецело определяется стремительным развитием различных отраслей современного естествознания. Среди них одно из ведущих мест по праву принадлежит органической и биологической химии.
Перед работниками сельского хозяйства в области животноводства поставлена сложная задача по увеличению приспособленности животных и реализации генетического потенциала продуктивности. Ускоренное решение этой проблемы может быть достигнуто при широком внедрении в практику животноводства новейших достижений биологической науки, в том числе биохимии. Выяснение обменных процессов в организме животного позволит выработать приемы регулирования, интенсивного выращивания, использования животных. Это связано с тем, что продуктивные и племенные качества животного обуславливаются уровнем биохимических процессов в организме. В связи с этим возрастает значимость изучения органической и биологической химии, так как индивидуальные характеристики животного по взаимосвязи хозяйственных показателей с уровнем в организме (например, в крови) тех или иных органических соединений могут быть использованы как тесты для прогнозирования продуктивности животных. Это, в свою очередь, позволит вести эффективную и целенаправленную селекционную работу.
Таким образом, освоение материала по органической и биологической химии даст возможность студентам углубить знания в области химических дисциплин и тем самым окажет положительное влияние на формирование биологического мышления будущего специалиста-животновода высшей квалификации.
Настоящие методические указания составлены в соответствии с программой курса «Органическая и биологическая химия», утвержденной Главным управлением образования и кадров 26 декабря
2000 г. по специальности С 02.01.00 – зоотехния.
Весь материал в соответствии с программой разбит на отдельные темы. В отдельную тему выделены основные теоретические вопросы, касающиеся особенностей соединений углерода, их многообразия и роли в живой природе. В первой теме даны сведения об основных положениях теории строения органических соединений А. М. Бутлерова, типах химических связей и механизмах реакций. В остальные темы включена характеристика отдельных классов органических соединений. Помимо вопросов органической химии, согласно программы дисциплины, в настоящих методических указаниях рассматриваются две темы статической биохимии: «ферменты» и «витамины». Данные темы предполагают изучение строения, физико-химических свойств и поведение в живом организме ферментов и витаминов. Органическая химия является фундаментом для последующего освоения материала по биохимии животных. Поэтому, чтобы приобрести знания по биологической химии, студенту, прежде всего, необходимо хорошо знать теоретические основы органической химии, строение и свойства органических соединений.
В период лабораторно-экзаменационной сессии по общетеоретическим и труднодоступным для понимания вопросам студентам читаются лекции.
Основной формой учебы студента-заочника является самостоятельная работа с рекомендуемой литературой. Приступая к изучению дисциплины, целесообразно вначале ознакомиться с программой и прочитать весь материал, включенный в программу по учебнику. Для основательного освоения материала рекомендуется конспектировать отдельные положения, формулировки, выводы и тренироваться в написании строения формул органических веществ и уравнений реакций.
После изучения каждой темы необходимо ответить на вопросы для самопроверки, приведенные в методических указаниях. Только после этого можно приступить к выполнению контрольной работы. При необходимости студент может получать на кафедре письменные и устные консультации преподавателей.
В соответствии с учебным планом, до вызова на сессию, студенты зооинженерного факультета выполняют две контрольные работы (одну – по органической химии, другую – по биологической химии).
Вопросы и условия задач контрольной работы студент обязан переписывать полностью и указывать номера задач в соответствии с его шифром.
Если контрольная работа преподавателем не зачтена, то студент выполняет ее повторно, учитывая при этом замечания рецензента. Исправлять и удалять замечания рецензента нельзя. Исправленные и доработанные ответы оформляют в этой же тетради.
Учебный процесс в период сессии состоит из лекций, лабораторных занятий, консультаций, зачета (по органической химии) и экзамена (по биологической химии). Курс лекций и лабораторно-практические занятия проводятся согласно учебному плану.
1. Органическая химия
1.1. Теоретические основы органической химии
Органическая химия – химия соединений углерода. В связи с этим необходимо вспомнить из курса общей химии строение атома углерода и его валентное состояние с различными типами гибридизации (sp3, sp2, sp), особенности σ-, π-связей, которые встречаются в органических соединениях. Уяснить основные понятия органической химии: гомологический ряд, гомолог, углеводородный радикал, функциональная группа, изомерия.
Необходимо основательно разобраться в номенклатуре органических соединений (тривиальной, рациональной, систематической) и научиться давать названия различным веществам по систематической номенклатуре.
В молекулах органических соединений встречаются различные типы связей (ковалентная, электровалентная, водородная, семиполярная), необходимо вспомнить способ образования указанных связей.
Для более полного восприятия и глубокого понимания вопросов курса органической химии следует обратить серьезное внимание на основные положения теории строения органических соединений А. М. Бутлерова:
1. В молекулах соединений существует определенный порядок связи атомов, который и носит название строения.
2. Химические свойства соединения определяются составом и строением его молекул.
3. Различное строение при одном и том же составе и молекулярной массе вещества обуславливает явление изомерии.
4. Химический характер атомов, входящих в молекулу, меняется в зависимости от того, с какими атомами они связаны в данной молекуле.
Это изменение химического характера обуславливается главным
образом взаимным влиянием непосредственно связанных атомов. В настоящее время различают две основные формы такого влияния: индуктивный эффект и эффект сопряжения.
Все химические превращения могут осуществляться в строго определенных условиях (температура, давление, катализатор, растворитель), в значительной мере зависящих от механизма реакции. Под механизмом реакции подразумевают способ разрыва имеющихся валентных связей и образование новых, а также совокупность состояний, через которые проходят реагирующие вещества.
По способу разрыва старых связей и образования новых различают гомолитические и гетеролитические реакции, в зависимости от того, разрываются ли связи «симметрично» или «несимметрично». Объясним более подробно.
(1)

 А• + •В
А• + •ВА׃ В (2) А׃σ- + Вσ+

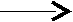
(3) Аσ+ + ׃Вσ-
Механизм (1) называется гомолитическим (радикальным). Образующиеся незаряженные частички А• и •В, имеющие неспаренные электроны, называются радикалами. Радикальный механизм характерен, например, для реакций замещения водорода в молекулах предельных углеводородов.
Механизмы (2) и (3) – гетероциклические (ионные) способы разрыва связей. Ковалентные связи разрываются несимметрично: обобщенная пара электронов передается одному атому, обладающему большей электроотрицательностью.
Частицы, несущие положительный заряд (Аσ+, Вσ+), например Н+, N+O2, H3+O, а также молекулы, имеющие центры с пониженной электронной плотностью (H2SO4, BF3, AlCl3), – называются электрофильными реагентами, а реакции, в которых они участвуют – электрофильными. Примером может служить реакция электрофильного замещения в молекулах ароматических углеводородов.
Частицы, несущие отрицательный заряд (А:σ-, В:σ-) –CN-, –OH-,
–NH2-, HAl, RCOO- и др., а также молекулы, имеющие центры с повышенной электронной плотностью (NH3, NR3), называются нуклеофильными реагентами. Реакции, в которых они принимают участие, – нуклеофильные. Примером может служить щелочной гидролиз галогенпроизводных.
Как правило, электронная плотность в молекулах соединений
располагается несимметрично. Симметричное распределение электронной плотности характерно для соединений с ковалентной неполярной связью (H-H, Cl-Cl). Если же в состав молекулы входят атомы элементов с разной электроотрицательностью, то происходит смещение электронной плотности к атому с большей электроотрицательностью +, -.
Индуктивный эффект (I-эффект) – эффект смещения электронной плотности вдоль σ-связей. Тот атом, который притягивает к себе электронную пару связи, обладает отрицательным индуктивным эффектом (-I-эффект). Например, CH3σ+ Iσ-. Тот атом, который смещает электронную пару связи в сторону другого атома, обладает положительным индуктивным эффектом (+I-эффект). Например, CH3σ- Naσ+. При этом на атомах возникают эффективные частичные долевые заряды, обозначаемые +, -.
Индуктивный эффект может передаваться по цепи атомов с быстрым затуханием:
σ"+ σ'+ σ+ σ- σ+ > σ'+ > σ"+
CH3 CH2 CH2 Cl
π-связи характеризуются большей легкостью смещения электронов, чем σ-связи:
σ+ σ-
CH3CH=CH2 (+I-эффект).
Если в молекуле имеются двойные связи, чередующиеся с простыми, то такие связи называются сопряженными. Например, в молекуле бутадиена-1,3
1 2 3 4
CH2=CH-CH=CH2.
Атомы углерода находятся в состоянии sp2-гибридизации, т. е. имеют по одной негибридной р-орбитали, которые перекрываются не только у первого и второго, третьего и четвертого атомов, но и у второго и третьего, образуя для всех четырех атомов единое π-электронное облако. Таким образом, образуется общая система разделения электронной плотности.
Эффект сопряжения или мезомерный эффект (М-эффект) – это эффект перераспределения электронной плотности в молекуле, происходящий с участием π-орбиталей. В отличие от индуктивного эффекта мезомерный эффект с расстоянием не затухает. Мезомерный эффект принято считать (как и индуктивный) отрицательным, если замести-
тель оттягивает электроны связи на себя (-М-эффект), и положитель-
ным (+М-эффект), если он отдает их в цепь:
Oσ-
C σ+ =C–C C=C-O-CH3
Н
-М – эф. группы С=О +М – эф. группы –О–СН3
Л и т е р а т у р а: [1, с.11-13, 25-82].
Вопросы для самопроверки
1. Приведите электронные конфигурации атома углерода в основном и возбужденном состоянии.
2. Какие виды гибридизации возможны для атома углерода? Охарактеризуйте в каждом случае форму и пространственную направленность атомных орбиталей.
3. Дайте определение σ- и π-связям.
4. Какие частицы называются свободными радикалами? Чем они отличаются от ионов? Приведите примеры органических радикалов.
5. Дайте характеристику основным типам связи в молекулах органических соединений.
6. В чем особенности индуктивного эффекта и эффекта сопряжения?
7. В чем различие между гетеролитическим и гомолитическим способами разрыва ковалентных связей?
Углеводороды
Изучение органической химии необходимо начинать с класса углеводородов. Это объясняется не только тем, что они имеют простой состав, но главным образом тем, что углеводороды являются как бы родоначальниками всех других классов органических соединений.
Углеводороды – класс простейших органических соединений, состоящих из углерода и водорода. Путем замещения атомов водорода различными группами или радикалами из углеводородов можно получить самые разнообразные соединения.
В зависимости от характера строения углеводородного скелета и связи между атомами углерода, углеводороды делятся на предельные, непредельные и ароматические.
В свою очередь соединения перечисленных углеводородов группи-
руются в гомологические ряды, в которых каждый последующий гомолог отличается от предыдущего на группу –СН2–, называемую гомо-
логической разностью. Каждый гомологический ряд объединяет большое количество соединений и имеет свою общую формулу.
По характеру строения углеводородного скелета углеводороды делятся на ациклические (алифатические) и циклические. Ациклические углеводороды имеют открытую неразветвленную или разветвленную цепь:
CH3-CH2-CH2-CH2-CH3 CH3-CH=CH2-CH3
пентан CH3
2-метилбутан (изопентан)
CH3
CH3-C-CH3
CH3
2,2-диметилпропан (неопентан).
В зависимости от наличия в молекуле алифатических углеводородов одинарных и кратных углерод-углеродных связей они делятся на насыщенные (алканы) и ненасыщенные (алкены, алкины и др.).
Циклические углеводороды в зависимости от строения циклов делятся на алициклические (насыщенные и ненасыщенные) и ароматические.





 CH3
CH3циклогексан циклогексен бензол толуол
Общие обозначения и названия наиболее распространенных классов органических соединений, получаемых на основе
углеводородов

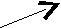 R-Hal** R-OH
R-Hal** R-OHгалогенпроизводные спирты и фенолы
О
R-C R* - H R-NH2




 H амины
H аминыальдегиды
R-C-R O R-NO2
 O R-C нитросоединения
O R-C нитросоединениякетоны OH
карбоновые кислоты
R* - остаток углеводорода (радикал)
Hal** - галогены (фтор, хлор, бром, йод)
Л и т е р а т у р а: [1, с. 115-190].
Предельные углеводороды (алканы)
Предельными углеводородами (алканами) называются соединения, состоящие из атомов углерода и водорода, соединенных между собой только σ-связями и не содержащие циклов. В алканах атомы углерода находятся в степени гибридизации sp3. Общая формула ряда СnH2n+2.
Первые углеводороды гомологического ряда получили случайные названия (тривиальные): СН4 – метан, СН3-СН3 – этан, СН3-СН2-СН3 – пропан, СН3-(СН2)2-СН3 – бутан. В основу названий следующих неразветвленных гомологов были положены греческие числительные, соответствующие числу атомов углерода с окончанием – ан: пентан, гексан и т.д.
Если от молекулы предельного углеводорода отнять атом водорода, то остаток называется алкильным радикалом R: CH3 – метил; С2Н5 – этил; С3Н7 – пропил и т.д.
При выведении структурной формулы углеводородов следует обратить внимание на то обстоятельство, что молекулы их могут быть не только с прямой цепью, но и с разветвленной.
Органические соединения, имеющие одинаковый химический состав, но различную структурную формулу , называются изомерами. Для алканов характерна изомерия углеродного скелета (структурная).
C

 4H10
4H10CH3-(CH2)2-CH3 CH3-CH-CH3
бутан CH3
2-метилпропан (изобутан)
Углеродные атомы, составляющие цепь в молекулах углеводородов и их производных, могут быть первичными, когда они соединены с одним атомом углерода, вторичными – с двумя атомами углерода, третичными – с тремя атомами углерода и четвертичными – с четырьмя.
I
СH3
I II III IV I
C
 H3–CH2–CH–C–CH3
H3–CH2–CH–C–CH3I I
CH3 CH3
I – первичный атом
II – вторичный атом
III – третичный атом
IV – четвертичный атом.
Атомы водорода при таких атомах углерода соответственно называются первичными, вторичными, третичными.
С конца прошлого столетия начала разрабатываться международная систематическая номенклатура, которая претерпела ряд преобразований и в конечном варианте получила название номенклатура ИЮПАК (международный союз по чистой и прикладной химии). Согласно этой номенклатуре, все органические вещества рассматриваются как производные неразветвленно построенных углеводородов. За основу выбирается самая длинная и самая сложная углеродная цепь. Нумерацию начинают с того конца, от которого ближе разветвление. Если разные углеводородные радикалы (алкилы) находятся на равном расстоянии от обоих концов цепи, то нумерацию начинают с того конца, к которому ближе радикал с меньшим числом атомов углерода. Несколько одинаковых заместителей обозначают приставками от греческих числительных: ди-, три-, тетра- и т. д. Цифрами показывается положение этих заместителей в главной цепи. В заключение называется нормальная углеводородная цепь:
1 2 3 4 5
CH3-CH-CH-CH2-CH3 2-метил-3-этилпентан
СH3 CH2
CH3
CH3
1 2 3 4 5
CH3-C-CH2-CH-CH3 2,2,4-триметилпентан.
CH3 CH3
Приступая к изучению химических свойств, следует иметь в виду, что предельные углеводороды при обычных условиях обладают большой химической инертностью. Это объясняется тем, что все σ-связи углерод-углерод и углерод-водород в них весьма прочны. К реакциям присоединения они вообще не способны вследствие насыщенности всех связей атомов углерода. Алканы устойчивы к действию кислот, щелочей и даже таких сильных окислителей как хромовая кислота и перманганат калия. При высоких t алканы сгорают с образованием углекислого газа и воды:
CH4 + 2O2 CO2 + 2 H2O.
Для предельных углеводородов характерными реакциями являются реакции радикального замещения (галогенирование, нитрование, сульфирование), обязательными условиями которых являются облучение ультрафиолетовыми лучами или нагревание.
Классический пример – хлорирование алканов. На первой стадии под влиянием света происходит гомолитический разрыв связи в моле-
куле хлора, и она распадается на 2 радикала:
- Cl : Cl
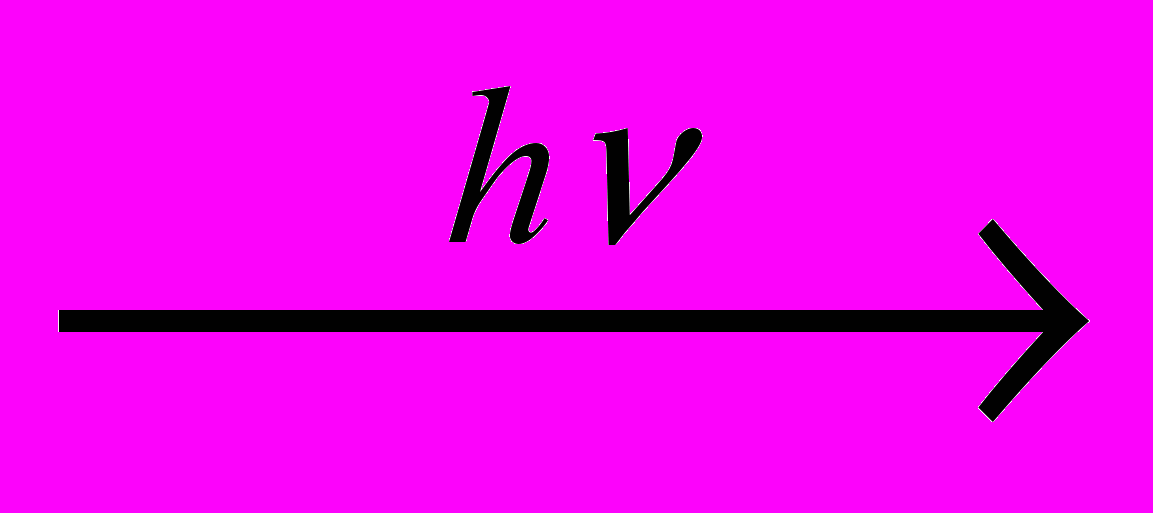 2Cl • инициирование цепи
2Cl • инициирование цепи
Н
 а следующей стадии реакции радикал Cl• атакует молекулу алкана, образуя хлороводород и генерируя алкильный радикал:
а следующей стадии реакции радикал Cl• атакует молекулу алкана, образуя хлороводород и генерируя алкильный радикал:2) CH4 + Cl• HCl + CH3• рост цепи
CH3• + Cl2 CH3Cl + Cl•
Т
 ечение цепной реакции ограничивается процессами обрыва цепи, при которых радикалы, реагируя между собой, выбывают из процесса:
ечение цепной реакции ограничивается процессами обрыва цепи, при которых радикалы, реагируя между собой, выбывают из процесса:3) CH3• + CH3• CH3-CH3
Cl• + Cl• Cl2 обрыв цепи
CH3• + Cl• CH3Cl
Общая схема реакции такова:
CH4 + Cl2 CH3Cl + HCl
хлористый метил (хлорметан)
CH3Cl + Cl2 CH2Cl2 + HCl
хлористый метилен (дихлорметан)
CH2Cl2 + Cl2 CHCl3 + HCl
хлороформ (трихлорметан)
CHCl3 + Cl2 CCl4 + HCl
четыреххлористый углерод (тетрахлорметан).
Бромирование и нитрование проходит селективно только по третичному атому углерода:
Br
CH3-CH-CH3+Br-Br
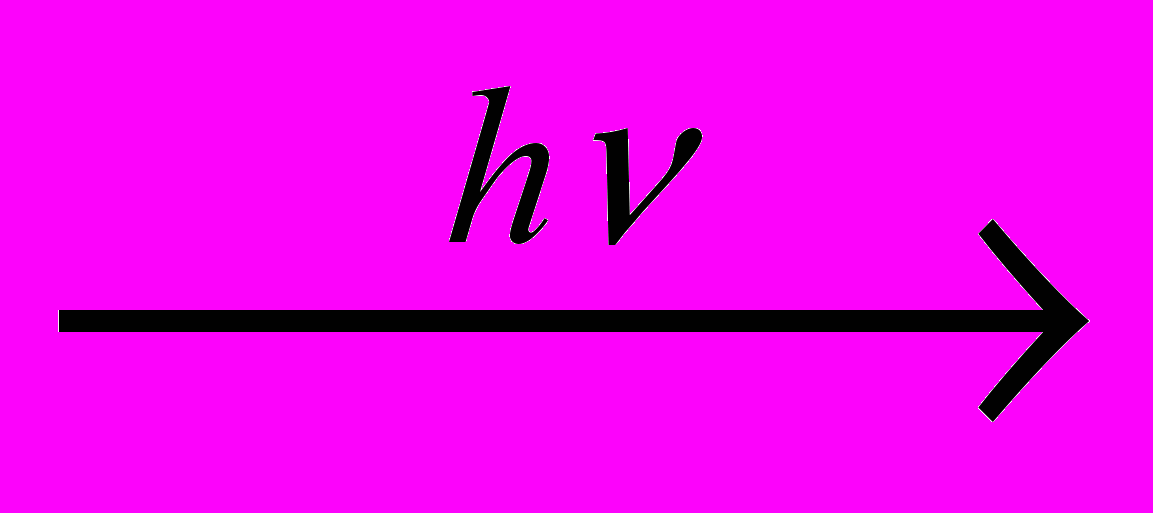 CH3-C-CH3
CH3-C-CH3CH3 -HBr CH3
2-бром-2-метилпропан
NO2
CH3-CH-CH3+HO-NO2
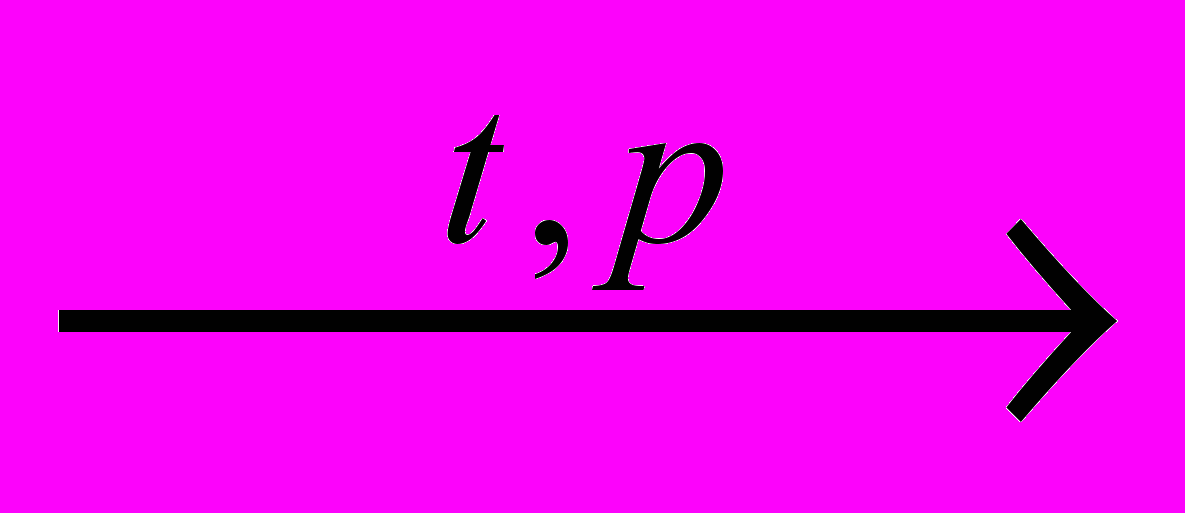 CH3-C-CH3
CH3-C-CH3CH3 - HOH CH3
2-нитро-2-метилпропан
(реакция Коновалова)
Л и т е р а т у р а: [1, с. 120-132].
