Методические указания по изучению дисциплины и задания для выполнения контрольных работ для студентов-заочников специальности 1-74 03 01 зоотехния
| Вид материала | Методические указания |
СодержаниеВопросы для самопроверки Вопросы для самопроверки Карбоновые кислоты Одноосновные непредельные (ненасыщенные) кислоты Вопросы для самопроверки Вопросы для самопроверки |
- Методические указания по изучению дисциплины и задания для контрольных и курсовых работ, 725.2kb.
- Методические указания по выполнению контрольной работы для студентов заочников специальности, 559.27kb.
- Задания для выполнения контрольных работ студентов-заочников по дисциплине, 58.66kb.
- Методические указания и контрольные задания для студентов-заочников Читинского лесотехнического, 346.73kb.
- Методические указания по изучению дисциплины и задание для контрольной и курсовой работы, 471.75kb.
- Методические указания по изучению дисциплины и задания для контрольных работ, 1053.88kb.
- Методические указания по выполнению контрольных работ ч. I общие положения, 556.66kb.
- Методические указания по изучению дисциплины и задания для контрольной работы для студентов-заочников, 398.39kb.
- Методические указания к изучению дисциплины и выполнению контрольной работы для студентов, 1280.73kb.
- Методические указания по изучению дисциплины и задание для контрольной работы для студентов-заочников, 328.95kb.
Вопросы для самопроверки
1. Какие вещества называются галогенпроизводными? Их классификация и номенклатура.
2. Напишите структурные формулы всех изомеров состава C5H11Br. Назовите их по тривиальной и систематической номенклатурам. Что такое изомерия положения и что такое изомерия углеродного скелета? Какие из этих бромистых алкилов являются первичными, вторичными, третичными?
3. Какими способами можно получить хлорэтан? Напишите соответствующие уравнения реакций.
4. Хлороформ, его получение и применение.
5. Напишите схемы полимеризации хлоропрена и хлорвинила.
Напишите уравнения реакций взаимодействия 2-бромпропана с цианидом калия, с металлическим натрием, с аммиаком, со спиртовым раствором щелочи и с ацетатом серебра.
Спирты
Спирты – это производные углеводородов, где одна или несколько
групп –ОН связаны с углеводородным радикалом.
В зависимости от числа гидроксогрупп спирты делятся на одно-,
двух-, трехатомные и т. д. Общая формула ряда предельных одноатомных спиртов CnH2n+1–OH.
В зависимости от того, с каким радикалом связаны гидроксогруппы, спирты делятся на первичные, вторичные и третичные:
R
R–CH2–OH R–CH–R R–C–R
OH OH
первичный вторичный третичный
спирт спирт спирт
В соответствии с номенклатурой ИЮПАК, при построении названия одноатомного спирта к названию соответствующего предельного углеводорода добавляется суффикс –ол.
CH3–CH2–CH2–OH – пропанол-1 CH3–CH–CH3 – пропанол-2
ОН
При определении начала нумерации гидроксогруппа имеет преимущество перед галогенами, двойной (тройной) связью, алкильными радикалами. Следовательно, нумерацию начинают с того конца цепи, ближе к которому находится гидроксогруппа. Если же в молекуле имеются более старшие группы, то группа –ОН получает название «окси».
4 3 2 1
СН2=СН–СН–СН2–ОН – 2-хлорбутанол-1-ен-3
Cl
1 2 3 4 5
СН3–С–СН2–СН–СН3 – 4-оксипентанон-2
О ОН
В ряде случаев для названия спиртов используется тривиальная номенклатура.
Спирты не обладают ярко выраженными кислотными или основными свойствами, но алкильный радикал в молекуле спирта вызывает смещение электронной плотности к атому кислорода. Диссоциация связи С–ОН проходит в большей степени, чем диссоциация связи О–Н, поэтому легче идут реакции замещения гидроксила.
При изучении химических свойств необходимо обратить серьезное внимание на реакцию окисления первичных и вторичных спиртов, на
реакцию образования алкоголятов, гликолятов, глицератов, сахаратов, а также на получение простых и сложных эфиров.
Наряду с этим надо иметь в виду , что химический характер соединения определяется не только реакциями той группы, которая характе-
ризует данный класс органических веществ, но и реакциями связанного с ней радикала. Этим объясняется различие в химических свойствах предельных и непредельных спиртов жирного ряда.
Типичные реакции спиртов:
Na

 R–O-Na+
R–O-Na+H–Hal

 R–Hal
R–Halили PHal3
R–OH PHal5

 R–COORH Rэ–COOR
R–COORH Rэ–COOR180oC
 H2C=CH2
H2C=CH2(к)H2SO4 140oC
C2H5OH
 C2H5–O–C2H5
C2H5–O–C2H50oC
 C2H5–O–SO3H
C2H5–O–SO3HРеакции окисления:
О О
R–CH2OH R–C R–C
H OH
первичный альдегид кислота
спирт
R–CH–R R–C–R
OH O
вторичный кетон
спирт
полное
Спирты CO2 + H2O
сгорание
Для многоатомных спиртов характерны реакции одноатомных спиртов с тем лишь различием, что в реакции могут участвовать как одна, так и более спиртовых групп. Строение глицерина С3Н8О3 доказывается тем, что он образует три ряда производных: моно-, ди- и триметаллические производные (глицераты), кроме того, при действии
избытка галогенводородной кислоты (например НBr) он превращается
в вещество состава С3Н5Br3. Следовательно, в его молекуле находятся 3 гидроксильные группы С3Н5(ОН)3.
Получают глицерин гидролизом жиров, брожением сахаристых веществ, а также синтетическим путем из пропилена.
Окисляясь, глицерин образует глицериновый альдегид и диоксиацетон:
О
СН2ОН СН2(ОН)–СН(ОН)–С
Н
СНОН [O]




CH2OH CH2(OH)–C–CH2OH
O
Вопросы для самопроверки
1. Какие вещества называются спиртами? Классификация спиртов. Приведите примеры.
2. Напишите все возможные изомеры спиртов для состава С5Н12О. Укажите среди них первичные, вторичные и третичные спирты. Назовите соединения.
3. Напишите уравнения реакций взаимодействия пропанола-2 со следующими веществами: металлическим натрием, хлороводородом, уксусной кислотой, пентахлоридом фосфора. Какие соединения образуются при окислении пропанола-2 и при дегидратации?
4. Составьте уравнения реакций взаимодействия этиленгликоля и глицерина с азотной кислотой, бромоводородом и гидроксидом меди (II).
5. Какими методами из жиров получают глицерин? Напишите уравнения реакций.
Фенолы
Фенолы – это производные ароматических углеводородов, в молекуле которых один или несколько атомов водорода в ароматическом кольце замещены гидроксильными группами. В зависимости от количества гидроксогрупп, различают фенолы одноатомные, двухатомные и трехатомные. Если же гидроксильная группа находится в боковой цепи, то такие соединения называют ароматическими спиртами.

 ОН
ОН
 СН2–ОН
СН2–ОНфенол бензиловый спирт
Кроме различия в строении, следует уяснить различие спиртов и фенолов в характере химических реакций. Различие это, с одной стороны, обусловлено электроотрицательным характером фенильного радикала, который придает фенолу кислые свойства. Поэтому фенолы взаимодействуют со щелочами, а спирты этой реакции не дают, так как являются нейтральными соединениями.
С другой стороны, характерным для фенолов является то, что под влиянием гидроксильной группы атомы водорода в бензольном ядре в орто- и параположениях приобретают большую подвижность и большую способность к реакциям замещения.
Бензол при обычных условиях с бромом не реагирует, но в фенолах, при тех же условиях, под влиянием гидроксильной группы, водородные атомы легко замещаются на галогены.
Важнейшие реакции фенолов:

 Na –ONa
Na –ONa
 или NaOH
или NaOHСН3СОCl О



 –O–C–CH3
–O–C–CH3[OH-]

 PCl5
PCl5
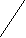 –Сl
–СlOH

 Br
Br
 Br2
Br2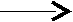
 Br– –OH
Br– –OH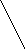 Br
Br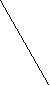



 разб. HO–NO2
разб. HO–NO2 OH + O2N OH
OH + O2N OHNO2

 конц. HO–SO3H
конц. HO–SO3H

 OH + HO3S OH
OH + HO3S OHSO3H
Л и т е р а т у р а: [1, с. 237-242].
Альдегиды и кетоны
К классу оксосоединений относятся органические вещества, содержащие группу –С=О, называемую карбонильной группой или карбонилом. Две валентности атома углерода карбонила могут быть заняты алкильными радикалами R–C–R (кетоны) или алкильным радикалом
О
и атомом водорода R–C–H (альдегиды).
О
Общая формула гомологического ряда предельных алифатических альдегидов и кетонов одинакова CnH2nO.
Называют эти соединения, согласно номенклатуре ИЮПАК, добавляя к названию углеводорода соответствующее окончание –аль для альдегидов и –он для кетонов.
О О
H–C CH3–CH–C CH3–C–CH3.
H CH3 H O
метаналь 2-метилпропаналь пропанон
(формальдегид, (изомасляный (ацетон)
муравьиный альдегид)
альдегид)
Среди альдегидов и кетонов много природных продуктов, они играют важную роль в физиологических процессах и являются очень реакционноспособными соединениями. Их химическая активность обусловлена сильным дефицитом электронов на атоме углерода карбонильной группы.
- - -
+ О + О + О
Н–С RC RC .
H H R
Наиболее характерны для альдегидов и кетонов реакции присоединения, которые нужно уметь написать. Следует сопоставлять химические свойства альдегидов и кетонов, указать реакции, отличающие эти два вида соединений.
Типичные реакции альдегидов и кетонов
CN
HCN C
 OH
OHNa+HSO3- OH
 C
CSO3-Na
 –C=O H2/Kt OH
–C=O H2/Kt OH

 –C
–CH
PCl5 Cl
 –C
–CCl
NH2OH –C=N–OH
Л и т е р а т у р а: [1, с. 264-285].
Вопросы для самопроверки
1. Какие соединения называются альдегидами и кетонами?
2. Назовите по международной номенклатуре уксусный альдегид, ацетон, изомасляный альдегид, изопропилбутилкетон.
3. Какие соединения образуются при гидратации по Кучерову следующих веществ: ацетилена, этилацетилена?
4. При помощи каких реакций можно отличить альдегиды от кетонов?
5. Напишите уравнения реакций уксусного альдегида и ацетона со следующими реагентами: водородом, гидросульфатом натрия, синильной кислотой, гидроксиламином.
Карбоновые кислоты
Одноосновные предельные (насыщенные) кислоты
К классу карбоновых кислот относятся производные углеводоро-
О
дов, содержащие карбоксильную группу –С . У одноосновных
ОН
карбоновых кислот имеется одна карбоксильная группа. Карбоновые кислоты широко распространены в природе, играют важную роль в физиологических процессах, являются продуктами многотоннажного синтеза, находят применение во всех отраслях народного хозяйства.
Номенклатура ИЮПАК разрешает использовать тривиальные названия карбоновых кислот (муравьиная, уксусная, масляная). При наличии заместителей, их положение обозначают буквами греческого алфавита.
По системе ИЮПАК алифатические кислоты называют, прибавляя к названию соответствующего углеводорода окончание –овая кислота. Нумерацию начинают с карбоксильной группы.
О
СН3–С ; CH3–CH–COOH
ОН СН3
уксусная кислота изомасляная кислота
(этановая кислота) (-метилпропионовая кислота)
В водном растворе кислоты диссоциируют на ионы. Под влиянием карбонильной группы подвижность водорода в гидроксиле настолько увеличивается, что он способен к отщеплению в виде протона. Это объясняется смещением электронной плотности под влиянием атома кислорода карбонильной группы; связь между водородом и гидроксильным кислородом ослабляется, и отщепление атома водорода в виде иона облегчается:
-
+ О О
R–C
 R–C + H+.
R–C + H+.OH O-
Химические свойства одноосновных карбоновых кислот обусловлены свойствами карбоксильной группы и связанного с ней углеводородного радикала, а также их взаимным влиянием. Все реакции, в которые вступают кислоты, можно разделить на четыре группы: реакции атома водорода в карбоксиле (1), реакции гидроксильной группы карбоксила (2), реакции связанного с карбоксилом углеводородного радикала (4) и реакции карбоксильной группы в целом (3).
отщепление карбоксила
 3 О
3 О
 R–СН2–––С 2 1
R–СН2–––С 2 1
 4 О––Н замещение Н на металл
4 О––Н замещение Н на металл 2 1
2 1отщепление и замещение ОН-

 замещение Н
замещение НКарбоновые кислоты легко образуют соли ангидриды, хлорангидриды, амиды, нитрилы, эфиры и взаимодействуют с галогенами, которые замещают атомы водорода радикала, находящиеся в -положении.
Важнейшими представителями одноосновных предельных карбоновых кислот являются: муравьиная, уксусная, пропионовая, масляная, валериановая, капроновая, пальмитиновая, стеариновая.
Типичные реакции карбоновых кислот
Ме

 R–COOMe
R–COOMeNaOH

 R–COO-Na+
R–COO-Na+NH3

 R–COO-NH4+
R–COO-NH4+R–OH O

 R–COOH R–C
R–COOH R–C
 O–R
O–RPCl5
 R–COCl
R–COClO
P4O10 R–C
 O + H2O
O + H2OR–C
O
Л и т е р а т у р а: [1, с. 286-300].
Вопросы для самопроверки
1. Дайте определение одноосновным предельным карбоновым кислотам.
2. Напишите уравнения диссоциации пропионовой и масляной кислот.
3. Напишите уравнения реакций взаимодействия пропионовой кислоты с магнием, аммиаком, пентахлоридом фосфора, хлором, этиловым спиртом.
4. Напишите уравнение реакции взаимодействия глицерина с тремя молекулами стеариновой кислоты.
5. Напишите уравнения образования: а) ацетата натрия; б) хлорангидрида уксусной кислоты; в) амида уксусной кислоты.
Одноосновные непредельные (ненасыщенные) кислоты
Одноосновные непредельные карбоновые кислоты содержат в своем составе одну карбоксильную группу, а в радикале имеются одна или несколько кратных (ненасыщенных) связей.
По карбоксильной группе эти кислоты проявляют те же свойства, что и предельные одноосновные карбоновые кислоты: диссоциируют, образуют соли, амиды, галогенангидриды, ангидриды, сложные эфиры.
Ввиду того, что в радикале у непредельных карбоновых кислот имеются кратные связи, они могут участвовать в реакциях гидрирования, присоединения галогенов, галогенводородов, воды, полимеризации.
Следует обратить внимание, что у непредельных одноосновных карбоновых кислот кислотные свойства выражены сильнее, чем у соответствующих предельных кислот. Это объясняется влиянием непредельного радикала на карбоксильную группу.
Важнейшими представителями этой группы кислот являются: акриловая, кротоновая, метакриловая, олеиновая, линолевая, линоленовая кислоты. Необходимо изучить распространение этих кислот в природе и их применение.
Л и т е р а т у р а: [1, с. 307-310].
Вопросы для самопроверки
1. Какие соединения называются непредельными одноосновными карбоновыми кислотами? Привести примеры этих соединений.
2. Напишите уравнение диссоциации акриловой кислоты.
3. Напишите уравнения реакций взаимодействия акриловой кислоты с раствором гидроксида натрия, хлором, хлороводородом, раствором перманганата калия и бромной водой.
4. Напишите уравнение реакции образования сложного эфира из акриловой кислоты и пропанола-2.
5. Напишите уравнение реакции взаимодействия глицерина с тремя молекулами линолевой кислоты.
Двухосновные предельные (насыщенные) кислоты
Двухосновными предельными карбоновыми кислотами называются соединения, в молекуле которых содержатся две карбоксильные группы.
При изучении химических свойств двухосновных кислот, следует уяснить, что они проявляют все реакции карбоксильной группы, но в отличие от одноосновных кислот, они могут образовывать два вида производных – полные, когда в реакцию вступают обе карбоксильные группы, и неполные – когда только одна карбоксильная группа вступает в реакцию. Обратите внимание на то, что двухосновные кислоты неодинаково относятся к нагреванию в зависимости от расположения
карбоксильных групп относительно друг друга.
Двухосновные кислоты диссоциируют последовательно:
HOOC–COOH
 [HOOC–COO]- +H+
[HOOC–COO]- +H+[HOOC–COO]-
 [OOC–COO]2- + H+.
[OOC–COO]2- + H+.Важнейшие представители двухосновных предельных карбоновых кислот – щавелевая, малоновая, янтарная, глутаровая, адипиновая.
Л и т е р а т у р а: [1, с. 301-303].
Вопросы для самопроверки
1. Какие соединения называются предельными двухосновными кислотами? Напишите уравнение ступенчатой диссоциации малоновой кислоты.
2. На примере янтарной кислоты составьте уравнения реакций, характеризующих химические свойства предельных двухосновных карбоновых кислот.
3. Составьте уравнения реакций образования кислого и среднего эфира из янтарной кислоты и этилового спирта.
4. Как получить ангидрид янтарной кислоты?
5. Напишите уравнения реакций декарбоксилирования малоновой и янтарной кислот.
