Методические указания по изучению дисциплины и задания для выполнения контрольных работ для студентов-заочников специальности 1-74 03 01 зоотехния
| Вид материала | Методические указания |
- Методические указания по изучению дисциплины и задания для контрольных и курсовых работ, 725.2kb.
- Методические указания по выполнению контрольной работы для студентов заочников специальности, 559.27kb.
- Задания для выполнения контрольных работ студентов-заочников по дисциплине, 58.66kb.
- Методические указания и контрольные задания для студентов-заочников Читинского лесотехнического, 346.73kb.
- Методические указания по изучению дисциплины и задание для контрольной и курсовой работы, 471.75kb.
- Методические указания по изучению дисциплины и задания для контрольных работ, 1053.88kb.
- Методические указания по выполнению контрольных работ ч. I общие положения, 556.66kb.
- Методические указания по изучению дисциплины и задания для контрольной работы для студентов-заочников, 398.39kb.
- Методические указания к изучению дисциплины и выполнению контрольной работы для студентов, 1280.73kb.
- Методические указания по изучению дисциплины и задание для контрольной работы для студентов-заочников, 328.95kb.
Вопросы для самопроверки
1. В чем заключаются основные положения теории строения органических соединений?
2. Что такое гомологические ряды и их значение в органической химии?
3. Что такое изомерия? Напишите изомеры гептана.
4. Напишите структурные формулы: а) 4-изопропилгептана;
б) 2,3-диметилбутана; в) 2,2-диметил-3-этилоктана.
5. Какие реакции свойственны предельным углеводородам?
Этиленовые углеводороды (алкены)
Углеводороды, содержащие одну π-связь (т.е. двойную связь), называются алкенами или, по первому члену ряда – этилену, этиленовыми углеводородами. Общая формула гомологического ряда CnH2n. Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации.
Название каждого члена гомологического ряда этиленовых углеводородов соответствует названию предельного углеводорода с тем же числом атомов углерода, но только окончание «ан» замещается на «ен».
CH3-CH3 CH3-CH2-CH3
этан пропан
CH2=CH2 CH2=CH-CH3
этен пропен
При названии этиленовых углеводородов с разветвленной цепью углеродных атомов в качестве главной цепи выбирают цепь, включающую двойную связь, даже если эта цепь и не является самой длинной. Нумерацию проводят так, чтобы атом углерода, от которого начинается двойная связь, получал наименьший номер, этим номером и указывают положение двойной связи.
1
CH2
2CH
1 2 3 4 3 4 5 6 7
CH2=CH-CH-CH3 CH3-CH2-CH2-CH-CH2-CH2-CH2-CH3
CH3
3-метилбутен-1 3-пропилгептен-1
В гомологическом ряду алкенов благодаря наличию двойной связи появляется уже несколько видов изомерии:
1) Изомерия углеродного скелета.
2) Изомерия положения двойной связи.
CH2=CH-CH2-CH3 CH3-CH=CH-CH3
бутен-1 бутен-2.
3) Пространственная геометрическая (цис-, транс-изомерия).
Геометрические изомеры различаются пространственным расположением заместителей по отношению к двойной связи. Если одинаковые заместители расположены по одну сторону плоской двойной связи, то изомеры называются цис-, если по разные стороны, то транс-изомерами.
H CH3 H CH3
C C
C C
H CH3 H3C H
цис-бутен-2 транс-бутен-2
Изучая алкены, необходимо усвоить, что их химические свойства определяются прежде всего наличием π-связи. Эти соединения проявляют непредельный характер, т. е. легко вступают в реакции присоединения с разрывом π-связи и образованием насыщенных соединений.
Присоединение водорода к алкенам приводит к образованию алканов:
R-CH=CH2 + H2
 R-CH2-CH3
R-CH2-CH3Галогены присоединяются к алкенам с образованием вицинальных дигалогенпроизводных, т.е. содержащих атомы галогена у соседних атомов углерода:
R-CH=CH2 + Br2 R-CH-CH2.
Br Br
Полярные вещества, такие как галогенводороды, вода и др., в случае несимметричных алкенов присоединяются селективно по правилу Марковникова, т. е. водород присоединяется к более гидрогенизированному атому углерода (связанному с наибольшим числом атомов водорода), а оставшаяся часть молекулы – к менее гидрогенизированному.
+ -
+HCl

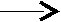 + - R-CH-CH3
+ - R-CH-CH3R
 -CH=CH2 Cl
-CH=CH2 Cl+HOH
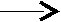 R-CH-CH3
R-CH-CH3OH
Полярность молекулы алкена обусловлена положительным индуктивным эффектом алкильной группы (+I –эф.), сдвигающей π-электронное облако в сторону наиболее обогащенного водородом ненасыщенного атома углерода.
Следует обратить внимание на такие реакции алкенов, как окисление и полимеризация, в результате которых получаются ценные про-
дукты, имеющие большое народнохозяйственное значение.
Л и т е р а т у р а: [1, с. 135-146].
Вопросы для самопроверки
1. Какие виды изомерии характерны для этиленовых углеводородов? Покажите на примере углеводорода C4H8.
2. Напишите структурные формулы следующих соединений: 2-метилпентен-1; 2,3,4-триметилпентен-2, 3-метилбутен-1.
3. Изложите основные химические свойства этиленовых углеводородов и приведите уравнения реакций.
4. В чем заключается правило Марковникова? Напишите уравнение реакции взаимодействия пропена с HBr.
5. Особенности окисления алкенов в нейтральной и кислой средах. Напишите уравнения реакций окисления пропена в нейтральной и кислой средах.
6. Напишите схемы полимеризации этилена, пропилена.
Ацетиленовые углеводороды (алкины)
Ацетиленовые углеводороды относятся к ненасыщенным соединениям, имеют общую формулу CnH2n-2 и характеризуются наличием одной тройной связи между атомами углерода. Тройная связь представляет собой сочетание одной σ-связи и двух π-связей, углерод при этом находится в состоянии sp-гибридизации.
По международной номенклатуре ацетиленовые углеводороды называются алкинами. Каждый член гомологического ряда алкинов называется в соответствии с числом углеродных атомов и добавляется окончание -ин.
HCCH HCC-CH3
этин пропин
Изомерия ацетиленовых углеводородов обусловлена строением углеводородного скелета и местоположением тройной связи:
HCC–CH2–CH2–CH3 HCC–CH–CH3
CH3
пентин-1 3-метилбутин-1
HCC-CH2-CH3 CH3-CC-CH3
бутин-1 бутин-2
Алкины изомерны алкадиенам.
При изучении химических свойств алкинов обратите внимание, что типы реакций для них характерны те же, что и у алкенов: присоединение, оксиление и полимеризация.
У алкинов следует обратить внимание на своеобразие реакции присоединения воды (реакция Кучерова). Разберитесь в механизме этой
реакции. Большое значение имеют реакции присоединения к ацетилену синильной кислоты, спиртов, карбоновых кислот, альдегидов, кетонов, так как продукты этих реакций используются в народном хозяйстве.
В отличие от алкенов для алкинов характерна реакция замещения атома водорода, находящегося у тройной связи, на металлы.
Л и т е р а т у р а: [1, с. 147-154].
Вопросы для самопроверки
1. Какие углеводороды называются алкинами?
2. Напишите структурные формулы следующих соединений: 3-ме-тилпентин-1, этилизопропилацетилен.
3. Напишите уравнения реакций присоединения избытка (одного или двух молей) водорода, хлора, хлористого водорода к ацетилену.
4. Напишите уравнения реакций взаимодействия ацетилена и метилацетилена с водой.
5. Напишите уравнения реакций димеризации, тримеризации ацетилена.
Ди- и полиеновые углеводороды
Диеновыми углеводородами называются углеводороды с двумя двойными связями. Их общая формула CnH2n-2. Названия диеновых углеводородов образуются от названий соответствующих предельных углеводородов с добавлением окончания «диен». Цифрами указывается положение двойных связей:
CH3-CH2-CH2-CH3 ; CH2=CH-CH-CH2
бутан бутадиен-1,3
При изучении диеновых углеводородов обратите внимание на изомерию ненасыщенных связей. В зависимости от местоположения двойных связей диены подразделяются на углеводороды с кумулированными связями (две двойные связи расположены у одного атома
углерода), сопряженными (две двойные связи разделены одной
одинарной), изолированными (двойные связи разделены двумя и более одинарными связями). У диеновых углеводородов имеет место и изомерия углеродного скелета.
При изучении химических свойств диеновых углеводородов обратите внимание на свойства сопряженных диенов. Присоединение к ним реагентов может протекать как в положение 1,4, так и 1,2. В случае присоединения по концам молекулы (1,4) происходит перемещение двойной связи в положение 2,3.
σ+σ-
+HCl

 CH2-CH=CH-CH3
CH2-CH=CH-CH3Cl
1-хлорбутен-2
 CH2=CH-CH=CH2
CH2=CH-CH=CH2 +HCl
 CH2=CH-CH-CH3
CH2=CH-CH-CH3Cl
3-хлорбутен-1
При полимеризации алкадиенов-1,3 образуются каучуки:
nCH2=CH-CH=CH2(-CH2-CH=CH-CH2-)n
бутадиеновый каучук
nСH2=C-CH=CH2 (-CH2-C=CH-CH2-)n
CH3 CH3
изопреновый (натуральный) каучук
Структура изопрена очень распространена в природе и входит во многие природные соединения. Все соединения, углеродный скелет которых построен из изопреновых единиц, соединенных последовательно «голова к хвосту», называют изопреноидами.
 –С–С = С–С–
–С–С = С–С–СH3
голова хвост
В эфирных маслах растений, растительных смолах, бальзамах находятся терпены – непредельные углеводороды состава C10H16, а также сексвитерпены и дитерпены составов C15H24 и C20H32. Широко распространены в природе каротиноиды C40H56, являющиеся провитамином витамина А.
Л и т е р а т у р а: [1, с. 155-165].
Вопросы для самопроверки
1. Какие углеводороды называются диеновыми?
2. Напишите формулы изомеров пентадиена и укажите типы связи
(кумулированные, сопряженные, изолированные).
3. Напишите уравнения реакций взаимодействия бутадиена-1,3 с бромом и бромоводородом.
4. Напишите уравнение полимеризации изопрена. Как используется полученный полимер в народном хозяйстве.
Ароматические углеводороды (арены)

 Характерной особенностью ароматических углеводородов является то, что их молекулы представляют собой плоские циклы, содержащие (4n+2) обобщенных электронов (правило Хюккеля), где n может принимать значения 0, 1, 2, 3 и т.д. Согласно этому правилу, системы, содержащие 2, 6, 10, 14 и т. д. обобщенных р-электронов, являются ароматическими. Важнейшими представителями ароматических углеводородов являются бензол
Характерной особенностью ароматических углеводородов является то, что их молекулы представляют собой плоские циклы, содержащие (4n+2) обобщенных электронов (правило Хюккеля), где n может принимать значения 0, 1, 2, 3 и т.д. Согласно этому правилу, системы, содержащие 2, 6, 10, 14 и т. д. обобщенных р-электронов, являются ароматическими. Важнейшими представителями ароматических углеводородов являются бензол и его гомологи, образующиеся в результате замещения атомов водорода бензольного кольца алифатическими радикалами, например толуол:

 CH3.
CH3. Эти соединения содержат делокализованную систему из 6(р)-электронов (n=1).
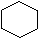
Общая формула гомологического ряда бензола CnH2n-6. Первый гомолог бензола – толуол не имеет изомеров положения, так как все шесть атомов углерода бензольного кольца равноценны. Второй гомолог может существовать в виде четырех изомеров:
CH2-CH3 CH3 CH3 CH3


 CH3
CH3



CH3
CH3
этилбензол ортоксилол метаксилол параксилол
(1,2-диметилбензол) (1,3-диметилбензол) (1,4-диметилбензол)
По химическому составу бензол и его гомологи являются непредельными соединениями. Их непредельный характер не проявляется в типичных реакциях. Они не обесцвечивают бромную воду, устойчивы в обычных условиях к действию окислителей. Для ароматических соединений в основном характерны реакции замещения(1, 2, 3, 4), а не присоединения (5, 6).
Важнейшие реакции бензола

 к. HNO3 NO2 NO2
к. HNO3 NO2 NO2

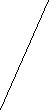
[H2SO4]
NO2
 1 Br2 Br
1 Br2 Br
2
[FeBr3]
 к. HO-SO3H
к. HO-SO3H 

 3 SO3H
3 SO3H
 4 CH3
4 CH3

 CH3Cl
CH3Cl 

 CH3 CH3
CH3 CH35 [AlCl3]
 3H2
3H2 6 кt, t
6 кt, t3Cl2 Cl Cl

hν Cl Cl
Cl Cl
В реакциях замещения производных бензола следует учитывать, что каждый заместитель в бензольном ядре обладает определенным направляющим действием. Все заместители делятся на 2 группы:
1. заместители первого рода, или орто-пара-ориентанты.
К заместителям этого рода относятся –NH2, - OH, алкильные радикалы, галогены. Эти заместители, обладая положительным индуктивным и мезомерным эффектом, увеличивают электронную плотность бензольного кольца (за исключением галогенов), особенно в орто- и параположениях, в которые и направляются электрофильные реагенты.

 CH3 OH
CH3 OHσ - σ- σ- σ-
σ- σ-
+I - эф. гр. –CH3 +M – эф. гр. – OH
Например: при моносульфировании толуола получается 2 изомера:


 CH3 CH3 CH3
CH3 CH3 CH3

 σ- σ+ SO3H
σ- σ+ SO3H + HO-SO3H
+ HO-SO3H -HOH
σ- о-толуолсульфокислота SO3H
n-толуолсуль-
фокислота
2. Заместители второго рода или мета-ориентанты. К ним относятся заместители, обладающие отрицательным индуктивным или мезомерным эффектами:
+ + σ+ σ+ O σ+ O σ+ O
-NH3; -NO2; -SO3H; –C ; –C ; –C .
H R OH
Они оттягивают электронную плотность от бензольного кольца и дезактивируют его. Реакции протекают трудней, чем в бензоле. В наибольшей степени обедняются электронной плотностью орто- и параположения, в метаположениях она несколько выше, что и обусловливает большую реакционную способность мета- положения:
+
NO2
 + +
+ +- -
+
-I-эф. и –М-эф. группы NO2.
Например, при моносульфировании нитробензола получается один изомер нитробензолсульфокислоты:
NO2 NO2



 + НО–SO3H
+ НО–SO3H 
SO3H
м-нитробензолсульфокислота
При окислении гомологов бензола боковые цепи любой длины превращаются в конечном итоге в карбоксильные группы. В результате этого образуются кислоты ароматического ряда, окисление протекает по -атому:



 СH2–CH3
СH2–CH3  СOOH+CO2+H2O
СOOH+CO2+H2Oэтилбензол бензойная кислота
Л и т е р а т у р а: [1, с. 168-189].
Вопросы для самопроверки
1. Классификация ароматических углеводородов.
2. Напишите формулы изомеров ксилола.
3. Какие типы реакций характерны для аренов?
4. На какие группы делятся заместители по характеру своего направляющего действия?
5. Напишите уравнения реакций нитрования и бромирования бензола, толуола.
6. Что такое гексахлоран, как он получается и где применяется?
Галогенпроизводные углеводородов
Галогенпроизводными углеводородов называются органические соединения, образующиеся при замене атомов водорода в углеводородах на атомы галогенов (фтор, хлор, бром, йод).
В зависимости от числа атомов водорода, замещенных галогеном, различают моно-, ди-, тригалогенпроизводные и т. д. Например:
СН3Cl CH2Cl2 CHCl3 CCl4
хлористый хлористый хлороформ четыреххлористый
метил метилен углерод
Галогенпроизводные – продукты многотоннажного производства, среди которых такие ценные вещества, как пестициды, растворители, хладоагенты (фреоны), мономеры для каучуков и пластмасс. Они являются обезболивающими и обеззараживающими веществами. Для названия галогенпроизводных по системе ИЮПАК, нумерацию цепи начинают с того конца, ближе к которому стоит атом галогена.
4 3 2 1
СН3–СН–СН–СН3
СН3 Сl
2-хлор-3-метилбутан
Существует несколько способов получения галогенпроизводных: галогенирование углеводородов, замещение гидроксила на галоген, присоединение галогенов и галогенводородов по кратным связям.
У галогенпроизводных галоген непрочно соединен с углеродом (полярная связь) С+Наl-, поэтому галоген легко отщепляется, замещаясь на различные группы.
Типичные реакции галогеналканов:
Na+OH-
 R–OH+ NaHal
R–OH+ NaHalспирт
R’O–Na
 R–O–R’+NaHal
R–O–R’+NaHalпростой эфир
O
R’C О
 O-Na+ R–C + NaHal
O-Na+ R–C + NaHalО–R
 R–Hal cложный эфир
R–Hal cложный эфир
 К+CN-
К+CN-  R–CN + KHal
R–CN + KHalнитрил
Na+NO2-
 R–NO2 + NaHal
R–NO2 + NaHalнитросоединение
избыт. NH3
 R–NH2 + HHal
R–NH2 + HHalамин
Л и т е р а т у р а: [1, с. 209-221].
