Методические указания по изучению дисциплины и задания для выполнения контрольных работ для студентов-заочников специальности 1-74 03 01 зоотехния
| Вид материала | Методические указания |
СодержаниеДвухосновные непредельные (ненасыщенные) кислоты Ароматические кислоты Вопросы для самопроверки Оксокислоты (альдегидо- и кетокислоты) Амины и аминоспирты Структура углеводов |
- Методические указания по изучению дисциплины и задания для контрольных и курсовых работ, 725.2kb.
- Методические указания по выполнению контрольной работы для студентов заочников специальности, 559.27kb.
- Задания для выполнения контрольных работ студентов-заочников по дисциплине, 58.66kb.
- Методические указания и контрольные задания для студентов-заочников Читинского лесотехнического, 346.73kb.
- Методические указания по изучению дисциплины и задание для контрольной и курсовой работы, 471.75kb.
- Методические указания по изучению дисциплины и задания для контрольных работ, 1053.88kb.
- Методические указания по выполнению контрольных работ ч. I общие положения, 556.66kb.
- Методические указания по изучению дисциплины и задания для контрольной работы для студентов-заочников, 398.39kb.
- Методические указания к изучению дисциплины и выполнению контрольной работы для студентов, 1280.73kb.
- Методические указания по изучению дисциплины и задание для контрольной работы для студентов-заочников, 328.95kb.
Двухосновные непредельные (ненасыщенные) кислоты
Двухосновными непредельными карбоновыми кислотами называются соединения, в молекуле которых имеется две карбоксильные группы, а в радикале – одна или несколько ненасыщенных связей.
Основным представителем этой группы кислот является бутендиовая кислота HOOC–CH=CH–COOH. Для этой кислоты возможны две пространственные конфигурации:
H COOH H COOH
C C
С С
Н СООН НООС Н
малеиновая кислота фумаровая кислота
(цис-форма) (транс-форма)
Обратите внимание, что для этой кислоты характерны все реакции карбоксильной группы, но наличие пространственной изомерии влияет на проявление отдельных свойств, например, ангидрид легко получа-
ется у малеиновой кислоты и очень трудно у фумаровой.
Кроме того, для этих кислот характерны реакции и по двойной связи: восстановление, присоединение галогенов, воды и т. д.
Л и т е р а т у р а: [1, с. 310-312].
Вопросы для самопроверки
1. Что такое непредельные двухосновные кислоты? Привести примеры этих соединений.
2. Напишите уравнение реакций образования малеинового ангидрида.
3. Напишите уравнения реакций образования кислого и среднего эфира фумаровой кислоты и этанола.
4. Напишите уравнение реакции присоединения воды к фумаровой кислоте.
Ароматические кислоты
Ароматическими карбоновыми кислотами называют производные бензола, содержащие карбоксильные группы, непосредственно связанные с углеродными атомами бензольного ядра. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирноароматические.
Важнейшими представителями ароматических кислот являются бензойная и фталевая кислоты.
У бензойной кислоты изомеров нет, а фталевая кислота имеет три изомера в зависимости от положения карбоксильных групп.


 СООН СООН СООН
СООН СООН СООНСООН НООС
СООН
фталевая изофталевая терефталевая
(орто-) (мета-) (пара-)
Ароматические кислоты вступают во все те реакции, которые свойственны и кислотам жирного ряда: диссоциация, образование солей, ангидридов, амидов, галогенангидридов, сложных эфиров, декарбоксилирование. Но у ароматических кислот большая степень диссоциации, так как бензольное кольцо обладает электрофильным характером и, оттягивая электронную плотность на себя, ослабляет связь водорода с карбоксильной группой.
Л и т е р а т у р а: [1, с. 303-305].
Вопросы для самопроверки
1. Какие кислоты называются ароматическими?
2. Напишите структурные формулы соединений: п-толуиловая кислота, бензоат кальция, п-бензоилхлорид.
3. Напишите уравнение реакции декарбоксилирования бензойной кислоты.
4. Напишите уравнение реакции получения ангидрида из фталевой кислоты.
Оксикислоты
Оксикислоты относятся к соединениям со смешанными функциями: в молекуле оксикислот имеется карбоксильная группа, характерная для кислот, и гидроксильная группа, характерная для спиртов. Общая формула всех оксикислот:
R–(COOH)n,
(OH)m
где n – число карбоксильных групп;
m – число спиртовых гидроксилов.
По номенклатуре ИЮПАК названия оксикислот образуются путем введения префикса гидрокси (окси-). Например, гликолевая кислота – оксиэтановая кислота; - и - оксипропионовые кислоты – соответственно 2- и 3- оксипропановые кислоты:
СН3
СH3–C–COOH CH3–CH–CH–COOH
OH CH3 OH
2-метил-2-оксипропановая 3-метил-2-оксибутановая
кислота кислота
Основные представители оксикислот: гликолевая, молочная, оксимасляная, глицериновая, яблочная, винная, лимонная.
В связи с тем, что в составе молекул оксикислот имеются спиртовая и карбоксильная группы, введены понятия основности и атомности. Основность кислоты определяется числом карбоксильных групп, атомность – общим числом гидроксилов, т. е. свободных и входящих в
карбоксил. Например, CH3–CH–COOH (молочная кислота) является
ОН
одноосновной и двухатомной кислотой.
Изучение оксикислот тесно связано со спиртами и карбоновыми кислотами. При этом необходимо запомнить определение, классификацию, номенклатуру, способы получения и химические свойства.
У оксикислот отмечается как структурная изомерия: изомерия углеводородной цепи, изомерия положения оксигруппы (-, -, - и т. д. оксикислоты), так и стереоизомерия. Стереоизомерия проявляется при наличии в молекуле асимметрического атома углерода (у которого все четыре валентности связаны с различными атомами или группами атомов).
Являясь одновременно кислотами и спиртами, оксикислоты дают реакции как по карбоксильной группе (диссоциация, образование солей, амидов, ангидридов, галогенангидридов, сложных эфиров), так и по спиртовой группе (алкоголяты, окисление, простые эфиры, сложные эфиры). Но, кроме того, во всех превращениях оксикислот следует учитывать взаимное влияние гидроксильной и карбоксильной групп (например, реакция отщепления воды позволяет отличить -, -, - оксикислоты).
Надо уметь дифференцировать строение оксикислот ароматического ряда и фенолокислоты, имея в виду, что гидроксильная группа в ароматических оксикислотах находится в боковой цепи, а у фенолокислот – присоединяется к углеродному атому бензольного кольца. У фенолокислот отмечается изомерия положения гидроксила относительно карбоксила (орто-, мета-, пара-).
Основными представителями фенолкарбоновых кислот являются салициловая и галловая кислоты:
OH OH

 СООН НО ОН
СООН НО ОН

СООН
салициловая кислота галловая кислота
Необходимо уяснить общие химические реакции, свойственные как ароматическим оксикислотам, так и фенолокислотам, а также знать реакции, характерные только для тех или иных оксикислот.
Л и т е р а т у р а: [1, с. 326-333].
Вопросы для самопроверки
1. Какие соединения называются оксикислотами? Их общая формула. Какие функциональные группы для них характерны? Что положено в основу классификации оксикислот?
2. Напишите формулы всех изомеров оксимасляной кислоты.
3. На примере оксипропионовой кислоты составьте уравнения реакций, характеризующих химические свойства оксикислот.
4. Как можно отличить друг от друга -, -, - оксикислоты?
5. Какие соединения называются фенолокислотами?
6. Напишите уравнения реакций образования метилового эфира салициловой кислоты, аспирина, реакцию декарбоксилирования галловой кислоты.
Оксокислоты (альдегидо- и кетокислоты)
Оксокислоты – это карбоновые кислоты, в углеводородном радикале которых содержатся карбонильные группы. При наличии альдегидной группы их называют альдегидокислотами, кетонной – кетокислотами.
Необходимо разобраться в изомерии оксокислот и знать формулы основных представителей: глиоксалевой кислоты, пировиноградной, щавелевоуксусной, -кетоглутаровой, ацетоуксусной.
О
С–СООН СН3–С–СООН НООС–С–СН2–СООН
Н О О
глиоксалевая пировиноградная щавелевоуксусная
кислота кислота кислота
Изучая химические свойства оксокислот, уясните реакции, обусловленные наличием карбоксильной и карбонильной групп.
Л и т е р а т у р а: [1, с. 334-341].
Вопросы для самопроверки
1. В чем отличие альдегидокислот и кетокислот по строению?
2. Напишите уравнения реакций с пировиноградной кислотой, характерные для карбоксильной и кетогрупп.
3. Напишите уравнения реакций с глиоксалевой кислотой, характерные для альдегидной группы.
Амины и аминоспирты
Амины – это алкильные либо арильные производные аммиака. Они подразделяются на первичные, вторичные или третичные, в зависимости от того, сколько алкильных или арильных групп присоединено к атому азота:
R–NH2 R–NH R–N–R
первичный R R
амин вторичный третичный
амин амин
Например,
CH3–NH2 CH3–NH CH3–N–CH3
метиламин CH3 CH3
диметиламин триметиламин
СН3







 NH2 NH N
NH2 NH N СН3
фениламин дифениламин N,N-диметилфениламин
(анилин)
Необходимо уяснить классификацию аминов в зависимости от характера углеводородного радикала (амины жирного и ароматического ряда).
Амины так же, как и аммиак, обладают основными свойствами, которые обусловлены наличием у азота свободной электронной пары, притягивающей протон.
СН3–NH2 + H+OH-
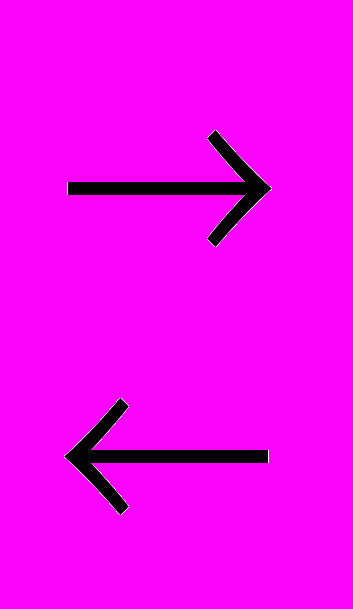 CH3–NH3 + OH-
CH3–NH3 + OH-При изучении химических свойств аминов надо знать, как реагируют амины с водой, изучить реакции образования кислых и средних солей.
Амины жирного ряда более сильные основания, чем аммиак. Более сильная щелочная реакция водных растворов аминов объясняется положительным индукционным влиянием алкильных радикалов за счет чего повышается электронная плотность у атома азота. Нужно знать, как ведут себя амины с азотистой кислотой, так как эта реакция является характерной для них и дает возможность отличить первичные, вторичные и третичные амины. У ароматических аминов основные свойства выражены слабее, чем у аминов жирного ряда, так как сказывается влияние бензольного кольца.
Разберитесь в способах получения различных аминов, особенно обратите внимание на реакции Гофмана и Зинина.
Аминоспирты – это соединения, в молекуле которых одновременно содержатся амино- и гидроксильная группы. Основными представителями этой группы соединений являются 2-аминоэтанол (коламин) и гидроокись оксиэтилтриметиламмония (холин).
HO–CH2–CH2–NH2 [HO–CH2–CH2–N+(CH3)3]OH-
коламин холин
Необходимо изучить способы их получения, свойства и биологическую роль. Указанные аминоспирты входят в состав фосфолипидов, а также биологически активных веществ.
Л и т е р а т у р а: [1, с. 251-263].
Вопросы для самопроверки
1. Что такое аминосоединения? Их строение, изомерия, классификация и номенклатура.
2. Почему амины обладают основными свойствами?
3. Напишите уравнения реакций взаимодействия этиламина с соляной кислотой, уксусным ангидридом, хлористым ацетилом.
4. Как реагируют первичные, вторичные и третичные амины с азотистой кислотой?
5. Каковы химические свойства анилина и его гомологов?
6. Что такое аминоспирты? Напишите структурные формулы коламина и холина. Укажите их биологическую роль.
1.2. Гетероциклические соединения
Гетероциклическими соединениями называют органические вещества, молекулы которых содержат цикл, образованный, кроме атомов углерода, атомами других химических элементов, чаще всего азота, серы, кислорода. Такие неуглеродные атомы называют гетероатомами, а содержащие их циклические системы – гетероциклами.
Гетероциклические соединения классифицируются по числу атомов в гетероцикле, по числу колец, входящих в гетероцикл и по характеру и числу гетероатомов. Большинство гетероциклических соединений имеют тривильные названия, от которых образуют названия и их производные. Для обозначения местоположения заместителей, атомы гетероциклов нумеруют, начиная с гетероатома, или же обозначают их буквами греческого алфавита.
Необходимость изучения гетероциклов связана с тем, что они входят в состав многих органических соединений, играющих важную роль в жизнедеятельности растений и животных. Они являются составными компонентами сложных белков, нуклеиновых кислот, ферментов, витаминов, хлорофилла, гемоглобина, гетероауксинов, антибиотиков, алкалоидов, лекарственных веществ и т. д. Наибольшее значение имеют ароматические гетероциклы.
В природных соединениях распространены пяти- и шестичленные гетероциклические соединения. Простейшие пятичленные гетероциклы с одним гетероатомом – фуран, тиофен и пиррол. Они близки между собой по строению, имеют ряд общих свойств и напоминают бензол, т. е. не проявляют явной ненасыщенности и обладают ароматическим характером. Вступают в реакции электрофильного замещения, при этом, в первую очередь, замещается водород в -положении.
Ароматический характер гетероциклов с точки зрения электронной теории объясняется возникновением единого шестиэлектронного облака, в образовании которого принимают участие 2 пары -электронов от углеродных атомов и одна неподеленная электронная пара от гетероатома. Таким образом, на гетероциклические соединения распространяется правило Хюккеля, выведенное для ароматических систем. Этим обусловлены пониженная активность ненасыщенных пятичленных гетероциклов к реакциям замещения.
Если атом азота отдает свою электронную пару в ароматический цикл, он теряет основные свойства. Например, пиррол основных свойств не проявляет, так как электронная пара атома азота достраива-
ет электронную оболочку гетероцикла до шести. В том случае, когда атом азота находится при двойной связи в цикле, он, являясь акцептором электронов, понижает электронную плотность на атомах углерода ароматического гетероцикла, уменьшает его способность к реакциям электрофильного замещения. При этом основные свойства сохраняются.


N N
H
пиррол пиридин
Так, пиридин является устойчивой ароматической системой с наибольшей электронной плотностью в положениях 3 и 5, в которые направляются электрофильные реакции в жестких условиях:
Вr


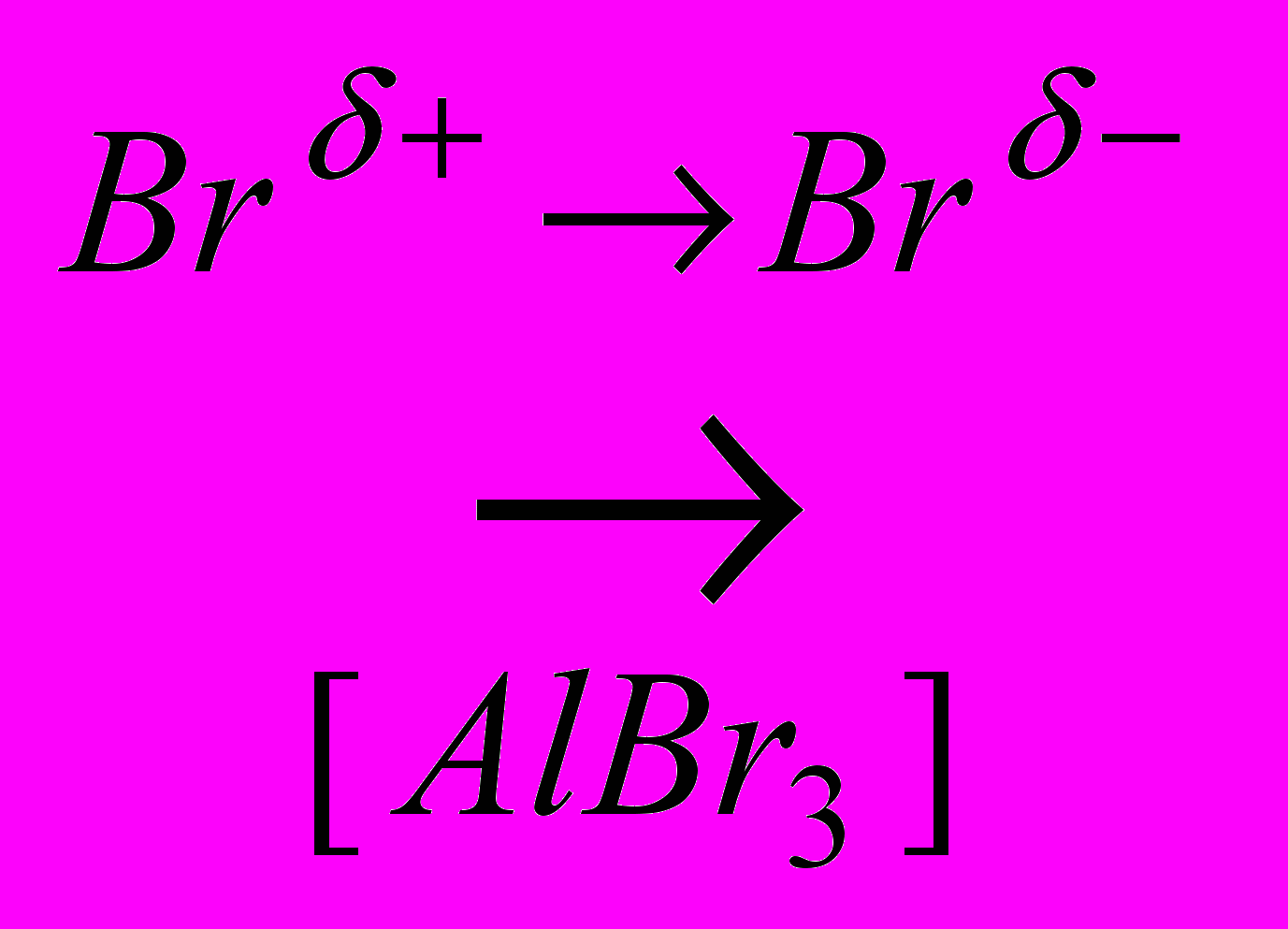 + HBr
+ HBrС кислотами пиридин дает соли:


+ HBr
N N
H+Br
бромистоводородный
пиридин
Особое внимание уделите пиримидину и пурину и их производным.
Л и т е р а т у р а: [1, с. 411-438].
Вопросы для самопроверки
1. Какие соединения называют гетероциклическими? Чем они отличаются от карбоциклических?
2. Классификация и ароматичность гетероциклических соединений.
3. Напишите формулы гетероциклов, входящих в состав аминокислот.
4. Биологическая роль пурина и пиримидина.
5. Алкалоиды как представители гетероциклических систем. Токсические и лекарственные их свойства.
6. Какие соединения называют антибиотиками? Каково их строение?
- Углеводы, их биологическая роль, классификация,
номенклатура
Углеводы и их производные образуют один из важнейших классов природных органических соединений. Они широко распространены в растительных и животных организмах.
Углеводы образуются растениями в процессе фотосинтеза. Суммарное стехиометрическое уравнение этого процесса имеет вид:
h
6CO2 + 6H2O C6H12O6 + 6O2.
хлорофилл
Затем глюкоза и другие простейшие углеводы превращаются в более сложные углеводы, например, крахмал и целлюлозу. Приблизительно от 60 до 90 % всего твердого растительного материала состоит из углеводов. Растения используют углеводы как химическую кладо-
вую энергии, полученной от солнечного света, высвобождая ее в процессе дыхания. Этот процесс, в сущности, обратен процессу фотосинтеза:
C6H12O6 + 6 O2 6CO2 + 6 H2O + энергия.
Углеводы, содержащиеся в растениях, служат также источником энергии для животных, питающихся растениями.
Название углеводов связано с тем, что большинство этих соединений имеет общую эмпирическую формулу Cn(H2O)m.
Углеводы принято подразделять на моносахариды, олигосахариды и полисахариды.
1. Моносахариды – углеводы, не способные подвергаться гидролизу. Общая формула моносахаридов CnH2nOn, где n= от 3 до 8. В зависимости от числа атомов углерода их делят на триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6) и т. д. Важным представителем пентоз является рибоза. Их общая формула C5H10O5. Моносахариды с общей формулой С6Н12О6 называются гексозами. К гексозам принадлежат глюкоза, фруктоза.
2. Олигосахариды представлены молекулами, содержащими от 2 до 10 моноз. Из этой группы углеводов наиболее распространены в природе дисахариды. Дисахариды образуются конденсацией двух моносахаридных фрагментов с одновременным отщеплением молекул воды. К дисахаридам принадлежат: лактоза, сахароза, мальтоза и
целлобиоза. Дисахариды, образующиеся из двух гексозных фрагментов, имеют общую формулу С12Н22О11.
Моносахариды и дисахариды представляют собой белые кристаллические вещества, растворимые в воде и имеющие сладкий вкус. Иначе их называют сахарами. Пищевой сахар представляет собой сахарозу.
3. Полисахариды могут рассматриваться как полимеры моносахаридов. Общая формула полисахаридов, образованных из гексозных фрагментов, имеет вид (С6Н10О5)n. Полисахариды могут состоять из одного или нескольких разных моносахаридных мономеров. Некоторые полисахариды содержат сотни или тысячи моносахаридных фрагментов и поэтому имеют высокие значения относительной молекулярной массы.
Двумя наиболее распространенными полисахаридами в природе являются целлюлоза и крахмал. Как правило, полисахариды нерастворимы в воде либо образуют в ней коллоидные растворы.
Структура углеводов
В первую очередь, необходимо разобраться в строении моноз, уяснить особенности строения ациклических и циклических форм.
Углеводы могут рассматриваться как альдегиды и кетоны, содержащие несколько гидроксильных групп. Моносахариды с альдегидной группой называются альдозы, а моносахариды с кетогруппой – кетозы.
O
C CH2–OH
H C=O
H–C–OH HO–C–H
HO–C–H H–C–OH
H–C–OH H–C–OH
H–C–OH CH2OH
CH2OH
глюкоза фруктоза
Альдозы и кетозы содержат асимметрические атомы углерода. Для них известно большое число стереоизомеров (2n, где n – число асимметрических атомов). Например, альдогексозы имеют четыре асимметрических атома углерода. Существует восемь различных альдогексоз. Каждая из них имеет два оптических изомера. Таким образом, общее количество изомеров альдогексоз насчитывает 16. Наиболее важными из них являются два оптических изомера глюкозы.
CHO CHO
Н–С–ОН HO–C–H
HO–C–H H–C–OH
H–C–OH HO–C–H
H–C–OH HO–C–H
CH2OH CH2OH
D-глюкоза L-глюкоза
Символы D- и L- указывают конфигурацию гидроксильной группы, присоединенной к атому С5.
Для углеводов характерен еще один вид структурной изомерии: циклоцепная таутомерия.
Циклизация моносахаридов происходит в результате того, что атом водорода гидроксильной группы (С5) присоединяется к кислороду альдегидной группы за счет разрыва -связи, образуя так называемый полуацетальный (гликозидный) гидроксил.





 О
О
 HO–C–H С Н–C– OH
HO–C–H С Н–C– OHН–С–ОН H H–C–OH
HO–C–H О Н–С–ОН HO–C–H О

 H–C–OH
H–C–OH 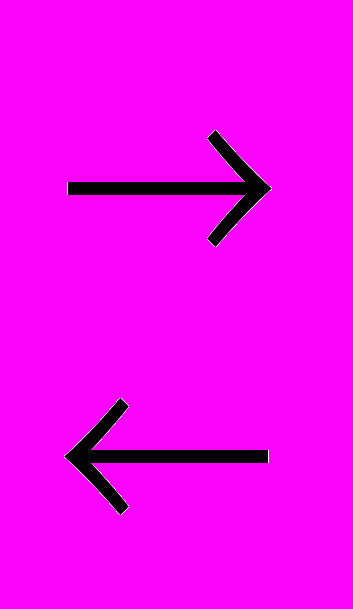 HO–C–H
HO–C–H  H–C–OH
H–C–OH

 H–C– H–C–OH H–C–
H–C– H–C–OH H–C–CH2OH H–C– OH CH2OH
CH2OH
-D-глюкоза D-глюкоза -D-глюкоза
В результате разрыва -связи С1 образует связь с кислородом гидроксильной группы С5.
Если гликозидный гидроксил расположен так же, как и гидроксил, определяющий принадлежность к D- или L-ряду, то такая форма называется -формой, если с противоположной стороны, то -формой.
При изучении углеводов и их производных обратите внимание, что именно за счет этого гликозидного гидроксила идет образование сложных углеводов, глюкопротеидов, нуклеиновых кислот и других природных соединений.
Более наглядно строение молекулы углевода можно представить, используя так называемые перспективные формулы Хеуорса. атом кислорода расположен в правом верхнем углу. Заместители, которые были слева или справа в проекционных формулах, пишут соответственно сверху или снизу по отношению к плоскости кольца, изменяя положение заместителей у атома углерода за счет которого осуществляется циклизация. Шестичленные циклы называют пиранозами, а пятичленные – фуранозами.
CH2OH CH2OH

 H С OH
H С OH H H H H
OH H
HO OH H OH
H OH H OH
-D-глюкопираноза -D-глюкофураноза
При изучении химических свойств сахаров следует исходить из химических свойств функциональных групп, входящих в молекулу. Так, если молекула углевода содержит свободный гликозидный гидроксил, то в водном растворе она будет находиться в равновесии с открытой формой и давать реакции карбонильной группы, например, окисление. Следует учесть, что именно наличие или отсутствие свободного гликозидного гидроксила определяет дисахарид в группу восстанавливающих или невосстанавливающих сахаров.
К восстанавливающим дисахаридам относятся вещества, образующиеся при отщеплении воды за счет гликозидного гидроксила одной молекулы моносахарида и спиртового гидроксила другой (мальтоза, лактоза, целлобиоза). Такие дисахариды имеют один свободный гликозидный гидроксил, способный к таутомерным превращениям. Для них характерны типичные реакции на карбонильную группу: образование фенилгидразонов и озазонов, присоединение водорода и синильной кислоты, восстановление гидроксида меди и фелинговой жидкости, реакция серебряного зеркала и т. д.
К невосстанавливающим дисахаридам относятся вещества, образующиеся при отщеплении воды за счет полуацетальных гидроксилов обоих моносахаридов (сахароза). Сахароза состоит из остатков глюкозы и фруктозы. В дисахаридах этого типа нет свободного полуацетального гидроксила, они не способны к таутомерным превращениям, не дают характерных реакций на карбонильную группу и не обладают восстанавливающими свойствами. Они способны только к реакциям, обусловленным присутствием гидроксильных групп – образованию простых и сложных эфиров и сахаров.
Изучение полисахаридов надо начинать со знакомства с их строением, с отличительных особенностей структурных формул крахмала и клетчатки, знать особенности - и - гликозидных связей, а также биологическое и практическое значение этих полисахаридов. Обратить внимание на строение и свойства гетерополисахаридов: гиалуроновой кислоты, хондроитинсульфата, гепарина.
В процессе изучения сахаров обратите внимание на образование сложных эфиров, ибо они играют важную биохимическую роль (фосфорные эфиры в синтезе и распаде углеводов) и имеют большое народнохозяйственное значение (нитроклетчатка, ацетатное волокно, ацетобутират целлюлозы и т. д.).
Л и т е р а т у р а: [1, с. 360-385].
