Перенесших инфаркт миокарда
| Вид материала | Автореферат |
- Задачи : Формирование 2-х клинических групп обоего пола: 30 пожилого возраста (65-86, 118.29kb.
- Задачи : Формирование 2-х клинических групп обоего пола: 30 пожилого возраста (65-86, 127.2kb.
- Публикуется по изданию: Н. А. Корнетов, Е. В. Лебедева Депрессивные расстройства, 218.38kb.
- Комплексное применение информационно-волнового метода физиотерапии на различных этапах, 570.75kb.
- Низкоинтенсивная лазерная терапия в комплексном восстановительном лечении больных,, 846.06kb.
- «Военно-медицинская академия им. С. М. Кирова», 363kb.
- «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению, 562.88kb.
- Инфаркт миокарда, 46.55kb.
- Прогностическое значение клинико-функциональных показателей и воспалительных маркеров, 500.64kb.
- Острый Инфаркт Миокарда Ведение на догоспитальном и госпитальном этапах руководство, 928.77kb.
Полиморфизм гена АПФ, ангиотензиногена и мозгового натрийуретического пептида у больных ИМ.
Изучалось влияние гена АПФ и АТГ на развитие сердечно-сосудистых осложнений, в том числе, ХСН, поэтому пациенты были разделены на группы больных без клинических признаков ХСН (1-я группа) и с ХСН II-IV ФК по NYHA, осложнившей ИМ (2-я группа). В каждую группу вошло по 60 человек. По таким клинико-демографическим характеристикам, как пол, возраст, локализация ИМ, наличие в анамнезе гипертонии, СД 2 типа группы не различались. Во 2-й группе 16 (26,7%) пациентов имели II ФК ХСН, 35 (58,3%) пациентов – III ФК ХСН, 9 (15%) пациентов – IV ФК ХСН. В 1-й группе ФВ левого желудочка составила 42,3±0,65%, во 2-й - 30,3±0,76% (р<0,001).
Частота распределения генотипов гена АПФ и АТГ в 1-й и 2-й группе была одинаковой. Следовательно, полиморфизм этих генов не влиял на развитие ХСН у больных ИМ. У обследованных пациентов генотип ММ гена АТГ не выявлялся.
Полиморфизм гена АПФ у больных 2-й группы был ассоциирован с тяжестью ХСН (табл. 4):
Таблица 4
Распределение генотипов гена АПФ в зависимости от ФК ХСН
Генотип | Функциональный класс ХСН (NYHA) | ||
ФК II (n=16) | ФК III (n=35) | ФК IV (n=9) | |
II | 31,3% | 22,9% | 11,1% |
ID | 37,4% | 34,2% | 22,2% |
DD | 31,3% | 42,9% * | 66,7% ** |
* - различие с II (ХСН III ФК): р=0,06297; ** - различие с II (ХСН IV ФК): р<0,05.
Среди пациентов с III и IV ФК ХСН чаще встречались лица с генотипом DD (42,9% и 66,7% соответственно), причем различия у гомозигот по аллелю D с ХСН IV ФК с гомозиготами по I аллелю были достоверными (р<0,05). При исследовании за год наблюдения частоты появления или нарастания симптомов ХСН у всех 120 больных ИМ, включенных в генетический анализ, ухудшение отмечалось чаще среди лиц с ID и DD генотипами (рис. 6):

%
*- различия с генотипом II: р<0,05; **- различие с с генотипом II: р<0,0001
Рисунок 6. Частота развития или нарастания симптомов ХСН у больных ИМ в зависимости от полиморфизма гена АПФ.
Следует сказать, что в группе исходно без явлений ХСН пациенты с генотипом ТМ чаще госпитализировались по поводу нестабильной стенокардии (38,1%), чем лица с ТТ генотипом (12,8%)(р<0,05). Во 2-ой группе ТМ полиморфизм был связан с более частыми госпитализациями по поводу декомпенсации ХСН (28,6% против 8,1%, р<0,05). По другим сердечно-сосудистым событиям различий в зависимости от полиморфизма гена АПФ и АТГ получено не было.
При анализе показателей ЭХО-КГ получены ассоциации генотипа DD гена АПФ и генотипа ТМ гена АТГ с более низкой ФВ ЛЖ (рис. 7):
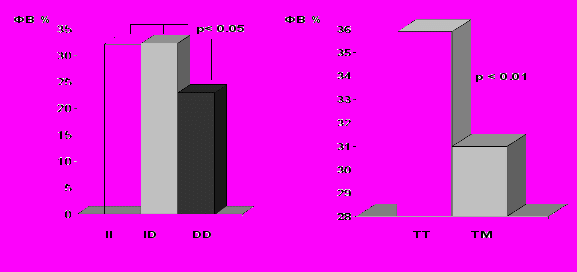
Рисунок 7. Показатель ФВ у больных ИМ с ХСН II-IV в зависимости от генотипов гена АПФ и АТГ.
Впервые проводился анализ полиморфизма гена МНП у больных ИМ. Достоверных различий по преобладанию того или иного генотипа у больных ИМ без явлений ХСН и с ХСН II-IV получено не было (табл. 5). Распределение полиморфизма соответствовало распределению в группе здоровых лиц без наличия сердечно-сосудистой патологии. Не обнаружено каких–либо ассоциаций полиморфизма гена МНП с течением ИМ.
Таблица 5
Частота распределения генотипов гена МНП у больных ИМ
| | Без признаков ХСН n-76 | С ХСН II-IV n-72 | Контроль n-50 | р |
| Генотип СС | 21 (27%) | 17 (24%) | 16 (32%) | нд |
| Генотип СТ | 40 (53%) | 42 (58%) | 26 (52%) | нд |
| Генотип ТТ | 15 (20%) | 13 (18%) | 8 (16%) | нд |
Таким образом, DD генотип гена АПФ у больных ИМ ассоциирован с тяжестью ХСН, более низким уровнем ФВ по данным Эхо-КГ, а также прогрессированием симптомов ХСН и частыми госпитализациями по поводу недостаточности кровообращения. ТМ генотип гена АТГ ассоциирован с частыми госпитализациями по поводу нестабильной стенокардии и декомпенсации ХСН, более худшими показателями ФВ.
Влияние медикаментозной терапии на прогноз больных ОИМ, оценка эффективности терапии в зависимости от генетических факторов, маркеров воспаления и уровня мозгового натрийуретического пептида.
Влияние ранней терапии селективными бета-адреноблокаторами эсмололом и метопролола сукцинатом на течение постинфарктного периода у больных ОИМ.
В исследование включено 60 пациентов с острым ИМ давностью до 24 часов, осложненным ОСН (Killip II).Средний возраст составил 62,72± 12,7 лет. Пациенты были разделены на две группы в зависимости от назначения ББ: 1-я группа (30 пациентов) получала эсмолол внутривенно в 1-е сутки ОИМ в начальной дозе 25 мкг/кг/мин, с последующей титрацией в течение 24 часов в зависимости от ЧСС и состояния пациентов. За время инфузии средняя доза Э составила 37 мкг/кг/мин. За 30 минут до окончания инфузии данной группе перорально назначалась начальная доза метопролола сукцината. Титрация дозы проводилась каждые 3 дня с учетом ЧСС и/или развития побочных эффектов до максимально переносимой терапевтической дозы, средняя доза метопролола сукцината в исследуемой группе составила 118,97 мг 1 раз в сутки; 2-я группа – группа сравнения – это 30 пациентов, получавших метопролола тартрат 75 г в сутки (22 больных), атенолол 50 мг в сутки (5 пациентов) или не принимавших ББ. В обеих группах пациенты получали стандартную терапию при ИМ. Исходно группы были однородны и сопоставимы по клинико-демографическим данным: по полу, возрасту, локализации ИМ, наличию ГБ, СД 2 типа, стенокардии, перенесенного ИМ и сопутствующей терапии. В 1-й группе пациенты поступали в среднем через 7,2 ± 0,8 ч от начала ИМ, во 2-й группе через 7,9 ±0,4 ч (p>0,05). Длительность госпитализации в 1-й группе составила 24±2,3 дня, во 2-й - 23±3,8 дней (p>0,05).
В течение первых 7 суток наблюдения отмечены следующие изменения в течении ОСН: прогрессирование ОСН в 1-й группе выявлено у 2 пациентов (6,7 %), во 2-й группе - у 4 пациентов (13,3%), (р=0,389). Вместе с тем, регресс симптомов ОСН в 1-й группе отмечался достоверно чаще, чем во 2-й группе (56,7 % и 30 % соответственно, р=0,03). По частоте смерти в этот период достоверных различий не получено.
При изучении влияния терапии метопролола сукцинатом на течение ИМ за год наблюдения в 1-й группе отмечена более низкая частота развития стенокардии ( 41,4% и 69,6% соответственно, р=0,043). В ходе исследования на фоне лечения ББ риск развития СН снижался на 68%, в то время как в группе без исследуемых ББ повышался на 33%.
По группам проведен анализ динамики ХСН, который показал достоверное увеличение в группе с исследуемыми ББ количества больных со II ФК ХСН к моменту выписки из стационара (с 39,3% до 71,4% пациентов, р=0,016) и к концу года наблюдения (до 66,7%, р=0,05), а также уменьшение количества пациентов с III ФК за эти же периоды с 53,6% до 17,9% (р=0,005) и до 9,5% (р=0,001) соответственно. Во 2-й группе существенной динамики класса ХСН не отмечалось. В 1-й группе за год наблюдения отмечена более низкая частота смерти, чем в группе сравнения (р=0,05). Снижение абсолютного риска составило 20% (95% доверительный интервал 10,03%-29,97%). При проведении корреляционного анализа получена обратная зависимость между назначением метопролола сукцината и частотой смерти за период наблюдения (r=-0,3, р=0,04).
Эффективность ранней терапии ББ изучалась по динамике МНП (рис. 8). Достоверных различий в уровнях МНП на 1-е, 7-е и 21-е сутки не получено. В 1-й группе отмечено достоверное снижение МНП через год по сравнению с исходным (с 655,0±512 фмоль/мл до 166,9±84,5 фмоль/мл соответственно, р=0,019) и с 21 сутками ИМ (с 666,0 фмоль/мл до 166,9 фмоль/мл соответственно, р=0,003).
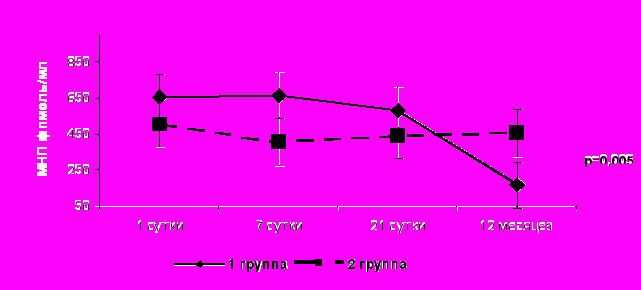
Рисунок 8. Динамика уровня МНП по группам за период наблюдения.
Во 2-й группе в динамике МНП достоверных различий не получено. Анализ вероятности наступления летального исхода в группах в зависимости от уровня МНП за год наблюдения показал следующие результаты (рис. 9):
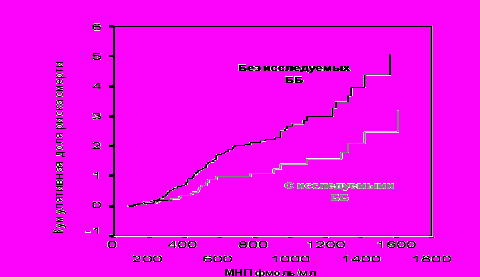
Рисунок 9. Кумулятивная доля риска летального исхода в зависимости от уровня МНП на фоне приема исследуемых бета-адреноблокаторов.
Таким образом, кумулятивная доля риска летального исхода в группе без исследуемых ББ была достоверно выше (р<0,05).
В заключение важно отметить, что ранняя терапия ББ приводит к благоприятному течению постинфарктного периода, что проявляется в достоверном снижении частоты развития постинфарктной стенокардии, в позитивном влиянии на течение острой и хронической СН. Раннее применение ББ у больных ИМ, осложненным СН, благоприятно влияет на динамику уровня МНП, что согласуется с достоверным снижением тяжести СН в этой группе.
Эффективность ингибитора АПФ периндоприла у больных ИМ и ее оценка с помощью динамики МНП и полиморфизма гена АПФ.
Проводилась оценка эффективности периндоприла у больных ОИМ с левожелудочковой дисфункцией в условиях повседневной клинической практики. На этапе скрининга пациентов были отобраны лица с ОИМ и ФВ < 40%. Эффективность периндоприла оценивалась по сравнению с другим ингибитором АПФ – каптоприлом. С целью оценки эффективности терапии применялось определение уровня МНП на различных этапах наблюдения.
В исследование было включено 125 больных с ОИМ, из них 68 мужчин, 57 женщин. Средний возраст 67,1+3,4 лет. По полу, возрасту, локализации ИМ, гемодинамическим параметрам (АД, ЧСС), тяжести СН, наличию в анамнезе гипертонии, СД 2 типа, ХОБЛ, а также терапии ОИМ между группами достоверных различий не было. При соответствии всем критериям включения и исключения проводилась рандомизация пациентов на группы в зависимости от назначения периндоприла или каптоприла. В 1-ю группу (63 пациента) вошли больные, получающие периндоприл, во 2-ю – каптоприл (62 пациента). В обеих группах средний показатель МНП был повышен и достоверно не отличался, так в группе периндоприла – 397,7+30,2 фмоль/мл, в группе каптоприла – 423,6+39,7 фмоль/мл (p = 0,606). Титрование дозы периндоприла и каптоприла начиналось с 2 мг/сутки и 18,75 мг/сутки соответственно и происходило по усмотрению исследователя в зависимости от состояния пациента в соответствии с официальными рекомендациями по лечению ХСН. Максимальная доза для периндоприла составила 8 мг в сутки однократно, каптоприла 75-150 мг в сутки в три приема. Больные наблюдались 12 месяцев.
Уже
к 3 неделе терапии с
редняя доза периндоприла составила 3,7+0,3 мг/сут (93% от рекомендованной). По группе каптоприла средняя суточная доза была достигнута к концу исследования (24 неделя) и составила 56,3+10,6 мг, т.е. 37,5% от рекомендованной целевой дозы. Следует отметить, что целевую дозу периндоприла (4–8 мг/сут) получили 76,5% пациентов, а каптоприла (75–150 мг/сут) - всего 40,4% пациентов.
Исходно больные обеих групп по тяжести ХСН не различались между собой. В группе периндоприла средний ФК ХСН составлял 2,5 + 0,1, в группе каптоприла - 2,4 + 0,1 (p=0,462). К концу госпитального периода наблюдалось достоверное снижение среднего ФК ХСН в группе периндоприла до 1,8 + 0,08 (p<0,001), в группе каптоприла – до 1,9 + 0,10 (p=0,002), различия между группами не достоверны (р=0,815). К концу наблюдения в обеих группах также выявлено достоверное снижение среднего ФК класса: в группе периндоприла на 36% (с 2,5 + 0,1 до 1,6 + 0,18, p<0,001), в группе каптоприла – на 29,2% (с 2,4 + 0,1 до 1,7 + 0,18, p<0,001). Хотя различий между группами получено не было (р=0,938), обращает внимание, что в группе пациентов, получавших периндоприл, достоверно меньше (р=0,01) было больных с III ФК ХСН (2%), чем в группе каптоприла (17%).
В каждой группе умерло по 4 пациента, что составило в группе периндоприла 6,3%, а в группе каптоприла 6,6% (р=0,981).
Динамика МНП на фоне терапии в группах представлена на рис. 10. Исходно уровень МНП в обеих группах был повышен и достоверно не отличался между группами.
Рисунок 10. Динамика уровня МНП на фоне проводимой терапии у пациентов с ИМ.
На 8 неделе в группе периндоприла зарегистрировано достоверное уменьшение уровня МНП на 25,4% (р=0,004), а в группе каптоприла - на 19,1% (р=0,06). К концу исследования в обеих группах наблюдалось дальнейшее достоверное снижение уровня МНП по сравнению с исходным: в группе периндоприла - на 32,2% (р= <0,0001), в группе каптоприла – 27,6% (р=0,008). Достоверных различий между группами не было (р=0,13). Таким образом, на фоне терапии периндоприлом наблюдается более выраженное снижение МНП, и к 12 месяцу отмечается нормализация уровня пептида.
К концу наблюдения в группе периндоприла произошло улучшение качества жизни («Опросник Миннесотского Университета для больных сердечной недостаточностью»), что подтверждается достоверным снижением суммарного показателя «качества жизни» - 23,8+2,5 (р=0,047), а в группе каптоприла суммарный показатель качества жизни остался без изменений по сравнению с 3 неделей.
Таким образом, периндоприл и каптоприл являются эффективными средствами терапии больных ОИМ с левожелудочковой дисфункцией. Для периндоприла характерно более быстрое достижение целевой дозы и соответственно терапевтического эффекта, что подтверждается динамикой МНП и клиническим улучшением качества жизни больных.
В анализ по влиянию ингибитора АПФ периндоприла на показатели гемодинамики и течение ХСН у больных, перенесших ИМ, в зависимости от полиморфизма гена АПФ, вошло 98 больных (75 мужчин, 23 женщины) с ОИМ в первые сутки заболевания, средний возраст составил 60,0+0,9 лет. Отбирались пациенты в стабильном состоянии. Пациентам назначался периндоприл в дозе 2 мг с последующим увеличением вдвое через каждую неделю, принимая во внимание данные гемодинамики. На этапе скрининга по данным ЭХО-КГ отбирались пациенты с ФВ<40%. Продолжительность лечения составила 12 месяцев.
Генотип II определялся у 22 пациентов, ID – у 40 больных, DD – у 36. По полу, возрасту, ФК ХСН, ФВ, наличия гипертонии в анамнезе и СД 2 типа в зависимости от генотипа гена АПФ достоверных различий не выявлено.
Динамика среднего ФК ХСН в зависимости от генотипа гена АПФ представлена на рис. 11. Согласно представленным на рисунке данным, периндоприл оказался наиболее эффективным у больных с DD генотипом, у которых уже к концу 2 недели отмечено достоверное уменьшение ФК ХСН.
П
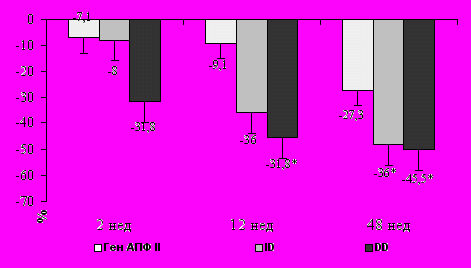
римечание: * - достоверные различия по сравнению с исходными данными, р<0,05.
Рисунок 11. Динамика среднего ФК ХСН в зависимости генотипа гена АПФ.
Наименее эффективен периндоприл у больных с II генотипом, однако, и у этой группы больных к концу наблюдения выявлено достоверно снижение ФК. В ходе анализа достоверных различий между группами по динамике ХСН, госпитализаций по этой причине и смертям не выявлялось. Полученные результаты, вероятно, связаны с тем, что периндоприл оказывал позитивное влияние на течение ХСН чаще у пациентов с DD генотипом.
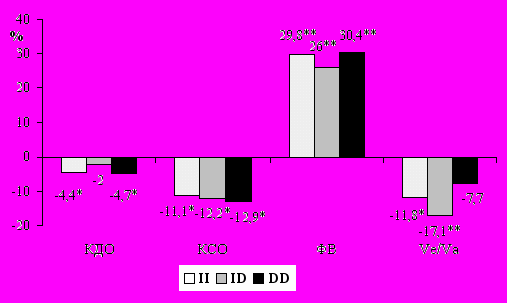
Исследовалась динамика структурно-функциональных показателей ЛЖ, исходно не отличавшихся достоверно в зависимости от генотипа гена АПФ. Анализ их на фоне года лечения периндоприлом выявил однонаправленную статистически значимую положительную динамику (рис. 12). Достоверных отличий в зависимости от генотипа гена АПФ не выявлено, хотя отмечается несколько больший процент изменений КДО, КСО и ФВ у больных с DD генотипом.
* - р<0,05 по сравнению с исходными данными
** - р<0,01 по сравнению с исходными данными
Рисунок 12. Влияние периндоприла на структурно-функциональные показатели ЛЖ в зависимости от генотипа гена АПФ.
Таким образом, при анализе влияния периндоприла на показатели систолической и диастолической функции ЛЖ у больных ИМ не было выявлено достоверных различий в зависимости от полиморфизма гена АПФ. Однако положительная динамика ФК ХСН была более выражена у больных с DD генотипом гена АПФ, и его достоверное снижение было получено уже к концу 2 недели терапии. Достоверное уменьшение ФК ХСН во всех группах было выявлено в конце исследования.
Влияние ранней терапии ингибитором GMG-CoA-редуктазы розувастатином на динамику маркеров воспаления и течение постинфарктного периода у больных ОИМ.
В исследование было включено 47 больных (25 (53,2%) мужчин и 22 (46,8%) женщины), средний возраст составил 60+1,9 лет. Пациенты методом случайной выборки были разделены на две группы: 1-я группа (n=26) получала розувастатин на 1-е сутки ИМ дополнительно к стандартной схеме терапии, а во 2-й группе (n=21) лечение проводилось без применения статинов в раннем постинфарктном периоде. Сравниваемые группы не различались по полу, возрасту, локализации ИМ, частоте встречаемости гипертонии, СД, стенокардии и ИМ в анамнезе. Между группами не выявлено различий по сопутствующей терапии. Розувастатин назначался в 1-е сутки ОИМ. Начальная доза составляла 10 мг в сутки. В дальнейшем при необходимости доза увеличивалась до 20 мг в сутки. Средняя доза составила 13,8 мг. За время наблюдения больным на 1-е, 21-е сутки и через 1 год проводилось исследование СРБ, ФНО-α, ИЛ-6, МБВ-1α, фибриногена и липидного профиля (ЛПНП, ЛПВП, триглицериды, общий холестерин); на 1-е, 7-е, 21-е сутки ОИМ и через 1 год - исследование плазменного уровня МНП.
За время наблюдения не отмечено нежелательных явлений, связанных с приемом исследуемого препарата. По частоте постинфарктной стенокардии, регистрации нарушений ритма (пароксизмы мерцания предсердий, единичные суправентрикулярные и желудочковые экстрасистолы), рецидивов и повторных ИМ, нарастания симптомов СН различий между группами не выявлялось. В группе розувастатина отмечено 3 летальных исхода на 77-е, 100-е и 120-е сутки ОИМ. Во 2-й группе зафиксировано 4 случая смерти. Следует отметить, что все они зарегистрированы на стационарном этапе наблюдения. Таким образом, несмотря на то, что по частоте случаев смерти за год по группам различий не было, в группе с поздним назначением статинов смерть наступала в более ранние сроки. Следовательно, терапия розувастатином с первых суток ОИМ оказывала позитивное влияния на течение постинфарктного периода, что проявлялось в отсутствии случаев смерти в раннем постинфарктном периоде.
При изучении гиполипидемического эффекта розувастатина, а также его влияние на факторы воспаления получены следующие данные (табл. 6):
Таблица 6
Динамика показателей липидного спектра и маркеров воспаления на фоне терапии розувастатином у больных ОИМ
| Показатель | | 1 сутки | ∆% на 21сут (р) | %∆ на 12 мес (р) |
| ЛПНП, моль/л ЛПВП, моль/л ТГ, моль/л ХС, моль/л ФНО-α, пг/мл СРБ, мг/л Фибриноген, мг/дл МНП, фмоль/мл | 1 группа 2 группа 1 группа 2 группа 1 группа 2 группа 1 группа 2 группа 1 группа 2 группа 1 группа 2 группа 1 группа 2 группа 1 группа 2 группа | 3,29±1,63 3,10±0,74 1,40±0,45 1,47±0,72 2,39±2,06 1,63±0,89 5,81±1,81 5,57±0,96 11,06±1,91 10,69±1,04 10,0±1,63 10,21±1,54 353,19±15,69 318,00±13,56 494,02±43,77 521,18±24,02 | -33,43 (<0,05) 9,68 нд* 4,29 нд -11,56 (<0,05) -28,87 (<0,05) 30,06 (<0,05) -26,16 (<0,05) -5,26 нд -42,13 0,018 -15,34 нд -45 0,008 -20,7 нд -12,15 0,056 -4,11 нд -32,17 0,054 -26,08 нд | -38,7 (<0,05) -4,2 нд 8,0 (<0,05) -1,7 нд -36,2 (<0,05) 10,4 нд -31,58 (<0,05) 10,2 нд -33,8 0,068 -15,6 нд -37,0 0,041 -22,6 нд -21,1 0,005 -2,8 нд - 60,49 0,007 -52,84 0,029 |
Нд* – не достоверно
Из представленных данных видно, что на фоне терапии розувастатином уже к 21 суткам отмечается снижение уровня ЛПНП на 33,43%, ТГ - на 28,87%, ХС – на 26,16%. Аналогичная динамика данных показателей сохраняется и к 10 месяцу наблюдения: снижение ЛПНП от исходного на 38,7%, ТГ - на 36,2%, ХС – на 31,58%. Кроме того, отмечалось увеличение уровня ЛПВП к 12 месяцу терапии на 8,0%. В группе сравнения происходил некоторый прирост уровня ТГ на каждом этапе наблюдения, уровня ХС к 12 месяцу, уровня ЛПНП к 21 дню. ЛПВП незначительно снижалось. Таким образом, полученные данные демонстрируют позитивное влияние розувастатина на липидный профиль.
Также в 1-й группе отмечена значимая динамика маркеров воспаления по сравнению со 2-й группой. Так, СРБ в 1-й группе снижался на 45% от исходного на 21-е сутки (р=0,008), к 12 мес – на 37,0% (р=0,041) от исходного, а во 2-й группе – на 20,7% (р>0,05) и 22,6% (р>0,05) соответственно. ФНО-α в 1-й группе снижался достоверно: на 21-е сутки на 42,13% (р=0,018) от исходного, к 12 месяцу – на 33,8% от исходного уровня (р=0,068), а во 2-й группе его снижение было не достоверным и составило 15,34% и 15,6% соответственно (р<0,05). Следует отметить, что исходно высокие уровни СРБ коррелировали с наличием СД 2 типа (r=0,588, p=0,057), повышенными показателями ФНО- α (r=0,579, p=0,062) и низкой ФВ ЛЖ (r=0,588, p=0,057).
Из факторов воспаления нами также впервые изучался МБВ-1α, который одинаково нарастал на первые сутки ОИМ в обеих группах. Но различий в изменении данного белка между группами получено не было. Несмотря на это, повышенные уровни МБВ-1α коррелировали с наличием постинфарктной стенокардии (r=0,458, p=0,048). Также была проанализирована динамика уровня фибриногена. К 12-му месяцу терапии в 1-й группе отмечена более выраженная динамика этого показателя, чем во 2-й группе. При анализе динамики уровня МНП между группами отмечались различия к 12 месяцу: на розувастатине его уровень снижался на 60,49%, а во 2-й группе – на 52,84% от исходного (р= 0,041).
На фоне терапии розувастатином на всех этапах наблюдения не выявлено нарастания уровня АЛТ и АСТ, а также КФК, креатинина и мочевины, что говорит о возможности применения исследуемого препарата у больных с ОИМ, начиная с 1-х суток. При этом розувастатин оказывает позитивное влияния на течение постинфарктного периода, что проявляется в отсутствии на ранних сроках рецидивов ИМ, летальных исходов. В отличие от пациентов, не получавших статины с первых суток ОИМ, на фоне терапии исследуемым препаратом отмечена более позднее развитие неблагоприятных сердечно-сосудистых исходов (смерть, повторный ИМ); при этом наблюдается эффективное снижение ЛПНП, ТГ и общего ХС уже на 3 неделе терапии. Данный эффект сохраняется к 12 месяцу терапии. На фоне терапии розувастатином с первых суток ОИМ отмечается значимая динамика маркеров воспаления – СРБ, ФНО-α, фибриногена, что во многом определяет ранние плейотропные эффекты розувастатина.
Влияние триметазидина на ближайший и отдаленный прогноз ОИМ у больных, страдающих СД 2 типа.
Включено 74 пациента с СД 2 типа с ОИМ давностью до 24 ч. Средний возраст составил 68,9 ± 8,5. Пациенты были разделены на две группы в зависимости от назначения триметазидина. Исходно группы были однородны и сопоставимы по клинико-демографическим характеристикам, а также терапии сахароснижающими препаратами и уровню гликированного гемоглобина. В обеих группах пациентам проводилась стандартная терапия ОИМ. Все больные для коррекции уровня гликемии получали дробную инсулинотерапию в соответствии с международными рекомендациями. В течение первых суток ОИМ больным проводилось МВ-картирование, а также определение уровня МНП на 1-е, 7-е, 21-е сутки ИМ и через 12 месяцев. Пациентам в 1-й группе (n=36) с первых суток ОИМ назначался триметазидин перорально в дозе 35 мг 2 раза в сутки. Во 2-й группе (n=38) пациенты данный препарат не получали.
У больных в группе триметазидина отмечено достоверное снижение на 66,7% частоты приступов стенокардии с 7-го по 21-е сутки (р=0,03), а в группе сравнения изменения были недостоверны (р=0,33). Тенденция к снижению частоты приступов стенокардии на фоне терапии триметазидином сохранялась и к концу 12 месяцев наблюдения: в 1-й группе по сравнению с 7-ми сутками отмечено снижение на 41,7 % (р=0,04). Анализ частоты развития приступов стенокардии за весь период наблюдения показал, что в 1-й группе этот показатель достоверно ниже по сравнению с группой стандартной терапии (44,4% и 60,5% соответственно, р=0,02). В 1-й группе отмечена более высокая переносимость физической нагрузки, а количество принимаемых таблеток нитроглицерина в сутки было достоверно ниже, чем во 2-й группе (0,4 ± 0,03 таб/сут в течение 2-х недель и 0,86 ± 0,05 таб/сут соответственно, р=0,05). К концу наблюдения сохранялась ранее полученная тенденция: количество принимаемых таблеток нитроглицерина в 1-й группе составило 0,14 ± 0,03 таб/сут в течение 2-х недель, во 2-й - 0,43 ± 0,04 таб/сут, р=0,05. Таким образом, по результатам Сиэтловского опросника тяжесть стенокардии в 1-й группе была достоверно ниже, чем во 2-й группе.
На фоне терапии триметазидином отмечено увеличение количества пациентов с I классом ОСН за счет уменьшения частоты II и III класса. Получена обратная корреляционная зависимость между назначением триметазидина и прогрессированием ОСН (r=0,3; р=0,04). При проведении анализа течения ХСН по группам уже к 21 суткам терапии триметазидином отмечалось достоверное нарастание количества пациентов со II ФК (36,1% и 72,2% соответственно, р=0,001) за счет достоверного уменьшения числа пациентов с III ФК (58,3% и 25 % соответственно, р=0,005). Эта тенденция сохранялась и после выписки больных из стационара к 12 месяцу наблюдения. В группе сравнения к 12 месяцу наблюдения по сравнению с 7 сутками ОИМ наблюдалось достоверное уменьшение количества пациентов с III классом ХСН (44,7% и 13,2 % соответственно, р=0,043). Остальные показатели не менялись. Частота повторных госпитализаций в 1-й группе составила 16,7 %, во 2-й группе - 29 % (p=0,05).
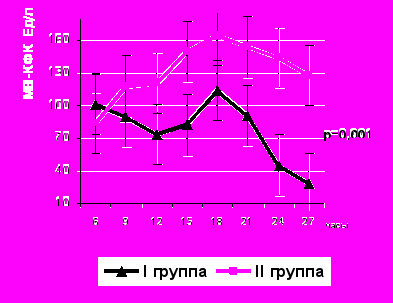
Исследовалось влияние триметазидина на динамику МВ-фракции КФК. В связи с тем, что уровень МВ-КФК у больных с ОИМ при проведении ТЛТ и без нее существенно различался, для анализа динамики МВ-КФК и определения величины зоны некроза больные в обеих группах разделены на две подгруппы в зависимости от ТЛТ (рис. 13). По возрасту, локализации ИМ, классу ОСН, анамнестическим данным подгруппы не различались.