Я. П. Сольский эндокринная гинекология
| Вид материала | Задача |
- «Гинекология», 66.62kb.
- Рабочая учебная программа дисциплины акушерство и гинекология, детская гинекология, 749.47kb.
- История развития гинекологии, 42.5kb.
- Примерная программа наименование дисциплины «акушерство и гинекология» Рекомендуется, 499.66kb.
- Гинекология детей и подростков клиническая лекция асс. Кудина, 128.9kb.
- Программа курса «Акушерство, гинекология и биотехника размножения животных», 86.79kb.
- Реферат по биологии. Тема: «Эндокринная система», 295.02kb.
- Рабочая учебная программа По интернатуре Для специальности 140001 акушерство и гинекология, 510.03kb.
- Рабочая учебная программа По ординатуре Для специальности 140001 акушерство и гинекология, 539.88kb.
- Темы рефератов к экзамену по предмету «Физическая культура», 23.19kb.
182 Эндокринная гинекология
Особенно выраженная тендерная разница, отмеченная в отношении аутоиммунных заболеваний, которые дебютируют в возрасте старше 35 лет, дает основание трактовать их развитие не столько как результат инволюции иммунной системы с возрастом, сколько как следствие неадекватной реакции иммунного статуса на инволюцию репродуктивной системы у женщин.
Следует отметить, что согласно данным C.J. Grossman et al. (1994) у женщин как гуморальная, так и клеточная составляющие иммунного ответа более выражены, чем у мужчин (длительнее продолжительность иммунного ответа, более низкий порог для его развития, а также выше пик антител). Это подтверждает существование феномена, называемого в литературе иммунологическим половым диморфизмом (Grossman С.J. et al., 1994).
Он состоит, прежде всего, в более выраженной реакции женского организма на экзогенные инвазивные факторы — инфекция, чужеродное вмешательство и др. (Grossman C.J. et al., 1994; Druckmann R., 2001).
Так, уровень Ig M выше у женщин, чем у мужчин, при этом уровни Ig G практически не отличаются (Grossman C.J. et al., 1994; Druckmann R., 2001).
Кроме того, у женщин обнаружен более высокий уровень Т-хелперных и меньшее содержание Т-супрессорных клеток, то есть более выраженная активация В-системы иммунитета, что и объясняет вышеупомянутые различия в содержании антител (Grossman C.J. et al., 1994; Druckmann R., 2001).
При этом женщины демонстрируют более сильную реакцию на трансплантаты, у женщин более активна клеточно-опосредованная иммунная реакция на вирусные инфекции (Grossman C.J. et al., 1994; Druckmann R., 2001).
Таким образом, на все экзогенные факторы, которые включаются в той или иной мере в жизнедеятельность организма, женский организм реагирует более остро, чем мужской. Это прослеживается как на уровне системного иммунитета, так и на уровне секреторного (местного). Так, доказано, что у женщин уровни Ig А в моче и в бронхиальных смывах выше, чем у мужчин (Grossman C.J. et al, 1994; Druckmann R., 2001).
,; * При беременности иммунная система женщины настраивается еще более агрессивно на внешние раздражители (у беременных женщин выше уровни антител к Escherichia coli, чем у небеременных) и при этом формирует иммуно-резистентность к плоду, который согласно современным концепциям рассматривается как аллотрансплантат (Grossman C.J. et al., 1994; Druckmann R., 2001).
С другой стороны, у женщин по сравнению с мужчинами больше патологических аутоантител, что, соответственно, и объясняет более частое развитие у них аутоиммунной патологии, которая дебютирует в периоды дисгормо-нальных изменений, особенно с началом инволюции репродуктивной системы (Deborah J. Anderson, 2000; Druckmann R., 2001).
В ходе освещения данного вопроса считаем целесообразным представить
структуру и эволюцию иммунной системы.
Так, органы иммунной системы, обеспечивающие приобретенный иммунитет, принято (Дранник Г.Н., 1999) подразделять на две группы: центральные (первичные) и периферические (вторичные).
Глава 9. Половые стероидные гормоны и иммунная система 183
К центральным органам иммунной системы относятся вилочковая железа (тимус) и костный мозг; к периферическим — селезенка, лимфатические узлы, лимфоглоточное кольцо, лимфоидная ткань слизистых оболочек, а также лимфоидные клетки, циркулирующие в периферической крови (Дранник Г.Н., 1999).
Органы и клетки иммунной системы вместе составляют единый диффузный орган (масса его около 1,5-2 кг, а количество лимфоидных клеток колеблется в пределах 1-2x1012), объединенный общей функцией (Дранник Г.Н., 1999).
Основная функция иммунной системы — иммунный надзор, т.е. защита организма от экзо- или эндогенных веществ, несущих признаки генетически чужеродной информации (Дранник Г.Н., 1999).
Все клетки иммунной системы происходят из единого предшественника — гемопоэтической полипотентной стволовой клетки (рис. 1).
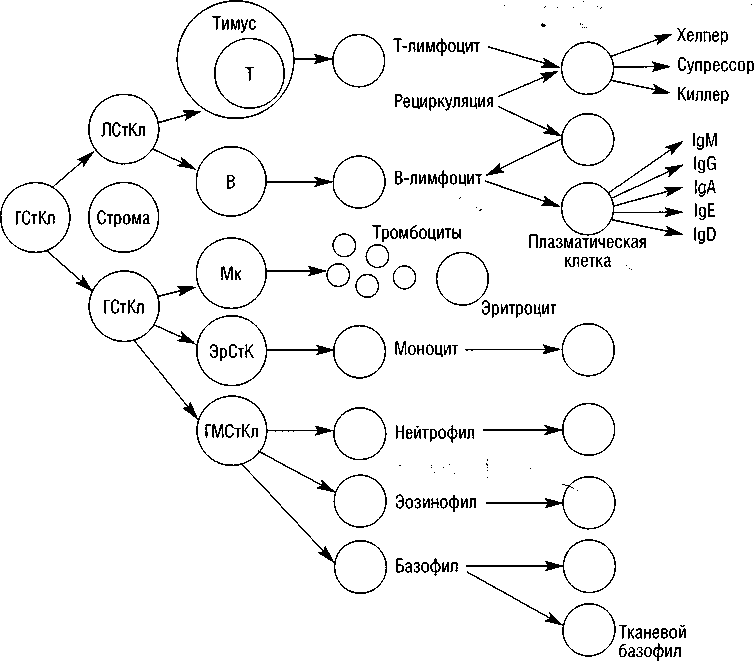
Примечание: ЛСтКл — лимфоидная стволовая клетка; ГСтКл — гемопоэтическая стволовая клетка; ЭрСтКл — эритроидная стволовая клетка; ГМСтКл — гранулоцитарно-моноцитарная стволовая клетка; Мк — мегакариоцитарная стволовая клетка
Рисунок 1. Основные сведения о структуре иммунной системы
184 Эндокринная гинекология
Гемопоэтическая полипотентная стволовая клетка (ГСтКл), в свою оче
редь, происходит из эмбриональной стволовой клетки и обнаруживается у эм
бриона вначале в желточном мешке, а затем в эмбриональной печени. После
рождения местом ее пребывания становится костный мозг. Гемопоэтическая
полипотентная стволовая клетка дает начало лимфоидной стволовой клетке,
из которой образуются Т- и В-лимфоциты, а также миелоидной стволовой
клетке, дающей начало тромбоцитам, гранулоцитам и моноцитам (Дранник Г.Н.,
1999).
Гемопоэтическая полипотентная стволовая клетка располагается в при-костной части костного мозга в тесном контакте со специализированной стромой. Контакты стволовой клетки с клетками стромы и локальная продукция цитокинов являются теми сигналами, которые регулируют пролиферацию и дальнейшую дифференцировку стволовой клетки (Дранник Г.Н., 1999).
Специальными органами, в которых происходит дифференцировка гемо-поэтических стволовых клеток, служат: для Т-лимфоцитов — тимус, для В-лимфоцитов в эмбриональном периоде — печень, во взрослом организме — костный мозг (Дранник Г.Н., 1999).
Процесс формирования элементов иммунной системы происходит в три этапа (табл. 2) и на каждом этапе определяется состоянием гормонального гомео-стаза в определенный период (Дранник Г.Н., 1999; Grossman C.J. et al., 1994).
Таблица 2 Этапы дифференцировки Т- и В-лимфоцитов
(Дранник Г.Н., 1999)
| | 1 этап (ранних предшественников) | II этап (незрелых предшественников) | III этап (зрелых, покоящихся, Т- и В-лимфоцитов) |
| Т-лимфоциты | Протекает в костном мозге. Под действием дифференцированного сигнала на поверхности лимфоидной стволовой клетки экспрессируется рецептор ГП-33 (гликопротеин с молекулярной массой 3,3x1 (ГД) | Протекает в тимусе. ГП-33 трансформируется в антиген, распознающий рецептор (АГРР). Обеспечивается развитие толерантности к аутоантигенам | Протекает в тимусе. На поверхности лимфоцитов появляются дифференцировочные рецепторы для различных субпопуляций |
| В-лимфоциты | Протекает в костном мозге. Под действием дифференцированного сигнала на поверхности лимфоидной стволовой клетки экспрессируется суррогатная легкая цепь (L-цепь) ig M | Протекает в костном мозге. На поверхности В-лимфоцитов экспрессируется молекула Ig M. Обеспечивается развитие толерантности к аутоантигенам | Протекает в костном мозге. На поверхности появляется IgG |
После антигенной стимуляции различные ступени формирования клонов активизируются и приводят к образованию полных функционально зрелых эффекторных лимфоцитарных субклассов (Дранник Г.Н., 1999).
Глава 9. Половые стероидные гормоны и иммунная система 185
В соответствии с международной классификацией все основные антигенные маркеры лимфоцитов и других клеток иммунной системы сведены в группы и обозначены как кластеры дифференцировки (CD). Набор различных CD на отдельных клетках (табл. 3) составляет фенотип (поверхностная характеристика).
Таблица 3 Специфические и неспецифические клетки иммунной системы
(Aydin Arici et al., 1999)
| Клетки | Функция |
| В-лимфоциты | Предшественники антителпродуцирующих клеток |
| Т-лимфоциты | Распознают и взаимодействуют с антигенами, представленными на чужеродных агентах, существуют различные популяции |
| Т-хелперы (CD4+) | Способствуют делению, дифференциации В-клеток и продукции антител |
| Т-цитотоксики (CDe+) | Повреждают клетки-мишени |
| Т-супрессоры | Угнетают активность других Т- и В-клеток |
| Моноциты | Циркулирующие,неспецифические фагоциты, антигенпрезентирующие клетки |
| Макрофаги | Моноциты, мигрирующие в ткани |
| Гранулоциты | фагоцитарные клетки с коротким сроком жизни (2-3 дня), мигрирующие в ткани под влиянием хемотаксиса |
| Естественные киллеры | Неспецифические, цитотоксические клетки, обладают способностью лизировать различные опухоли или вирусинфицированные клетки |
Адгезионной молекулой для главного комплекса гистосовместимости первого класса является CD8+, которая экспрессируется примерно на одну треть периферических Т-клеток. Субпопуляция С08+Т-лимфоцитов включает цито-токсические/супрессорные Т-лимфоциты (Дранник Г.Н., 1999).
Адгезионной молекулой для главного комплекса гистосовместимости второго класса является CD4+, которая экспрессируется на субпопуляции Т-лим-фоцитов-хелперов. В свою очередь, Т-лимфоциты-хелперы разделяются (табл. 4) на две субпопуляции первого и второго типов (Th-1 и Th-2), выполняющие разные хелперные функции за счет продукции разных цитокинов (Дранник Г.Н., 1999).
Гуморальное звено иммунной системы представляют собой В-лимфоциты, продолжительность жизни которых колеблется от нескольких дней до многих лет (Дранник Г.Н., 1999).
Как уже упоминалось (Grossman С J. et al., 1994), кроме антигенной стимуляции, факторами, приводящими к активации иммунной системы, являются изменения гормонального гомеостаза (рис. 2).
186 Эндокринная гинекология

Рисунок 2. Взаимосвязь иммунной и эндокринной систем (по Grossman C.J. et al., 1994 с изменениями и дополнениями)
Таблица 4 Характеристика Т-клеток (Aydin Arici et al., 1999)
| Субпопуляция Т-клеток | Символ | Специфический клайстер дифферен- цировки | Класс главного комплекса гистосов- местимости | Клетка-мишень | Функция |
| Цитотоксики | Тс | CD8 | 1 | Опухоли, вирус-инфицированные клетки и др. | Уничтожение незнакомых клеток и клеток с новыми антигенными свойствами |
| Хелперы | Th | CD4 | 2 | В-клетки, Тс-клетки | Секреция интерлейкинов |
| Индукторы | Th | CD4 | 2 | В-клетки, Тс-клетки предшественники, макрофаги | Секреция интерлейкинов |
| Супрессоры | Ts | CD8 | 2 | В-клетки, Th-клетки, Тс-клетки | Угнетение роста клеток |
| Клетки гиперчувствительности | Tdth | CD4 | 2 | Клетки Лангерганса, макрофаги, Тс-клетки | Уменьшение макрофаг-активи-рующего фактора, фактора угнетения миграции и других цитокинов |
| Клетки памяти | Tm | CD8 CD4 | 1,2 | В-клетки, Т-клетки | Обеспечение иммунного анамнеза |
Глава 9. Половые стероидные гормоны и иммунная система 187
Так, в последние годы доказано (Grossman C.J. et al., 1994), что именно половые стероидные гормоны влияют на способность зрелых эффекторных клеток к реализации иммунного ответа (рис. 3).
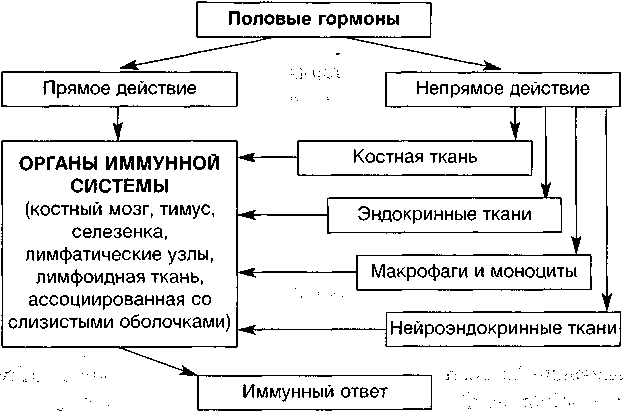
Рисунок 3. Половые стероидные гормоны и иммунный ответ (Druckmann R., 2001)
Прямое воздействие половых стероидных гормонов на органы и ткани
иммунной системы обеспечивается рецепторно-опосредованным путем. В на
стоящее время (Donald P., McDonnell, 2000) отчетливо идентифицируются
различные рецепторы как прогестерона (PRA, PRB), так и эстрогенов (ER-ot,
ER-P). *
В связи с этим определенный интерес представляют сведения о преимуще
ственной локализации подвидов эстрогенных рецепторов в различных орга
нах и тканях, в том числе и иммунной системе, представленные в таблице 7
главы 14 этой книги. ' ' •'• - "■ ■-- '<" ' - '> ,..:,...!
Знание преимущественного размещения рецепторов в различных тканях важно особенно в отношении выбора препарата для лечения эстроген-дефицитных состояний. Так, известно, что 17Р-эстрадиол и эстрадиола валерат действуют в одинаковой степени как на а-, так и на Р-рецепторы эстрогенов. В то же время различные фитоэстрогены 'с разной степенью интенсивности связываются с а- и Р-рецепторами (Donald P., McDonnell, 2000; Michelle P. Warren et al, 2000).
Наличие рецепторов к эстрогенам на ретикулоэпителиальном матриксе тимуса объясняет возможность регуляции функций иммунной системы как непрямым путем — через снижение продукции гормонов тимуса (тимозина, ти-мопоэтина, тимического гуморального фактора, тимулина) и воздействие на уровень цитокинов, так и прямым путем — через лимфоцитарные стероидные рецепторы (Grossman C.J. et al., 1994).
188 Эндокринная гинекология
При этом рецепторы к эстрогенам только в меньшей степени выраженности идентифицированы и на лимфоидных клетках, и на циркулирующих лимфоцитах. Особенно много соответствующих рецепторов на CDg+T-клетках, то есть клетках цитолитической/супрессивной природы (Chernyshov V.P. et al., 2001; Deborah J. Anderson, 2000).
Выявлено, что эстрадиол стимулирует антигенспецифический иммунный ответ, возможно путем угнетения СБ8+Т-клеток и, соответственно, активации С04+Т-клеток, и, впоследствии, регулирует В-клеточную функцию (Chernyshov V.P. et al., 2001; Deborah J. Anderson, 2000).
Кроме того, обнаружено существование как андрогенных, так и эстроген-ных рецепторов и на стромальных клетках костного мозга. Это позволяет предположить, что стромальные клетки представляют собой потенциальную мишень для эстрогенной активности (Kincade P.W. et al., 2000).
Так, эстрогены замедляют продукцию лимфоцитов опосредовано через стромальные клетки, вызывая в них синтез субстанций, супрессирующих В-лимфопоэз. Кроме того, сами предшественники В-лимфоцитов также являются прямой мишенью для половых стероидов. Это важно для генетической идентификации факторов транскрипции и других критических молекул, регулируемых эстрогенами (Kincade P.W. et al., 2000).
Высокая афинность эстрогенных рецепторов проявляется не только на лимфоцитах и клетках костного мозга, но и на тимоцитах, макрофагах и эндо-телиальных клетках (Grossman C.J. et al, 1994).
Влияние эстрогенов на макрофаги и другие антигенпрезентирующие клетки выражено незначительно, но в то же время отмечается повышение фагоцитарной активности и ингибирование макрофагального интерлейкина (ИЛ-1). Таким образом, макрофаги можно рассматривать как мишень прямого и непрямого действия половых гормонов (Grossman C.J. et al., 1994).
Эстрогенные рецепторы обнаружены также на естественных киллерах, основное свойство которых — цитотоксичность и способность продуцировать цитокины (Дранник Г.Н., 1999; Brunelli R. et al., 1996). Это позволяет предположить помимо прямого опосредованный через иммунную систему путь влияния эстрогенов на опухолевый рост (Brunelli R. et al., 1996). v Эстрогены воздействуют не только, как уже упоминалось, на продукцию гормонов тимуса и цитокинов, но и на активацию мембраносвязывающих рецепторов к тимусным гормонам и цитокинам (Дранник Г.Н., 1999; Brunelli R. et al, 1996).
Цитокины — группа белковых соединений или гликопептидов (табл. 5), которые вырабатываются, в основном, активированными клетками иммунной системы, являются медиаторами межклеточных и межсистемных взаимодействий при иммунном ответе, гемопоэзе, воспалении и неспецифичны по отношению к антигенам (Дранник Г.Н., 1999; Brunelli R. et al., 1996).
Эстрогены влияют на цитокины, обеспечивая:
• альтерацию экспрессии цитокинов на уровне транскрипции и посттранскрипционном этапе;
Глава 9. Половые стероидные гормоны и иммунная система 189
Таблица 5 Цитокины, их биологические эффекты и точки приложения (Aydin Arici et a!., 1999)
| Цитокины | Источник | Клетки-мишени | Эффект |
| ИЛ-1 | Макрофаги, В-клетки, ЕК | Т-клетки, В-клетки, макрофаги | Активация лимфоцитов, стимуляция макрофагов, термогенного эффекта и индукция острой стадии воспаления |
| ИЛ-2 | Т-клетки, ЕК | В-клетки, Т-клетки, ЕК, макрофаги | Активация лимфоцитов, макрофагов, стимуляция секреции лимфокинов |
| ил-з | Т-клетки | Стволовые клетки | Пролиферация |
| ИЛ-4 | Т-клетки | В-клетки, макрофаги | Пролиферация лимфоцитов, активация макрофагов, влияние на различные классы иммуноглобулинов |
| ИЛ-5 | Т-клетки | В-клетки, стволовые клетки, эозинофилы | Пролиферация, дифференциация, включение lg A |
| ИЛ-6 | Многочисленные клетки | В-клетки, макрофаги | Пролиферация, стимуляция секреции иммуноглобулинов, индукция острой стадии воспаления |
| ИЛ-7 | Стромальные клетки | Пре -В-клетки, макрофаги | Пролиферация |
| ИЛ-8 | Многочисленные клетки | Нейтрофилы, Т-клетки | Хемотаксис лейкоцитов |
| ИЛ-9 | Т-клетки | Th-клетки | Пролиферация |
| ИЛ-10 | Т-клетки | Т-клетки | Угнетение синтеза лимфокинов |
| ИЛ-11 | Стромальные клетки | Гемопоэтические клетки | Гемопоэз |
| ИЛ-12 | Макрофаги | ЕК | Стимуляция |
| ИЛ-13 | Активированные Т-клетки | Моноциты, В-клетки | Пролиферация В-клеток |
| ИЛ-14 | Т-клетки | В-клетки | Угнетение синтеза иммуноглобулинов |
| ИЛ-15 | Многочисленные клетки | Т-клетки | Пролиферация ■* . |
| ГМ-КСФ | Т-клетки, моноциты | Стволовые клетки, моноциты, гранулоциты | Пролиферация, дифференциация |
| МХП-1 | Многочисленные клетки | Моноциты | Активация хемотаксиса |
| ОНФ | Макрофаги, Т-клетки, ЕК | В-клетки | Рост и дифференциация |
| ЛИФ | Многочисленные клетки | Клетки-предшественники, эмбриональные клетки, трофобласт | Пролиферация, дифференциация |
| Иф-у | Т-клетки, ЕК | Макрофаги, В-клетки | Дифференциация |
Примечание; ИЛ — интерлейкин, ЕК — естественные киллеры, ГМ-КСФ — гранулоцит-макрофаг колониестиму-
лирующий фактор, МХП-1 — моноцит хемотаксический протеин, ОНФ — опухоль некротизирующий фактор, ЛИФ —
лейкоцит ингибирующий фактор, ИФ-у—интерферон }
190 Эндокринная гинекология
- модуляцию экспрессии цитокиновых рецепторов;
- модификацию эффекта цитокинов на клетки-мишени (Alan В. Me Cruden and William H. Stimson, 1994).
Доказано, что адекватный иммунный ответ обеспечивается определенным гормональным гомеостазом, и любые его изменения приводят, соответственно, к нарушению нормальной иммунологической реактивности. Так, в условиях дефицита эстрогенов, т.е. в менопаузе, значительно снижается соотношение CD4+/CD84, повышается уровень CDgt, CD3+ и CD,+, происходит повышение активности естественных киллеров, растет количество и активность В-лимфоцитов (Brunelli R. et al., 1996; White H.D. et al., 1997).
Таким образом, обобщая данные о воздействии эстрогенов на иммунный ответ (рис. 4), следует, однако, отметить дозозависимость влияния эстрогенов на Т-, В-лимфоциты и на иммунную систему в целом (Grossman C.J. et al., 1994).

