«Ставропольская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
| Вид материала | Автореферат |
- «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению, 423.77kb.
- «Челябинская государственная медицинская академия федерального агентства по здравоохранению, 333.68kb.
- «Санкт-Петербургская государственная педиатрическая медицинская академия Федерального, 682.04kb.
- «Астраханская государственная медицинская академия Федерального агентства по здравоохранению, 341.75kb.
- Рабочая учебная программа по физической культуре для специальности 040400 стоматология, 649.09kb.
- «Пермская государственная медицинская академия имени академии Е. А. Вагнера Федерального, 315.55kb.
- Рабочая учебная программа по нормальной физиологии Электив «Физиологические основы, 90.61kb.
- Фомин Михаил Владимирович ТоксиколОго-гигиеническая характеристика компонентов производства, 338.79kb.
- Рабочие учебные программы по немецкому языку для специальностей 060101 − «Лечебное, 3171.73kb.
- Рабочая учебная программа по патологической физиологии для специальности 060105 стоматология, 432.52kb.
Структура клинических исходов у больных ИБС в течение 2-х лет после ОКС. За период наблюдения конечных точек (КТ) достигли 126 больных (45,0%), в том числе умерло 34 пациента (12,1%). В 28 случаях причиной смерти оказался ОИМ, у 4 больных – острая коронарная недостаточность. Ещё двое больных умерли в результате ишемического инсульта и массивного желудочного кровотечения осложнённого шоком. В дальнейшем анализе в качестве случаев «сердечной смерти» учитывали летальные исходы в результате ОИМ и острой коронарной недостаточности. У 35 больных имел место нефатальный ОИМ, у 57 отмечалось прогрессирование стенокардии. Операцию реваскуляризации на коронарных артериях за период наблюдения перенесли 11 больных – 9 мужчин и 2 женщины. 6 пациентов были оперированы по поводу атеросклероза периферических сосудов. Однократное обострение ИБС в течение 24 месяцев зафиксировано у 90 (32,1%) больных; у 36 (12,9%) конечные точки имели место дважды.
За первые 12 месяцев конечных точек достигли 66 больных, т.е. более половины (56,9%) пациентов с неблагоприятным течением ИБС и почти каждый четвёртый (23,6%) из всей обследованной группы. Аналогичные соотношения благоприятного и неблагоприятного течения ИБС зафиксированы на втором году наблюдения. Суммарная частота эпизодов нестабильной стенокардии на втором году наблюдения оказалась выше, чем на первом (57,1% против 41,7%, р=0,04). Отмечена тенденция к большей частоте развития как фатального, так и нефатального ОИМ в течение первого года наблюдения. Частота летальных исходов в результате острой коронарной недостаточности также оказалась выше в первые 12 месяцев после ОКС (5,0% против 1,8%, р=0,05).
Не было выявлено статистически значимых различий по факту достижения конечных точек, их количеству, а также по структуре неблагоприятных исходов между мужчинами и женщинами, за исключением частоты летального исхода. Среди умерших больных достоверно преобладали мужчины (94%, р<0,04).
Клинико-анамнестические характеристики, факторы риска и клинические исходы в течение 24 месяцев после ОКС. Пациенты, достигшие конечных точек в течение двух лет после ОКС, достоверно отличались от больных с благоприятным течением ИБС по ряду анамнестических характеристик и показателей соматического статуса, ранее уже ассоциировавшихся с неблагоприятным исходами при коронарной патологии. Более высокий риск достижения коронарной конечной точки имели пациенты, ранее перенёсшие инфаркт миокарда, страдающие артериальной гипертензией, симптомным атеросклерозом периферических артерий (АПА), с ФВ ЛЖ < 54%, а также с желудочковой экстрасистолией 4-5 классов (Lown) в период ОКС. Больные с неблагоприятным течением ИБС были достоверно моложе (в среднем на 4 года). Для пациентов, переживающих индивидуально значимую психотравмирующую ситуацию, значения ОШ достижения конечной точки составили 2,2 с 91% вероятностью (табл. 1).
Таблица 1
Анализ вероятности наступления неблагоприятного исхода в течение 24 месяцев после ОКС в зависимости от присутствия отдельных факторов сердечно-сосудистого риска
| Изучаемые показатели | Не достигли КТ (n=154), n (%) | Достигли КТ (n=126), n (%) | ОШ (95% ДИ) | р (χ2) |
| Клинико-анамнестические характеристики | ||||
| Пол: мужчины женщины | 30 (19,5) | 24 (19,0) | 0,97 (0,54; 1,77) | 0,92 |
| Возраст старше 55 лет | 94 (61,0) | 46 (36,5) | 0,37 (0,23; 0,6) | 0,001 |
| Возраст старше 45 лет | 138 (93,2) | 110 (87,3) | 0,5 (0,22; 1,14) | 0,1 |
| ИМ в анамнезе | 56 (36,4) | 80 (63,5) | 3,04 (1,87; 4,96) | 0,001 |
| Отягощённый семейный анамнез | 34 (22,1) | 36 (28,6) | 1,41 (0,82; 2,43) | 0,21 |
| НРС в анамнезе | 56 (36,4) | 52 (41,3) | 1,23 (0,76; 1,99) | 0,4 |
| Табакокурение | 76 (49,4) | 66 (52,4) | 1,13 (0,71; 1,81) | 0,61 |
| Депрессивное состояние в течение года до ОКС | 74 (48,1) | 58 (48,0) | 0,92 (0,58; 1,48) | 0,74 |
| Психологические потрясения в течение года до ОКС | 40 (26,0) | 44 (34,9) | 1,53 (0,92; 2,56) | 0,11 |
| Индивидуально-значимая стрессовая ситуация в течение года до ОКС | 120 (77,9) | 108 (85,7) | 1,7 (0,91; 3,19) | 0,09 |
| Высокая физ. активность | 23 (14,9) | 7 (5,6) | 0,34 (0,14; 0,81) | 0,02 |
| Артериальная гипертензия | 60 (51,9) | 98 (77,8) | 3,24 (1,91; 4,48) | 0,001 |
| Сахарный диабет, 2 тип | 18 (11,7) | 20 (15,9) | 1,43 (0,72; 2,83) | 0,31 |
| АПА | 18 (11,7) | 30 (23,8) | 2,36 (1,25; 4,48) | 0,009 |
| Клинико-функциональные и лабораторные параметры | ||||
| ИМТ > 25 кг/м2 | 54 (35,1) | 32 (25,4) | 0,78 (0,46; 1,31) | 0,34 |
| ФВ ЛЖ < 54% | 54 (40,9) | 60 (55,0) | 1,77 (1,07; 2,91) | 0,03 |
| ФВ ЛЖ ≤ 40% | 8 (6,8) | 10 (9,1) | 1,37 (0,52; 3,62) | 0,52 |
| Гиперлипидемия | 98 (63,6) | 84 (66,7) | 1,14 (0,69; 1,87) | 0,59 |
| Креатинин > 115 мкмоль/л | 19 (12,3) | 14 (11,1) | 1,1 (0,6; 2,3) | 0,91 |
| Клинико-электрокардиографические и лабораторные характеристики ОКС | ||||
| Q-ОИМ в исходе ОКС | 44 (28,6) | 34 (27,2) | 0,95 (0,57; 1,59) | 0,86 |
| ОКСП ST | 50 (33,3) | 42 (33,3) | 1,0 (0,6; 1,65) | 1,0 |
| Депрессия сегмента ST | 35 (22,7) | 34 (26,9) | 1,47 (0,85; 2,54) | 0,16 |
| Желудочковая э/систолия | 52 (33,8) | 58 (46,0) | 1,67 (1,03; 2,72) | 0,04 |
| Повышение тропонина Т | 60 (39,0) | 46 (36,5) | 0,9 (0,55; 1,46) | 0,67 |
Достоверно более низкий риск развития неблагоприятных исходов имели больные с высоким уровнем физической активности до эпизода ОКС, а также сравнительно более пожилые пациенты (табл. 1). Среди больных, неоднократно достигших конечных точек, по сравнению со случаями однократного достижения КТ за период наблюдения оказалась более высокой доля лиц с ФВ ЛЖ < 54% (88% против 42%, ОШ 10,4 (3,37; 32,2), р<0,001), симптомным АПА (44,4% против 15,6%, ОШ 4,3 (1,8; 10,4), р=0,001), нарушениями ритма и проводимости сердца (НРС), сопровождавшими ОКС (61% против 40%, ОШ 2,4 (1,1; 5,2), р=0,03), и депрессивным состоянием на протяжении предшествующего ОКС года (61% против 40%, ОШ 2,4 (1,1; 5,2), р=0,03).
Установлено наличие прямой умеренной корреляционной связи (r=0,5, p=0,001) между количеством факторов кардиоваскулярного риска и частотой эпизодов дестабилизации ИБС в течение 24 месяцев после ОКС.
Больные, перенесшие нефатальный ОИМ, отличались от пациентов с благоприятным исходом большей частотой отягощённости анамнеза инфарктом миокарда (65,1% против 36,4%, ОШ 3,26 (1,77; 6,02), р<0,001), более высокой долей пациентов, переживающих состояние дистресса (90,5% против 77,9%, ОШ 2,69 (1,07; 7,78), р=0,04) и имеющих сниженную ФВ ЛЖ (72,9% против 40,9%, ОШ 3,88 (1,98; 7,59), р<0,001) и НРС в период ОКС (55,6% против 33,8%, ОШ 2,45 (1,35; 4,46), р=0,003). В возрасте старше 55 лет больные реже переносили инфаркт миокарда (20,6% против 61%, ОШ 0,16 (0,08; 0,33), р<0,001) в течение 24 месяцев после ОКС. Средний возраст пациентов с перенесённым после ОКС нефатальным ОИМ (52,1±8,0 лет) оказался достоверно меньше, чем у больных, не перенёсших сердечно-сосудистых событий (57,5±7,8 лет, р=0,001).
При сравнении групп пациентов с разными вариантами ОИМ в период наблюдения оказалось, что достоверно более высокий риск смерти от ОИМ ассоциирован с наличием инфаркта миокарда в анамнезе (ОШ 3,5 (1,13; 10,6), р=0,03), ОКС с подъёмом сегмента ST (ОШ 1,2 (1,17; 9,5), р=0,02), повышением тропонина Т (ОШ 4,2 (1,55;13,1), р=0,006), с нарушениями сердечного ритма и проводимости (ОШ 3,3 (1,16; 9,61), р=0,026) и исходом ОКС в Q-позитивный ОИМ (ОШ 6,4 (2,03; 20,4), р=0,002), с гиперлипопротеидемией (ОШ 1,4 (1,14; 14,0), р=0,03) главным образом за счёт более высоких показателей ХС ЛПНП (р=0,05), а также с более низким показателем ФВ ЛЖ (р=0,005). Следует отметить, что больные с ФВ ЛЖ < 40% встречались только среди умерших от ОИМ в ходе 24-месячного наблюдения.
Из числа пациентов с повторными ОКС в виде нестабильной стенокардии, в отличие от группы больных с нефатальным ОИМ, преобладали больные старше 55 лет (ОШ 7,48) Средний возраст в данной подгруппе составил 56,4±7,9 лет против 51,03±5,4 лет – у пациентов, перенёсших острый инфаркт миокарда (р=0,001).
Умершие больные отличались от пациентов, не перенёсших неблагоприятных клинических событий вообще, по нескольким основным параметрам. Высокий риск смерти наиболее достоверно имели пациенты с артериальной гипертензией (ОШ 6,48 (2,17; 19,34), р=0,001), со снижением ФВ ЛЖ < 54% (ОШ 3,97 (1,65; 9,58), р=0,002), с инфарктом миокарда в анамнезе (ОШ 5,25 (2,21; 12,47), р<0,001), симптомным атеросклерозом периферических артерий (ОШ 4,53 (1,9; 10,8), р=0,001), с нарушением сердечного ритма и проводимости в период ОКС (ОШ 4,07 (1,79; 9,23), р=0,001) главным образом, в виде пароксизмов желудочковой тахикардии (ОШ 2,2 (1,09; 4,5), р=0,05), с ОКС, сопровождающимся подъёмом сегмента ST (ОШ 2,57 (1,18; 5,59), р=0,02), повышением сывороточного уровня тропонина Т (ОШ 2,61 (1,19; 5,73), р=0,02) и исходом в Q-позитивный ОИМ (ОШ 2, 8 (1,31; 6,18), р=0,008).
Более высокий риск летального исхода (ЛИ) по сравнению с пациентами, перенесшими нефатальные коронарные события, имели больные с ФВ ЛЖ менее 54% (ОШ 2,8 (1,1; 6,84), р=0,03) (средняя ФВ 45,3±9,9, р<0,001) и, особенно, с ФВ ЛЖ менее 40% (ОШ 15,6 (3,07; 79,3), р=0,001), больные с исходом ОКС в Q-позитивный ОИМ (ОШ 5,29 (2,22; 12,59), р<0,001), с ОКС, сопровождающимся подъёмом сегмента ST (ОШ 4,09 (1,75; 9,54), р=0,001), с повышением сывороточного уровня тропонина Т (ОШ 4,7 (2,0; 11,15), р<0,001), нарушением сердечного ритма и проводимости в период ОКС (ОШ 3,7 (1,5; 8,9), р=0,003), в частности, с пароксизмальной желудочковой тахикардией (ОШ 2,7 (1,3; 5,5), р=0,04). Очевидно, что данные анамнеза, за исключением гендерных различий, в данном случае утратили свою предиктивную способность. Меньший риск смерти от сердечно-сосудистых причин по сравнению с пациентами, перенесшими нефатальные коронарные события, имели женщины (ОШ 0,21 (0,05; 0,96), р=0,04).
Учитывая спектр ФР, продемонстрировавших достоверную ассоциацию с неблагоприятным течением ИБС, проанализирована предиктивная значимость сочетания нескольких факторов сердечно-сосудистого риска. Со значительным повышением риска сердечно-сосудистых событий вообще (ОШ 4,32 (2,02; 8,14), р=0,001), фатального ИМ (ОШ 3,56 (1,78; 7,13), р=0,01) и сердечной смерти, в частности (ОШ 2,3 (1,06; 5,61), р=0,02), достоверно связано сочетание 4 и более факторов кардиоваскулярного риска.
По результатам применения критерия log-rank, вероятность стабильного течения ИБС в течение 2 лет после перенесённого ОКС была достоверно ниже у пациентов старше 45 лет (р<0,01), в случае ассоциации коронарной патологии с артериальной гипертензией (р=0,02), атеросклерозом периферических артерий (р=0,04), ФВ ЛЖ<50% (р=0,05), желудочковой экстрасистолией 4-5 класса (Lown) в период ОКС (р=0,03). Более короткая продолжительность жизни после ОКС была характерна для мужчин (271,7 против 698,0 дня у женщин, р=0,008), больных с симптомным АПА (194,5 против 370,6 дня, р=0,02), имевших невысокий уровень физической активности (257,4 против 513,8 дня, р=0,03), пониженную ФВ ЛЖ (250,9 против 446,8 дня, р=0,04), а также перенёсших ОКС с повышением уровня маркёров некроза миокарда (141,4 против 379,5 дня, р=0,02).
Фенотипические характеристики и клинические исходы в течение 24 месяцев после ОКС. У 280 больных ишемической болезнью сердца, перенёсших ОКС, и у 216 практически здоровых людей был изучен ряд внешних фенотипических характеристик. Установлена большая частота встречаемости при ИБС таких внешних морфогенетических вариантов, как волосяные дорожки (ОР 5,2, р=0,001), неодинаковая длина бровей (ОР 2,7, р=0,01) и вросшие ногти (ОР 2,4, р=0,01). Среднее количество стигм, выявленных при внешнем осмотре у больных, равнялось 8,8 и превышало аналогичный показатель у здоровых (5,1, р=0,02).
Определялось преобладание в группе пациентов с ИБС лиц с каштановым (49,4%, ОР=1,1, р=0,2) и черным (42,4%, ОР=1,6, р=0,1) цветом волос. У лиц с черным цветом волос достоверно чаще регистрировались осложнения ИБС и клинические состояния, повышающие риск неблагоприятных сердечно-сосудистых событий. У 57,9% больных мужчин с черным цветом волос коронарная болезнь манифестировала острым инфарктом миокарда. У большинства пациентов с русым цветом волос (68,4%, р=0,006) ИБС не сопровождалась развитием инфаркта миокарда. В нашем исследовании больных с рыжим цветом волос было 2,2%. Следовательно, лица с русым и рыжим цветом волос не относятся к группе высокого риска развития ИБС и инфаркта миокарда. При отоскопическом исследовании установлено преобладание лиц с влажным типом ушной серы как среди больных ИБС (75,4%), так и среди здоровых людей (60%). Среди больных ИБС отчётливо преобладали лица, имеющие гиперстенический тип телосложения (66,1%, р<0,001).
Проведён анализ различий исследуемых фенотипических характеристик в группах с благоприятным и различными вариантами неблагоприятных исходов при долгосрочном наблюдении.
Согласно данным таблицы 2, выявлена достоверная ассоциация повторных обострений ИБС (в том числе неоднократных) с наличием у больных низкой границы роста волос, вросших ногтей, чёрного цвета волос, гиперстенического телосложения, роста менее 170 см, а также более 4 и, особенно, более 7 стигм дисэмбриогенеза.
Таблица 2
Анализ риска развития неблагоприятного исхода у больных ИБС в течение 24 месяцев после ОКС в зависимости от присутствия отдельных фенотипических характеристик
| Фенотипические характеристики | Не достигли КТ (n=154), n (%) | Достигли КТ (n=126), n (%) | ОШ (95% ДИ) | р (χ2) |
| Долихоцефалия | 60 (39,0) | 22 (17,5) | 0,33 (0,19; 0,58) | 0,003 |
| Низкая граница роста волос | 28 (18,2) | 57 (45,2) | 3,72 (2,17; 6,37) | 0,001 |
| Волосяные дорожки | 22 (14,3) | 26 (20,6) | 1,56 (0,84; 2,91) | 0,16 |
| Неодинаковая длина бровей | 30 (19,5) | 14 (11,1) | 0,52 (0,26; 1,02) | 0,06 |
| Вросшие ногти | 7 (4,5) | 32 (25,4) | 7,15 (3,03; 16,9) | 0,002 |
| Стигмы дисэмбриогенеза: | | | | |
| более 4 | 60 (39,0) | 88 (69,8) | 3,63 (2,2; 5,98) | 0,01 |
| более 7 | 10 (6,5) | 38 (30,2) | 6,22 (2,95; 13,1) | 0,001 |
| Цвет волос: | | | | |
| светлый | 34 (22,1) | 23 (18,3) | 0,79 (0,44; 1,42) | 0,43 |
| каштановый | 92 (59,7) | 59 (46,8) | 0,59 (0,37; 0,95) | 0,03 |
| чёрный | 30 (19,5) | 44 (34,9) | 2,2 (1,29; 3,81) | 0,004 |
| Тип ушной серы: | | | | |
| влажный сухой | 88 (57,1) | 86 (68,3) | 1,6 (0,98; 2,64) | 0,06 |
| Телосложение: | | | | |
| гиперстеническое | 12 (7,8) | 29 (23,0) | 3,54 (1,72; 7,27) | 0,001 |
| нормостеническое | 118 (76,6) | 87 (69,0) | 0,69 (0,41; 1,18) | 0,18 |
| астеническое | 22 (14,3) | 8 (6,3) | 0,68 (0,4; 1,16) | 0,4 |
| Рост: | | | | |
| ≤ 170 см 170 см | 120 (77,9) 34 (22,1) | 69 (54,8) 57 (45,2) | 2,92 (1,74; 4,89) | 0,005 |
Достоверно более низкий риск развития неблагоприятных исходов имели больные с долихоцефалией и светлым цветом волос. Реже достигали повторных конечных точек светловолосые пациенты и нормостеники. Комбинации этих стигм могут быть использованы в первоначальной оценке прогноза у больных, перенёсших острый коронарный синдром (табл. 2).
Наличие прямой достоверной связи между частотой эпизодов дестабилизации ИБС в течение 24 месяцев и количеством стигм дисэмбриогенеза (r=0,4, p=0,03) подтверждено результатами корреляционного анализа.
Профиль достоверных внешних фенотипических отличий больных, перенёсших ОИМ или умерших от кардиальных причин, по сравнению с пациентами, не достигшими КТ в течение 24 месяцев после ОКС, включал большинство стигм, которые были свойственны больным ИБС в целом: вросшие ногти (ОШли 11,0, ОШоим 17,9), низкая граница роста волос (ОШли 5,79, ОШоим 6,84), более 4 (ОШли 6,4, ОШоим 9,4) и, особенно, более 7 (ОШли 8,64, ОШоим 13,1) стигм дисэмбриогенеза, влажный тип ушной серы (ОШли 5,25, ОШоим 2,63), чёрные волосы (ОШли 2,48, ОШоим 2,91), гиперстеническое телосложение (ОШли 4,8, ОШоим 4,73) и рост менее 170 см (ОШли 3,5, ОШоим 3,21). Повышенный риск сердечной смерти при сравнении с больными, перенёсшими нефатальные сердечно-сосудистые события, ассоциировался лишь с влажным типом ушной серы (ОШ 4,5 (1,46; 13 ,9), р=0,009).
Редко фиксировали случаи летального исхода у больных с долихоцефалией (ОШ 0,28 (0,1; 0,75), р=0,01) и у нормостеников (ОШ 0,41 (0,19; 0,92), р=0,03). Достоверно более низкий риск развития ОИМ также имели больные с долихоцефалией (ОШ 0, 2 (0,08; 0,46), р<0,001), с астеническим (ОШ 0,41 (0,13; 1,23), р=0,01) или нормостеническим телосложением (ОШ 0,5 (0,26; 0,93), р=0,03). Для астеников повторное развитие эпизодов ОКС в течение 24 месяцев было также нехарактерно (ОШ 0,34 (0,04; 2,86), р=0,3).
Анализ двухлетней выживаемости позволил установить фенотипические характеристики, ускоряющие развитие повторных обострений ИБС. К ним следует отнести наличие более 4 (р=0,02) и, особенно, более 7 (р<0,001) стигм дисэмбриогенеза, а также гиперстеническое телосложение (р=0,001). Больные, имевшие более 7 стигм дисморфогенеза, характеризовались более коротким, по сравнению с менее стигмированными пациентами, периодом до развития нефатального ОИМ (283,9 против 444,5 дня, р=0,007), нестабильной стенокардии (251,0 против 342,8 дня, р=0,02) и сердечной смерти (133,2 против 383,6 дня, р<0,001).
Полиморфизм антигенных систем групп крови, резус-принадлежность и клинические исходы в течение 24 месяцев после ОКС. Проведён анализ риска повторного обострения ИБС в зависимости от иммуногенетических маркеров систем АВ0, MN и Kell в группах с благоприятным (32 пациента) и неблагоприятным (38 больных) исходами по прошествии 24 месяцев после клинико-биохимической стабилизации.
Выявлена достоверная связь осложнённого течения ИБС с наличием у больных II (А) группы крови (ОШ 3,03 (1,74; 5,27), р<0,001) и ММ фенотипа (ОШ 2,38 (1,38; 4,07), р=0,002). Достоверно более низкий риск развития неблагоприятных исходов имели носители I (0) группы крови (ОШ 0, 49 (0,28; 0,88), р=0,02) и NN фенотипа (ОШ 0, 42 (0,22; 0,78), р=0,007).
Среди больных, неоднократно достигших конечных точек, доля пациентов со II (0) группой крови оказалась выше (ОШ 2,77 (1,25; 6,13), р=0,01). С наиболее низким риском неоднократных повторных обострений ИБС ассоциировалось наличие III (B) группы крови (ОШ 0,21 (0,06; 0,75), р=0,02) и Kell-позитивность (ОШ 0,33 (0,12; 0,87), р=0,03).
Больные, перенесшие ОИМ, отличались от лиц, не перенесших неблагоприятных сердечно-сосудистых событий, большей частотой встречаемости II (А) группы крови (ОШ 4,48 (2,34; 8,57), р=0,01) и MМ-фенотипа (ОШ 2,9 (1,5; 5,5), р=0,01). При этом вероятность развития фатального ОИМ оказалась выше у обладателей ММ-фенотипа (ОШ 6,1 (2,01; 18,3), р=0,03). Kell-позитивные больные (ОШ 0,47 (0,22; 1,0), р=0,05) с I (0) группой крови (ОШ 0,16 (0,06; 0,46), р=0,01) и NN-фенотипом (ОШ 0,42 (0,18; 0,95), р=0,04) реже переносили инфаркт миокарда.
Высокий риск смерти в течение 24 месяцев после ОКС в сравнении с не достигшими КТ наиболее достоверно имели пациенты со II (А) группой крови (ОШ 4,9 (2,19; 11,1), р=0,02) и ММ-фенотипом (ОШ 5,3 (2,38; 11,9), р=0,01), более низкий риск развития летального исхода имели носители NN-фенотипа (ОШ 0,18 (И 0,04); 0,78, р=0,02) и обладатели I (0) группы крови (ОШ 0,16 (0,04; 0,68), р=0,01). Среди пациентов, достигших конечных точек, более высокий риск смерти от сердечно-сосудистых причин имели только ММ-позитивные пациенты (ОШ 2,94 (1,28; 6,72), р=0,01).
Среднее время дожития до конечной точки было меньше у обладателей ММ-фенотипа (248,9 против 338,7 дня, р=0,02) и А (II) группы крови (305,6 против 436,9 дня, р=0,002) по сравнению с больными, имевшими другой фенотип.
Личностно-характерологические особенности, спектр патопсихологических нарушений и двухлетний прогноз у больных ИБС. Отличия средних значений психологических показателей у 280 пациентов основной группы от таковых у здоровых людей, согласно результатам многовекторного анализа, носили в целом негативный характер. Психопатологические изменения достигали невротического уровня по шкалам вегетативных нарушений и невротической депрессии (р<0,001), истерического реагирования (р<0,01), а также по шкалам обсессивно-фобических нарушений, невротической и конституциональной тревоги (р<0,05). Распространённость у больных ИБС психопатологических нарушений, соответствовавших диапазону пограничных психических расстройств, составила 86,4%. У большинства больных психические расстройства «зашторивались» соматическими жалобами, носили атипичный характер. Личностно-характерологический профиль больных коронарной болезнью характеризовался рядом достоверных отличий от группы здоровых: снижением интеллектуальных функций, ухудшением способности к обучению, меньшей эмоциональной устойчивостью, внутренней озабоченностью, чувствительностью, подозрительностью, консерватизмом и зависимостью от социального одобрения, демонстративностью поведения, стойкостью аффекта, низким контролем над влечениями, импульсивностью, склонностью к снижению общего фона настроения и идеомоторной заторможенностью.
Анализ психологических свойств личности больных ИБС с позиций конституциональной психиатрии и психологии (Э. Кречмер, К. Леонгард, А.Е. Личко) позволил выделить подгруппы с циклоидной, истероидной, шизоидной, эпилептоидной, а также смешанной структурой психотипа личности. Среди больных коронарной болезнью достоверно чаще встречались лица с циклоидной (29%, ОР 2,4, p<0,05) и истероидной (22%, ОР 2,1, p<0,05) структурами психотипов. Различий в частоте психотипов с эпилептоидной и смешанной структурами отмечено не было.
С помощью дискриминантного анализа была проведена оценка характера и степени выраженности различий в психологическом профиле больных ИБС с учётом половозрастных и социальных характеристик, клинических особенностей коронарной болезни, наличия сопутствующей патологии, гено-фенотипических параметров. Сдвиги, предрасполагающие к формированию аномальных личностных и поведенческих реакций, способные усугубить проявления коронарной болезни, обнаружены у гиперстеников, пациентов в возрасте старше 50 лет, имеющих нарушения ритма сердца, ОНМК и/или более одного ОИМ в анамнезе, находящихся на инвалидности, а также у обладателей тёмного цвета волос, 7 и более стигм дисэмбриогенеза.
Анализ связи психологических характеристик и спектра психопатологических нарушений с клиническими исходами у больных в течение 2-х лет после перенесённого ОКС показал, что наибольшей прогностической значимостью в отношении риска неблагоприятного течения ИБС обладает взаимосочетание циклоидной структуры личностного психотипа и показателей шкал астении, невротической депрессии, тревоги и истерического реагирования, характеризующих степень выраженности психопатологической симптоматики. Высокий уровень чувствительности полученной прогностической модели отражает значение D2 Махаланобиса (74,13). Истероидная структура личностного психотипа в сочетании с высоким уровнем тревожности, демонстративности, эмотивности и экзальтированности, является предиктором неоднократных эпизодов дестабилизации в течение 2-х лет после перенесённого острого коронарного синдрома. Анализ степени дифференцированности личностно-характерологического профиля в группах больных с благоприятным исходом и различными вариантами дестабилизации ИБС (эпизоды нестабильной стенокардии, ОИМ, летальный исход) не выявил информативных параметров, что не позволило построить достоверные патопсихолого-математические модели дискриминации.
Полиморфизм генов-кандидатов ИБС и маркёры эндотелиальной дисфункции в определении двухлетнего прогноза после ОКС. Варианты I/D полиморфизма гена ACE позволили сформировать 3 группы: 69 пациентов (28,5%) имели генотип II, 56 (23,1%) – генотип DD, а 117 (48,3%) пациентов оказались гетерозиготными. Частота аллеля I составила 0,53, а аллеля D – 0,47. Распределение аллелей и генотипов гена ACE и других обсуждаемых ниже генов соответствовало равновесию Харди-Вайнберга.
Показана более высокая частота встречаемости носителей генотипа DD среди пациентов моложе 45 лет по сравнению с обладателями II генотипа (16,4% против 1,5%, р=0,02), вместе с тем последние чаще встречались в старшей возрастной группе (>60 лет) (37,7% против 19,6%, р=0,03). Обладатели DD генотипа характеризовались более ранней клинической манифестацией ИБС (48,2±5,2 против 54,9±5,8 года, р=0,05).
Среди носителей DD генотипа преобладали пациенты с атеросклерозом периферических артерий (32,1% против 11,6%, р=0,04), ФВ ЛЖ < 40% (16,1% против 5,8%, р=0,05) и на уровне тенденции – больные, ранее перенесшие ОИМ (60,7% против 52,2%, р=0,06) и переживающие индивидуально значимую психотравмирующую ситуацию (92,9% против 78,3%, р=0,06). Пациенты с DD генотипом по сравнению с носителями других генотипов АСЕ характеризовались склонностью к гиперкоагуляции в виде наиболее короткого времени свёртывания крови. Более низкая систолическая функция левого желудочка была характерна для гомозигот DD (49,5±8,8% против 55,7±8,3% у II гомозигот, р<0,001).
Генотип Glu/Glu полиморфного маркёра Glu298Asp гена NOS3 имел 91 больной (37,6%), Glu/Asp – 122 (50,4%), Asp/Asp – 29 (11,9%) больных. Частота аллеля Glu cоставила 0,63, аллеля Asр – 0,37. Группы больных с различными вариантами полиморфизма Glu298Asp гена NOS3 были сопоставимы по большинству изученных факторов риска атеросклероза, но имели клинико-анамнестические особенности. Обладатели Asр/Asр генотипа достоверно раньше гомозигот Glu/Glu заболевали коронарной болезнью (49,4±5,6 против 55,3±5,2 года, р=0,04). У носителей аллеля Asр достоверно чаще ОКС сопровождался подъёмом сегмента ST (37,4% против 20,7%, р=0,01), а фракция выброса левого желудочка была ниже (49,5±4,3% против 56,8±5,2%, р=0,02).
Изучение характера распределения генотипов полиморфизма Lys198Asn гена EDN1 у больных ИБС позволило выявить 143 (59,1%) гомозиготы Lys/Lys, 90 (37,2%) гетерозигот и 8 (3,31%) гомозигот Asn/Asn. Частоты аллелей Lys и Asn составили 0,78 и 0,22.
Показана достоверная связь между Lys/Lys генотипом и избыточной массой тела. Генотип Lys/Lys встречался более чем у половины (50,7%) больных с ИМТ >25 кг/м и лишь у четверти (22,4%) пациентов с нормальной массой тела (р=0,02). Три четверти лиц с нормальной массой тела являлись носителями аллеля Asn.
Выявлены статистически значимые различия показателей свёртывающей системы крови между носителями аллеля Asn и Lys. У носителей аллеля Lys зарегистрированы более короткие время свёртывания крови (512±64,3 сек против 584±96, сек, р=0,01) и время рекальцификации плазмы (98,4±15,7 сек против 119,3±17,8 сек, р=0,02) по сравнению с больными ИБС, не имеющими аллеля Lys в генотипе.
Распределение вариантов полиморфизма VNTR по интрону 4 гена NOS3, идентифицированных у 242 больных, оказалось следующим: 30 пациентов (12,4%) имели 4а4а генотип, 61 (25,2%) – 4а4b, 151 (62,4%) больной был гомозиготным по аллелю 4b. Частоты аллелей 4a и 4b составили 0,25 и 0,75 соответственно. Обладатели генотипа 4a4a оказались в среднем на 4 года старше носителей аллеля 4b (59,13±8,2 против 55,23±7,6 при генотипе 4а4b, р=0,05; 59,13±8,2 против 55,77±8,1 при генотипе 4b4b, p=0,06). Около половины (46,7%) этих пациентов оказались старше 60 лет, а большинство носителей аллеля 4b принадлежали к возрастной группе от 46 до 60 лет (4a4b – 72,1%, р=0,006, 4b4b – 61,6%, р=0,07). Средний возраст начала ИБС у носителей различных вариантов полиморфного маркёра 4a/4b гена NOS3 не различался. Среди носителей 4b4b генотипа, по сравнению с гомозиготами 4а4а, достоверно чаще встречались пациенты с ФВ ЛЖ < 54% (48,2% против 25%, р=0,01).
Генотип GG полиморфного маркёра G(-455)A гена FGB имели 100 из 170 больных (58,8%), GА – 43 (25,3%), АА – 27 (15,9%) больных. Частота аллеля G составила 0,71, а аллеля A – 0,29. Подгруппы не различались по основным клинико-анамнестическим характеристикам. Исключение составила ассоциация гиперлипидемии с генотипом АА (76,0%) в отличие от варианта GG (59,3%, р=0,05). У пациентов с АА генотипом, в отличие от гомозигот по аллелю G, отмечалась умеренная склонность к гиперкоагуляции в виде сравнительного укорочения времени свёртывания крови (548,3±84,6 сек против 564,6±56,2 сек, р=0,03) при сохранении средних значений оцениваемых параметров в пределах нормы.
Генотип PlА1/PlА1 полиморфного маркёра Leu33Pro гена ITGB3 имели 175 больных ИБС (72,3%), генотип PlА1/PlА2 – 59 (24,4%), PlА2/PlА2 – 8 (3,3%) больных. Частота аллеля PlА1 составила 0,85, а аллеля PlA2 – 0,15.
Выделенные подгруппы были сопоставимы по основным клинико-анамнестическим характеристикам. Однако у носителей аллели PlА2, по сравнению с PlA1/PlA1 гомозиготами, отмечена склонность к гиперкоагуляции в виде достоверного укорочения времени свёртывания крови (509±68,5 сек против 578,2±71,4 сек, р=0,02), а также тенденция к более высоким значениям протромбинового индекса (98,2±6,3% против 94,5±5,8%, р=0,16) и времени рекальцификации плазмы крови (115,3±16 сек против 108,2±14,5 сек, р=0,06).
Генотип АА полиморфного маркёра N291S гена LPL имели 127 больных (45,4%), АG – 111 (39,6%), генотип GG – 42 (15%) пациента. Частота аллеля А составила 0,65, аллеля G – 0,35. Не было выявлено достоверных различий выделенных подгрупп по основным клинико-анамнестическим характеристикам.
Был проведен анализ клинического течения ИБС у носителей разных генотипов изученных полиморфных маркёров генов-кандидатов.
Согласно данным таблицы 3, DD генотип гена ACE достоверно ассоциировался с наиболее высоким риском неблагоприятного течения коронарной болезни в течение 24 месяцев после ОКС (ОШ 6,51, р<0,0001), тогда как для больных с генотипом II наиболее вероятным было стабильное течение заболевания (ОШ 0,11, р=0,001). Вероятность стабильного течения ИБС (метод Каплана-Мейера) у обладателей генотипа DD оказалась ниже, чем у гомозигот по аллелю I (0,4 против 0,8, р=0,02). Достоверно более высокий риск неблагоприятных сердечно-сосудистых событий выявлена также среди гомозигот по аллелю 4а полиморфного маркёра 4a/4b гена NOS3, по аллелю Asp полиморфного маркёра Glu298Asp гена NOS3, по аллелю А (ОШ 4,1, р=0,002) и генотипу АА полиморфного маркёра G(-455)A гена FGB (табл. 3), что подтверждается более низкой вероятностью стабильного течения ИБС и более ранним достижением КТ.
Только двое носителей аллеля G полиморфного маркёра N291S гена LPL достигли конечных точек, в связи с чем, анализ по этому гену не проводился.
Таблица 3 Анализ вероятности наступления неблагоприятного исхода у больных ИБС в 24 месяцев после ОКС в зависимости от генотипов генов-кандидатов
| Генотип | Не достигли КТ (n=131), n (%) | Достигли КТ (n=111), n (%) | ОШ (95% ДИ) | р (χ2) |
| ACE (I/D) | | | | |
| II | 61 (46,6) | 10 (9,0) | 0,11 (0,05; 0,24) | 0,001 |
| ID | 64 (48,9) | 52 (46,8) | 0,92 (0,56;1,53) | 0,75 |
| DD | 6 (4,6) | 49 (44,1) | 6,51 (3,23; 13,2) | 0,0001 |
| NOS3 (Glu298Asp) | | | | |
| Glu/Glu | 60 (45,8) | 32 (28,8) | 0,48 (0,28; 0,82) | 0,007 |
| Glu/Asp | 68 (51,9) | 52 (46,8) | 0,85 (0,51; 1,4) | 0,52 |
| Asp/Asp | 3 (2,3) | 29 (26,1) | 3,59 (1,52; 8,47) | 0,004 |
| NOS3 (4а/4b) | | | | |
| 4а4a | 7 (5,3) | 22 (19,8) | 4,38 (1,79; 10,7) | 0,001 |
| 4a4b | 40 (30,5) | 20 (18,0) | 0,5 (0,27; 1,02) | 0,06 |
| 4b4b | 84 (64,1) | 67 (60,4) | 0,85 (0,51; 1,44) | 0,55 |
| EDN1 (Lys198Asn) | | | | |
| Lys/Lys | 51 (38,9) | 46 (41,4) | 1,11 (0,66; 1,86) | 0,69 |
| Lys/Asn, Asn/Asn | 80 (61,1) | 65 (58,6) | – | – |
| ITGB3 (PlA1/PlA2) | | | | |
| PlA1/PlA1 | 104 (79,4) | 68 (61,3) | 1,82 (0,91; 3,51) | 0,14 |
| PlA1/PlA2,PlA2/PlA2 | 27 (20,6) | 43 (38,7) | – | – |
| FGB (G(-455)A) | (n=90) | (n=80) | | |
| GG | 65 (72,2) | 38 (47,5) | 0,35 (1,18; 0,66) | 0,001 |
| GA | 17 (18,9) | 24 (30,0) | 1,29 (0,64; 2,6) | 0,08 |
| AA | 8 (8,9) | 18 (22,5) | 2,28 (1,2; 4,6) | 0,04 |
Среди больных, достигших конечных точек неоднократно, преобладали носители 4а4а генотипа полиморфного маркёра 4а/4b гена NOS3 (ОШ 3,27 (1,21; 8,84), р=0,01). Установлено, что число эпизодов нестабильности, приходящихся на одного человека у носителей 4а аллеля, было выше, чем у больных с генотипом 4b4b (р=0,02).
Выявлена достоверная взаимосвязь между случаями развития ОИМ в течение периода наблюдения и генотипами полиморфизмов генов ACE, NOS3 и ITGB3. Очень высокий риск ОИМ и более короткий период до его развития оказались ассоциированы с генотипом DD гена ACE (ОШ 9,23 (4,18; 20,4), р<0,0001) и генотипом Asp/Asp гена NOS3 (ОШ 4,65 (1,8; 11,98), р=0,001). У носителей аллеля PlA2 гена ITGB3 время до развития ОИМ составило в среднем 415,2±36,8 дня, что было достоверно больше, чем у пациентов с генотипом PlА1/PlA1 (207,9±28,2 дня, р=0,01).
С низким риском ОИМ в течение периода наблюдения оказались ассоциированы генотипы ID (ОШ 0,38 (0,2; 0,74), р=0,004) и II (ОШ 0,46 (0,22; 0,95), р=0,03) гена АСЕ.
Среди больных с неблагоприятным течением ИБС повышенный риск развития сердечной смерти в течение 2-х лет после ОКС с высокой степенью достоверности ассоциировался с генотипом DD гена ACE (ОШ 5,25 (2,1 13,4), р=0,001), генотипом Asp/Asp полиморфного маркёра Glu298Asp гена NOS3 (ОШ 3,3 (1,32; 8,23), р=0,02), 4а4а вариантом полиморфизма 4а/4b гена NOS3 (ОШ 11, (3,9; 32,8), р<0,001) и генотипом AA гена FGB (ОШ 8,3 (4,4; 16,7), р=0,001). С низким риском развития летального исхода ассоциированы генотипы ID гена ACE (ОШ 1,22 (0,29; 6,1), р=0,79), GG – гена FGB (ОШ 0,06 (0,01; 0,29), р=0,001) и 4b4b – гена NOS3 (ОШ 0,19 (0,08; 0,48), р<0,001).
Выживаемость в подгруппе больных с II вариантом составила 0,67 и превышала аналогичные показатели в группе с DD генотипом (0,05, p=0,03). Среднее время дожития у обладателей DD генотипа не превышало года (264,0±41,9 дня), а для носителей II генотипа равнялось 624,7±73,3 дня. Выживаемость носителей генотипа АA гена FGB оказалась в два раза ниже аналогичных показателей у гетерозигот (0,11 против 0,26, р=0,07), а также в 4 раза ниже, чем у гомозигот по аллелю G (0,33, р=0,002). Период до развития летального исхода у пациентов с АА генотипом в среднем составил не более полугода (174,9±33,9 дня), в то время как носители аллеля G достигали данной конечной точки лишь на втором году после ОКС (GA – 476,1±80,9 дня, GG – 575,0±46,6 дня). Отмечено также достоверное ухудшение выживаемости пациентов с генотипом Asp/Asp гена NOS3, по сравнению с Glu/Glu гомозиготами (0,16 против 0,33, р=0,05). Время до развития сердечной смерти у обладателей Asp/Asp генотипа не превышало 7 месяцев (194,0±64,1 дня), а для носителей Glu/Glu генотипа равнялось 393,0±83,8 дня.
Следовательно, несмотря на выявление достоверной ассоциации между большинством изученных генетических маркёров и риском сердечной смерти, применение более жёсткого критерия – log-rank подтвердило достоверно более низкую выживаемость только для носителей генотипа DD гена АСЕ, аллеля А и генотипа АА – гена FGB, аллеля Asp и генотипа Asp/Asp гена NOS3 (рис. 1, 2, 3).
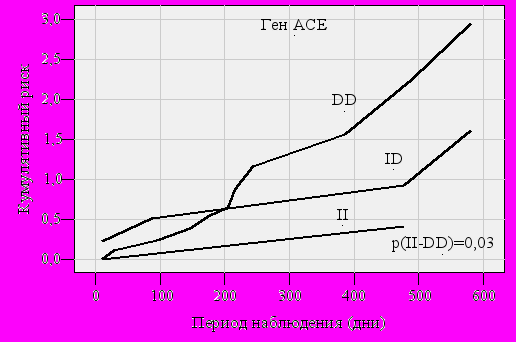
Рис. 1. Кривые вероятности наступления сердечной смерти в течение двух лет после ОКС в зависимости от генотипа полиморфного маркёра I/D гена ACE.

Рис. 2. Кривые вероятности наступления сердечной смерти в течение двух лет после ОКС в зависимости от генотипа полиморфного маркёра Glu298Asp гена NOS3.
